Возможности стресс-эхокардиографии при ХСН
СтатьиРябова Т. Р., Соколов А. А., Рябов В. В.
ФГБУ «НИИ кардиологии» СО РАМН, 634012, Томск, ул. Киевская, д. 111а Ключевые слова: диагностика, стресс–тесты, ХСН, эхокардиография
Keywords: diagnostics, stress-tests, CHF, echocardiography
Ссылка на эту статью: Рябова Т. Р., Соколов А. А., Рябов В. В. Возможности стресс-эхокардиографии при хронической сердечной недостаточности. Журнал Сердечная Недостаточность. 2014;82 (1):56–64.
Резюме
Представлен обзор литературы, посвященный возможностям современной нагрузочной ЭхоКГ у больных ХСН. Дано патофизиологическое обоснование метода, приведены показания, методологические подходы и возможные перспективы применения стресс-ЭхоКГ для оценки функциональной способности сердца при ХСН, а также для диагностики СН с сохраненной ФВ.
Summary
The review is focused on potentialities of current stress-EchoCG in patients with CHF. The authors provided a pathophysiological justification for the method, indications, methodological approaches, and possible prospective use of stress-EchoCG for evaluation of heart functional capability in CHF as well as for diagnostics of HF with preserved EF.
Эхокардиография – универсальный и доступный метод, позволяющий неинвазивно и точно оценивать анатомию и функцию сердца, исследовать гемодинамику в покое и при нагрузках. Cтресс-ЭхоКГ является функциональным нагрузочным тестом, сочетающим двухмерную ЭхоКГ с физической, фармакологической нагрузкой, а также с электрокардиостимуляцией. Этот метод идеально подходит для объективной оценки патофизиологических механизмов, лежащих в основе развития и поддержания ХСН.
Подобно большинству научных инноваций, стрессЭхоКГ за последние 30 лет прошла путь от «многообещающей технологии» (80–90-е гг. XX века), продвигаемой небольшим кругом энтузиастов на фоне общего скептицизма, до общепринятого в кардиологии метода (последние 10 лет), играющего ключевую роль в диагностике и стратификации риска у больных с известной или предполагаемой ИБС [1]. В настоящее время стресс-ЭхоКГ – хорошо изученный метод диагностики и функциональной оценки ИБС. Его прогностическая ценность доказана в больших многоцентровых исследованиях [2–4].
Проведение стресс-ЭхоКГ рекомендовано для оценки риска сердечно-сосудистых осложнений у больных перед несердечными операциями, прогнозирования восстановления функции жизнеспособного миокарда перед реваскуляризирующими процедурами, а также для выявления больных с высоким риском сердечных событий и смерти [5]. Этот метод значительно дешевле и безопаснее, нежели другие визуализирующие нагрузочные технологии, при этом он позволяет точно диагностировать ИБС и прогнозировать исходы заболевания. Cтресс-ЭхоКГ, радионуклидная сцинтиграфия миокарда и компьютерная томография сопоставимы по чувствительности и специфичности, в то же время ультразвуковое исследование не связано с радиационным облучением и поэтому более предпочтительно [6, 7]. Кроме того, ЭхоКГ имеет больше возможностей для оценки состояния клапанов сердца, перикарда, размеров камер и толщины стенок сердца [5].
За последние 10 лет нозологический спектр применения стресс-ЭхоКГ в кардиологии значительно расширился. Если в 80–90 гг. прошлого века клиническое использование стресс-ЭхоКГ ограничивалось ИБС и выявлением жизнеспособного миокарда при дилатационной кардиомиопатии (ДКМП), то с появлением новых ультразвуковых технологий (тканевая допплерография, трехмерная ЭхоКГ, контрастная ЭхоКГ) в начале третьего тысячелетия изучается роль нагрузочной ЭхоКГ в оценке функциональной способности сердца при ХСН, клапанных пороках сердца, гипертрофической кардиомиопатии, в дифференциальной диагностике симптома одышки неясной этиологии.
Клинические проявления СН, как синдрома различных заболеваний сердца, известны давно. Тем не менее изучение механизмов развития и прогрессирования СН, поиск способов ранней диагностики, лечения и профилактики не теряют своей актуальности. Это объясняется высокой заболеваемостью и распространенностью СН (1–2 % в популяции, причем среди них более 10 % – это пациенты старше 70 лет), продолжающимся ростом этих показателей, плохим прогнозом при развитии симптомов СН [8].
Единым патофизиологическим механизмом развития СН, независимо от вида сердечно-сосудистой патологии, является снижение насосной функции, что приводит к дисбалансу между гемодинамической потребностью организма и возможностями сердца. Иными словами, «сердце не может перекачивать кровь объемом, соизмеримым с требованиями метаболизма тканей» [8, 9].
Известно, что пациенты с признаками СН неоднородны по структурно-функциональным изменениям сердца и клиническим проявлениям. Эволюция взглядов на механизмы развития ХСН, основанная на изучении макро- и ультраструктурных, функциональных, нейрогормональных и молекулярных основ прогрессирования СН привела к выделению двух патогенетически различных синдромов СН, а именно СН с нормальной ФВ (или диастолическая СН) и СН с низкой ФВ (или систолическая / застойная СН) [10].
Сердечная недостаточность со сниженной ФВ характеризуется прогрессирующей дилатацией камер сердца, эксцентрическим ремоделированием, преобладанием систолической дисфункции, что клинически проявляется увеличением ЧСС, низким сердечным выбросом (СВ) и периферической вазоконстрикцией. Одышка у этой категории больных, как проявление легочно-венозного застоя, обусловлена, по крайней мере, частично, диастолической дисфункцией ЛЖ. Таким образом, у пациентов с СН со сниженной ФВ преобладают нарушения систолической функции сердца, а диастолические нарушения сопутствуют или являются вторичными. В противоположность этому пациенты с СН и сохраненной ФВ имеют нормальный или уменьшенный объем ЛЖ, концентрическое ремоделирование или гипертрофию ЛЖ, нормальные или незначительно сниженные показатели сократимости ЛЖ. У данной категории больных преобладают нарушения диастолической функции ЛЖ, а именно замедление расслабления и ухудшение растяжимости ЛЖ, и как следствие этого – увеличение давления наполнения ЛЖ и дилатация ЛП. Основные клинические проявления диастолической СН – это одышка в покое и при нагрузке и периферические отеки [11]. В основе клинико-патофизиологических различий этих двух вариантов СН лежат структурные и молекулярнобиологические изменения, которые представлены в табл. 1.
Таблица 1. Структурные различия диастолической и систолической ХСН [10]
| СН с нормальной ФВ (диастолическая СН) | СН со сниженной ФВ (систолическая или застойная СН) |
Самым распространенным признаком ХСН, а зачастую и основной причиной обращения больных за медицинской помощью является постепенное снижение переносимости физической нагрузки, одышка [12]. Сердечными механизмами ухудшения толерантности к физической нагрузке при ХСН могут быть отсутствие достаточной компенсаторной дилатации ЛЖ (по механизму Франка–Старлинга для увеличения СВ), снижение податливости (compliance) стенок ЛЖ и, как следствие, уменьшение кровенаполнения ЛЖ в диастолу и снижение СВ, выраженная систолическая дисфункция, увеличение функциональной митральной регургитации, асинхрония сокращения миокарда ЛЖ, которые в свою очередь, также ведут к снижению СВ, легочная гипертензия [13]. Все эти патофизиологические механизмы развития и прогрессирования СН могут быть точно оценены с использованием ЭхоКГ, что и является обоснованием применения стрессЭхоКГ у больных с явной и скрытой СН (рис. 1, 2).
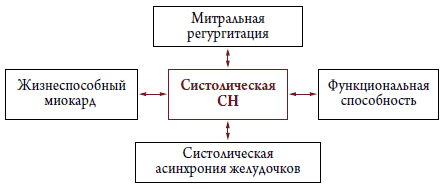
Рисунок 1. Патофизиологические механизмы СН со сниженной ФВ, которые могут быть потенциально исследованы во время стресс–ЭхоКГ [13]
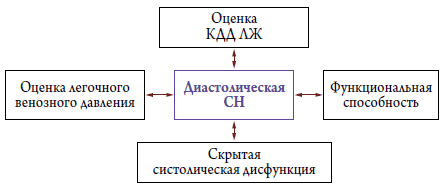
Рисунок 2. Патофизиологические механизмы диастолической СН, выявляемые во время стресс–ЭхоКГ [13]
Возможности нагрузочной ЭхоКГ при СН активно изучаются. Если в предшествующих Европейских рекомендациях по диагностике и лечению острой и ХСН 2008 г. [14] отмечено, что стресс-ЭхоКГ не может быть рекомендована в качестве метода рутинной диагностики при СН, то в пересмотренных рекомендациях 2012 года указывается, что диастолический стресс-ЭхоКГ тест является новой процедурой для выявления СН с сохраненной ФВ у больных с одышкой напряжения, нормальной ФВ и неубедительными признаками диастолической дисфункции в покое [8]. Cтресс-ЭхоКГ показана пациентам для верификации диастолической СН. Кроме того, нагрузочная ЭхоКГ используется у больных СН для определения наличия и степени выраженности индуцированной ишемии и определения жизнеспособности несокращающегося миокарда. Этот метод также может быть полезен при подозрении на тяжелый аортальный стеноз у больных с низкой ФВ и низким трансклапанным градиентом давления [9].
Таким образом, стресс-ЭхоКГ является перспективной для клинического применения методикой, постепенно вытесняющей другие визуализирующие технологии, использующие радиацию. Потенциальными возможностями стресс-ЭхоКГ при СН являются [13, 15]:
- Диагностика СН у больных с отсутствием симптомов в покое (в том числе выявление диастолической СН, дифференциальная диагностика синдрома одышки);
- оценка функциональной способности сердца у больных с симптомами СН в покое;
- оценка жизнеспособности несокращающегося миокарда;
- определение выраженности аортального стеноза и недостаточности митрального клапана;
- прогнозирование течения заболевания;
- прогнозирование ответа на кардиоресинхронизирующую терапию (КРТ).
Cтресс-ЭхоКГ и функциональная способность сердца при СН
Во время нагрузочных проб для оценки переносимости физических нагрузок и определения функциональной способности сердца определяют ряд параметров [13] (табл. 2) и сопоставляют их с появлением симптомов СН.
Таблица 2. Нагрузочные пробы и СН [13]
| Общие параметры | ЭхоКГ параметры |
(соотношение ФВ ЛЖ в покое и при нагрузке) |
Стресс–тест с физической нагрузкой (применяя протоколы тредмил–теста или велоэргометрии) в большей степени, чем с добутамином, является методом выбора для того, чтобы оценить функциональную способность сердца, так как дает возможность объединять данные ЭхоКГ с обычными параметрами, регистрируемыми во время физиологической нагрузки [7, 15].
Увеличение ФВ ЛЖ во время нагрузки не менее чем на 5 % (в абсолютных значениях) является критическим уровнем для определения наличия сократительного резерва. При расчете систолического давления в ПЖ (СДПЖ) по скорости трикуспидальной регургитации в покое и во время нагрузки допускается постоянная величина давления в правом предсердии во время выполнения пробы. Легочная гипертензия, оцененная ЭхоКГ методом, определяется как СДПЖ >30 мм рт. ст. в покое и СДПЖ >45 мм рт. ст. во время нагрузки [13].
Нарушение систолической функции ПЖ ухудшает прогноз больных ХСН [16, 17]. Сократимость ПЖ можно оценить по выраженности систолической экскурсии фиброзного кольца трикуспидального клапана (ФК ТК), используя М-режим и тканевой допплер в апикальной 4-камерной позиции ЛЖ. Величина систолической экскурсии ФК ТК 14 мм и менее и значение скорости систолического движения ФК ТК менее 10,8 см / с свидетельствуют о снижении сократимости ПЖ, что, в свою очередь, связано с увеличением смертности больных СН [17, 18].
Максимальное поглощение кислорода (VO2max) во время нагрузки <14 мл / кг / мин – хорошо известный показатель для решения вопроса о необходимости трансплантации сердца. Установлено, что значения VO2max <10 мл / кг / мин однозначно определяют высокий риск, в то время как величина VO2max >18 мл / кг / мин связана с низким риском; промежуточные величины представляют неопределенную, так называемую «серую зону». CтрессЭхоКГ позволяет стратифицировать риск у больных с промежуточными значениями VO2max (10–14 мл / кг / мин) и выявить пациентов из «серой зоны», которым необходима трансплантация сердца (табл. 3) [19].
Таблица 3. Дополнительные прогностические показатели стресс–ЭхоКГ с физической нагрузкой у больных с промежуточными значениями VO2max (10–14 мл / кг / мин) [13]
| Показатели | Низкий риск (5–10 % в год) | Высокий риск (≥25-30 % в год) |
| Продолжительность нагрузки | ≥8-10 мин | <8 мин |
| Сократительный резерв | да | Нет |
| Легочная гипертензия | <45 мм рт. ст. | >45 мм рт. ст. |
| Дисфункция ПЖ | нет | да |
| Митральная регургитация | ↓ или = | ↑↑ |
Оценка сократительного резерва и выявление жизнеспособного миокарда не ограничивается пациентами с ИБС и систолической дисфункцией ЛЖ. Определение общего сократительного резерва ЛЖ у больных с неишемической ДКМП имеет существенное клиническое значение. Известно, что функциональное состояние ЛЖ у больных ДКМП является самым сильным предиктором выживания. Однако наличие сократительного резерва, выявляемого при добутаминовой стресс-ЭхоКГ, является лучшим маркером благоприятного прогноза у пациентов с ДКМП и выраженной дисфункцией ЛЖ в покое [20, 21].
У больных СН с наличием сократительного резерва наблюдается большее улучшение ФВ ЛЖ на фоне лечения β-АБ за счет биологического увеличения функционирующих кардиомиоцитов. Тогда как при отсутствии сократительного резерва (когда кардиомиоциты замещаются соединительной тканью) функция ЛЖ не может улучшиться за счет этих биологических механизмов, так как в миокарде недостаточно сокращающихся миоцитов и симпатолитические эффекты β-АБ преобладают [22]. Однако клиническое использование стресс-ЭхоКГ с добутамином у пациентов с ХСН может быть ограничено тем, что многие больные уже получают β-АБ во время исследования. У этих больных стресс-ЭхоКГ с эноксимоном могла бы быть реальной альтернативой низким дозам добутамина для того, чтобы оценить сократительный резерв, являясь более сильной и более безопасной, чем добутаминовый тест [23].
В последние годы ряд исследователей предлагают использовать стресс-ЭхоКГ для прогнозирования ответа на кардиоресинхронизирующую терапию (КРТ) и отбора пациентов для этой процедуры [24–27]. Предполагается, что нагрузка (физическая или фармакологическая) может выявить значимую динамическую диссинхронию, независимо от ширины комплекса QRS. Кроме того, наличие жизнеспособного миокарда и хорошего сократительного резерва, определяемые стресс-ЭхоКГ с добутамином, может также прогнозировать долгосрочные положительные результаты после КРТ [27, 28]. Однако до сих пор не определена роль стресс-ЭхоКГ в отборе пациентов для проведения КРТ [28].
Cтресс-ЭхоКГ и диастолическая СН
Нарушения диастолы ЛЖ являются общими практически для всех форм СН и влияют на исходную и резервную функцию сердца, однако их роль в клинике СН остается неясной [29].
Примерно у 1/3 больных с клинически выраженной ХСН развитие декомпенсации не связано с явным нарушением сократительной способности миокарда и возникает, вероятно, вследствие диастолических расстройств. В настоящее время установлено, что, по крайней мере, половина больных (от 38 до 54 %) с симптомами и признаками ХСН имеют нормальную или незначительно сниженную ФВ ЛЖ [10]. Эту форму СН называют по-разному: диастолическая СН или СН с сохраненной систолической функцией ЛЖ, или просто СН с нормальной ФВ ЛЖ, а также синдром «жесткого сердца» [30]. На основании инвазивного исследования гемодинамики доказано [31], что пациенты с симптомами и признаками СН и сохраненной ФВ ЛЖ имеют значительные нарушения активного расслабления и высокую жесткость ЛЖ. Следовательно, у данной категории больных патофизиологической причиной повышения диастолического давления в ЛЖ и развития СН является непосредственно нарушение диастолической функции ЛЖ. Тем не менее многие вопросы патофизиологии СН с сохраненной ФВ, диагностики и лечения остаются спорными.
Что является причиной диастолической СН? Нарушения диастолы ЛЖ наблюдаются практически при всех состояниях, сопровождающихся структурными изменениями миокарда и / или нарушениями гемодинамики. Наиболее часто встречающиеся патологии – это ИБС, АГ, старение, СД, аортальный стеноз. Более редкие причины – кардиомиопатии, эндокардиальный фиброэластоз, заболевания перикарда, объемная перегрузка ЛЖ (артерио-венозные фистулы, введение жидкости), анемия, тиреотоксикоз [32].
На рисунке 3 схематично показаны некоторые наиболее распространенные процессы, ведущие к диастолической дисфункции и СН. В результате повышенной постнагрузки вследствие АГ, потери сосудистого комплайнса и эластичности из-за атеросклероза, старения и эндотелиальной дисфункции ЛЖ подвергается структурным и функциональным изменениям. Кроме того, возрастные изменения сердца, а также у некоторых пациентов эпизоды ишемии оказывают прямое воздействие на миокард. Эти процессы приводят к гипертрофии миокарда и фиброзу, с ухудшением податливости миокарда («жесткое» сердце) и в некоторых случаях к нарушению расслабления. Все это является причиной постоянного или периодического повышения конечного диастолического давления (КДД) ЛЖ и появлению симптомов и признаков СН [33].
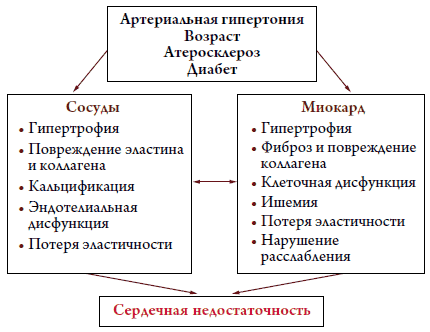
Рисунок 3. Процессы, которые ведут к развитию диастолической СН [33]
Таким образом, при диастолической СН ЛЖ неспособен заполняться объемом крови, достаточным для поддержания адекватного СВ при нормальном среднем давлении в легочных венах (<12 мм рт. ст.) [34]. Следовательно, диастолическая СН развивается в случае, когда для полноценного заполнения ЛЖ требуется повышенное давление в легочных венах и левом предсердии. Основные причины ухудшения заполнения ЛЖ при диастолической дисфункции – это нарушение активного расслабления миокарда ЛЖ и ухудшение податливости, растяжимости стенок ЛЖ (пассивный компонент) [31, 35, 36]. Нарушение диастолы наблюдается при патологии хотя бы одного из этих компонентов – активного или пассивного.
Пассивный компонент диастолы обусловлен растяжимостью ЛЖ (compliance). Увеличение жесткости ЛЖ наблюдается при гипертрофии миокарда, гипертензии, диффузном отложении коллагена и развитии фиброза, постинфарктном рубцевании, нарушении клеточной архитектоники кардиомиоцитов, изменении внеклеточного матрикса (инфильтрация различными патологическими веществами), перикардитах [32].
Активный компонент диастолы характеризуется временем расслабления. Нарушение активной релаксации происходит также при гипертрофии, гипертензии, отложении коллагена и развитии фиброза, ишемии миокарда, асинхронии, увеличении пред- и постнагрузки на ЛЖ, нарушении трансмембранного потока кальция, тахикардии [32, 36].
Классически диастолическая функция определяется, как патологическая на основании параметров, определяемых инвазивно: время постоянного расслабления >48 мс, КДД ЛЖ >16 мм рт. ст., среднее диастолическое давление ЛЖ (давление заклинивания легочных капилляров) >12 мм рт. ст., камерная жесткость >27 [36, 37]. Установлено, что эти показатели хорошо коррелируют с ЭхоКГ маркерами диастолы (Е / А, DT, ВИР, Е / е, PVd / PVs, Adur / Ad) [37–40]. Более того, в практике допплер–ЭхоКГ оценка функции расслабления ЛЖ более удобна и доступна в сравнении с инвазивными методами.
При СН с сохраненной ФВ ЛЖ присутствуют нарушения и систолической функции ЛЖ, что становится более очевидным при нагрузке. Нарушение систолической функции ЛЖ проявляется нарушением деформационных свойств миокарда (уменьшением систолического миокардиального стрейна), ротации, присасывающего эффекта ЛЖ, продольного движения ЛЖ и задержки раскручивания ЛЖ. Таким образом, диастолическая СН не является изолированным расстройством диастолы [41]. Инвазивно определенные параметры расслабления и раннего наполнения ЛЖ (активное расслабление ЛЖ) тесно взаимосвязаны с величиной механического раскручивания ЛЖ в начале диастолы, определяемого ЭхоКГ (speckle tracking imaging) [37, 42]. На основании неинвазивной оценки биомеханики сердечного сокращения Tan Y. T. с соавт. [41] предложили схему патогенеза СН с сохраненной ФВ (рис. 4). Предполагается, что диастолическая СН обусловлена не только замедлением релаксации и высокой жесткостью сердца и сосудов, но и задержкой раскручивания ЛЖ и, как следствие этого, ухудшением функции ЛП [41].
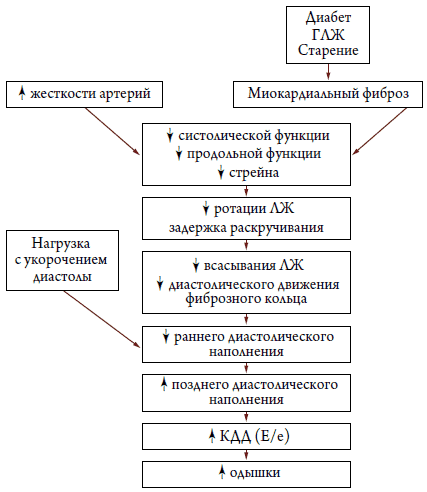
Рисунок 4. Схема патогенеза СН с сохраненной ФВ ЛЖ [41]
Диастолическая дисфункция и диастолическая СН не являются синонимами [43]. Термин «диастолическая дисфункция» обозначает функциональные нарушения расслабления, наполнения и растяжимости ЛЖ независимо от величины ФВ ЛЖ и наличия или отсутствия симптомов СН. Тогда как при изолированной диастолической СН нарушения расслабления ЛЖ сопровождаются клиническими признаками и симптомами недостаточности кровообращения, при этом ФВ ЛЖ нормальная или снижена незначительно [11, 44].
Критерии «диастолической» СН [8, 11] Необходимые критерии:
- Клинические симптомы и признаки СН [8]: Framingham, Boston [45, 46] критерии СН.
- Увеличение содержания в плазме крови мозгового натрийуретического пептида (BNP ≥35 пг / мл и NT-proBNP ≥125 пг / мл) и / или признаки легочно-венозной гипертензии на рентгенограмме грудной клетки.
- Нагрузочный тест (спировелоэргометрия).
- Нормальная или незначительно сниженная систолическая функция ЛЖ ФВ ЛЖ (≥50 %), индекс КДО ЛЖ <97 мл / м², индекс КДР ЛЖ <3,2 см / м².
- Гипертрофия ЛЖ (индексы массы ЛЖ >95 г / м² для женщин и >115 г / м² для мужчин) или концентрическое ремоделировнаие ЛЖ;
- Дилатация левого предсердия (ЛП) (при отсутствии фибрилляции предсердий) – индекс объема ЛП >34 мл / м²
- ЭхоКГ или инвазивное выявление нарушения диастолы ЛЖ.
Согласно рекомендациям (2012) рабочей группы Европейского общества кардиологов [8] диагноз СН с сохраненной ФВ правомочен при обязательном наличии всех четырех следующих критериев: типичные клинические симптомы СН, типичные признаки СН, нормальная или незначительно сниженная ФВ ЛЖ и отсутствие дилатации ЛЖ, соответствующие структурные изменения сердца (гипертрофия ЛЖ и / или дилатация ЛП) и / или нарушения диастолы ЛЖ.
Диагностика СН с сохраненной ФВ сложнее, чем со сниженной ФВ, так как это диагноз исключения. Иными словами, чтобы диагностировать диастолическую СН необходимо прежде всего исключить все потенциальные несердечные причины симптомов у пациента (например, анемия или хронические заболевания легких). Как правило, у этой категории больных сердце не увеличено, присутствуют гипертрофия ЛЖ, дилатация ЛП и инструментальные признаки диастолической дисфункции ЛЖ [8].
Итак, от 30 до 50 % пациентов с признаками и симптомами СН имеют нормальные размеры ЛЖ и нормальную или незначительно сниженную ФВ ЛЖ. На основании только клинических данных сложно отличить больных с диастолической СН от тех, у кого имеется систолическая дисфункция ЛЖ (табл. 4), тогда как ЭхоКГ позволяет дифференцировать эти состояния [34, 44]. Нарушение диастолы неинвазивно и просто оценивается во время стандартной ЭхоКГ в покое. Для того чтобы определить, является ли нарушение диастолической функции причиной клинических симптомов у больного, необходимо показать, что существование такой дисфункции является причиной снижения толерантности к физическим нагрузкам. Поэтому стресс-ЭхоКГ (предпочтительнее с физической нагрузкой) может быть использована у больных с одышкой и нормальной систолической функцией ЛЖ, чтобы выявить диастолическую дисфункцию (признаком которой является повышение давления заполнения ЛЖ) во время стресс–теста, как причину симптомов заболевания (рис. 2).
Таблица 4. Распространенность специфических симптомов и признаков систолической СН в сравнении с диастолической
| Симптомы и признаки | Диастолическая СН (ФВ >50 %) | Систолическая СН (ФВ <50 %) | ||||||||||||||||||||||||||||||||||
| Симптомы | ||||||||||||||||||||||||||||||||||||
| 85 | 96 | 55 | 50 | 60 | 73 | Объективные признаки | 35 | 46 | 72 | 70 | 50 | 60 | 45 | 65 | 15 | 16 | 30 | 40 | Рентгенография ОГК | 90 | 96
| | ||||||||||||||
У больных с диастолической СН наблюдается низкая толерантность к физическим нагрузкам. Причинами снижения переносимости физических нагрузок у этой категории больных являются: во-первых, повышение конечного диастолического давления (КДД) ЛЖ и легочного венозного давления во время стресс–теста вследствие уменьшения растяжимости ЛЖ, что приводит к увеличению частоты дыхания и появляется одышка [44]; во-вторых, у многих пациентов имеется гипертрофия ЛЖ, относительно высокая толщина стенок ЛЖ и маленький конечный диастолический объем (КДО), и, следовательно, низкий ударный объем (УО) и сниженный минутный объем крови (МОК). Эти сердца имеют ограниченную возможность использовать механизм Франка–Старлинга во время физических нагрузок. Такой небольшой резерв преднагрузки, особенно в сочетании с хронотропной недостаточностью, ограничивает СВ во время выполнения физических упражнений. Легкие и скрытые нарушения сократимости могут присутствовать у многих пациентов, но при этом диастолическая дисфункция преобладает [44]. Все эти аспекты могут быть оценены во время стресс-ЭхоКГ (табл. 5).
Таблица 5. Использование эхоКГ параметров для оценки диастолической функции во время стресс теста у больных с предполагаемой диастолической СН [13]
Для оценки давления наполнения ЛЖ можно использовать соотношение скорости трансмитрального потока и скорости движения фиброзного кольца митрального клапана, применяя тканевой допплер (E / е) [47, 48]. Величина E / е >15 в покое свидетельствует о повышении давления заполнения. Значение E / е <8 предполагает нормальное давление заполнения; E / е в диапазоне 8–15 имеет неопределенное значение и представляет «серую зону», т. е. при значениях E / е от 8 до 15 КДД ЛЖ может быть как повышенным, так и нормальным. Скорости E и е значительно увеличиваются после нагрузки. В норме из-за пропорционального увеличения обеих скоростей, отношение E / е существенно не изменяется на фоне нагрузки – это нормальный диастолический ответ на стресс [49]. Если отношение E / е увеличивается до 15, можно предполагать наличие патологического увеличения давления заполнения ЛЖ во время нагрузки [48]. Эти изменения должны сопровождаться снижением СВ, увеличением СДПЖ и появлением симптомов во время выполнения нагрузки. Кроме того, оценивая сократимость ЛЖ во время стресса, можно выявить группу больных с сопутствующей скрытой систолической дисфункцией, но с преобладанием диастолической дисфункции (рис. 5).
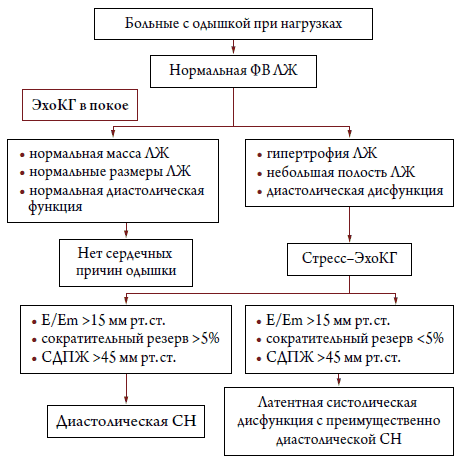
Рисунок 5. Схема диагностического алгоритма у больных предполагаемой диастолической СН [13]
Можно использовать производные параметры для оценки систолической и диастолической функции ЛЖ в покое и при нагрузке [50]: Индекс эластичности артерии = 0,9 × АДсист / УО
Конечно-систолический индекс эластичности = 0,9 × АДсист / КСО
Индекс максимальной нагрузки = LVOT Vpeak × АДсист / КДО
Давление / объем = (Е / е) / КДО
Жесткость ЛЖ = 70 / (DT–20)²
Систолический индекс резерва продольной функции = ΔSm × [1–1 / Smrest)]
Диастолический индекс резерва продольной функции = ΔEm × [1–1 / Emrest)], где
АД сист – САД; LVOT Vpeak – максимальная скорость выброса, измеренная импульсно-волновым допплером в выводном тракте ЛЖ; DT – время замедления потока Е раннего наполнения ЛЖ; Smrest – систолическая скорость движения фиброзного кольца митрального клапана (ФК МК) в покое; ΔSm – разница систолических скоростей движения ФК МК на пике нагрузки и в покое; Emrest – ранняя диастолическая скорость движения ФК МК в покое; ΔEm – разница ранних диастолических скоростей движения ФК МК на пике нагрузки и в покое.
Одышка, ограничивающая переносимость физических нагрузок, является распространенным поводом обращения за медицинской помощью. Причины одышки разнообразны (рис. 6). Не во всех случаях сердечное происхождение одышки можно установить на основании исходной ЭхоКГ. У больных с необъяснимой одышкой напряжения, умеренным нарушением диастолической функции ЛЖ и нормальным давлением заполнения ЛЖ в покое стресс-ЭхоКГ может помочь в диагностике. Однако недостаток клинических исследований, наличие потенциальных ограничений в оценке диастолы у больных с локальными нарушениями сократимости, патологией митрального клапана и фибрилляцией предсердий не позволяют широко использовать стресс-ЭхоКГ у этой категории лиц в рутинной клинической практике [5, 51].

Рисунок 6. Схема дифференциального диагноза диастолической СН [50]
Как уже упоминалось, частота СН с сохраненной ФВ высока в популяции, на ее долю приходится почти половина всех пациентов с ХСН. Чаще всего это пожилые люди, женщины с АГ и гипертрофией ЛЖ. Таким образом, общая заболеваемость, риск неблагоприятных исходов, смертность у этой категории пациентов близки к таковым у больных с систолической дисфункцией ЛЖ. Диастолические нарушения у этой категории больных являются основными механизмами болезни, а сопутствующие заболевания, такие как хронические заболевания легких, ишемия и метаболические расстройства, играют второстепенную роль. Диастолическая дисфункция является действительно общим процессом, потому что большинство пациентов имеют повышенное КДД ЛЖ или замедленное расслабление, у многих из которых КДО ЛЖ нормальный или уменьшенный. Кроме того, большинство этих показателей нарушены у пожилых лиц с АГ, но без симптомов СН. Необходимо учитывать, что в основном эти данные были получены у пациентов в состоянии покоя. Следовательно, изменения геодинамики, возникающие при нагрузке и потенциально ведущие к декомпенсации, часто пропускаются. Остается открытым вопрос, как диастолическая дисфункция в покое (нередко при отсутствии симптомов СН) отвечает за декомпенсацию [29].
Исследования Kawaguchi M. с соавт. [52] показали, что декомпенсации могут способствовать увеличению желудочковой и сосудистой жесткости. Последняя связана с АД, лабильностью симптомов и чувствительностью к мочегонным. В связи с этим эти нарушения могут быть не «болезнью диастолы» как таковой, а скорее всего, отражать неблагоприятное взаимодействие сосудистой и желудочковой жесткости, влияющей на наполнение и выброс ЛЖ. Это больше, чем академические различия, потому что переключают внимание на патофизиологию и помогают определить терапевтическую тактику [29, 53, 54].
Диастолическая дисфункция, скорее всего, составная часть нарушений, а не изолированный фактор, приводящий к декомпенсации функции сердца, особенно если другие сердечно-сосудистые изменения присутствуют. Кроме того, не хватает информации о тканевом, миокардиальном субстрате нарушений диастолы (очень мало данных биопсии или материалов вскрытия), а также генетических и молекулярных профилей, которые могли бы характеризовать диастолическую дисфункцию и в конечном итоге предсказать, у кого и как будет развиваться болезнь [29].
Диастолические нарушения важны в патофизиологии СН, что и объясняет актуальность новых исследований, изучающих биохимические и структурные механизмы, лежащие в их основе, для того чтобы прояснить роль диастолы в патогенезе СН, а также разработать целевые методы лечения [29, 55].
Диастола является мишенью почти всех патологических процессов, затрагивающих систему кровообращения, однако эффективных способов коррекции нарушений диастолы нет. Терапия диастолической СН имеет две основные цели. Во-первых, устранить последствия диастолической дисфункции (например, венозный застой), а во-вторых, устранить или уменьшить влияние факторов, ответственных за диастоличесую дисфункцию (например, гипертрофии миокарда, фиброза и ишемии) [44].
ЭхоКГ – высокоинформативный и доступный метод для удовлетворения растущей потребности в неинвазивной оценке функционального состояния сердечно-сосудистой системы у больных ХСН в покое и в условиях нагрузки, для динамичного наблюдения на фоне проводимой терапии. Кроме того, ЭхоКГ, в том числе стресс-ЭхоКГ, предоставляют важные данные при выборе тактики лечения больных ХСН – консервативная медикаментозная терапия, хирургическое вмешательство или имплантация ЭКС (кардиовертер–дефибриллятор, кардиоресинхронизация). Новые технологии, позволяющие оценивать механику сердечного сокращения, возможности трехмерной реконструкции сердца открывают огромные перспективы для улучшения качества диагностики и ведения больных ХСН [40].
Список литературы
