Средняя эффективная доза (ЭД50) нефопама и кетопрофена для лечения послеоперационной боли: исследование взаимодействия с помощью последовательного определения пороговой дозы и изоболографического анализа
СтатьиОпубликовано в журнале:
Медицинский алфавит. Неотложная медицина 2 / 2012
Доктор медицины Noemie Delage, доктор медицины Hilal Maaliki, доктор медицины Helene Beloeil, доктор медицины Dan Benhamou, доктор медицины, к. н. Jean-Xavier Mazoit
Median effective dose (ED50) of nefopam and ketoprofen in postoperative patients: a study of interaction using sequential analysis and isobolographic analysis
Delage N., Maaliki H., Beloeil H., Benhamou D., Mazoit J. X. // Anesthesiology. 2005. Vol. 102 (6). P. 1211–1216.
Сбалансированная анальгезия, т. е. использование комбинации препаратов, относящихся к разным фармакологическим группам, по-видимому, может улучшать результаты обезболивающей терапии и уменьшать частоту возникновения и тяжесть побочных эффектов каждого лекарственного средства в отдельности [1]. Поскольку применение анальгетиков, традиционно используемых для лечения послеоперационного болевого синдрома (например, морфина, нестероидных противовоспалительных средств (НПВС) и парацетамола), связано с определёнными ограничениями и с развитием ряда побочных эффектов, таких как тошнота, рвота, подавление функции тромбоцитов, нарушение работы почек или ограничение дозы лекарственных средств изза гепатотоксичности, использование ненаркотического анальгетика нефопама может быть целесообразным. Нефопам представляет собой рацемическую смесь двух энантиомеров, имеющих лишь небольшие различия фармакокинетических и фармакодинамических свойств [2].
Нефопам имеет центральный механизм действия, подавляя обратный захват серотонина, дофамина, норадреналина нервными клетками мозга [4–6]. Нефопам также влияет на механизм глутаматергической передачи, ингибируя NMDA-рецепторы [7, 8]. Кроме того, установлено, что нефопам уменьшает иммунореактивную экспрессию транскрипционного фактора с-Fos в задних рогах спинного мозга у крыс через 1 ч. после внутриподошвенной инъекции препарата [9]. Несколько исследований показали его эффективность в лечении послеоперационного болевого синдрома [10–12]. Нефопам также увеличивал порог появления тремора в опытах с участием испытуемых [13] и доказал эффективность при лечении посленаркозного озноба [14]. Обычная доза препарата для внутривенного введения составляет 20 мг. В предыдущем исследовании авторы определяли среднюю эффективную анальгезирующую дозу (E50 = эффективная анальгезия у 50% больных) и 95% доверительный интервал (ДИ) для нефопама, морфина и их комбинации у больных с умеренным болевым синдромом [15]. Величина E50 для нефопама и морфина была, соответственно, 17 мг (95% ДИ: 15,4–18,6 мг) и 5 мг (95% ДИ: 4–6 мг) для каждого препарата в отдельности, а также 13,5 мг (95% ДИ: 9,8–17,2 мг) и 4,5 мг (95% ДИ: 3,3–5,7 мг) соответственно, когда оба препарата применялись одновременно. Тип взаимодействия между препаратами определён как инфрааддитивный эффект [15]. НПВС являются мощными анальгетиками, которые широко применяются для лечения больных в послеоперационном периоде [16–18]. Они проявляют активность как через центральные, так периферические механизмы действия в основном путём блокады синтеза простагландинов [8, 19]. В опытах на животных комбинация морфина и различных НПВС оказывала потенцирующее действие на обезболивающую активность исследуемых препаратов [20, 21]. Кетопрофен является НПВС, широко применяемым для лечения послеоперационной боли, обладающим выраженной способностью уменьшать необходимую дозу морфина [16, 22]. Однако в связи с тем, что эффект уменьшения дозы морфина сам по себе не позволяет однозначно сделать вывод о наличии синергического типа межлекарственного взаимодействия, авторы решили исследовать лечебную активность комбинации препаратов нефопам (анальгетик центрального действия) и кетопрофен (средство, частично реализующее фармакологический потенциал через периферические эффекты). Для этой цели вначале использовали метод Диксона «вверх и вниз» для определения ЭД50 [23, 24], а затем изоболографический анализ [25–27].
Материалы и методы
Отбор участников исследования
После одобрения этическим комитетом (госпиталь Кочин-Порт-Рояль государственной системы здравоохранения Парижа, Франция) и подписания формы письменного информированного согласия в исследование включены 72 пациента (I–II ASA). Все пациенты были включены в план проведения хирургического лечения, которое расценивалось как сопровождающееся умеренным послеоперационным болевым синдромом (например, устранение паховой грыжи или малые операции в отоларингологии). Критерии исключения из исследования: 1) противопоказания к назначению нефопама и кетопрофена, включая беременность; 2) возраст моложе 18 лет; 3) применение интраоперационной регионарной анестезии и 4) послеоперационная оценка боли меньше 3 баллов по цифровой шкале боли (numeric pain scale — NPS): 0 = нет боли, 10 = максимальная боль) на момент поступления в палату посленаркозного наблюдения (postanesthesia care unit, PACU).
Протокол проведения анестезии
Вечером накануне операции пациенты были проинструктированы о том, как использовать NPS. Всем пациентам проводили общую анестезию пропофолом или тиопенталом в сочетании с десфлураном или изофлураном. Разрешали применение следующих опиоидов: алфентанил, ремифентанил и суфентанил. В конце операции всем пациентам внутривенно вводили 1 мг дроперидола.
Протокол проведения анальгезии
Исследование было двойным слепым рандомизированным и проспективным. Рандомизацию проводили с использованием таблицы случайных чисел. «Ослепление» обеспечивалось путём использования свежеприготовленных шприцов с лекарственными средствами анестезиологом, который не участвовал в какой-либо другой части исследования, включая оценку тяжести болевого синдрома. Сразу же после прибытия пациентов в PACU интенсивность боли оценивали с помощью NPS. Адекватность обезболивания определял один из двух исследователей: N. D. или H. M. Если интенсивность боли оценивали в три балла и выше (на момент поступления в PACU — время 0 (time 0–T0), пациента включался в исследование и получал анальгезию, согласно установленному протоколу. В момент T0 больные в группе нефопама получали препарат в шприце 20 мл в виде непрерывной внутривенной инфузии в течение 10 мин. и в виде короткой инфузии в течение 10 мин. 125 мл изотонического раствора внутривенно. Пациентам из группы кетопрофена внутривенно вводили кетопрофен (короткая инфузия 125 мл раствора в течение 10 мин.) и физиологический раствор в шприце 20 мл (непрерывная внутривенная инфузия в течение 20 мин.). Проведение инфузий было необходимо при введении обоих препаратов для предотвращения развития побочных реакций. Дозу нефопама и кетопрофена для каждого пациента определяли на основании оценки эффективности лечения предыдущего больного той же группы исследования, используя метод последовательного определения пороговой дозы «вверх и вниз» [23]. В группе нефопама первый пациент получил 18 мг препарата. Интервал коррекции дозы составлял 2 мг. В группе кетопрофена первый пациент получил 40 мг. Интервал коррекции дозы составлял 5 мг. Интервалы коррекции доз были установлены в соответствии с ожидаемой стандартной ошибкой для E50 [23, 24]. Больные из группы нефопам-кетопрофен получали нефопам внутривенно в 20 мл шприце в виде непрерывной инфузии в течение 20 мин. и кетопрофен внутривенно в виде короткой инфузии 125 мл раствора препарата в течение 10 мин. Первый пациент получал 8 мг нефопама и 20 мг кетопрофена, исходя из предварительно рассчитанного соотношения эффективности препаратов 1:2,5 (примерно половина исходной дозы, использованной при испытаниях каждого компонента в отдельности). Интервал коррекции дозы составлял 2 мг для нефопама и 5 мг для кетопрофена. Эффективность исследуемого препарата оценивали с помощью NPS через 45 мин. после начала инфузии препарата [10, 16]. Учитывали два типа результатов: 1) положительный результат: значение по шкале NPS находится в пределах трех баллов и ниже из 10 возможных на 45-й мин. введения препарата (time 45–T45) (при положительном результате доза понижалась на 2 мг в группе нефопама, на 5 мг в группе кетопрофена, а также на 2 мг нефопама и 5 мг кетопрофена в группе нефопама-кетопрофен для следующего пациента) и 2) отрицательный результат: показатель тяжести боли по шкале NPS более трех баллов из 10 возможных на T45 (при отрицательном результате доза повышалась, как указано выше, для следующего пациента).
На 45-й мин. участникам исследования, которые сообщили о неэффективности проводимой терапии, назначали экстренное лечение морфином в дробных дозах по обычной схеме, предусмотренной в PACU.
Побочные эффекты
Известные побочные эффекты, развивающиеся при приёме нефопама (потливость, тошнота, рвота, головокружение, тахикардия, сухость во рту, повышение артериального давления, локальная боль в месте инфузии) и кетопрофена (тошнота, рвота, головокружение, боль в животе, головная боль, боль по ходу сосудов при внутривенном введении, сыпь на коже или зуд), регистрировались на 30-, 45-и 60-й мин. после начала инфузии и каждые 30 мин. после завершения введения препарата до момента перевода больного из PACU.
Статистический анализ
В исследование включали только тех пациентов, у которых тяжесть боли оценивалась на уровне трех баллов или выше на момент поступления в PACU. Сначала определяли среднюю дозу каждого препарата в отдельности (E50), которая вызывала эффективную анальгезию у 50% пациентов, включённых в исследование. Вероятность того, что тяжесть боли, согласно NPS, составит менее трех баллов после введения испытуемых анальгетиков, моделировали с помощью метода Диксона — последовательного определения пороговой дозы «вверх и вниз» [23, 24]. Метод «вверх и вниз» с применением принципа «всё или ничего» позволяет определить пороговое значение какого-либо параметра, выше которого 50% участников положительно реагируют на экспериментальный стимул и ниже которого 50% участников реагируют отрицательно. После введения исходной дозы первому пациенту последующие дозы рассчитываются по следующему правилу: если участник реагирует положительно на введение препарата, доза для следующего пациента снижается на одну ступень, и наоборот, если участник реагирует отрицательно на проводимую терапию, для следующего больного доза повышается на одну ступень. После того как E50 для каждого препарата в отдельности была определена, проводили испытания их комбинации в фиксированном соотношении, которое устанавливали на основании найденных ЭД50, для чего вновь применяли метод «вверх и вниз» для определения величины E50 для сочетанной терапии. Поскольку метод Диксон позволяет определить только среднюю дозу лекарственного средства и стандартное отклонение и не даёт возможности вывести полную кривую зависимости исходов лечения от величины использованной дозы препарата, исследовали межлекарственное взаимодействие испытуемых анальгетиков с помощью классического изоболографического анализа [28].
Изоболографический анализ — это графический метод, который позволяет проследить влияние двух (или более чем двух) лекарственных средств при использовании их в комбинации [25–27].
Изобола — это контур, который соединяет две экспериментально установленные дозы для пары лекарственных средств, которые вызывают определённую ответную реакцию.
Изоболограммы — это диаграммы изобол, помещённые на картезианский график. Эффект воздействия считается суммированным, когда невозможно провести различие между двумя препаратами (в соотношении, соответствующем их относительной эффективности).
В классическом представлении Loewe [26], суммирование эффектов лекарственных средств представляется в виде прямой линии на изоболограмме. Таким образом, можно квалифицировать эффект исследуемого лекарственного взаимодействия как суммирующий, потенцирующий (синергический) или антагонистический (рис. 1). Доверительные границы на уровне 95% для комбинированной терапии определены путём соединения показателей 95% ДИ на обеих осях изоболограммы. Результат лекарственного взаимодействия считался суммированным, если эти границы накладывались друг на друга. В других случаях сочетанный эффект считался синергическим или антагонистическим. Демографические данные больных трёх групп исследования сравнивались с использованием критерия χ² или с помощью дисперсионного анализа в зависимости от конкретных условий. Развитие нежелательных явлений и побочных эффектов в группах сравнивали с использованием точного критерия Фишера. Значения E50 представлены с указанием 95% ДИ.
Результаты
Демографические данные участников в трёх группах исследования (возраст, соотношение полов, масса тела, тип и продолжительность операции) были сопоставимы (табл. 1). Алфентанил не вводили ни одному из пациентов. Число больных, получавших ремифентанил, было сопоставимым во всех трёх группах (табл. 1). Ни один пациент не был исключён из исследования, поскольку их исходная оценка по NPS оказалась ниже трех баллов. Все участники полностью выполнили программу испытаний. При поступлении в PACU на момент времени Т0 тяжесть болевого синдрома, согласно оценкам NPS, была сопоставимой во всех трёх группах исследования (табл. 1 и рис. 2).
Значения E50 для нефопама и кетопрофена составили 28 мг (17–39 мг) и 30 мг (14–46 мг) соответственно. Значения E50 для сочетанной терапии — 1,75 мг (0,9–2,3 мг) для нефопама и 4,3 мг (2,2–6,5 мг) для кетопрофена, что указывает на выраженный потенцирующий эффект комбинированного лечения. Последовательность эффективных и неэффективных результатов обезболивания показана на рис. 3, изоболограммы представлены на рис. 4. За период пребывания пациентов в PACU боли в животе, кожная сыпь или зуд, брадикардия и гипотония не наблюдались ни у одного пациента. В отношении частоты случаев потливости, тошноты, рвоты, сухости во рту, головной боли, седативной реакции, головокружения или тахикардии существенных различий между группами не отмечено. В группе кетопрофена жалобы на локальную боль, связанную с внутривенным введением препарата, наблюдались значительно чаще (табл. 2).
Таблица 1
Демографические данные 72-х пациентов
| Показатель | Нефопам (n = 24) | Кетопрофен (n = 24) | Нефопам плюс кетопрофен (n = 24) |
| Пол, м/ж | 16/8 | 11/13 | 15/9 |
| Возраст, лет | 40 ± 13 | 43 ± 13 | 47 ± 15 |
| Масса тела, кг | 73 ± 16 | 68 ± 13 | 70 ± 14 |
| Продолжительность операции, мин. | 104 ± 62 | 123 ± 54 | 135 ± 85 |
| Общая доза ремифентанила (число больных) | 1,95 ± 0,31 (8) | 1,84 ± 0,42 мг (9) | 1,86 ± 0,38 мг (5) |
| Общая доза суфентанила (число больных) | 30,0 ± 9,4/нг (12) | 35,0 ± 9,8/г (11) | 35,0 ± 10,6/г (19) |
| Операция | |||
| Ортопедическая | 8 (33%) Удаление ортопедического материала (n = 6) Сшивание сухожилия (рука) Тенолиз | 5 (21%) Удаление ортопедического материала (n = 4) Сшивание сухожилия (рука) | 4 (17%) Удаление ортопедического материала (n = 3) Экзостоз пальца ноги |
| ЛОР | 8 (33%) Операция на ухе (n = 6) Удаление зубов (n = 2) | 9 (37%) Операция на ухе (n = 7) Удаление зубов (n = 2) | 6 (25%) Операция на ухе (n = 2) Удаление зубов (n = 2) Удаление слюнной железы (n = 2) |
| На брюшной полости и урогенитальной области | 8 (33%) Герниорафия (n = 4) Холецистэктомия* (n = 2) Закрытие колостомы Спленэктомия* (частичная) | 10 (42%) Герниорафия (n = 7) Холецистэктомия* (n = 2) Спленэктомия* (частичная) | 14 (58%) Герниорафия (n = 7) Холецистэктомия* (n = 2) Закрытие колостомы (n = 2) Адреналэктомия* (n = 2) Аппендэктомия |
| NPS | |||
| T0 | 6 (4-8) | 5 (5-6,5) | 5 (4-6) |
| T 45 мин. | 5 (2-6) | 2,5 (1-5) | 3 (1-4) |
Таблица 2
Частота развития побочных эффектов
| Показатель | Нефопам (n = 24) | Кетопрофен (n = 24) | Нефопам + + кетопрофен (n = 24) |
| Потливость | 3 (12%) | 0 | 1 (4%) |
| Тошнота | 1 (4%) | 2 (8%) | 1 (4%) |
| Рвота | 0 | 1 (4%) | 0 |
| Головокружение | 4 (17%) | 0 | 2 (8%) |
| Сухость во рту | 10 (42%) | 8 (33%) | 6 (25%) |
| Боль в месте инфузии | 0 | 7 (29%)* | 2 (8%) |
| Головная боль | 0 | 1 (4%) | 2 (8%) |
| Боль в животе | 0 | 0 | 0 |
| Зуд | 0 | 0 | 0 |
| Кожная сыпь | 0 | 0 | 0 |
| Гипертензия | 0 | 1 (4%) | 3 (12%) |
| Тахикардия | 3 (12%) | 0 | 0 |
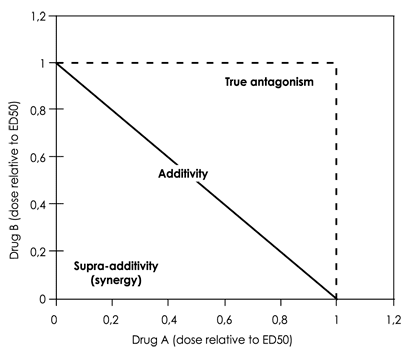
Рис. 1. Изоболограмма лекарственного взаимодействия типа «препарат–препарат». Изобола представлена в виде прямой линии, которая соединяет пары доз, которые вызывают одинаковую ответную реакцию (в данном случае средняя эффективная доза [Е50]). Результат лекарственного взаимодействия двух препаратов, комбинированных в соответствии и с их дозой Е50, тестируется путём нанесения на график точек с координатами доз, вызывающих ответную реакцию на уровне Е50. Комбинация обладает суммирующим эффектом, если точка расположена на изоболе; потенцирующим (синергическим), если точки находятся под изоболой; и взаимоподавляющим (антагонистическим) эффектом, когда координаты точки находятся выше изоболы. Например, эффект препарата А может составлять комбинированный эффект половины дозы препарата А и половины дозы препарата А или одной трети дозы препарата А и двух третей дозы препарата А.
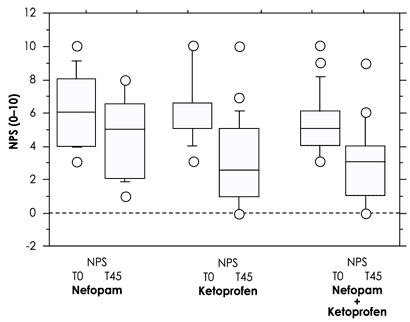
По оси абсцисс: непофам, кетопрофен, непофам + кетопрофен.
Рис. 2. Процентили значений числовой шкалы боли (NPS; от 0 до 10) в трёх группах перед введением препарата (T0) и через 45 мин. от начала лечения (ячейки), 10–90-е процентили (линии) и нетипичные значения (круги). Эффективность обезболивания на момент времени T45 оказалась ниже (хотя и незначительно) в группе нефопама, чем в других группах, вероятно, потому что исходная доза была далека от средней эффективной дозы в этой группе, что привело к тому, что качество анальгезии первых пациентов было низким (рис. 3).
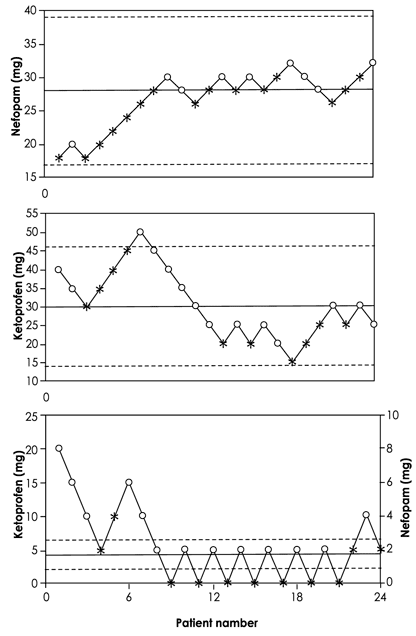
По оси абсцисс: номер пациента. По оси ординат: кетопрофен (мг); нефопам (мг).
Рис. 3. Последовательность дозирования в трёх группах больных, которым вводили нефопам, кетопрофен и сочетание нефопама и кетопрофена в соотношении 2,5/1. Качество обезболивания оценивали по цифровой шкале боли (от 0 до 10). Результат считали положительным (оценка <3 баллов) или отрицательным (оценка >3 баллов). Звёздочки обозначают отрицательный результат терапии (неэффективное обезболивание) и незакрашенные круги — положительный результат терапии (эффективное обезболивание). На каждом графике горизонтальные линии обозначают среднюю эффективную дозу (жирная линия) и её 95% доверительный интервал (пунктирные линии).
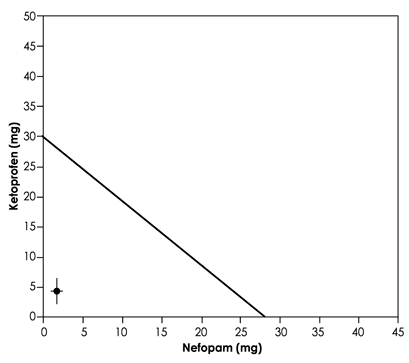
По оси абсцисс: нефопам (мг). По оси ординат: кетопрофен (мг).
Рис. 4. Изоболограмма лекарственного взаимодействия кетопрофена и нефопама. Линия, соединяющая средние эффективные дозы (E50) каждого препарата в отдельности (нефопам на оси X и кетопрофен на оси Y), представляет собой результат простого суммирования фармакологических эффектов. Значения ЭД50 показаны с доверительными 95% интервалами (жирные линии). Величина E50 для комбинированной терапии (в соотношении 2,5/1) показана в чёрном круге с 95% доверительным интервалом.
Обсуждение
Мы установили среднюю эффективную анальгезирующую дозу нефопама и кетопрофена при монотерапии и комбинированном лечении послеоперационного болевого синдрома средней степени тяжести. Комбинированная терапия нефопамом и кетопрофеном показала выраженный эффект потенцирования фармакологического действия испытуемых лекарственных средств.
Мы использовали метод последовательного определения эффективности лечения «вверх и вниз» для установления величины E50. На втором этапе исследования использовали изоболографический анализ для оценки эффективности межлекарственного взаимодействия при совместном применении обоих препаратов. Метод Диксона «вверх и вниз» позволяет определить E50 при включении в исследование меньшего числа пациентов, чем традиционные способы. В связи с этим данный метод широко используется для расчёта минимальной концентрации местных анестетиков, применяемых для регионарной анестезии, особенно в акушерской практике [29]. На втором этапе исследования использовали изоболографический анализ для сравнения E50 испытуемых препаратов по отдельности и при комбинированном назначении (рис. 1). Любопытно, что изоболографический анализ комбинации обезболивающих средств широко применяется в доклинических испытаниях, но очень редко в клинических экспериментах. Основываясь на нескольких предшествующих исследованиях [15, 20, 21, 3], мы хотели установить, обладает ли комбинация кетопрофена и нефопама эффектом взаимного усиления анальгетического действия.
В предыдущем исследовании [15] мы получили результат определения E50 при лечении нефопамом в дозе 17 мг (15,4–18,6 мг) в сравнимой группе больных, т. е. у пациентов с умеренным болевым синдромом в течение самого раннего этапа послеоперационного периода. В настоящем исследовании E50 была определена как 28 (17–39) мг, что также выше, чем 20 мг по рекомендации компании-производителя. Более высокий показатель E50 для нефопама по результатам текущего исследования по сравнению с предыдущими может объясняться тем, что мы оценивали тяжесть болевого синдрома через 45 мин. после 20-минутной инфузии лекарственных средств, а в первом исследовании эффективность анальгезии определяли через 30 мин. после начала 15-минутной инфузии препарата. Тем не менее в связи с тем, что границы ДИ относительно велики, различия в результатах этих исследований должны оцениваться с осторожностью. Если бы нефопам применяли в качестве монотерапии, нужно было бы использовать более высокие дозы препарата для того, чтобы достигнуть адекватный уровень анальгезии более чем у 90% больных.
Величина E50 для кетопрофена, широко используемого при ведении пациентов в послеоперационном периоде, никогда не изучалась. Мы определили E50 для кетопрофена на уровне 30 мг. Полученный результат находится в соответствии с эмпирическим опытом нашей клинической практики использования данного препарата в дозе 50 мг [31]. Это подтверждает целесообразность применения кетопрофена, как и большинства НПВС, для лечения послеоперационного болевого синдрома [32].
Значения E50 для сочетанной терапии нефопамом и кетопрофеном составили 1,75 мг (0,9–2,3 мг) для нефопама и 4,3 мг (2,2–6,5 мг) для кетопрофена, указывая на выраженный синергизм данной комбинации препаратов. Частично уменьшая местную воспалительную реакцию, кетопрофен имеет спектр анальгетической активности, который отличающийся от такового у других анальгетиков, таких как нефопам, действующих на центральные механизмы боли. Именно поэтому мы выбрали для исследования комбинацию кетопрофена и нефопама. Нефопам усиливает подавляющую активность нисходящих серотонинергических и норадренергических нисходящих нервных путей, блокируя транспорт дофамина, норадреналина и серотонина через синаптические мембраны [4]. Это подтверждается данными, полученными в работе Buritova и Besson [9], в которой показано влияние нефопама на экспрессию иммунореактивного белка с-Fos на уровне спинного мозга. Кетопрофен, как и другие НПВС, обладая частичным периферическим эффектом и уменьшая местную воспалительную реакцию [16, 18, 33, 34], тем не менее также влияет на центральные механизмы боли [18, 19, 34]. Таким образом, за счёт того, что кетопрофен и нефопам действуют на различные эффекторы и нервно-рефлекторные пути, они проявляют свойства синергизма при использовании в рамках комбинированной терапии. В предыдущих исследованиях мы изучали возможность синергической активности при сочетании морфина и нефопама — двух препаратов в основном центрального действия [15] — и комбинации морфина с трамадолом [30], также препаратов центрального действия. Ни одна из этих фармакологических комбинаций не проявила синергических свойств. Сочетание нефопама и кетопрофена явилось первым сочетанием, демонстрирующим синергический лечебный эффект в условиях клинических испытаний.
Как и ожидалось, в ходе исследования мы не наблюдали развития выраженных побочных эффектов. Низкая частота развития потливости у больных в группе нефопама (наиболее частая побочная реакция, типичная для данного лекарственного средства) может объясняться низкой скоростью введения препарата (20 мг в течение 20 мин.). Единственное различие между группами заключалось в том, что у пациентов, которым вводили кетопрофен, значительно чаще развивалась боль в месте внутривенного введения (29% пациентов), чем у пациентов в других группах исследования. Применение двух испытуемых препаратов в комбинации не снижало частоту возникновения побочных эффектов, вероятно, из-за того, что частота их развития была относительно низкой в ходе применения в качестве монотерапии (табл. 2). Тем не менее представляется благоприятной возможность использования минимальной дозы каждого препарата [35], так как комбинированная терапия потенциально может привести к снижению частоты развития и тяжести побочных эффектов.
В заключение следует отметить, что данное исследование является первым по определению средней эффективной анальгетической дозы (E50) кетопрофена (30 мг) для лечения послеоперационного болевого синдрома средней тяжести. Наряду с этим опыты комбинированной терапии нефопамом и кетопрофеном показали выраженный эффект потенцирования фармакологического действия испытуемых лекарственных средств. Мы полагаем, что причиной данного результата является воздействие на различные механизмы развития болевого синдрома. Необходимы дальнейшие исследования по сравнению комбинированной активности опиоидов, НПВС и парацетамола с целью дальнейшего выяснения механизмов межлекарственного взаимодействия фармакологических средств этой группы, что послужит основанием для улучшения результатов клинической практики.
Список литературы
