Послеоперационная боль: применение нестероидных противовоспалительных средств
Статьи| Предупреждение! Препарат рецептурного отпуска! Использовать только после назначения врача! |
Авторы: Никода В.В.
Издание: Российский научный центр хирургии РАМН.
СТАТЬЯ
Неудовлетворительная эффективность обезболивающей терапии в послеоперационном периоде остается одной из наиболее актуальных проблем в медицине. Несмотря на широкий выбор медикаментозного и немедикаментозного обезболивания, 33-75% пациентов жалуются на среднюю и сильную боль (Ferrante F.M., VadeBoncouer T.R. 1998).
"Хирургический" стресс и послеоперационная боль усиливают нагрузку на практически все жизненно важные системы организма. Напряжение функций этих систем, прежде всего кровообращения и дыхания, проявляется повышением давления, тахикардией, нарушением ритма сердца, учащением дыхания и т.д. К другим клиническим проявлениям "дискомфорта", обусловленного болью в раннем послеоперационном периоде, относятся: снижение двигательной активности, неспособность пациента откашливать мокроту и глубоко дышать, "вынужденное" положение, депрессивное состояние. Известно, что после операций на грудной клетке, эпигастральной области, у пациентов с неадекватным обезболиванием в ближайшем послеоперационном периоде, отмечаются нарушения функции внешнего дыхания: снижается жизненная емкость легких (ЖЕЛ) на 50-75%, функциональная остаточная емкость легких (ФОЕЛ). Spence A.A., Smith G.(1971) выявили различия вентиляционно-перфузионных отношений и альвеолярно-артериального градиента по О2 у больных при эффективном и неэффективном обезболивании. Снижение ФОЕЛ до 60% от исходной величины увеличивает количество осложнений в системе дыхания. Кроме того, снижение ФОЕЛ до 40% от исходной величины повышает тяжесть легочных осложнений. Наконец, неэффективное обезболивание в ближайшие сутки послеоперационного периода, возможно, служит одной из причин формирования впоследствии хронической боли, которая может сохраняться у пациентов в течение длительного времени.
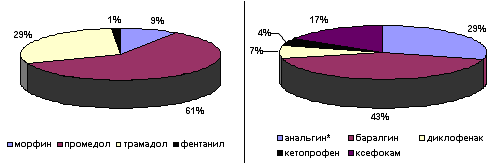
Появление умеренной или сильной боли в покое, при незначительных движениях заставляет пациента обратиться к медицинскому персоналу за болеутоляющим средством. Для лечения боли в послеоперационном периоде основной группой лекарственных средств остаются опиоидные аналгетики, которые по нашей оценке их назначают у 60% больных (рис. 1). В то же время, после обширных внутриполостных хирургических вмешательств, для достижения адекватного обезболивания у каждого третьего больного требуется введение опиоидов в дозах превышающих стандартно рекомендуемые (Лебедева Р.Н., Никода В.В., 1998). Очевидно, что тактика увеличения дозы опиоидных аналгетиков приводит к росту частоты побочных реакций: выраженной седации, угнетению дыхания, тошноты, рвоты, пареза ЖКТ, дисфункцию желче- и мочевыводящих путей. Желая избежать возникновение побочных эффектов при назначении опиоидов, врач ограничивает суточную дозу препарата, что является одной из основных причин неадекватного обезболивания. Двойственность положения заставляет клиницистов применять дополнительно препараты других лекарственных групп, способных потенцировать обезболивающий эффект опиоидов. Важным аспектом при этом, является возможность снижения дозы опиоидов.
Рис.1. Частота применения обезболивающих лекарственных средств у больных в раннем послеоперационном периоде (ноябрь 1998- ноябрь 1999 гг.)Примечание: * - назначался преимущественно в качестве жаропонижающего средства.
У больных в послеоперационном периоде патогенетически обоснованным является применение группы нестероидных противовоспалительных средств (НПВС). Медиаторы (серотонин, цитокины, лейкотриены, простагландины), выделяющиеся в месте повреждения тканей, стимулируют полимодальные ноцицепторы, которые вновь усиливают их выделение, снижая, таким образом, порог болевой чувствительности (первичная гипералгезия). Местный отек ткани, вследствие нарушения проницаемости капилляров, под воздействием гистамина, брадикинина, еще более сенситизирует рецепторы (вторичная гипералгезия). Простагландины усиливают проницаемость капилляров и повышают чувствительность ноцицепторов на столько, что даже невредные в норме стимулы (например, давление) вызывают боль.
В практике отделений интенсивной терапии применение неопиодных аналгетиков до недавнего времени ограничивалось их назначением при слабых или средних болях различного происхождения. (тематический сайт: Боль. Аналгезия. ).
Успехи фармакологии за последние два десятилетия привели к созданию новых препаратов для парентерального введения из группы НПВС (кеторолак, кетопрофен, лорноксикам), выделяющихся своей аналгетической активностью, позволяющей применять их сегодня наравне с опиоидными аналгетиками при острой боли (послеоперационная боль, ожоги, травма, почечная колика и т.д.). По сравнению с опиоидами их основные преимущества - минимальное влияние на состояние системы кровообращения и дыхания, моторику желудочно-кишечного тракта, тонус сфинктеров, отсутствие наркогенного потенциала. По нашим данным, обусловленное обезболивающим действием НПВС снижение потребности на 30-50% опиоидных аналгетиков у пациентов с острой болью является принципиальным положением, обосновывающим возможность альтернативного подхода в выборе аналгетических средств. На наш взгляд, обезболивание следует начинать с назначения НПВС (при отсутствии противопоказаний) в качестве "базисных" аналгетиков.
Значительное снижение (на 20-60%) потребления опиоидных аналгетиков (опиоид-сберегающий эффект) с одновременным улучшением качества обезболивания после различных хирургических вмешательствах отмечено многими авторами (Burns J.W.,1991; Kehlet H., Mather L.E. 1992; Merry 1992). Сочетанное применение опиоидов и представителей НПВС имеет ряд преимуществ по сравнению с монотерапией опиоидами: Реrttunen K.et al. (1992) отмечают после торакальных операций улучшение функции внешнего дыхания (менее значимое повышение раСО2, больше ЖЕЛ), Parker R.K., et al. (1994) указывают на более быстрое восстановление моторики ЖКТ у пациентов, оперированных в эпигастральной области.
В настоящее время, после небольших и малотравматичных операций целесообразно начинать обезболивание (при отсутствии противопоказаний) с монотерапии НПВС. Какие требования предъявляются сегодня к инъекционным НПВС, применяемым прежде всего в качестве аналгетиков?
Назначение НПВС, даже коротким курсом в послеоперационном периоде, может быть сопряжено с риском развития далеко небезобидных побочных эффектов. Противопоказания к назначению НПВС общеизвестны: повышенная чувствительность и аллергические реакции (отек Квинке, аллергический ренит, т.д.) на аспирин и другие представители группы НПВС, геморрагические диатезы, нарушение свертывающей системы крови, кровотечение в послеоперационном периоде, активная язва желудка или 12-перстной кишки (рецидивирующее течение), умеренные и тяжелые нарушения функции печени, почек, выраженная гиповолемия, предполагаемое или подтвержденное острое нарушение мозгового кровообращения, беременность.
Среди представителей группы НПВС для лечения послеоперационной боли заслуживают внимания такие аналгетики как кеторолак, кетопрофен, диклофенак и лорноксикам, которые существенно различаются фармакокинетическими и фармакодинамическими свойствами. Первые три - уже в течение длительного времени применяются для лечения острых болей. Одним из новых представителей группы НПВС является лорноксикам (ксефокам), который относится к группе оксикамов с короткой продолжительностью действия. Результаты лабораторно-экспериментальных исследований, свидетельствуют о выраженном обезболивающем и противовоспалительном действии препарата (табл.).
Таблица. Изучение противовоспалительной и аналгетической активности в экспериментальных исследованиях на животных.
| Тест системы для изучения противовоспалительных свойств (PrussT.P. и соавт., 1990): | Тест системы для изучения аналгетической активности: |
Механизм действия лорноксикама обусловлен подавлением синтеза простагландинов путем неселективного ингибирования активности циклооксигеназы-1 и -2. В отличие от других представителей группы НПВС лорноксикам не влияет на активность 5-липоксигеназы, не подавляет синтез лейкотриена из арахидоновой кислоты. Такое свойство лорноксикама McCormack K., (1994) считает важным, поскольку арахидоновая кислота и ее липоксигеназные метаболиты действуют как ретроградные медиаторы, влияющие на болевую импульсацию в спинном мозге. Возможны и другие механизмы обезболивающего действия лорноксикама: Kullich W., Klein G., (1992), отметили повышение уровня динорфина и (-эндорфина после внутривенного введения лорноксикама пациентам с болями в спине.
Фармакокинетические свойства. Лорноксикам, как и другие НПВС, при приеме внутрь быстро и полностью всасывается в желудочно-кишечном тракте, 99% его связывается с белками крови, период полувыведения, который не зависит от вводимой дозы, составляет 4 часа (Galbraith W.G. и соавт., 1990, Ankier S.I. и соавт., 1988). Лорноксикам подвергается метаболизму в печени, цитохромом Р450, преимущественно его изоферментом CYP-2C9. Неактивные метаболиты, производные 5-гидроксилирования, выводятся с мочей (1/3) и калом (2/3). Биодоступность лорноксикама при приеме внутрь и внутримышечном введении составляет 100%. Фармакинетические свойства лорноксикама у пациентов из "группы риска" (пожилой возраст, нарушение функции печени, почек) практически не меняются.
Исследования в клинике. Для изучения эффективности лорноксикама у пациентов острой болью его применяли в хирургии (Ilias W., Jansen M., 1996; Rosenow D.E., van Krieken I., Stolke D., et al., 1996, Rosenow D.E., и соавт., 1998; Staunstrup H., и соавт. 1999), при травме (Frensel W., Kursten F.W., 1995). Применение в течение первых послеоперационных суток лорносикама и морфина методом контролируемой пациентом аналгезии выявило практически их одинаковое потребление за указанный период времени - 20 мг и 22 мг, соответственно. При сравнении лорноксикама в различных дозах с петидином 50 мг, Rosenow E.D. и соавт. (1996) приходят к выводу, что при одинаковой эффективности аналгетиков (8 мг и 50 мг), переносимость первого была значительно лучше. Хотя в зарубежной литературе уже накоплен определенный опыт применения лорноксикама после ортопедических, гинекологических и стоматологических операций, в то же время его введение больным после обширных брюшнополостных операций представлено незначительным количеством работ.
Изучение эффективности и переносимости лорноксикама в зависимости от дозы (8-16 мг, 24-32 мг/сут) при обезболивании 52 пациентов, оперированных на органах брюшной полости (49%), легких и бронхах (29%), магистральных и периферических сосудах (22%), показало, что аналгетик обеспечивает адекватное обезболивание у 84% больных и обладает "опиоид-сберегающим" действием. Лорноксикам назначали по двум схемам: во-первых, стандартно - "при болях". Начальная разовая доза 8 или 16 мг, поддерживающая терапия - 8 мг два раза в сутки. Максимальная суточная доза у больных этой группы не превышала 16 мг (0,2 мг/кг). До начала обезболивания лорноксикама пациенты, получали промедол. Длительность проведения обезболивающей терапии лорноксикамом в указанной суточной дозе и при наличии болевого синдрома средней или сильной интенсивности составила 3 - 6 сут. Для повышения эффективности обезболивающей терапии назначали контролируемую пациентом аналгезию (Graseby PCA 3300) промедолом. При этом начальную дозу не применяли. Пациент получал в режиме "по требованию" только болюсные доза (3 мг) препарата.
По второй схеме, лорноксикам вводили у 22 пациентов внутривенно в виде постоянной инфузии в дозе 1 мг/час. в течение до 2 суток. При сильных болях перед началом постоянной инфузии вводили начальную дозу лорноксикама 8 мг. При недостаточном обезболивающем эффекте назначали промедол 20 мг (п/к).
Интенсивность боли на 2, 3 и 4 час после первой внутривенной инъекции лорноксикама в дозе 0,1 мг/кг массы тела исследования снизилась с 3,6±0,6 до 2,7±0,5, 2,7±0,7 и 2,9±0,7 (M?() соответственно (p<0,05). Эффективность первой дозы лорноксикама представлена на рис. 2.
Рис. 2. Эффективность лорноксикама у больных в раннем послеоперационном периоде
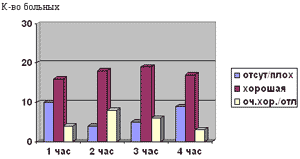
Максимальное снижение интенсивности болей после внутривенной инъекции лорноксикама зарегистрировано нами ко второму часу исследования. Необходимость в дополнительном введении аналгетиков (опиоидов) в первые сутки при обезболивании лорноксикамом по стандартной схеме отмечена у 90% больных. В этой связи мы считаем, что монотерапия лорнокикама в суточной дозе 16 мг является недостаточной у больных после обширных полостных операций. Именно эти данные послужили основанием для дальнейшего исследования лорноксикама в дозе 24-32 мг/сут. Применение лорноксикама в таких дозах позволяет, если не отказаться, то значительно сократить потребность в опиоидных аналгетиках (промедоле) - суточная доза промедола составила 46-27 мг, что практически составляет 50% от стандартно рекомендуемой дозы. Сокращение дозы вводимых опиоидов снижает частоту, характер и тяжесть нежелательных явлений, наблюдаемых при обезболивании в раннем послеоперационном периоде.
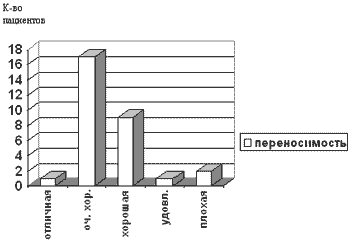
Оценка переносимости препарата. По данным исследования (II, III фазы), которое включало 4349 пациентов с длительностью приема лорноксикама до года, частота развития нежелательных явлений составляет 24,9% (Frenzel W., Kursten F.W.,1995). К наиболее частым нежелательным явлениям относятся: желудочно-кишечные осложнения (диспепсии, боль в животе, тошнота, диарея, рвота), при этом, прослеживается их дозо-зависимый характер. Исследования, выполненные на добровольцах с применением лорноксикама в течение 2-х недель (4 и 8 мг/сут.) не выявили изменений показателей гемостаза. Существенным отличием, которое рассматривается в качестве преимущества по сравнению с другими представителями группы НПВС, является тот факт, что при длительном приеме риск развития желудочно-кишечных расстройств не повышается у женщин и пациентов пожилого возраста. Результаты наших исследований демонстрируют хорошую переносимость и низкую частоту нежелательных явлений не зависимо от способа введения аналгетика (рис.3). При приеме внутрь и внутримышечном введении нежелательные реакции имели место соответственно у 5% (тошнота) и 10% больных (жар, потливость, головокружение, слабость) и не требовали проведения лечебных мероприятий. Важно подчеркнуть, что из сделанных 211 внутривенных инъекций больным в данном исследовании, ни у одного из них не возникло побочных явлений. Лорноксикам не влияет на показатели системной гемодинимики и дыхания при рутинном наблюдении в палате интенсивной терапии. Введение лорноксикама не оказывало влияния на уровень креатинина, аминотрансфераз (АЛТ, АСТ) сыворотки крови у больных в раннем послеоперационном периоде.
Рис. 3 Переносимость лорноксикама (за весь период наблюдения.)
Таким образом, лорноксикам является эффективным аналгетическим НПВС, обеспечивает адекватноое обезболивание у 84% больных в раннем послеоперационном периоде. Наиболее высокая эффективность прослеживается у пациентов на 3-4 послеоперационные сутки. Инъекционная форма лорноксикама (16-24 мг/сут), при отсутствии противопоказаний, может применяться для лечения умеренной и сильной боли у пациентов в раннем послеоперационном периоде, что позволяет сократить потребность в опиоидных аналгетиках, повысить качество аналгезии. Список литературы
