Современные представления о диагностике и лечении функциональной диспепсии
СтатьиОпубликовано в журнале:
«ФАРМАТЕКА», 2011, № 12, с. 44-48
А.Н. Иванов, А.С. Прянишникова, Л.П. Краснолобова
Кафедра гастроэнтерологии ФУВ РГМУ, Москва
Функциональная диспепсия (ФД) является хроническим заболеванием и широко распространена в мире. Она проявляется абдоминальной болью или дискомфортом в отсутствие ясной органической причины, которая могла бы выявиться при детальном обследовании. Римские критерии-III дали определение ФД и вариантов ее течения – постпрандиального дистресс-синдрома и эпигастрального болевого синдрома. Множественные механизмы, такие как замедленное опорожнение желудка, нарушенная желудочная аккомодация, увеличенная экспозиция соляной кислоты, висцеральная гиперчувствительность и дисфункция центральной нервной системы, вероятно, вовлечены в патогенез ФД. Хотя возможности лекарственной терапии ФД пока еще ограничены, накоплен опыт применения ингибиторов протонной помпы, прокинетиков, трициклических антидепрессантов и ряда альтернативных методик в лечении заболевания. Ключевые слова: функциональная диспепсия, моторика желудка, лекарственная терапия
Functional dyspepsia (FD) is widespread chronic disease in the world. It is manifested by abdominal pain or discomfort in the absence of a clear organic cause, which could be determined during the detailed examination. Rome III criteria have presented a definition of FD and versions of its course - postprandial distress syndrome and epigastric pain. Multiple mechanisms, such as delayed gastric emptying, impaired gastric accommodation, increased exposure of hydrochloric acid, visceral hypersensitivity and dysfunction of the central nervous system, are probably involved in the pathogenesis of FD. Although the possibilities of drug therapy of FD are still limited, the experience of use of proton pump inhibitors, prokinetics, tricyclic antidepressants, and a number of alternative methods for the treatment of this disease is accumulated. Key words: functional dyspepsia, gastric motor activity, drug therapy
В литературных источниках можно встретить различные определения термина “диспепсия”, который в переводе с греческого (‘δυς-’ – dys- и ‘πέψη’ – pepse)) означает “нарушенное пищеварение”. Первые упоминания о диспепсии известны с середины XVII века [1], в XVIII веке диспепсия считалась одним из “нервных расстройств” у пациентов с гипохлоргидрией и истерией [2]. В настоящее время под диспепсией понимают боль или ощущение дискомфорта, локализующиеся в верхней части живота – преимущественно по срединной линии [3].
Принято выделять органическую и функциональную диспепсию. Органическая диспепсия встречается у пациентов с заболеваниями, имеющими ясные анатомические и патофизиологические причины появления данных симптомов (язвенная болезнь, хронический панкреатит, желчекаменная болезнь и др.). Функциональная диспепсия (ФД) рассматривается с позиций Международной рабочей группы по разработке диагностических критериев функциональных гастроэнтерологических заболеваний как группа симптомов, относящихся к гастродуоденальной области, в отсутствие органических, системных или метаболических заболеваний, которые могли бы объяснить эти проявления (Римские критерии-III, 2006) [3].
Эпидемиология
Проведенные исследования показали высокую распространенность диспепсических жалоб среди населения развитых стран мира, которая, по некоторым данным, достигает 30–40 % [4, 5]. В широкомасштабном европейском популяционном исследовании было установлено, что в течение предшествовавших 12 месяцев симптомы ФД испытывали 20,6 % населения [6].
Отмечено, что симптомы ФД значительно чаще выявляются у женщин, чем у мужчин (24,4 и 16,6 % соответственно) [6]. По некоторым данным, частота выявления диспепсических симптомов существенно увеличивается с возрастом, не зависит от социального статуса и уровня урбанизации [6]. Показано, что влияние диспепсических симптомов на качество жизни сопоставимо у пациентов с ФД и хроническими “органическими” заболеваниями, такими как бронхиальная астма и воспалительные заболевания кишечника [7].
В последнее время пересмотрено отношение к хроническим воспали- тельным заболеваниям желудка и двенадцатиперстной кишки. На данный момент диагноз “функциональная диспепсия” объединяет пациентов с наличием диспепсических жалоб при таких заболеваниях, как хронический гастрит, хронический дуоденит и гастродуоденит без эрозивного поражения слизистой оболочки желудка и двенадцатиперстной кишки. Установлено, что не существует корреляции между выраженностью воспалительного процесса в слизистой оболочке желудка или двенадцатиперстной кишки и наличием, а также тяжестью диспепсических симптомов. Хронический гастрит выявляется приблизительно у 80 % лиц старше 40 лет, тогда как симптомы диспепсии – лишь у 30–40 % [5]. Таким образом, у каждого второго больного хроническим гастритом вообще отсутствуют какие-либо клинические проявления заболевания. Согласно современным представлениям, хронический гастрит и хронический дуоденит – это морфологические диагнозы, которые используют для описания гистологических изменений в слизистой оболочке желудка и двенадцатиперстной кишки (степени активности воспаления, наличия атрофии, метаплазии или дисплазии) и их связи с Helicobacter pylori-инфекцией.
Этиология и патогенез
Несмотря на многочисленные исследования патофизиологических механизмов ФД, проведенные в последние 20 лет во всем мире, определенной причины заболевания пока не установлено. ФД является, вероятно, гетерогенным расстройством с вовлечением в патогенез множественных механизмов (см. рисунок) [8].
Рис. Мнение международных экспертов по поводу назначения НПВС для купирования БС
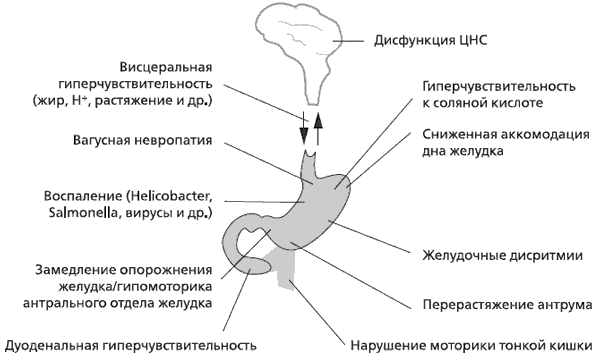
Наибольшее значение в возникновении диспепсических жалоб у больных ФД имеют нарушения моторики верхних отделов желудочно-кишечного тракта (ЖКТ), которые, по данным W. Sha и соавт. (2009), встречаются более чем у 2/3 пациентов [9]. Как известно, при поступлении пищевого комка в желудок происходит адаптивная релаксация его проксимальных отделов, необходимая для депонирования пищи без увеличения напряжения желудочной стенки. За счет перистальтики дна желудка его содержимое продвигается в дистальную часть желудка для перемешивания, измельчения и эвакуации. В обеспечении нормальной эвакуаторной функции желудка существенную роль играет антродуоденальная координация синхронизации перистальтики антрального отдела желудка с открытием пилорического сфинктера. У большинства пациентов с ФД выявляются нарушения антродуоденальной координации, ослабление постпрандиальной моторики антрального отдела желудка, нарушение распределения пищи внутри желудка (расстройства релаксации желудка; нарушенная аккомодация пищи в дне желудка), нарушения циклической активности желудка в межпищеварительном периоде – желудочные дисритмии (тахигастрия, брадигастрия, антральная фибрилляция), дуоденогастральный рефлюкс [5]. Длительное существование нарушений гастродуоденальной моторики и координации сокращений пилорического сфинктера ведет к развитию гастропареза (ослаблению моторно-эвакуаторной функции желудка).
Важную роль в возникновении диспепсических расстройств играет снижение порога чувствительности стенки желудка к растяжению (висцеральная гиперчувствительность). В недавнем исследовании S. Kindt и соавт. (2009) показали, что у пациентов с висцеральной гиперчувствительностью имела место более высокая скорость появления чувства насыщения и переполнения в эпигастрии [10].
Определенную роль в механизмах возникновения диспепсических расстройств при ФД может играть повышенная секреция соляной кислоты (HCl) париетальными клетками желудка, что подтверждается эффективностью применения у таких больных антисекреторных препаратов (ингибиторов протонной помпы и Н2-блокаторов). Однако у большинства пациентов с ФД выраженная гиперсекреция HCl не выявляется [11]. Вероятно, более существенное значение в механизмах возникновения симптомов диспепсии имеет не гиперсекреция HCl, а увеличение времени контакта кислого содержимого со слизистой оболочкой желудка и двенадцатиперстной кишки, а также гиперчувствительность ее хеморецепторов с формированием неадекватного ответа.
В последние годы активно изучается роль хеликобактерной инфекции при ФД. Известно, что инфицирование H. pylori приводит к развитию хронического хеликобактерного гастрита, сопровождающегося у ряда пациентов нарушением функции водителя ритма желудка, недостаточной фундальной релаксацией и ослаблением его постпрандиальной моторики, что ведет к нарушению моторно-эвакуаторной функции желудка с развитием гастропареза. Ингибирующее влияние H. pylori на моторику желудка оказывают цитокины интерлейкин-1b (ИЛ-1b), ИЛ-6, ИЛ-8 и фактор некроза опухоли α, вырабатываемые иммунокомпетентными клетками в ответ на продукты жизнедеятельности микро- организма в слизистой оболочке желудка [5]. Кроме того, хеликобактерная инфекция может способствовать развитию висцеральной гиперчувствительности и увеличению секреции HCl в слизистой оболочке желудка.
В некоторых исследованиях отмечена связь между появлением симптомов ФД и перенесенными острыми желудочно-кишечными инфекциями, вызываемыми Salmonella gastroenteritis [12] и Giardia lamblia [13].
Диспепсические расстройства нередко ассоциированы с нарушением центральной нервной регуляции функций верхних отделов ЖКТ. Изучение психологического статуса пациентов с ФД выявило частые нарушения сна, тревожность и депрессии, которые могут быть триггерами формирования циклических патологических процессов, вовлекающих центральную нервную систему (ЦНС) и ЖКТ [14]. Определенную роль в генезе ФД играют изменения уровней нейропептидов и кишечных гормонов, участвующих в регуляции моторики желудка и секреции HCl. Так, у пациентов с ФД выявлены изменения уровня общего и тощакового грелина [15], вырабатываемого в желудке, а также других кишечных гормонов (мотилина, холецистокинина, пептида YY, лептина) [8].
Классификация
В современной классификации функциональных желудочно-кишечных расстройств, предложенной в результате консенсуса 60 ведущих гастроэнтерологов мира (Римский консенсус-III, 2006), ФД отнесена к разделу гастро-дуоденальных заболеваний (категория В) [3] и значится в Международной классификации болезней 10-го пересмотра под шифром КЗ0.
Для более детального определения ФД с учетом ее патофизиологического механизма Римский консенсус-III разделил эту функциональную патологию на два новых варианта диспепсических симптомов, вызываемых приемом пищи (meal-induced dyspeptic symptoms):
1) эпигастральный болевой синдром;
2) постпрандиальный дистресс-синдром.
Как известно, в Римском консенсусе-II предлагалось подразделение ФД по доминирующему симптому – боль или дискомфорт – на три варианта:
1) язвенноподобный (преобладание боли);
2) дискинетический (преобладание дискомфорта);
3) неспецифический (без отчетливого преобладания).
Комитет экспертов исключил традиционный термин “дискомфорт” из определения диспепсии. Выделявшийся прежде 4-й вариант ФД (рефлюксоподобный) в настоящее время обоснованно отнесен к неэрозивной рефлюксной болезни (НЭРБ).
Диагностика и дифференциальный диагноз
Согласно положениям Римского консенсуса-III (2006), диагностическими критериями ФД являются “наличие симптомов постоянной или повторяющейся диспепсии в течение не менее 3 последних месяцев с началом клинических проявлений не позднее 6 месяцев перед постановкой диагноза при отсутствии органического заболевания, которое бы объяснило наличие данных симптомов”. Достоверными симптомами ФД международные эксперты признали эпигастральную боль, эпигастральное жжение, чувство переполнения (полноты) после еды, раннее насыщение (см. таблицу).
Таблица. Симптомы ФД и их определение (Римские критерии-III)
| Симптом | Определение |
| Эпигастральная боль | Боль определяется как субъективно неприятное ощущение; некоторые пациенты могут ощущать боль как “повреждение ткани” |
| Эпигастральное жжение | Жжение воспринимается как субъективно неприятное ощущение жара |
| Чувство переполнения (полноты) после еды | Неприятное ощущение, подобное длительному ощущению нахождения пищи в желудке |
| Раннее насыщение | Ощущение быстрого наполнения желудка после начала еды, непропорционального объему съеденной пищи, в связи с чем невозможно съесть пищу до конца |
Эпигастральный болевой синдром (ЭБС) характеризуется перемежающейся болью или ощущением жжения, локализующимися в эпигастральной области, возникающими не реже одного раза в неделю, не купирующимися после отхождения стула или газов и не соответствующими критериям диагностики желчекаменной болезни, заболеваний сфинктера Одди.
Постпрандиальный дистресс-синдром (ПДС) проявляется ощущением переполнения (полноты) после приема привычных объемов пищи и ранним насыщением, что препятствует завершению приема пищи и возникает несколько раз в неделю.
Диагноз ФД устанавливается посредством исключения органических заболеваний, которые могли послужить причиной появления диспепсии. Особого внимания требуют пациенты с т. н. симптомами тревоги – симптомами диспепсии, возникшими в возрасте старше 45 лет, дисфагией, рвотой с кровью, меленой, лихорадкой, немотивированной потерей массы тела, анемией, лейкоцитозом, повышением СОЭ. Пациентам проводят полный комплекс лабораторного обследования, включающий клинический анализ крови, мочи, кала, биохимический анализ крови. Всем пациентам обязательно проводят эзофагогастродуоденоскопию (Римские критерии-III, 2006) [3] и кроме того, доступными методами выявляют наличие обсеменения слизистой оболочки желудка H. pylori. По показаниям для исключения органической диспепсии также проводят ультразвуковое исследование органов брюшной полости, рентгеновское исследование желудка, реже – компьютерную и магнитно-резонансную томографию, 24-часовую интрагастральную и интрапищеводную рН-метрию. Для уточнения характера нарушений двигательной функции желудка применяют электрогастрографию, сцинтиграфию желудка, антродуоденальную манометрию, дыхательные тесты с меченым углеродом, спирулином, РЕТ-компьютерную томографию, радиокапсулы. Для выявления висцеральной гиперчувствительности слизистой оболочки желудка может быть использован желудочный баростат-тест. Нередко ФД приходится дифференцировать с синдромом раздраженного кишечника (СРК) и НЭРБ. Клинические проявления ФД отличаются от СРК отсутствием облегчения симптомов после дефекации и их связи с изменением частоты, а также характера стула. Затруднения также могут возникать в дифференциальной диагностике “изжоги” при НЭРБ и “эпигастрального жжения” при ФД. В данной ситуации немаловажно выделить, какие жалобы и симптомы доминируют в клинической картине. Нередко СРК, ГЭРБ и ФД сочетаются друг с другом [8], т. к. имеют общие патогенетические механизмы, связанные с нарушениями двигательной функции ЖКТ (эфферентное звено) и сниженным порогом восприятия раздражителей (афферентное звено).
Лечение
Лечение пациентов с ФД должно быть комплексным и включать нормализацию образа жизни, диетические рекомендации и медикаментозную терапию. Нормализация образа жизни подразумевает отказ от вредных привычек и по возможности устранение стрессовых факторов. Определенное значение в лечении пациентов с ФД имеет диетическое питание, которое должно быть дробным (5–6 раз в день), небольшими порциями, со сниженным содержанием жира, т. к. жир стимулирует выделение холецистокинина, замедляющего моторно-эвакуаторную функцию желудка.
Основными направлениями медикаментозной терапии у пациентов с эпигастральным болевым синдромом считают нормализацию экспозиции HCl в желудке, двенадцатиперстной кишке и снижение висцеральной гиперчувствительности. Среди антикислотных препаратов ингибиторы протонной помпы (ИПП) показали наибольшую эффективность при данном варианте течения ФД. Их применение (причем нередко в минимальных дозах) приводит к быстрому стиханию клинических проявлений. Так, по некоторым данным, эффективность половинной дозы ИПП (омепразол 10 мг, лансопразол 15 мг), принимаемой 1 раз в сутки, существенно не отличалась от таковой полной дозы препарата [16]. Н2-блокаторы были эффективными в купировании симптоматики у пациентов с ФД только при двукратном приеме (ранитидин по 150 мг, фамотидин по 20 мг 2 раза/ сут). Как показали некоторые исследования, результативность применения антацидных препаратов при ФД сопоставима с плацебо [5].
Препараты на основе солей висмута могут успешно использоваться в лечении ФД как в эрадикационных схемах H. pylori, так и в комбинации с ИПП в связи с их цитопротективными свойствами в отношении слизистой оболочки желудка. Другие цитопротективные препараты (сукральфат, мизопростол) оказались неэффективными при ФД [8].
Независимо от варианта течения ФД при выявлении хеликобактерного гастрита показано проведение эрадикационной терапии H. pylori с помощью одной из принятых схем тройной терапии или квадротерапии (Маастрихтские соглашения-III, 2005, и -IV, 2010). Успешная эрадикация H. pylori приводит к полному устранению диспепсических жалоб приблизительно у 20–25 % пациентов с ФД [5].
Поскольку в генезе ПДС ведущую роль играют нарушения двигательной функции верхних отделов ЖКТ; наиболее обоснованным в лечении таких больных является использование препаратов, нормализующих гастродуоденальную моторику (прокинетиков). В настоящее время ведущее место среди прокинетиков занимают блокаторы дофаминовых рецепторов. Препараты этой группы улучшают двигательную функцию главным образом проксимальных отделов ЖКТ, усиливая моторику пищевода, желудка и двенадцатиперстной кишки, улучшая гастродуоденальную координацию. Проведенные исследования показали, что длительное применение метоклопрамида невозможно вследствие частого развития побочных эффектов. При ФД наиболее показано применение периферического блокатора дофаминовых рецепторов домперидона. Данный препарат практически не проникает через гематоэнцефалический барьер, поэтому почти лишен центральных побочных эффектов, свойственных метоклопрамиду.
В проведенных исследованиях показана высокая эффективность курсового лечения ФД домперидоном в дозе 10–20 мг 3 раза/сут [5].
Среди массы лекарственных средств, используемых при лечении ФД, особое внимание обращает на себя комбинированный препарат Омез Д, в состав которого входят омепразол в дозе 10 мг и домперидон в дозе 10 мг. Данная комбинация позволяет осуществлять двунаправленное кислотосупрессивное и прокинетическое действия препарата, что значительно повышает результативность лечения и приверженность пациентов с ФД лечению. Омез Д обладает достаточно высокой безопасностью и может быть использован как в курсовой терапии ФД, так и в терапии “по требованию”. Наш собственный опыт применения препарата при лечении 30 пациентов с ФД показал его наиболее высокую эффективность в купировании симптоматики у больных ПДС. Так, полное купирование или значительное улучшение клинической симптоматики ФД после 4-недельного курса монотерапии препаратом в дозировке по 1 капсуле 2 раза/сут отмечено у 46,1 и 70,6 % больных ЭБС и ПДС соответственно. Пациентам с сохранившейся симптоматикой ФД увеличивали дозировку омепразола или заменяли антисекреторный препарат. Побочных эффектов на фоне приема Омез Д нами отмечено не было. Анализ результатов клинической апробации препарата свидетельствует о необходимости отказа от применения прокинетиков у пациентов с выраженной гиперацидностью желудочного содержимого, выявленной у некоторых пациентов с ЭБС. Ускорение эвакуации кислого желудочного содержимого в двенадцатиперстную кишку может приводить к увеличению времени закисления двенадцатиперстной кишки и дуоденальной гиперчувствительности, что, по-видимому, играет существенную роль в генезе клинических проявлений ФД [8]. Несмотря на невысокую частоту выявления гиперсекреции HCl при ФД [11], считаем обоснованным проведение интрагастральной рН-метрии пациентам с ЭБС для выявления выраженной гиперацидности желудочного содержимого и последующей коррекции терапии.
Некоторым пациентам с ФД показаны психотропные препараты, в частности седативные средства (диазепам и др.) и трициклические антидепрессанты (малые дозы амитриптилина), проведение рациональной психотерапии. Имеются сообщения об эффективности гипноза и акупунктуры при лечении таких пациентов [8].
Вместе с тем, несмотря на значительные успехи в изучении функциональных заболеваний желудка и двенадцатиперстной кишки, ряд вопросов остается нерешенным и нуждается в дальнейшем исследовании.
ЛИТЕРАТУРА
1. Baron JH, Watson F, Sonnenberg A. Three centuries of stomach symptoms in Scotland. Aliment Pharmacol Ther 2006;24:821–29.
2. Hare E. The history of ‘nervous disorders’ from 1600 to 1840, and a comparison with modern views. Br J Psychiatry 1991; 159:37–45.
3. Talley NJ, Ruff K, Jiang X, et al The Rome III classification of dyspepsia: will it help research? Dig Dis 2008;26:203–09.
4. Shaib Y, El-Serag HB. The prevalence and risk factors of functional dyspepsia in a multiethnic population in the United States. Am J Gastroenterol 2004;99: 2210–16.
5. Старостин Б.Д. Современные представления о функциональной (неязвенной) диспепсии // РМЖ 2000. № 3. С. 3–7.
6. Piessevaux H, De Winter B, Louis E, et al. Dyspeptic symptoms in the general population: a factor and cluster analysis of symptom groupings. Neurogastroenterol Motil 2009;21:378–88.
7. Sundberg R, Palmqvist M, Tunsater A, et al. Health-related quality of life in young adults with asthma. Respir Med 2009;103(10):1580–85.
8. Brun R, Kuo B. Functional dyspepsia. Therap Adv Gastroenterol 2010;3(3):145–64.
9. Sha W, Pasricha PJ, Chen JD. Correlations among electrogastrogram, gastric dysmotility, and duodenal dysmotility in patients with functional dyspepsia. J Clin Gastroenterol 2009;3(8):716–22.
10. Kindt S, Dubois D, Van Oudenhove L, et al. Relationship between symptom pattern, assessed by the PAGI-SYM(C) questionnaire, and gastric sensorimotor dysfunction in functional dyspepsia. Neurogastroenterol Motil 2009;21(11):1183– 205.
11. Collen MJ, Loebenberg MJ. Basal gastric acid secretion in nonulcer dyspepsia with or without duodenitis. Dig Dis Sci 1989;34:246–50.
12. Mearin F, Perez-Oliveras M, Perello A, et al. Dyspepsia and irritable bowel syndrome after a S. gastroenteritis outbreak: one-year follow-up cohort study. Gastroenterology 2005;129:98– 104.
13. Hanevik K, Dizdar V, Langeland N, et al. Development of functional gastrointestinal disorders after Giardia lamblia infection. BMC Gastroenterol 2009;9:27–8.
14. Gathaiya N, Locke III GR00, Camilleri M, et al. Novel associations with dyspepsia: a community-based study of familial aggregation, sleep dysfunction and somatization. Neurogastroenterol Motil 2009; 21(9):922–69.
15. Lee KJ, Cha DY, Cheon SJ, et al. Plasma ghrelin levels and their relationship with gastric emptying in patients with dysmotility-like functional dyspepsia. Digestion 2009;80:58–63.
16. Moayyedi P, Soo S, Deeks J, et al. Pharmacological interventions for non-ulcer dyspepsia. Cochrane Database Syst Rev 2006:CD001960–CD001960.
Информация об авторах
Иванов Александр Николаевич – кандидат медицинских наук, доцент кафедры гастроэнтерологии факультета усовершенствования врачей РГМУ;
Прянишникова Антонина Семеновна – кандидат медицинских наук, доцент кафедры гастроэнтерологии факультета усовершенствования врачей РГМУ;
Краснолобова Людмила Петровна – аспирант кафедры гастроэнтерологии факультета усовершенствования врачей РГМУ.
