Субклинический гипотиреоз: обзор доказательной базы 2014 года
Статьи Опубликовано в журнале:
« Клинические обзоры в эндокринологии » июнь, 2015, № 2 Расширенный реферат статьи Baumgartner C., Blum M.R., Rodondi N. Subclinical hypothyroidism: summary of evidence in 2014 // Swiss Med Wkly, 2014, Dec 23, 144.
Реферат подготовлен Ю.П. Сыч
Субклинический гипотиреоз (СГ), который определяется как изолированное повышение уровня тиреотропного гормона (ТТГ) при сохранении нормальных концентраций свободного тироксина, частое состояние, распространенность которого увеличивается с возрастом до 18 % среди пожилых людей, особенно среди женщин. Проспективные исследования продемонстрировали увеличение риска сердечно-сосудистых коронарных событий, сердечной недостаточности и сердечно-сосудистой смертности среди пациентов с СГ. Неоднозначна связь СГ с когнитивными расстройствами, депрессией и риском переломов. По-прежнему нет однозначного мнения о скрининге и лечении СГ, хотя продолжающееся рандомизированное европейское контролируемое исследование TRUST призвано ответить на существующие вопросы. Этот обзор посвящен анализу накопленных клинических данных, а также существующим рекомендациям по скринингу и лечению СГ у взрослых.
Субклинический гипотиреоз
Биохимически субклинический гипотиреоз (СГ) определяется как повышение уровня тиреостимулирующего гормона (ТТГ) в сочетании с нормальным уровнем свободного тироксина (fT4) [1], хотя референсные границы ТТГ в настоящее время активно обсуждаются [2]. Распространенность СГ среди взрослых варьирует от 3 до 18 %, повышаясь среди женщин, пожилых людей и жителей регионов с нормальным йодным обеспечением [3]. 94 % врачей общей практики за год ставят хотя бы один диагноз СГ [4, 5].
Несмотря на большую распространенность, однозначных выводов о пользе скрининга и лечения СГ пока нет [2]. Наиболее частой причиной развития СГ является аутоиммунный тиреоидит, сопровождающийся носительством антител к тиреоидной пероксидазе [6]. СГ обычно бессимптомен, но некоторые пациенты могут предъявлять неспецифические жалобы на слабость, усталость, прибавку веса, запоры, что характерно и для явного гипотиреоза [6].
Нежелательные последствия явного гипотиреоза хорошо известны. Учитывая роль тиреоидных гормонов в функционировании сердечно-сосудистой системы, головного мозга и костной ткани, можно ожидать, что неблагоприятные изменения произойдут и при субклиническом на рушении функции щитовидной железы. В табл. 1 представлены доказательные данные о связи между СГ и различными клиническими состояниями. Ранее были опубликованы два систематических обзора [7, 8] и два несистематических обзора [6, 9], посвященных скринингу и лечению СГ, а также систематические обзоры по оценке рисков СГ [10, 11]. Настоящий обзор охватывает информацию этих публикаций и дополнительных исследований, опубликованных до 2014 г. (по анализу базы данных Pubmed).
Естественное развитие СГ и прогрессирование до явного гипотиреоза
В среднем у 2-6 % пациентов СГ за год переходит в манифестный гипотиреоз; риск развития манифестного гипотиреоза выше у женщин, лиц с высоким уровнем ТТГ и у носителей антител к тиреопероксидазе [12]. Без лечения ТТГ нормализуется примерно у 15-65 % пациентов за период наблюдения от года до 6 лет, чаще — при уровне ТТГ менее 10 мМЕ/л [13].
Уровень ТТГ подвержен суточным колебаниям и достигает максимальных значений в ночное время. У одного и того лее человека он может меняться в течение месяца под действием физических нагрузок или недостаточного сна [14]. Известно, что уровень ТТГ увеличивается с возрастом, однако это может не сопровождаться увеличением смертности [15] и быть обусловлено долгожительством, по мнению авторов исследования Leiden 85+ [16].
Другие причины транзиторного повышения ТТГ в отсутствие патологии щитовидной железы включают в себя период выздоровления после тяжелых заболеваний (euthyroid sick syndrome), ожирение, надпочечниковую недостаточность, проблемы с определением ТТГ (например, присутствие гетерофильных антител), лекарственные препараты (амиодарон, сертралин, литий, ингибиторы тирозинкиназы и др.), хроническую почечную недостаточность, центральный гипотиреоз, редкие случаи мутаций, инактивирующих рецептор ТТГ [9]. По результатам популяционного Викгемского исследования уровень ТТГ выше 2 мМЕ/л уже сопровождается повышенным риском развития гипотиреоза в будущем [12]. В настоящее время ведутся активные дискуссии по поводу верхней границы референсных значений ТТГ [14]. Если снизить границу референсных значений, то миллионы людей окажутся в состоянии СГ; в отсутствие убедительных доказательств нежелательных последствий СГ этот факт используется как аргумент против сужения референсного диапазона уровней ТТГ [14].
Таблица 1.
Уровень доказательности в 2014 г. для риска и пользы терапии СГ
| Клинический параметр | Сила взаимосвязи | Польза терапии | |
|---|---|---|---|
| ТТГ 4,5 - 9,9 мМЕ/л | ТТГ ≥ 10 мМЕ/л | ||
| Прогрессирование до явного гипотиреоза | Хорошая | Сильнее | Выраженная, особенно при ТТГ ≥ 10 мМЕ/л |
| Повышение общего холестерина и ЛНП | Слабая | Сильнее | Недостаточна |
| Риск ИБС | Недостаточная | Сильнее | Нет данных |
| Риск застойной сердечной недостаточности | Недостаточная | Сильнее | Нет данных |
| Дисфункция сердца | Недостаточная | Недостаточная | Нет данных |
| Системные симптомы гипотиреоза | Недостаточная | Недостаточная | Недостаточна |
| Нейропсихические симптомы (депрессия, когнитивные нарушения) | Недостаточная | Недостаточная | Недостаточна |
| Мышечная сила | Недостаточная | Недостаточная | Недостаточна |
| Слабость | Недостаточная | Недостаточная | Недостаточна |
| Риск терапии | |||
| Развитие субклинического тиреотоксикоза | 14-21 % | ||
| Приводится с изменениями по [59]. LDL — холестерин ЛНП; ТТГ — тиреостимулирующий гормон. | |||
Сердечно-сосудистый риск и сердечная недостаточность
Известна роль тиреоидных гормонов в работе сердца и состоянии сосудов, поэтому последние годы активно изучается влияние СГ на сердечно-сосудистую систему. СГ может приводить к изолированному снижению систолической и диастолической функции сердца [17], повышению жесткости сосудистой стенки и эндотелиальной дисфункции [18]. Объединенный анализ индивидуальных данных выявил повышение частоты случаев сердечной недостаточности среди пациентов с уровнем ТТГ 10 мМЕ/л и выше в сравнении с эутиреоидным контролем с отношением рисков (ОР) 1,86 (95 % ДИ 1,27–2,72) [11] (табл. 2).
Таблица 2.
Риск смерти и событий ишемической болезни сердца (ИБС) и сердечной недостаточности в зависимости от уровня тиреотропного гормона
| Уровень ТТГ | ОР для смерти от ИБС (95 % ДИ) | ОР для событий ИБС (95 % ДИ) | ОР для СН (95 % ДИ) |
|---|---|---|---|
| 10,0–19,9 мМЕ/л | 1,58 (1,10-2,27) | 1,89 (1,28-2,80) | 1,86 (1,27-2,72) |
| 7,0-9,9 мМЕ/л | 1,42 (1,03-1,95) | 1,17 (0,96-1,43) | 1,65 (0,84-3,23) |
| 4,5-6,9 мМЕ/л | 1,09 (0,91-1,30) | 1,00 (0,86-1,18) | 1,01 (0,81-1,26) |
| 0,45-4,49 мМЕ/л* | 1,00 (референс) | 1,00 (референс) | 1,00 (референс) |
| 0,10-0,44 мМЕ/л | 1,24 (0,96-1,61) | 1,27 (1,03-1,58) | 1,31 (0,88-1,95) |
| 1,84 (1,12-3,00) | 1,08 (0,69-1,69) | 1,94 (1,01-3,72) | |
| С изменениями по [10, 11, 27]. ИБС — ишемическая болезнь сердца; ДИ — доверительный интервал; ОР — отношение рисков (с поправкой на пол и возраст); ТТГ — тиреостимулирующий гормон, СН — сердечная недостаточность. *ТТГ 0,5–4,49 мМЕ/л для связи субклинического гипотиреоза и смертей или событий ИБС. | |||
СГ сопряжен с повышенным риском фатальной и нефатальной ишемической болезни сердца (ИБС) [10]. В анализе данных 55 тыс. пациентов с ИБС ОР с поправкой на возраст составило 1,89 (95 % ДИ 1,28–2,80) для событий ИБС при ТТГ выше 10 мМЕ/л [10] в сравнении с эутиреозом и 1,58 (95 % ДИ 1,10–2,27) для летальной ИБС (табл. 2). Эти риски не увеличивались у лиц с уровнем ТТГ ниже 7 мМЕ/л, при этом смертность от всех причин не повышалась с увеличением ТТГ. Другое, позже опубликованное исследование также не выявило увеличения общей смертности у пожилых пациентов с СГ [15]. В исследовании Leiden 85+ Study, напротив, было продемонстрировано снижение сердечно-сосудистой и общей смертности у лиц с СГ старше 85 лет [16]. Увеличение сердечно-сосудистого риска, связанное с повышением уровня ТТГ выше 10 мМЕ/л, может быть объяснено несколькими причинами. При СГ повышается уровень холестерина и развивается дислипидемия [19].
В систематическом обзоре 13 гетерогенных исследований было показано, что заместительная терапия левотироксином при СГ приводит к снижению концентраций холестерина ЛНП и общего холестерина [20]; такие же результаты были получены в рандомизированных контролируемых исследованиях (РКИ) [18].
Связь между СГ и артериальной гипертензией неоднозначна, в ряде работ СГ сопровождается повышением артериального давления [21], а в других — нет [22]. В интервенционном исследовании среди 56 женщин с СГ обнаружено повышение систолического и диастолического давления, сывороточных концентраций холестерина и гомоцистеина в сравнении со здоровой контрольной группой, с последующей нормализацией этих параметров через 18 месяцев заместительной терапии левотироксином [23].
В другом проспективном когортном исследовании описано увеличение распространенности, но не заболеваемости метаболическим синдромом среди взрослых с СГ [24], а в другом когортном исследовании СГ не сопровождался изменением веса пациентов [25]. В повышение сердечно- сосудистого риска при СГ также вносят вклад увеличение толщины интима-медиа в артериях [19], склонность к гиперкоагуляции, резистентность к инсулину, окислительный стресс [6] и эндотелиальная дисфункция [18]. На фоне заместительной терапии левотироксином у лиц с СГ отмечено уменьшение толщины интимы-меда в сонных артериях [19] и улучшение функции эндотелия [18], улучшение функции сердца [17]. Такая терапия может способствовать снижению риска ИБС у относительно молодых пациентов с СГ, но не у лиц старше 70 лет [26]. Адекватных РКИ, посвященных изучению сердечно-сосудистых событий при восстановлении эутиреоза, пока мало.
В отличие от известного риска развития мерцательной аритмии при субклиническом тиреотоксикозе [27], существуют данные о том, что СГ может оказывать протективный эффект в отношении фибрилляции предсердий [28].
Таблица 3.
Рекомендации по скринингу субклинического гипотиреоза у взрослых
| Организация | Рекомендации по скринингу |
|---|---|
| Американская тиреодологическая ассоциация, Американская ассоциация клинических эндокринологов и Эндокринологическое общество | Рутинное обследование у всех взрослых, включая беременных и планирующих беременность женщин, особенно при наличии симптомов гипотиреоза |
| Колледж американских патологов | Женщины > 50 лет, обращающиеся к врачу, все госпитализируемые пожилые пациенты или у всех каждые пят лет |
| Американская академия семейных врачей | Пациенты > 60 лет |
| Американский колледж акушеров и гинекологов | Пациенты высокого риска (аутоиммунные заболевания, заболевания щитовидной железы в семье) |
| Американский колледж врачей | Женщины > 50 лет с недавно возникшими симптомами гипотиреоза |
| Королевский колледж врачей | Скрининг не показан |
| U.S. Preventive Services Task Force | Недостаточно данных за или против скрининга |
| Шведское общество эндокринологии и диабета [55] | Женщины в возрасте > 40 лет, неспецифические жалобы, пожилые пациенты, пациенты группы риска: после лечения тиреотоксикоза, сочетанные аутоиммунные заболевания, курильщики |
| С изменениями по [59] | |
Скелетные мышцы и общая активность
Пациенты с СГ часто страдают от общей слабости и болей в мышцах [29], и у них действительно выявляется снижение мышечной силы [30]. Терапия левотироксином устраняет мышечную слабость [30] и увеличивает кардиореспираторную выносливость при физических нагрузках [31]. Причиной развития мышечной слабости при СГ может быть неадекватное поступление кислорода в мышцы [31] на фоне сопутствующей анемии [32]. Однако одно крупное когортное исследование не выявило уменьшения подвижности или снижения функциональных способностей у пожилых людей с СГ [33, 34]. При явном гипотиреозе повышенный ТТГ напрямую влияет на метаболизм костной ткани, подавляя образование и выживаемость остеокластов, дифференцировку остеобластов и экспрессию коллагена 1 типа [35]. В одном проспективном когортном исследовании у 3567 пациентов с СГ и длительностью наблюдения до 13 лет повышение риска перелома бедра отмечено у мужчин (ОР с множественными поправками 2,31; 95 % ДИ 1,25–4,27), но не у женщин [36]. В другом проспективном норвежском исследовании у 25 205 человек значимой связи переломов бедра или предплечья с уровнем ТТГ получено не было; исключение составила отдельная подгруппа женщин с ТТГ > 4,0 мМЕ/л и отрицательными антителами к тиреопероксидазе, где ОР для переломов бедра составило 1,75 (95 % ДИ 1,24–2,46) [37].
Нейропсихические симптомы
Предположительно существует связь СГ с нарушениями настроения, включая тревогу и депрессию [38], и со снижением качества жизни [18], хотя это подтверждается не всеми исследованиями [39]. У пациентов с СГ часто терапия депрессии оказывается малоэффективной [40]. Информация о когнитивных нарушениях при СГ также неоднозначна [16, 41]. В недавнем популяционном исследовании среди 2050 человек, в том числе 141 с СГ, не была доказана связь гипотиреоза и легких когнитивных нарушений [42]. В самом крупном на текущий момент РКИ по оценке влияния заместительной терапии левотироксином на когнитивные функции у 94 пожилых пациентов с СГ за 12 месяцев лечение не привело к существенному улучшению когнитивных способностей [43].
Другие клинические проявления СГ
При явном гипотиреозе хорошо известным симптомом является снижение моторики желудочно-кишечного тракта с развитием запоров. В одном исследовании описано снижение моторики кишечника у женщин пременопаузального возраста с СГ [44]. Учитывая потенциальную связь СГ и метаболического синдрома, Chung и соавт. провели одномоментное исследование и обнаружили дозозависимую взаимосвязь между уровнями ТТГ и выраженностью неалкогольной жировой болезни печени у пациентов с СГ [45].
Пока не получено убедительных данных о связи между СГ и анемией [46]. В двух РКИ добавление к терапии левотироксина у пациентов с СГ и железодефицитной анемией сопровождалось более выраженным увеличением содержания гемоглобина и ферритина, чем при монотерапии солями железа [32, 47]. Но в другом РКИ с участием 66 женщин с СГ восстановление эутиреоза не привело к такому изменению [48].
Субклинический гипотиреоз и беременность
Тиреоидные гормоны необходимы для нормального развития плода. Не только явный, но и СГ в период беременности приводит к нежелательным последствиям для матери и ребенка. СГ выявляется у 0,5–2,5 % женщин репродуктивного возраста и может приводить к повышению частоты отслойки плаценты [49], спонтанному прерыванию беременности [50], геста-ционной гипертензии и тяжелой преэклампсии [51]. У женщин с СГ повышен риск преждевременных родов [49], СГ также может отчасти объяснять развитие перинатальных осложнений, наблюдаемых у детей, рожденных от таких матерей, включая неонатальный дистресс-синдром, раннюю перинатальную смертность [49, 50]. Пока не установлено, приводит ли СГ матери к нарушениям когнитивного развития детей [52].
Рекомендации по скринингу и лечению
В связи с отсутствием крупных РКИ по оценке клинических последствий СГ, имеющиеся рекомендации по скринингу и лечению основываются на данных обсервационных и небольших клинических исследований, а также на мнениях экспертов. Рекомендации по скринингу сильно отличаются в разных профессиональных объединениях (табл. 3) [6]. В целом скрининг СГ в общей популяции не рекомендуется и может быть применен только у ограниченного числа пациентов с аутоиммунными заболеваниями, заболеваниями щитовидной железы в семье и предъявляющих специфические жалобы (табл. 3). У беременных женщин без характерных симптомов большинство профессиональных сообществ рекомендуют избирательное проведение скрининга, например при проживании женщины в условиях йодного дефицита, при наличии ожирения, сахарного диабета 1 типа, заболеваниях щитовидной железы у родственников или случаях самопроизвольных абортов или преждевременных родов в анамнезе [53].
Главным вопросом остается дилемма: лечить или не лечить СГ. Несколько интервенционных плацебо-контролируемых исследований изучали эффекты тироксина у пациентов с СГ в отношении различных параметров, таких как суррогатные маркеры сердечнососудистого риска [19], функции сердца [17], расстройств настроения [54] и когнитивных функций [43]. Главными ограничениями этих работ были небольшие размеры выборок (до 110 участников) и небольшая продолжительность. Кохрановский систематический обзор, опубликованный в 2007 г., продемонстрировал положительное влияние заместительной терапии тироксином на суррогатные параметры сердечно-сосудистого риска, такие как уменьшение дислипидемии и улучшение функции сердца, но реальные клинические исходы не могли быть оценены по имевшимся данным. Поэтому авторы не могли дать четкого заключения об эффективности и безопасности терапии тироксином при СГ и предложили подходить к ее назначению индивидуально [7]. В табл. 1 суммированы эффекты заместительной терапии в отношении различных клинических состояний.
Большинство экспертов рекомендуют начинать терапию СГ при уровне ТТГ > 10 мМЕ/л [2]. Для лиц с умеренно повышенным ТТГ (4,5–10 мМЕ/л) рекомендуется контролировать уровень ТТГ каждые 6–12 месяцев [2] без назначения терапии [1]. Шведское общество эндокринологии и диабета рекомендует назначать лечение СГ в зависимости от стратифицированного риска, с уровня ТТГ > 10 мМЕ/л, наличия зоба, антитиреоидных антител, факторов сердечно-сосудистого риска или наличия ИБС, курения, дислипидемии, овариальной дисфункции или бесплодия или беременности [55]. У беременных женщин с уровнем ТТГ выше допустимого для конкретного триместра или у планирующих беременность женщин с ТТГ > 2,5 мМЕ/л рекомендуется назначение левотироксина [2, 53]. Все эти рекомендации основаны на мнении экспертов при отсутствии данных рандомизированных клинических исследований. Шведские рекомендации советуют назначать лечение у лиц старше 50 лет или с сопутствующей ИБС с 25 мкг левотироксина в сутки; для всех остальных пациентов доза левотироксина может составлять от 50 до 75 мкг в сутки, поддерживающая ТТГ — в пределах референсных значений [55].
Европейская тиреоидная ассоциация аналогичным образом рекомендует начинать терапию тироксином с 25–50 мкг в сутки для пожилых пациентов или лиц с сопутствующими сердечно-сосудистыми заболеваниями и для остальных пациентов — из расчета 1,5 мкг/кг веса в сутки [56]. До назначения лечения рекомендуется повторить определение ТТГ через 3–6 месяцев в связи с высокой частотой его спонтанной нормализации. Риски заместительной терапии могут быть связаны только с передозировкой, которая выявляется у 14–21 % пациентов [3] и может приводить к нарушениям сердечного ритма [1] и снижению минеральной плотности костей с повышением риска переломов [57].
Несмотря на отсутствие хорошей доказательной базы, назначение левотироксина неуклонно увеличивается. Частота его назначения при СГ сильно варьирует между странами, от 35 % в Нидерландах до 75 % в Германии [4].
Несколько экспертов призвали к проведению РКИ для того, что устранить имеющиеся разногласия в заместительной терапии СГ [1, 2, 7].
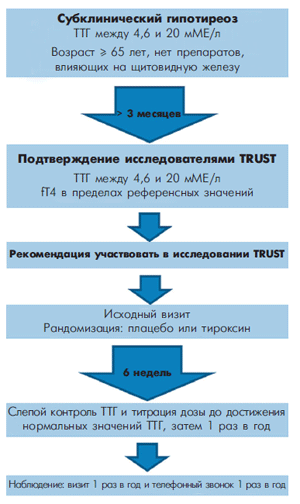
Рисунок. Исследование TRUST. Процесс отбора пациентов для исследования TRUST:
подтверждение субклинического гипотиреоза и план визитов.
С изменениями из [59].
fT4 — свободный тироксин; ТТГ — тиреостимулирующий гормон.
Заключение и перспективы: исследование TRUST
Чтобы устранить неясности в вопросах рисков и преимуществ терапии у пожилых людей с субклиническим гипотиреозом, было инициировано первое адекватно организованное РКИ [58] — исследование TRUST (Thyroid hormone Replacement for Untreated older adults with Subclinical hypothyroidism — Заместительная терапия тиреоидными гормонами у ранее нелеченых пожилых пациентов с субклиническим гипотиреозом): рандомизированное контролируемое, многоцентровое европейское исследование. Оно проводится в пяти центрах четырех европейских стран — Швейцарии, Шотландии, Ирландии, Нидерландов (рисунок) и исследует эффекты заместительной терапии гормонами щитовидной железы в сравнении с плацебо у пожилых пациентов с персистирующим СГ. В это исследование планируется включить 3000 человек в возрасте 65 лет или старше, со стабильным СГ, который определяется как уровень ТТГ от 4,6 до 19,9 мМЕ/л, двукратно или более измеренных с интервалом не менее трех месяцев, в сочетании с нормальным содержанием fT4.
С целью получить результаты, которые могли бы быть предложены практическим врачам, в исследовании определены только несколько критериев исключения: прием препаратов, влияющих на функцию щитовидной железы, хирургическое вмешательство на щитовидной железе или терапия радиоактивным йодом в анамнезе, IV класс сердечной недостаточности по классификации NYHA, недавняя госпитализация по поводу тяжелых состояний для исключения «синдрома эутиреоидного больного», ранее установленный диагноз деменции, острый коронарный синдром за последние четыре недели. Участники исследования рандомизируются для терапии плацебо или левотироксином в стартовой дозе 50 мкг в сутки (25 мкг для пациентов с весом менее 50 кг или с ИБС в анамнезе) с последующей титрацией дозы до достижения целевых значений ТТГ.
Период наблюдения составит от года до четырех лет — до получения необходимого количества сердечно-сосудистых и других клинических исходов, которые включают в себя фатальные и нефатальные сердечно-сосудистые события, болезнь-специфическое качество жизни (первичные конечные точки), оценку мышечной силы, артериальное давление, когнитивные функции, общую работоспособность, общее качество жизни и смертность. Литература 1. Helfand M. Screening for subclinical thyroid dysfunction in nonpregnant adults: a summary of the evidence for the U.S. Preventive Services Task Force // Ann Intern Med. 2004; 140 (2): 128–41. Epub 2004/01/22. PubMed PMID: 14734337.
2. Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH, et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management // JAMA: the journal of the American Medical Association. 2004; 291 (2): 228–38. Epub 2004/01/15; doi: 10.1001/ jama.291.2.228. PubMed PMID: 14722150.
3. Canaris GJ, Manowitz NR, Mayor G, Ridgway EC. The Colorado thyroid disease prevalence study // Arch Intern Med. 2000; 160 (4): 526–34. Epub 2000/03/01. PubMed PMID: 10695693.
4. Virgini V, Baumgartner C, Bischoff T, Haller DM, Frey P, Rosemann T, et al. Comment les medecins de famille prennentils en charge l’hypthyroidie infraclinique? // Revue medicale suisse. 2014; 10 (420): 526–9. Epub 2014/04/08. PubMed PMID: 24701670
5. den Elzen WP, Lefabrevan de Fliert AA, Virgini V, Frey P, Mooijaart SP, Kearney P, et al. International variation in GP treatment strategies for subclinical hypothy-roidism in older adults // Br J Gen Pract. In press.
6. Biondi B, Cooper DS. The clinical significance of sub- clinical thyroid dysfunction // Endocr Rev. 2008; 29 (1): 76–131. Epub 2007/11/10; doi: 10.1210/er.2006–0043. PubMed PMID: 17991805
7. Villar HC, Saconato H, Valente O, Atallah AN. Thy- roid hormone replacement for subclinical hypothy-roidism. The Cochrane database of systematic reviews. 2007 (3): CD003419. Epub 2007/07/20; doi: 10.1002/14651858.CD003419.pub2. PubMed PMID: 17636722.
8. Rugge B, Balshem H, Sehgal R, Relevo R, Gorman P, Helfand M. Screening and treatment of subclin-ical hypothyroidism or hyperthyroidism. Comparative Effectiveness Reviews, No.24. Rockville (MD): Agency for Healthcare Research and Quality (US). 2011. http: //effectivehealthcare.ahrq.gov/ehc/ products/129/750/Hypo-Hyper-Thyroid_ CER24_20111114.pdf.
9. Cooper DS, Biondi B. Subclinical thyroid disease. Lancet. 2012; 379 (9821): 1142–54.
10. Rodondi N, den Elzen WP, Bauer DC, Cappola AR, Razvi S, Walsh JP, et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality // JAMA: the journal of the American Medical Association. 2010; 304 (12): 1365–74. Epub 2010/09/23; doi: 10.1001/ jama.2010.1361. PubMed PMID: 20858880; PubMed Central PMCID: PMC3923470.
11. Gencer B, Collet TH, Virgini V, Bauer DC, Gussek-loo J, Cappola AR, et al. Subclinical thyroid dysfunction and the risk of heart failure events: an individual participant data analysis from 6 prospective cohorts // Circulation. 2012; 126 (9): 1040–9. Epub 2012/07/24; doi: 10.1161/ CIRCULATIONA-HA.112.096024. PubMed PMID: 22821943; PubMed Central PMCID: PMC3884576.
12. Vanderpump MP, Tunbridge WM, French JM, Appleton D, Bates D, Clark F, et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey // Clinical endocrinology. 1995; 43 (1): 55–68. Epub 1995/07/01. PubMed PMID: 7641412.
13. Somwaru LL, Rariy CM, Arnold AM, Cappola AR. The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study // The Journal of clinical endocrinology and metabolism. 2012; 97 (6): 1962–9. Epub 2012/03/23; doi: 10.1210/jc.2011–3047. PubMed PMID: 22438233; PubMed Central PMCID: PMC3387427.
14. Surks MI, Goswami G, Daniels GH. The thyrotropin reference range should remain unchanged // J Clin Endocrinol Metab. 2005; 90 (9): 5489–96.
15. Waring AC, Arnold AM, Newman AB, Buzkova P, Hirsch C, Cappola AR. Longitudinal changes in thyroid function in the oldest old and survival: the cardiovascular health study all-stars study // J Clin Endocrinol Metab. 2012; 97 (11): 3944–50.
16. Gussekloo J, van Exel E, de Craen AJ, Meinders AE, Frolich M, Westendorp RG. Thyroid status, disability and cognitive function, and survival in old age // JAMA: the journal of the American Medical Association. 2004; 292 (21): 2591–9. Epub 2004/12/02; doi: 10.1001/ jama.292.21.2591. PubMed PMID: 15572717.
17. Monzani F, Di Bello V, Caraccio N, Bertini A, Gior-gi D, Giusti C, et al. Effect of levothyroxine on cardiac function and structure in subclinical hypothy-roidism: a double blind, placebo-controlled study // J Clin Endicrinol Metab. 2001; 86 (3): 1110–5.
18. Razvi S, Ingoe L, Keeka G, Oates C, McMillan C, Weaver JU. The beneficial effect of L-thyroxine on cardiovascular risk factors, endothelial function, and quality of life in subclinical hypothyroidism: randomized, crossover trial // J Clin Endocrinol Metab. 2007; 92 (5): 1715–23.
19. Monzani F, Caraccio N, Kozakowa M, Dardano A, Vittone F, Virdis A, et al. Effect of levothyroxine replacement on lipid profile and intima-media thickness in subclinical hypothyroidism: a double-blind, placebo-controlled study // J Clin Endocrinol Metab. 2004; 89 (5): 2099–106. Epub 2004/05/06; doi: 10.1210/ jc.2003–031669. PubMed PMID: 15126526.
20. Danese MD, Ladenson PW, Meinert CL, Powe NR. Clinical review 115: effect of thyroxine therapy on serum lipoproteins in patients with mild thyroid failure: a quantitative review of the literature // J Clin Endocrinol Metab. 2000; 85 (9): 2993–3001.
21. Liu D, Jiang F, Shan Z, Wang B, Wang J, Lai Y, et al. A cross-sectional survey of relationship between serum OOA level and blood pressure i J Hum Hyper-tens. 2010; 24 (2): 134–8.
22. Walsh JP, Bremner AP, Bulsara MK, O’Leary P, Leed-man PJ, Feddema P, et al. Subclinical thyroid dysfunction and blood pressure: a community-based study // Clin Endocrinol. 2006; 65 (4): 486–91. Epub 2006/09/21; doi: 10.1111/j.1365–2265.2006.02619.x. PubMed PMID: 16984241.
23. Adrees M, Gibney J, El-Saeity N, Boran G. Effects of 18 months of L-T4 replacement in women with subclinical hypothyroidism // Clin Endocrinol. 2009; 71 (2): 298–303.
24. Waring AC, Rodondi N, Harrison S, Kanaya AM, Simon- sick EM, Miljkovic I, et al. Thyroid function and prevalent and incident metabolic syndrome in older adults: the Health, Ageing and Body Composition Study // Clin Endocrinol. 2012; 76 (6): 911–8. Epub 2011/12/23; doi: 10.1111/j.1365–2265.2011.04328.x. PubMed PMID: 22187968; PubMed Central PMCID: PMC3334430.
25. Garin MC, Arnold AM, Lee JS, Tracy RP, Cappola AR. Subclinical hypothyroidism, weight change, and body composition in the elderly: the Cardiovascular Health Study // J Clin Endocrinol Metab. 2014; 99 (4): 1220–6. Epub 2014/01/18; doi: 10.1210/jc.2013–3591. PubMed PMID: 24432998; PubMed Central PMCID: PMC3973778.
26. Razvi S, Weaver JU, Butler TJ, Pearce SH. Levothy-roxine treatment of subclinical hypothyroidism, fatal and nonfatal cardiovascular events, and mortality // Arch Intern Med. 2012; 172 (10): 811–7.
27. Collet TH, Gussekloo J, Bauer DC, den Elzen WP, Cappola AR, Balmer P, et al. Subclinical hyperthy-roidism and the risk of coronary heart disease and mortality // Arch Intern Med. 2012; 172 (10): 799–809.
28. Selmer C, Olesen JB, Hansen ML, Lindhardsen J, Olsen AM, Madsen JC, et al. The spectrum of thyroid disease and risk of new onset atrial fibrillation: a large population cohort study // BMJ. 2012; 345: e7895. Epub 2012/11/29; doi: 10.1136/bmj.e7895. PubMed PMID: 23186910; PubMed Central PMCID: PMC3508199.
29. Reuters VS, Teixeira Pde F, Vigario PS, Almeida CP, Buescu A, Ferreira MM, et al. Functional capacity and muscular abnormalities in subclinical hypothy-roidism // Am J Med Sci. 2009; 338 (4): 259–63.
30. Brennan MD, Powell C, Kaufman KR, Sun PC, Bahn RS, Nair KS. The impact of overt and subclinical hyperthyroidism on skeletal muscle // Thyroid. 2006; 16 (4): 375–80.
31. Mainenti MR, Vigario PS, Teixeira PF, Maia MD, Oliveira FP, Vaisman M. Effect of levothyroxine replacement on exercise performance in subclinical hypothy-roidism // J Endocrinol Invest. 2009; 32 (5): 470–3.
32. Ravanbod M, Asadipooya K, Kalantarhormozi M, Nabipour I, Omrani GR. Treatment of iron-deficiency anemia in patients with subclinical hypothyroidism // Am J Med. 2013; 126 (5): 420–4.
33. Simonsick EM, Newman AB, Ferrucci L, Satterfield S, Harris TB, Rodondi N, et al. Subclinical hypothy-roidism and functional mobility in older adults // Arch Intern Med. 2009; 169 (21): 2011–7. Epub 2009/11/26; doi: 10.1001/archinternmed.2009.392. PubMed PMID: 19933964; PubMed Central PMCID: PMC2879334.
34. Virgini VS, Wijsman LW, Rodondi N, Bauer DC, Kearney PM, Gussekloo J, et al. Subclinical thyroid dysfunction and functional capacity among elderly // Thyroid. 2014; 24 (2): 208–14.
35. Abe E, Marians RC, Yu W, Wu XB, Ando T, Li Y, et al. OOA is a negative regulator of skeletal remodeling // Cell. 2003; 115 (2): 151–62.
36. Lee JS, Buzkova P, Fink HA, Vu J, Carbone L, Chen Z, et al. Subclinical thyroid dysfunction and incident hip fracture in older adults // Arch Intern Med. 2010; 170 (21): 1876–83. Epub 2010/11/26; doi: 10.1001/archinternmed.2010.424. PubMed PMID: 21098345.
37. Svare A, Nilsen TI, Asvold BO, Forsmo S, Schei B, Bjoro T, et al. Does thyroid function influence fracture risk? Prospective data from the HUNT2 study, Norway // European journal of endocrinology / European Federation of Endocrine Societies. 2013; 169 (6): 845–52. Epub 2013/09/14; doi: 10.1530/EJE-13–0546. PubMed PMID: 24031093.
38. Monzani F, Del Guerra P, Caraccio N, Pruneti CA, Pucci E, Luisi M, et al. Subclinical hypothyroidism: neurobehavioral features and beneficial effect of L-thyroxine treatment // Clin Investig. 1993; 71 (5): 367–71.
39. Roberts LM, Pattison H, Roalfe A, Franklyn J, Wilson S, Hobbs FD, et al. Is subclinical thyroid dysfunction in the elderly associated with depression or cognitive dysfunction? // Ann Intern Med. 2006; 145 (8): 573–81. Epub 2006/10/18. PubMed PMID: 17043339.
40. Pae CU, Mandelli L, Han C, Ham BJ, Masand PS, Patkar AA, et al. Thyroid hormones affect recovery from depression during antidepressant treatment // Psychiatry Clin Neurosci. 2009; 63 (3): 305–13.
41. Ceresini G, Lauretani F, Maggio M, Ceda GP, Mor-ganti S, Usberti E, et al. Thyroid function abnormalities and cognitive impairment in elderly people: results of the Invecchiare in Chianti study // J Am Geriatr Soc. 2009; 57 (1): 89–93. Epub 2008/12/05; doi: 10.1111/ j.1532–5415.2008.02080.x. PubMed PMID: 19054181; PubMed Cent- ral PMCID: PMC2631617.
42. Parsaik AK, Singh B, Roberts RO, Pankratz S, Edwards KK, Geda YE, et al. Hypothyroidism and risk of mild cognitive impairment in elderly persons: a population-based study // JAMA Neurol. 2014; 71 (2): 201–7.
43. Parle J, Roberts L, Wilson S, Pattison H, Roalfe A, Haque MS, et al. A randomized controlled trial of the effect of thyroxine replacement on cognitive function in community-living elderly subjects with subclini-cal hypothyroidism: the Birmingham Elderly Thyroid study // J Clin Endocrinol Metab. 2010; 95 (8): 3623–32. Epub 2010/05/27; doi: 10.1210/ jc.2009–2571. PubMed PMID: 20501682.
44. Canpolat AG, Kav T, Sivri B, Yildiz BO. Effects of L-thyroxine on gastric motility and ghrelin in sub-clinical hypothyroidism: a prospective study // J Clin Endocrinol Metab. 2013; 98 (11): 2013–1488.
45. Chung GE, Kim D, Kim W, Yim JY, Park MJ, Kim YJ, et al. Non-alcoholic fatty liver disease across the spectrum of hypothyroidism // J Hepatol. 2012; 57 (1): 150–6.
46. Bremner AP, Feddema P, Joske DJ, Leedman PJ, O’Leary PC, Olynyk JK, et al. Significant associa tion between thyroid hormones and erythrocyte indices in euthyroid subjects // Clin Endocrinol. 2012; 76 (2): 304–11.
47. Cinemre H, Bilir C, Gokosmanoglu F, Bahcebasi T. Hematologic effects of levothyroxine in iron-deficient subclinical hypothyroid patients: a randomized, double-blind, controlled study // J Clin Endocrinol Metab. 2009; 94 (1): 151–6.
48. Christ-Crain M, Meier C, Huber P, Zulewski H, Staub JJ, Muller B. Effect of restoration of euthyroidism on peripheral blood cells and erythropoietin in women with subclinical hypothyroidism // Hormones (Athens). 2003; 2 (4): 237–42.
49. Casey BM, Dashe JS, Wells CE, McIntire DD, Byrd W, Leveno KJ, et al. Subclinical hypothyroidism and pregnancy outcomes // Obstet Gynecol. 2005; 105 (2): 239–45. 50. Benhadi N, Wiersinga WM, Reitsma JB, Vrijkotte TG, Bonsel GJ. Higher maternal OOA levels in pregnancy are associated with increased risk for miscarriage, fetal or neonatal death // European journal of endocrinology / European Federation of Endocrine Societies. 2009; 160 (6): 985–91.
51. Wilson KL, Casey BM, McIntire DD, Halvorson LM, Cunningham FG. Subclinical thyroid disease and the incidence of hypertension in pregnancy // Obstet Gynecol. 2012; 119 (2 Pt 1): 315–20.
52. Lazarus JH, Bestwick JP, Channon S, Paradice R, Maina A, Rees R, et al. Antenatal thyroid screening and childhood cognitive function // N Engl J Med. 2012; 366 (6): 493–501.
53. Lazarus J, Brown RS, Daumerie C, Hubalewska-Dyde-jczyk A, Negro R, Vaidya B. 2014 European thyroid association guidelines for the management of sub-clinical hypothyroidism in pregnancy and in children // Eur Thyroid J. 2014; 3 (2): 76–94.
54. Kong WM, Sheikh MH, Lumb PJ, Naoumova RP, Freedman DB, Crook M, et al. A 6-month randomized trial of thyroxine treatment in women with mild subclinical hypothyroidism // Am J Med. 2002; 112 (5): 348–54. Epub 2002/03/21. PubMed PMID: 11904108.
55. Mu.. ller B. “Subklinische” Hypound Hyperthyreose. Schweizerische Gesellschaft fu..r Endokrinologie und Dia-betologie.http: //www.sgedssed.ch/fileadmin/files/doku-mente/DM_Key_Slides_2010–2011/ SGED_Subklinis-che_Hypo_Hyperthyresose.pdf 2010–2011.
56. Pearce SH, Brabant G, Duntas LH, Monzani F, Peeters RP, et al. 2013 ETA Guideline: Management of sub-clinical hypothyroidism // Eur Thyroid J. 2013; 2 (4): 215–28.
57. Flynn RW, Bonellie SR, Jung RT, MacDonald TM, Morris AD, Leese GP. Serum thyroid-stimulating hormone concentration and morbidity from cardiovascular disease and fractures in patients on long-term thyroxine therapy // J Clin Endocrinol Metab. 2010; 95 (1): 186–93.
58. Rodondi N, Bauer DC. Subclinical hypothyroidism and cardiovascular risk: how to end the controversy // J Clin Endocrinol Metab.2013; 98 (6): 2267–9. Epub 2013/05/02; doi: 10.1210/jc.2013–1875.
59. Blum MR, Collet TH, Krebs D, Stettler C, Christ E, Virgini V, et al. Subklinische Hypothyreose // Schweiz Med Forum. 2013; 13 (39): 772–5.
Комментарии
ПРАКТИКА ПЕДИАТРА
