Вторичные мессенджеры инсулина при синдроме поликистозных яичников и методы его патогенетической коррекции
СтатьиИ.А. Иванов, Г.И. Табеева, А.А. Сметник
ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, Москва, Российская Федерация
РЕЗЮМЕ
Изучение новых механизмов формирования инсулинорезистентности является необходимым условием разработки новых, патогенетически обоснованных методов терапии синдрома поликистозных яичников (СПЯ) и коррекции ассоциированных с ним нарушений углеводного и жирового обмена. Важными регуляторами сигналинга инсулина выступают его вторичные мессенджеры: миоинозитол (МИ), D-хироинозитол (ДХИ) и а-липоевая кислота (АЛК), которые опосредуют различные эффекты инсулина. Так, МИ индуцирует поглощение глюкозы клетками, усиливает гликолиз, тогда как ДХИ стимулирует гликогенез и регулирует энергетический обмен. Физиологическое для ооцитов соотношение МИ и ДХИ является важным условием оогенеза, стероидогенеза и регуляции менструального цикла. АЛК оказывает инсулиномиметическое действие путем индукции транслокации глюкозы в клетки, антиоксидантного и противовоспалительного влияния на клетки поджелудочной железы, а также путем подавления липолиза и снижения уровня триглицеридов. Крупные исследования, метаанализы и систематические обзоры демонстрируют важную роль МИ, ДХИ и АЛК в терапии пациенток с СПЯ. На фоне их приема продемонстрировано, в том числе на собственных клинических наблюдениях, снижение индекса HOMA, уровня глюкозы, инсулина, триглицеридов, липопротеинов низкой плотности, индекса массы тела, что восстанавливает овуляцию и ритм менструации у данных пациенток, а также способствует снижению рисков сердечно-сосудистых заболеваний, сахарного диабета и неалкогольной жировой болезни печени.
КЛЮЧЕВЫЕ СЛОВА: синдром поликистозных яичников, инозитол, миоинозитол, D-хироинозитол, а-липоевая кислота, инсулиноре-зистентность, жировой обмен, неалкогольная жировая болезнь печени.
ДЛЯ ЦИТИРОВАНИЯ: Иванов И.А., Табеева Г.И., Сметник А.А. Вторичные мессенджеры инсулина при синдроме поликистозных яичников и методы его патогенетической коррекции. РМЖ. Мать и дитя. 2024;7(*):1-9. DOI: 10.32364/2618-8430-2024-7-*-0.
Secondary messengers of insulin in polycystic ovary syndrome and its pathogenically-oriented treatment
I.A. Ivanov, G.I. Tabeeva, A.A. Smetnik
V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology, Moscow, Russian Federation
ABSTRACT
The study of new mechanisms of insulin resistance (IR) formation is a prerequisite for the development of new pathogenetically-oriented therapies of polycystic ovary syndrome (PCOS) and the treatment of associated disorders of carbohydrate and fat metabolism. Important regulators of insulin signaling are its secondary messengers, namely myo-inositol (MI), D-chiro inositol (DCI), and а-lipoic acid (ALA), which mediate various effects of insulin. Consequently, MI induces cellular glucose uptake and enhances glycolysis, whereas DCI stimulates glycogenesis and regulates energy metabolism. The physiologic MI/DCI ratio for oocytes is crucial for oogenesis, steroidogenesis, and the regulation of the menstrual cycle. ALA provides insulinomimetic effects through the induction of glucose translocation into cells, antioxidant and anti-inflammatory effects on pancreatic cells, and the suppression of lipolysis and the reduction of triglyceride levels. A wealth of evidence from large-scale studies, meta-analyses, and systematic reviews has demonstrated the crucial role of MI, DCI, and ALA in the treatment of PCOS. A multitude of studies, including those conducted by the authors, have demonstrated that the administration of these substances results in a reduction in HOMA, levels of glucose, insulin, triglycerides, low-density lipoproteins, and body mass index. This, in turn, has been shown to restore ovulation and the menstrual cycle in women with PCOS, as well as to reduce the risk of cardiometabolic diseases, including diabetes and nonalcoholic fatty liver disease.
KEYWORDS: polycystic ovary syndrome, inositol, myo-inositol, D-chiro inositol, alpha-lipoic acid, insulin resistance, fat metabolism, nonalcoholic fatty liver disease.
FOR CITATION: Ivanov I.A., Tabeeva G.I., Smetnik A.A. Secondary messengers of insulin in polycystic ovary syndrome and its pathogenically-oriented treatment. Russian Journal of Woman and Child Health. 2024;7(*):1-9 (in Russ.). DOI: 10.32364/2618-8430-2024-7-*-0.
Введение
Частота выявления синдрома поликистозных яичников (СПЯ) неуклонно растет, и в настоящее время считается, что он может затрагивать до 15-20% женского населения [1]. Данный синдром характеризуется многогранностью клинических проявлений, включая ановуляцию, ассоциированную с ней олигоаменорею и бесплодие, а также клиническую и/или биохимическую гиперандрогению. Но, вероятно, более важно, что многие патологические изменения, характерные для СПЯ, протекают латентно, без явных фенотипических проявлений, при этом провоцируют значимую соматическую патологию. Они включают нарушения углеводного и жирового обмена и связанные с ними риски формирования сахарного диабета (СД) и сердечно-сосудистых заболеваний (ССЗ) [2, 3]. Представления об этиопатогенетических основах СПЯ менялись на протяжении десятилетий и остаются предметом дискуссий, однако одними из ключевых элементов теории возникновения СПЯ рассматриваются инсулинорезистентность (ИР) и гиперинсулинемия (ГИ) [4].
Углеводный и жировой обмен при СПЯ
Инсулинорезистентность — это патологическое состояние, характеризующееся нарушением способности инсулина стимулировать захват глюкозы клетками-мишенями, вследствие чего ее уровень в сыворотке крови повышается, а синтез инсулина компенсаторно увеличивается [4, 5]. ГИ через центральные рецепторы нарушает пульсационную секрецию гонадотропин-рилизинг-гормона, тем самым индуцируя выработку лютеинизирующего гормона (ЛГ), который, в свою очередь, повышает продукцию андрогенов тека-клетками яичников [5-7]. По разным данным, повышение уровня ЛГ наблюдается у 30-90% пациенток с СПЯ, а те или иные проявления гиперандрогении, включая акне, гирсутизм и алопецию, — у 65-75% [8, 9]. При этом в отличие от других органов и тканей яичники сохраняют нормальную чувствительность к инсулину, что получило название «овариальный парадокс» [6, 10]. Вследствие этого при системной ИР и ГИ яичники подвергаются чрезмерному воздействию инсулина, это снижает чувствительность гранулезных клеток ооцитов к действию ФСГ, что совместно с повышением уровня ЛГ нарушает фолликулогенез [11, 12]. Кроме того, повышенный уровень инсулина может вызывать несвоевременную экспрессию рецепторов ЛГ в мелких фолликулах, что приводит к преждевременной терминальной дифференцировке гранулезы и остановке созревания ооцитов. Исследования показали, что инсулин может напрямую влиять на стероидогенез, в частности индуцировать синтез андрогенов и снижать уровень глобулина, связывающего половые гормоны, без изменения секреции гонадотропинов. Нарушение секреции гонадотропинов, рецепторного аппарата фолликулов и гиперандрогения приводят к ановуляции, олиго- или аменорее и бесплодию, основой которых является ИР [11-13].
Однако на современном этапе развития науки диагностика ИР не столь однозначна. Единственным прямым методом ее оценки является гиперинсулинемический эугликемический клэмп-тест, который сложен в проведении и не применяется в клинической практике. Наиболее распространенные и доступные методы — непрямые, включающие глюкозотолерантный тест, индекс HOMA. Согласно данным литературы ИР затрагивает около 50-70% женщин с СПЯ, а при наличии ожирения частота увеличивается до 95%. Но ввиду несовершенства существующих методов диагностики реальная распространенность ИР может быть еще выше [14-16]. По результатам клэмп-теста, по сравнению со здоровыми женщинами, у пациенток с СПЯ чувствительность к инсулину ниже на 27%, причем без четкой корреляции с индексом массы тела (ИМТ) [17], и может затрагивать до 86,6% пациенток [16, 17].
Инсулинорезистентность тесно взаимосвязана с нарушениями не только углеводного, но и липидного обмена, провоцируя в том числе увеличение висцеральной жировой массы. Так, при СПЯ от 30 до 70% пациенток имеют избыточную массу тела и ожирение [18, 19], к 40 годам у каждой второй может развиться метаболический синдром (МС) или СД 2 типа (СД2) [1], а скорость прогрессии с нарушением толерантности к глюкозе (НТГ) вплоть до СД2 выше, чем в среднем в популяции [19, 20]. В исследовании Г.Е. Чернуха и соавт. [21] избыточная масса тела и ожирение имелись примерно у каждой третьей (37,2%) пациентки с СПЯ, однако по данным двухэнергетической рентгеновской абсорбциометрии (денситометрия), избыток жировой ткани встречался вдвое чаще — у 73,6%. Авторы отмечают высокую распространенность так называемого скрытого ожирения, при котором у женщин с нормальным ИМТ может быть избыток жировой ткани. Согласно этим результатам риск скрытого ожирения имеется уже при ИМТ 23 кг/м2 и более [21]. Важно отметить значительное повышение массы и доли висцеральной жировой ткани, которая считается метаболически более активной и неблагоприятной. Широко известна ассоциированность висцерального ожирения с МС, что обусловлено более выраженными нарушениями липидного и эндокринного обмена, секрецией провоспалительных медиаторов, обусловливающих системное воспаление [21, 22].
Известно, что нарушения углеводного обмена и ожирение тесно связаны с окислительным стрессом, воспалением, накоплением свободных жирных кислот (СЖК) и триглицеридов (ТГ) в печени, и в конечном итоге развитием неалкогольной жировой болезни печени (НАЖБП) — состояния аккумуляции гепатоцитами жировой ткани. При наличии данных факторов частота НАЖБП может достигать 70-90% и более [23]. При НАЖБП липолиз в жировой ткани усиливается, в то время как β-окисление жирных кислот в печени снижается, что приводит к гипертриглицеридемии, гипергликемии, усугубляя ИР и завершая порочный круг СПЯ, ожирения и дислипидемии. Вследствие этого остается неясной первоначальная причина ИР при СПЯ. Считается, что ИР является эндогенной, но может прогрессировать при наличии ожирения [8]. С одной стороны, у пациенток с СПЯ и ожирением в ответ на введение инсулина отмечаются пониженная утилизация глюкозы и липолиз [24], но с другой — аналогичные результаты наблюдались также у женщин с СПЯ при отсутствии ожирения, НТГ, что подтверждает эндогенный генез ИР1 [25]. С учетом сложности патогенеза заболевания первой линией терапии, согласно клиническим рекомендациям, остаются симптоматическая терапия, в частности комбинированные оральные контрацептивы, стимуляция овуляции и программы вспомогательных репродуктивных технологий (ВРТ) [26, 27]. Разработка патогенетически обоснованной терапии остается приоритетным направлением исследований по СПЯ. С учетом значимой роли ИР инсулиносенситайзеры также входят в современные протоколы ведения пациенток с СПЯ, и в частности их наиболее изученный представитель метформин, хотя его эффективность в отношении регуляции цикла составляет лишь 27-53% [28]. Другим лимитирующим фактором метформина являются побочные эффекты, возникающие, по разным данным, в 60-74% случаев, включая боль в животе, тошноту, рвоту, диарею, потерю аппетита, метеоризм, что снижает комплаентность [27, 29]. Вследствие этого в последние годы один из основных векторов научных исследований направлен на изучение новых звеньев регуляции углеводного обмена и поиск точек терапевтического воздействия на ИР с меньшим количеством побочных эффектов. Одними из таковых стали миоинозитол (МИ), D-хироинозитол (ДХИ) и а-липоевая кислота (АЛК) (см. рисунок).
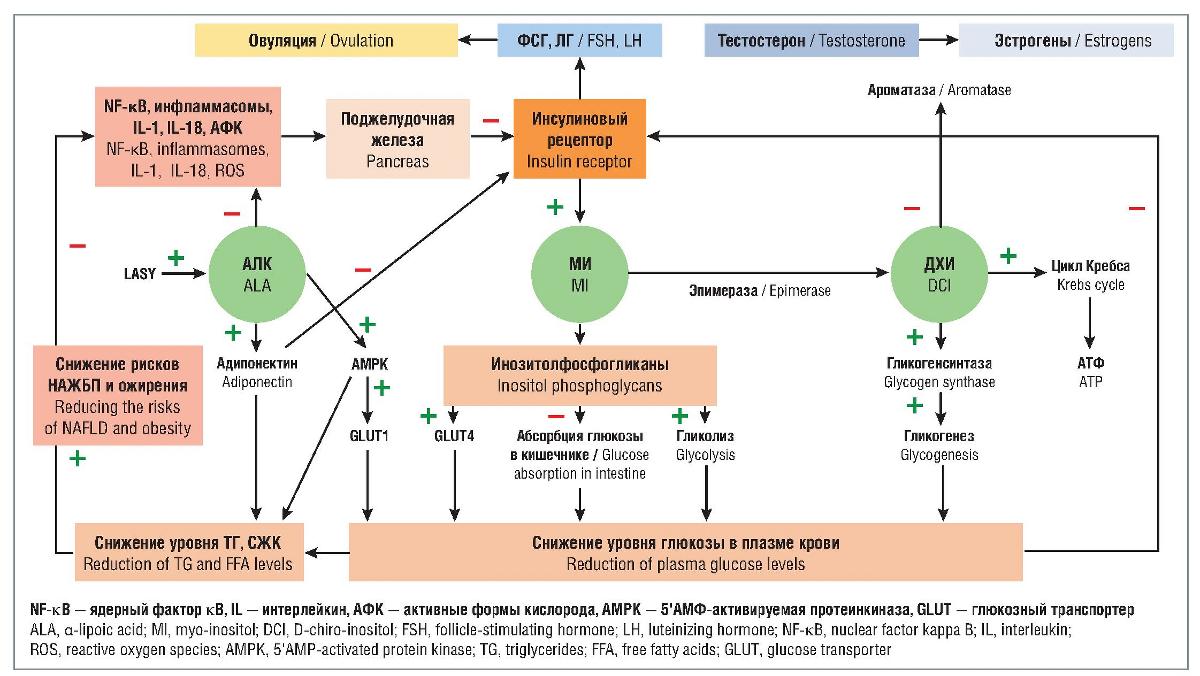
 Рисунок. а-Липоевая кислота, МИ и ДХИ в регуляции углеводного и жирового обмена
Рисунок. а-Липоевая кислота, МИ и ДХИ в регуляции углеводного и жирового обменаFigure. а-Lipoic acid, MI, and DCI in the regulation of carbohydrate and fat metabolism
Роль инозитолов в сигналинге инсулина
Инозитол — вторичный мессенджер инсулина, передающий сигнал от инсулинового рецептора к таргетным генам и регулирующий метаболизм глюкозы. В настоящее время установлено участие инозитола в регуляции таких физиологических процессов, как оплодотворение, оогенез, эмбриогенез, регенеративные процессы и жировой обмен [30, 31]. Инозитол представлен в виде девяти стереоизомеров, наиболее биологически важными из которых считаются МИ и ДХИ. В небольшом количестве МИ синтезируется в печени, головном мозге, почках, яичках, молочной железе, но в основном поступает с пищей [31]. При взаимодействии инсулина с рецептором активируется внутриклеточный синтез МИ, а также его метаболитов. Одними из них являются инозитолфосфогликаны, которые подавляют всасывание глюкозы в двенадцатиперстной кишке, участвуют в поглощении глюкозы клетками, индуцируя транслокацию белков — переносчиков глюкозы (в частности, GLUT4) через клеточную мембрану, тем самым снижая уровень глюкозы в крови [8, 32, 33]. Другой метаболит — ДХИ, который стимулирует гликогенсинтазу, ключевой фермент, трансформирующий глюкозу в гликоген. ДХИ способствует включению глюкозы в цикл Кребса, приводящему к синтезу АТФ, тем самым играя ключевую роль в энергетическом обмене [34, 35].
Как МИ, так и ДХИ проявляют инсулиномиметические свойства, снижая уровень глюкозы в крови после приема пищи, однако их действие разнонаправленно. При воздействии ДХИ метаболизм глюкозы смещается в сторону гликогенеза, МИ — в сторону гликолиза и поглощения глюкозы клетками. Существует и обратная взаимосвязь — при ГИ и ИР синтез инозитолов снижается [8, 36]. С учетом их различных функций, для адекватной передачи сигналов инсулина необходимо определенное соотношение МИ и ДХИ в цитоплазме клеток конкретной ткани, соответствующее ее метаболической активности [30, 37]. ДХИ индуцирует гликогенез, поэтому его концентрация выше в тканях, депонирующих гликоген, включая печень, жировую ткань, мышцы, и ниже — в активно использующих глюкозу [30]. И напротив, вследствие способности МИ индуцировать поступление глюкозы в клетки его концентрация выше в органах с высоким энергетическим потреблением, в частности в яичниках. Так, например, в фолликулярной жидкости соотношение МИ и ДХИ составляет 100:1, тогда как в плазме крови — лишь 40:1 [38-40]. Конвертация МИ в ДХИ происходит под действием фермента эпимеразы, активность которой инсулинозависима. В ответ на ГИ в тека-клетках яичников отмечается повышение активности эпимеразы, что приводит к чрезмерной конвертации МИ в ДХИ со снижением соотношения МИ и ДХИ до 0,2:1, что в конечном итоге и нарушает передачу сигнала инсулина. Таким образом, при СПЯ может наблюдаться не только снижение содержания МИ, но и избыток ДХИ [34, 40, 41].
Функции АЛК в углеводном обмене
Помимо инозитолов, не менее важным посредником инсулина выступает АЛК. Это производное жирных кислот, синтезируемое в митохондриях, обладающее выраженным противовоспалительным и антиоксидантным действием, а также играющее важную роль в регуляции углеводного и жирового обмена [42-45]. Основной механизм инсулиноподобного действия АЛК заключается в индукции ею фермента АМРК на плазматической мембране адипоцитов, скелетных мышцах и печени, что приводит к транслокации белков — переносчиков глюкозы GLUT4 и GLUT1. Эти белки транспортируют глюкозу в клетки, тем самым опосредуют эффект инсулина, снижают уровень глюкозы плазмы и ГИ [46]. АМРК также ингибирует синтез СЖК и их накопление в адипоцитах и печени [46, 47]. Во-вторых, АЛК и ее метаболиты являются мощными антиоксидантами и супрессорами воспаления, опосредованного сигнальным путем NF-κB. АЛК блокирует транслокацию в ядро, снижая высвобождение провоспалительных цитокинов. Таким образом, АЛК оказывает противовоспалительное и иммуномодулирующее влияние на β-клетки поджелудочной железы, синтезирующие инсулин [48, 49]. В серии исследований было показано, что АЛК снижает выработку ряда активных веществ, вызывающих пироптоз (особый вид программируемой клеточной гибели) и повреждающих β-клетки поджелудочной железы, а также оказывает ингибирующее влияние на воспалительные факторы, включая инфламмасомы, IL-1, IL-18, олеиновую кислоту и АФК. Захват АФК АЛК и ее метаболитами стимулирует выработку антиоксидантных ферментов глутатионпероксидазы и супероксиддисмутазы 1, защищая клетку от окислительного повреждения [49-51]. Таким образом, АЛК снижает секрецию инсулина и повышает чувствительность к нему, что является компенсаторным механизмом, защищающим β-клетки от истощения и оказывающим протективный эффект в отношении формирования ИР и СД [52, 53]. Соответственно дефицит АЛК ассоциирован с нарушением поглощения глюкозы клетками, а следовательно, способствует индукции системной ИР [54]. Это подтверждается тем, что у пациентов с ИР наблюдается дефицит фермента синтазы липоевой кислоты (LASY), ответственного за синтез АЛК. Дефицит LASY приводит к снижению концентрации АЛК, затем AMPK, GLUT4, снижению поглощения глюкозы, а соответственно, к ИР [54]. При комбинированном дефиците LASY и эпимеразы, ответственной за конверсию МИ и ДХИ, риск развития ГИ и СД повышается в еще большей степени [54]. Кроме того, поскольку основной источник инозитолов экзогенный (алиментарный), то АЛК синтезируется внутриклеточно и представляет собой своего рода «резервную систему» транслокации глюкозы при недостаточной концентрации МИ. На основании вышесказанного можно заключить, что для нормального функционирования яичников необходимо восстановление физиологических концентраций и соотношения всех участников передачи сигнала инсулина, включая МИ, ДХИ и АЛК [30, 39].
Роль вторичных мессенджеров инсулина в терапии СПЯ
За последние годы накоплен существенный пул исследований, изучавших терапевтические механизмы и эффективность медиаторов инсулина. Известно, что у пациенток с СПЯ МИ индуцирует транслокацию глюкозы в клетки, снижая ее уровень в крови и тем самым компенсируя ГИ, а также повышает чувствительность яичников к ФСГ. Это улучшает энергообмен ооцитов, повышает мейотическую активность, качество ооцитов и регулирует менструальный цикл [55]. Восстановление менструальной функции происходит за счет нормализации гипоталамо-гипофизарно-яич-никовой оси, ввиду снижения ГИ и гиперандрогении, а также снижения активности эпимеразы в тека-клетках яичников у женщин с СПЯ [55]. Дотация МИ и ДХИ может улучшать оогенез, качество ооцитов и эмбрионов, что продемонстрировано в программах ВРТ, в которых требовалась меньшая суммарная доза гонадотропинов и были короче протоколы стимуляции [56, 57]. Помимо этого, восстановление чувствительности тканей к инсулину при приеме инозитола является ключевым механизмом улучшения метаболических показателей, ассоциированных с ИР. В многочисленных исследованиях [58, 59] показано, что применение добавок МИ и ДХИ увеличивает внутриклеточную концентрацию фосфогликанов инозитола, снижает уровень инсулина и индекс HOMA. При этом инозитолы не вызывали побочных эффектов в отличие от препаратов группы бигуанидов. Вследствие вышеуказанного инозитол был включен в международные клинические протоколы по СПЯ, в том числе наиболее актуальные на данный момент рекомендации 2023 г. Европейского общества по репродукции человека и эмбриологии (ESHRE) [27], как рекомендованная терапия при СПЯ. Систематический Кохрейновский обзор, проанализировавший 42 рандомизированных клинических исследования (РКИ) эффективности различных инсулиносенситайзеров, заключил, что терапия ДХИ повышала вероятность овуляции в 3,57 раза, в то время как метформин — лишь в 1,72 раза. Однако авторы указывают, что необходимы дальнейшие исследования для повышения достоверности результатов [60, 61]. Кроме того, существуют обратные данные, что монотерапия ДХИ ассоциирована с негативным влиянием на активность фермента ароматазы и еще большим увеличением продукции андрогенов яичниками [62, 63].
При этом комбинация МИ и ДХИ продемонстрировала высокую эффективность в многочисленных исследованиях. Их прием в течение 3-6 мес. может восстанавливать овуляторный менструальный цикл, снижать содержание биомаркеров оксидативного стресса, нормализовать гормональный профиль у женщин с СПЯ, включая уровень андрогенов и ЛГ, а также метаболические показатели: ИР, глюкозу, инсулин, индекс HOMA, ИМТ [64-68]. В работе О.А. Пусто-тиной [69] на фоне трехмесячного курса приема комбинации МИ и ДХИ в соотношении 40:1 отмечено статистически значимое снижение ИМТ, ИР и количества пациенток с ГИ в 2,4 раза, а также уровней общего тестостерона в 1,3 раза, свободного тестостерона в 1,45 раза.
Наибольшая эффективность данного соотношения была доказана в ряде научных публикаций. Так, в исследовании на мышах продемонстрировано, что применение МИ и ДХИ в соотношении 40:1 приводило к более быстрому регрессу морфологических изменений яичников и восстановлению фертильности при СПЯ по сравнению с концентрациями 5:1; 20:1; 80:1, а более высокое содержание ДХИ негативно влияло на структуру яичников [70]. В исследовании M. Nordio et al. [71] проводилось сравнение эффективности различных концентраций МИ и ДХИ (1:3,5; 2,5:1; 5:1; 20:1; 40:1, 80:1) при СПЯ в течение 3 мес. У пациенток, получавших МИ и ДХИ в соотношении 40:1, наблюдалось наиболее выраженное, по сравнению с другими, снижение уровня ЛГ, тестостерона, инсулина и индекса HOMA, а в 62,5% случаев отмечена нормализация ритма менструального цикла. Схожие результаты получены в плацебо-контролируемом исследовании E. Benelli et al. [72], где отмечается, что прием комбинации МИ и ДХИ в соотношении 40:1 в течение 6 мес. приводил к снижению уровня ЛГ, свободного тестостерона, инсулина натощак и индекса HOMA. На основании данных результатов, согласно консенсусному заключению экспертов по терапии СПЯ и инсулинонезависимого СД инозитолом "The Expert Group on Inositol", прием МИ и ДХИ в соотношении 40:1 служит важным фактором нормализации их соотношения в фолликулярной жидкости и функции яичников у женщин с СПЯ [41].
Наличие множества крупных исследований позволило совету экспертов сделать также заключение об эффективности АЛК и рекомендовать рассмотрение ее в качестве перспективного терапевтического средства при эндокринных заболеваниях, ассоциированных с ИР, в частности СПЯ [54]. Так, например, в работе U. Masharani et al. [44] проводилась монотерапия АЛК пациенток с СПЯ без ожирения и НТГ. Ключевым преимуществом данной работы была оценка ИР с помощью гиперинсулинемического эугликемического клэмп-теста. После 16 нед. терапии отмечено статистически значимое повышение чувствительности к инсулину и захвата глюкозы, а также снижение уровня ТГ, что указывает также на антиатерогенное действие АЛК. Эффективность АЛК при СПЯ подтверждается результатами наиболее крупного и актуального на сегодняшний день систематического обзора и метаанализа 2024 г. Согласно его данным, прием АЛК приводит к снижению уровня глюкозы натощак (стандартизованная разность средних (SMD) -0,60), индекса НОМА (SMD -2,03), инсулина (SMD -0,74), ЛГ в первые 12 нед. (SMD -5,09). Полученные данные, по мнению авторов, могут указывать на перспективность применения АЛК при СПЯ, однако требуются более подробные исследования с оценкой дозы и длительности терапии [73]. Ряд метаанализов продемонстрировал, что АЛК способствует небольшому, но статистически значимому снижению массы тела и ИМТ по сравнению с плацебо. Это указывает на то, что АЛК влияет на важные патогенетические звенья нарушенного углеводного обмена, но для нормализации массы тела ключевым элементом остается формирование стойкого дефицита калорий [74, 75].
В научной литературе большая часть исследований описывает влияние АЛК при СПЯ при совместном приеме с МИ. A.D. Genazzani et al. [76] оценивали эффективность комбинации 400 мг АЛК и 1 г МИ в течение 12 нед. у пациенток с СПЯ и ожирением. Результаты продемонстрировали снижение ИМТ, а также уровня ТГ, инсулина и глюкозы натощак и после углеводной нагрузки в рамках глюкозотолерантного теста. Причем МИ и АЛК модулируют различные части сигналинга инсулина, которые по-разному контролируют активность ЛГ и GLUT4 [13, 77]. В недавнем исследовании A.D. Genazzani et al. [77] сравнили эффективность МИ, АЛК и их комбинации у пациенток с СПЯ и избыточной массой тела. Пациентки во всех группах продемонстрировали положительный эффект: МИ значительно снизил уровень ЛГ, умеренно — инсулина, индекса HOMA; АЛК в большей степени улучшала показатели инсулина, индекса НОМА и ИМТ, существенно не влияя на ЛГ; тогда как комбинация МИ и АЛК влияла как на метаболический, так и на гормональный профиль [77]. В других работах у пациенток с СПЯ на фоне приема МИ и АЛК также продемонстрировано укорочение менструального цикла, снижение ИМТ, индекса НОМА [78]. Синергический эффект МИ и АЛК может быть объяснен восстановлением различных механизмов передачи сигнала от инсулина к рецептору, а далее восстановлением пульсовой секреции ГнрГ, нормализацией секреции гонадотропинов и половых стероидов, в частности андрогенов [13]. По данным многочисленных исследований, у пациенток с СПЯ и ожирением при приеме МИ в комбинации с АЛК в течение 3 мес. наблюдалось укорочение цикла в среднем в 1,7-2,0 раза, тогда как полное восстановление менструального цикла отмечено у 24-51% пациенток. Также отмечено снижение других метаболических показателей: инсулина на 34-36%, глюкозы на 5,3-11%, индекса НОМА на 30-45%, ИМТ на 4,5-8,1%, липопротеинов низкой плотности (ЛПНП) на 5,5% и повышение уровня липопротеинов высокой плотности (ЛПВП) на 12,8%, наблюдались морфологические изменения, включая уменьшение объема яичников и числа антральных фолликулов [78, 79]. Примечательно, что у пациенток без признаков ГИ, НТГ и с нормальным индексом НОМА наблюдалось менее выраженное изменение вышеуказанных показателей [79, 80].
Помимо регуляции углеводного обмена, есть данные, что у пациенток с наследственной предрасположенностью к СД и с повышенным риском НАЖБП на фоне приема АЛК также наблюдалась нормализация уровней АЛТ и АСТ, что свидетельствует о положительном влиянии АЛК на функцию печени [81-83]. В исследовании H. Tutunchi et al. [23] оценивалось влияние МИ и АЛК на метаболические показатели у пациентов с НАЖБП. В работе отмечалось, что на фоне приема МИ в течение 3 мес. наблюдалось снижение уровней глюкозы, АЛТ, АСТ, общего холестерина и индекса НОМА, тогда как в группе АЛК отмечалось снижение показателей ЛПНП и АЛТ. Кроме того, систематический обзор и метаанализ [84] 14 РКИ с участием пациенток с СПЯ и другими метаболическими расстройствами продемонстрировал благоприятное влияние МИ на концентрации ТГ, холестерина и ЛПНП в сыворотке крови. А в РКИ I. Capasso et al. [85] на фоне 6-месячной комбинированной терапии МИ и АЛК отмечено снижение индекса HOMA более чем на 20% у 66,7% пациенток с метаболическим синдромом, уровня инсулина — у 89,3%, ТГ — у 43,2% и повышение уровня ЛПВП на 48,6% по сравнению с группой, принимавшей плацебо. Одним из предполагаемых механизмов улучшения липидного профиля под действием АЛК, по-видимому, является коррекция ИР как одного из важнейших факторов риска НАЖБП. Но также значимым фактором выступает способность АЛК повышать активность липопротеинлипазы и лецитинхолестеринацилтрансферазы, участвующих в липолизе и синтезе ТГ, повышении активности AMPK и снижении окисления липидов, благодаря своим антиоксидантным и противовоспалительным свойствам. Кроме того, АЛК подавляет дифференцировку адипоцитов, а также регулируют секрецию адипокинов и лептина, которые играют важную роль в формировании жирового гепатоза [23, 86].
На основании вышеизложенного можно сделать вывод о важной и взаимодополняющей роли МИ, ДХИ и АЛК в передаче сигнала инсулина, коррекции ИР и ГИ. Как показали крупные систематические обзоры и метаанализы, дотация данных элементов может приводить к статистически значимому улучшению показателей углеводного и липидного обмена, и, как следствие, облегчению клинической симптоматики у пациенток с СПЯ. В России зарегистрирована биологически активная добавка (БАД) Дифертон, содержащая в 1 таблетке инозит 1127,6 мг, включая МИ 1100 мг, ДХИ 27,6 мг, АЛК 75 мг, которая показана к применению женщинам с СПЯ, а также с нарушенной чувствительностью к инсулину2.
Собственный опыт терапии комбинацией МИ, ДХИ и АЛК пациенток с СПЯ
В рамках апробации терапии комбинацией МИ, ДХИ и АЛК на базе ФГБУ «НМИЦ АГП им В.И. Кулакова» Минздрава России в отделении гинекологической эндокринологии БАД Дифертон в течение 3 мес. применялась у пациенток с диагнозом СПЯ, которым не требовалась контрацепция. Диагноз СПЯ установлен на основании Роттердамских критериев, в соответствии с клиническими рекомендациями РОАГ (2021). На фоне лечения у всех пациенток оценивали клинический эффект, показатели гормонов (ФСГ, ЛГ, тестостерон общий), липидограммы, индекс HOMA, а также содержание печеночных ферментов (АЛТ, АСТ, щелочная фосфатаза).
Пациентка К., 21 год. На момент обращения менструации нерегулярные, через 35-45 дней, в среднем 40 дней, ИМТ 28,5 кг/м2 (избыточная масса тела). Уровень гормонов исходно на 3-й день менструального цикла (д.м.ц.): ФСГ 6,2 мМЕд/мл, ЛГ 13,2 мМЕд/мл, тестостерон 1,54 нмоль/л, что не превышало пороговых значений. Индекс НОМА был повышен и составил 2,8, тогда как уровень ТГ — 1,5 ммоль/л, ЛПНП — 3,1 ммоль/л и ЛПВП — 0,9 ммоль/л, т. е. были в норме. Через 3 мес. терапии Дифертоном отмечено укорочение менструального цикла в среднем на 4 дня, до 36 дней, что соответствует нормальным значениям, снижение уровня ЛГ до 9,4 мМЕд/мл, индекса НОМА до 2,2. Отмечались также изменения липидного профиля: уровень ТГ снизился до 1,4 ммоль/л, ЛПНП — до 2,8 ммоль/л и ЛПВП — до 1,1 ммоль/л. На фоне рационализации питания и терапии ИМТ также снизился до 25,1 кг/м2.
Пациентка Л., 19 лет. Нарушение ритма менструации — через 32-47 дней, в среднем 38 дней, избыточная масса тела (ИМТ 26,5 кг/м2). Исходный уровень гормонов на 3-й д.м.ц.: ФСГ 5,4 мМЕд/мл, ЛГ 9,8 мМЕд/мл, тестостерон повышен до 1,96 нмоль/л. Индекс НОМА, уровни ТГ, ЛПНП и ЛПВП были в рамках референтной нормы. Через 3 мес. приема Дифертона менструальный цикл сократился на 5 дней, до 33 дней, что соответствует норме, уровни ФСГ, ЛГ, индекс НОМА без существенной динамики, уровень тестостерона нормализовался и составил 1,65 нмоль/л. Отмечено также снижение ИМТ до 25,2 кг/м2.
Пациентка Б., 25 лет. Поликистозное строение яичников по данным УЗИ, олигоменорея, гиперандрогения, акне. Менструации через 32-67 дней, в среднем 45 дней, ИМТ 32,1 кг/м2, что соответствует ожирению I степени. Уровень гормонов до старта терапии на 2-й д.м.ц.: ФСГ 8,3 мМЕд/мл, ЛГ 18,4 мМЕд/мл, тестостерон 2,1 нмоль/л. Индекс НОМА 2,7. Показатели жирового обмена также были нарушены: ТГ 1,6 ммоль/л, ЛПНП 3,3 ммоль/л и ЛПВП 0,8 ммоль/л. В течение 3 мес. приема Дифертона цикл укоротился на 4 дня и составил 41 день, уровень ЛГ составил 12,9 мМЕд/мл, индекс НОМА также снизился до 1,5, концентрация ТГ составила 1,5 ммоль/л, ЛПНП — 3,0 ммоль/л и ЛПВП — 0,9 ммоль/л. Уровень тестостерона снизился до 1,81 нмоль/л, но оставался выше референтных значений, что, вероятно, связано с сохраняющимся избытком жировой ткани. ИМТ через 3 мес. составил 29,8 кг/м2.
На основе полученных результатов терапии Дифертоном можно отметить тенденцию к укорочению менструального цикла, что привело к его нормализации у двух пациенток за 3 мес. лечения. Также констатировали снижение массы тела, уровней ЛГ, общего тестостерона, ТГ, ЛПНП, индекса НОМА и повышение — ЛПВП, при этом ни в одном случае не отмечено побочных эффектов. Ни у одной из пациенток исходно не отмечалось повышение уровня печеночных трансаминаз. Необходимо дальнейшее наблюдение для уточнения эффекта от более длительной терапии.
Заключение
Обобщая данные литературы, можно заключить, что изучение новых патогенетических звеньев ИР является ключевым в вопросах разработки новых патогенетически обоснованных методов терапии СПЯ. Инозитол является сенсибилизатором инсулина и реализует его разнонаправленные эффекты через стереоизомеры МИ и ДХИ, модулируя поглощение глюкозы клетками и синтез гликогена. АЛК — важный регулятор транслокации глюкозы в клетке, антиоксидант и противовоспалительный фактор. Комбинация МИ, ДХИ и АЛК оказывает синергическое влияние, снижающее ИР у пациенток с СПЯ, в том числе при ожирении и избыточной массе тела. Это оказывает положительный фенотипический эффект в виде регуляции менструального цикла, восстановления овуляции и снижения уровня андрогенов, а также улучшения показателей углеводного и жирового обмена, ускорения снижения массы тела, тем самым уменьшая риски ССЗ, НАЖБ и СД2.
Литература / References
1. Azziz R. Polycystic Ovary Syndrome. Obstet Gynecol. 2018;132(2):321-336. DOI: 10.1097/AOG.0000000000002698.
2. Rojas J., Chavez M., Olivar L. et al. Polycystic Ovary Syndrome, Insulin Resistance, and Obesity: Navigating the Pathophysiologic Labyrinth. Int J Reprod Med. 2014;2014:1-17. DOI: 10.1155/2014/719050.
3. De Sousa S.M.C., Norman R.J. Metabolic syndrome, diet and exercise. Best Pract Res Clin Obstet Gynaecol. 2016;37:140-151. DOI: 10.1016/j. bpobgyn.2016.01.006.
4. Ткачук B.A., Воротников A.B. Молекулярные механизмы развития резистентности к инсулину. Сахарный диабет. 2014;17(2):29-40. DOI: 10.14341/DM2014229-40. Tkachuk V.A., Vorotnikov A.V. Molecular Mechanisms of Insulin Resistance Development. Diabetes mellitus. 2014;17(2):29-40. DOI: 10.14341/DM2014229-40.
5. Joham A.E., Norman R.J., Stener-Victorin E. et al. Polycystic ovary syndrome. Lancet Diabetes Endocrinol. 2022;10(9):668-680. DOI: 10.1016/ S2213-8587(22)00163-2.
6. Unluhizarci K., Karaca Z., Kelestimur F. Role of insulin and insulin resistance in androgen excess disorders. World J Diabetes. 2021;12(5):616-629. DOI: 10.4239/wjd.v12.i5.616.
7. Moghetti P., Tosi F. Insulin resistance and PCOS: chicken or egg? J Endocrinol Invest. 2021;44(2):233-244. DOI: 10.1007/s40618-020-01351-0. 8. Kamenov Z., Gateva A. Inositols in PCOS. Molecules. 2020;25(23):5566. DOI: 10.3390/molecules25235566.
9. Azziz R., Carmina E., Dewailly D. et al. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertil Steril. 2009;91(2):456-488. DOI: 10.1016/j. fertnstert.2008.06.035.
10. Carlomagno G., Unfer V., Roseff S. The D-chiro-inositol paradox in the ovary. Fertil Steril. 2011;95(8):2515-2516. DOI: 10.1016/j. fertnstert.2011.05.027.
11. De Leo V., Musacchio M.C., Cappelli V. et al. Genetic, hormonal and metabolic aspects of PCOS: an update. Reprod Biol Endocrinol. 2016;14(1):38. DOI: 10.1186/s12958-016-0173-x.
12. Behboudi-Gandevani S., Ramezani Tehrani F., Rostami Dovom M. et al. Insulin resistance in obesity and polycystic ovary syndrome: systematic review and meta-analysis of observational studies. Gynecol Endocrinol. 2016;32(5):343-353. DOI: 10.3109/09513590.2015.1117069.
13. Guarano A., Capozzi A., Cristodoro M. et al. Alpha Lipoic Acid Efficacy in PCOS Treatment: What Is the Truth? Nutrients. 2023;15(14):3209. DOI: 10.3390/nu15143209.
14. Tosi F., Bonora E., Moghetti P. Insulin resistance in a large cohort of women with polycystic ovary syndrome: a comparison between euglycaemic-hyperinsulinaemic clamp and surrogate indexes. Hum Reprod. 2017;32(12):2515-2521. DOI: 10.1093/humrep/dex308.
15. Cassar S., Misso M.L., Hopkins W.G. et al. Insulin resistance in polycystic ovary syndrome: a systematic review and meta-analysis of euglycaemic-hyperinsulinaemic clamp studies. Hum Reprod. 2016;31(11):2619-2631. DOI: 10.1093/humrep/dew243.
16. Stepto N.K., Cassar S., Joham A.E. et al. Women with polycystic ovary syndrome have intrinsic insulin resistance on euglycaemic-hyperinsulaemic clamp. Hum Reprod. 2013;28(3):777-784. DOI: 10.1093/humrep/des463.
17. Li W., Chen Q., Xie Y. et al. Prevalence and degree of insulin resistance in Chinese Han women with PCOS: Results from euglycemic-hyperinsulinemic clamps. Clin Endocrinol (Oxf). 2019;90(1):138-144. DOI: 10.1111/cen.13860.
18. Lim S.S., Davies M.J., Norman R.J., Moran L.J. Overweight, obesity and central obesity in women with polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod Update. 2012;18(6):618-637. DOI: 10.1093/humupd/dms030.
19. Strauss J.F., Barbieri R.L. Yen & jaffe's reproductive endocrinology: Physiology, pathophysiology, and clinical management. 7th ed. Elsevier Health Sciences; 2019:115-121.
20. Lemieux I., Despres J.-P. Metabolic Syndrome: Past, Present and Future. Nutrients. 2020;12(11):3501. DOI: 10.3390/nu12113501.
21. Чернуха Г.Е., Мирошина Е.Д., Кузнецов С.Ю. Иванов И.А. Индекс массы тела, композиционный состав тела и метаболический профиль пациенток с синдромом поликистозных яичников. 5кушерство и гинекология. 2021;10:103-111. DOI: 10.18565/aig.2021.10.103-111. Chernukha G.E., Miroshina E.D., Kuznetsov S.Yu., Ivanov I.A. Body mass index, body composition, and metabolic profile of patients with polycystic ovary syndrome. Obstetrics and Gynecology. 2021;10:103-111 (in Russ.). DOI: 10.18565/aig.2021.10.103-111.
22. Кологривова И.В., Винницкая И.В., Кошельская О.А., Суслова h.E. Висцеральное ожирение и кардиометаболический риск: особенности гормональной и иммунной регуляции. Ожирение и метаболизм. 2017;14(3):3-10. DOI: 10.14341/omet201733-10.
Kologrivova I.V., Vinnitskaya I.V., Koshelskaya O.A., Suslova T.E. Visceral obesity and cardiometabolic risk: features of hormonal and immune regulation. Obesity and metabolism. 2017;14(3):3-10 (in Russ.). DOI: 10.14341/omet201733-10).
23. Tutunchi H., Arefhosseini S., Ebrahimi-Mameghani M. Clinical effectiveness of a-lipoic acid, myo-inositol and propolis supplementation on metabolic profiles and liver function in obese patients with NAFLD: A randomized controlled clinical trial. Clin Nutr ESPEN. 2023;54:412-420. DOI: 10.1016/j.clnesp.2023.02.016.
24. Ciaraldi T.P. Cellular Insulin Resistance in Adipocytes from Obese Polycystic Ovary Syndrome Subjects Involves Adenosine Modulation of Insulin Sensitivity. J Clin Endocrinol Metab. 1997;82(5):1421-1425. DOI: 10.1210/jc.82.5.1421.
25. Vigil P., Contreras P., Alvarado J.L. et al. Evidence of subpopulations with different levels of insulin resistance in women with polycystic ovary syndrome. Hum Reprod. 2007;22(11):2974-2980. DOI: 10.1093/humrep/ dem302.
26. Teede H.J., Misso M.L., Costello M.F. et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril. 2018;110(3):364-379. DOI: 10.1016/j.fertnstert.2018.05.004.
27. Teede H.J., Tay C.T., Laven J.J.E. et al. Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2023;108(10):2447-2469. DOI: 10.1210/clinem/dgad463.
28. Fruzzetti F., Perini D., Russo M. et al. Comparison of two insulin sensitizers, metformin and myo-inositol, in women with polycystic ovary syndrome (PCOS). Gynecol Endocrinol. 2017;33(1):39-42. DOI: 10.1080/09513590.2016.1236078.
29. Agrawal A., Mahey R., Kachhawa G. et al. Comparison of metformin plus myoinositol vs metformin alone in PCOS women undergoing ovulation induction cycles: randomized controlled trial. Gynecol Endocrinol. 2019;35(6):511-514. DOI: 10.1080/09513590.2018.1549656.
30. Bevilacqua A., Bizzarri M. Inositols in Insulin Signaling and Glucose Metabolism. Int J Endocrinol. 2018;2018:1-8. DOI: 10.1155/2018/1968450.
31. Parthasarathy R., Eisenberg F. The inositol phospholipids: a stereochemical view of biological activity. Biochem J. 1986;235(2):313-322. DOI: 10.1042/bj2350313.
32. Lagana A., Vitale S., Nigro A. et al. Pleiotropic Actions of Peroxisome Proliferator-Activated Receptors (PPARs) in Dysregulated Metabolic Homeostasis, Inflammation and Cancer: Current Evidence and Future Perspectives. Int J Mol Sci. 2016;17(7):999. DOI: 10.3390/ijms17070999.
33. Chukwuma C.I., Ibrahim M.A., Islam M.S. Myo-inositol inhibits intestinal glucose absorption and promotes muscle glucose uptake: a dual approach study. J Physiol Biochem. 2016;72(4):791-801. DOI: 10.1007/ s13105-016-0517-1.
34. Heimark D., McAllister J., Larner J. Decreased myo-inositol to chiro-inositol (M/C) ratios and increased M/C epimerase activity in PCOS theca cells demonstrate increased insulin sensitivity compared to controls. Endocr J. 2014;61(2):111-117. DOI: 10.1507/endocrj.EJ13-0423.
35. Larner J. D-Chiro-Inositol — Its Functional Role in Insulin Action and its Deficit in Insulin Resistance. Int J Exp Diabetes Res. 2002;3(1):47-60. DOI: 10.1080/15604280212528.
36. Unfer V., Nestler J.E., Kamenov Z.A. et al. Effects of Inositol(s) in Women with PCOS: A Systematic Review of Randomized Controlled Trials. Int J Endocrinol. 2016;2016:1-12. DOI: 10.1155/2016/1849162.
37. Monastra G., Unfer V., Harrath A.H., Bizzarri M. Combining treatment with myo-inositol and D-chiro-inositol (40:1) is effective in restoring ovary function and metabolic balance in PCOS patients. Gynecol Endocrinol. 2017;33(1):1-9. DOI: 10.1080/09513590.2016.1247797.
38. Пустотина О.А. Инозитол и липоевая кислота в лечении инсулинорезистентности у женщин с синдромом поликистозных яичников. 5кушерство и гинекология. 2020;12:209-216. DOI: DOI: 10.18565/ aig.2020.12.209-216.
Pustotina O.A. Inositol and lipoic acid in the treatment of insulin resistance in women with polycystic ovary syndrome. Obstetrics and Gynecology. 2020;12:209-216 (in Russ.). DOI: 10.18565/aig.2020.12.209-216.
39. Facchinetti F., Dante G., Neri I. The Ratio of MI to DCI and Its Impact in the Treatment of Polycystic Ovary Syndrome: Experimental and Literature Evidences. In: Frontiers in Gynecological Endocrinology. 2016:103-109. DOI: 10.1007/978-3-319-23865-4_13.
40. Unfer V., Carlomagno G., Papaleo E. et al. Hyperinsulinemia Alters Myoinositol to d-chiroinositol Ratio in the Follicular Fluid of Patients With PCOS. Reprod Sci. 2014;21(7):854-858. DOI: 10.1177/1933719113518985.
41. Facchinetti F., Appetecchia M., Aragona C. et al. Experts' opinion on inositols in treating polycystic ovary syndrome and non-insulin dependent diabetes mellitus: a further help for human reproduction and beyond. Expert Opin Drug Metab Toxicol. 2020;16(3):255-274. DOI: 10.1080/17425255.2020.1737675.
42. Shay K.P., Moreau R.F., Smith E.J. et al. Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential. Biochim Biophys Acta. 2009;1790(10):1149-1160. DOI: 10.1016/j.bbagen.2009.07.026.
43. Padmalayam I., Hasham S., Saxena U., Pillarisetti S. Lipoic Acid Synthase (LASY). Diabetes. 2009;58(3):600-608. DOI: 10.2337/db08-0473.
44. Masharani U., Gjerde C., Evans J.L. et al. Effects of Controlled-Release Alpha Lipoic Acid in Lean, Nondiabetic Patients with Polycystic Ovary Syndrome. J Diabetes Sci Technol. 2010;4(2):359-364. DOI: 10.1177/193229681000400218.
45. Di Simone N., Di Nicuolo F., Marzioni D. et al. Resistin modulates glucose uptake and glucose transporter-1 (GLUT-1) expression in trophoblast cells. J Cell Mol Med. 2009;13(2):388-397. DOI: 10.1111/j.1582-4934.2008.00337.x.
46. Tosi F., Negri C., Perrone F. et al. Hyperinsulinemia Amplifies GnRH Agonist Stimulated Ovarian Steroid Secretion in Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2012;97(5):1712-1719. DOI: 10.1210/jc.2011-2939.
47. Huang S.-Y., Chung M.-T., Kung C.-W. et al. Alpha-Lipoic Acid Induces Adipose Tissue Browning through AMP-Activated Protein Kinase Signaling in Vivo and in Vitro. J Obes Metab Syndr. 2024. DOI: 10.7570/ jomes23048. Online ahead of print.
48. Ying Z., Kampfrath T., Sun Q. et al. Evidence that a-lipoic acid inhibits NF-kB activation independent of its antioxidant function. Inflamm Res. 2011;60(3):219-225. DOI: 10.1007/s00011-010-0256-7.
49. Ma X., He P., Sun P., Han P. Lipoic Acid: An Immunomodulator That Attenuates Glycinin-Induced Anaphylactic Reactions in a Rat Model. J Agric Food Chem. 2010;58(8):5086-5092. DOI: 10.1021/jf904403u.
50. Jakimiuk A.J., Weitsman S.R., Navab A., Magoffin D.A. Luteinizing Hormone Receptor, Steroidogenesis Acute Regulatory Protein, and Steroidogenic Enzyme Messenger Ribonucleic Acids Are Overexpressed in Thecal and Granulosa Cells from Polycystic Ovaries 1. J Clin Endocrinol Metab. 2001;86(3):1318-1323. DOI: 10.1210/jcem.86.3.7318.
51. Di Nicuolo F., Specchia M., Trentavizi L. et al. An Emerging Role of Endometrial Inflammasome in Reproduction: New Therapeutic Approaches. Protein Pept Lett. 2018;25(5):455-462. DOI: 10.2174/0929866 525666180412160045.
52. Cirillo F., Catellani C., Lazzeroni P. et al. HMGB1 is increased in adolescents with polycystic ovary syndrome (PCOS) and decreases after treatment with myo-inositol (MYO) in combination with alpha-lipoic acid (ALA). Gynecol Endocrinol. 2020;36(7):588-593. DOI: 10.1080/09513590.2020.1725967.
53. Fruzzetti F., Benelli E., Fidecicchi T., Tonacchera M. Clinical and Metabolic Effects of Alpha-Lipoic Acid Associated with Two Different Doses of Myo-Inositol in Women with Polycystic Ovary Syndrome. Int J Endocrinol. 2020;2020:1-8. DOI: 10.1155/2020/2901393.
54. Genazzani A. Expert's opinion: integrative treatment with inositols and lipoic acid for insulin resistance of PCOS. GREM Gynecol Reprod Endocrinol Metab. 2020;3:146-157. DOI: 10.53260/GREM.201033.
55. Carlomagno G., Unfer V. Inositol safety: clinical evidences. Eur Rev Med Pharmacol Sci. 2011;15(8):931-936. DOI: 21845803.
56. Bevilacqua A., Carlomagno G., Gerli S. et al. Results from the International Consensus Conference on myo-inositol and D-chiroinositol in Obstetrics and Gynecology — assisted reproduction technology. Gynecol Endocrinol. 2015;31(6):441-446. DOI: 10.3109/09513590.2015.1006616.
57. Lagana A.S., Vitagliano A., Noventa M. et al. Myo-inositol supplementation reduces the amount of gonadotropins and length of ovarian stimulation in women undergoing IVF: a systematic review and meta-analysis of randomized controlled trials. Arch Gynecol Obstet. 2018;298(4):675-684. DOI: 10.1007/s00404-018-4861-y.
58. Michell R.H. Do inositol supplements enhance phosphatidylinositol supply and thus support endoplasmic reticulum function? Br J Nutr. 2018;120(3):301-316. DOI: 10.1017/S0007114518000946.
59. Vitagliano A., Saccone G., Cosmi E. et al. Inositol for the prevention of gestational diabetes: a systematic review and meta-analysis of randomized controlled trials. Arch Gynecol Obstet. 2019;299(1):55-68. DOI: 10.1007/ s00404-018-5005-0.
60. Facchinetti F., Orru B., Grandi G., Unfer V. Short-term effects of metformin and myo-inositol in women with polycystic ovarian syndrome (PCOS): a meta-analysis of randomized clinical trials. Gynecol Endocrinol. 2019;35(3):198-206. DOI: 10.1080/09513590.2018.1540578.
61. Morley L.C., Tang T., Yasmin E. et al. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiroinositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst Rev. 2017;11(11):CD003053. DOI: 10.1002/14651858. CD003053.pub6.
62. Bevilacqua A., Dragotto J., Lucarelli M. et al. High Doses of D-Chiro-Inositol Alone Induce a PCO-Like Syndrome and Other Alterations in Mouse Ovaries. Int J Mol Sci. 2021;22(11):5691. DOI: 10.3390/ijms22115691.
63. Sacchi S., Marinaro F., Tondelli D. et al. Modulation of gonadotrophin induced steroidogenic enzymes in granulosa cells by d-chiroinositol. Reprod Biol Endocrinol. 2016;14(1):52. DOI: 10.1186/s12958-016-0189-2.
64. Gateva A., Unfer V., Kamenov Z. The use of inositol(s) isomers in the management of polycystic ovary syndrome: a comprehensive review. Gynecol Endocrinol. 2018;34(7):545-550. DOI: 10.1080/09513590.2017.1421632.
65. Colazingari S., Treglia M., Najjar R., Bevilacqua A. The combined therapy myo-inositol plus d-chiro-inositol, rather than d-chiro-inositol, is able to improve IVF outcomes: results from a randomized controlled trial. Arch Gynecol Obstet. 2013;288(6):1405-1411. DOI: 10.1007/s00404-013-2855-3.
66. Zeng L., Yang K. Effectiveness of myoinositol for polycystic ovary syndrome: a systematic review and meta-analysis. Endocrine. 2018;59(1):30-38. DOI: 10.1007/s12020-017-1442-y.
67. Pundir J., Psaroudakis D., Savnur P. et al. Inositol treatment of anovulation in women with polycystic ovary syndrome: a meta-analysis of randomised trials. BJOG. 2018;125(3):299-308. DOI: 10.1111/14710528.14754.
68. Воронцова A.B., Гаспарян C.A., Громова O.A. и др. Заключение совещания экспертов «Обоснование применения средств на основе инозитола у пациенток с нарушениями менструального цикла». Проблемы репродукции. 2020;26(1):44-54. DOI: 10.17116/repro20202601144. Vorontsova A.V., Gasparyan S.A., Gromova O.A. et al. The conclusion of the Expert Council ‘The product rationale based on inositol for use by patients with menstrual irregularities'. Russian Journal of Human Reproduction. 2020;26(1):44-54 (in Russ.). DOI: 10.17116/repro20202601144.
69. Пустотина O.A. Расулова И.А. Влияние миоинозитола и Д-хироинозитола в соотношении 40:1 на гормональные и метаболические показатели у женщин с синдромом поликистозных яичников. 5кушерство и гинекология. 2023;(9):170-178. DOI: 10.18565/ aig.2023.203. Pustotina O.A., Rasulova I.A. The effect of myoinositol and D-chiroinositol in a ratio of 40:1 on hormonal and metabolic parameters in women with polycystic ovary syndrome. Obstetrics and Gynecology. 2023;(9):170-178 (in Russ.) DOI: 10.18565/aig.2023.203.
70. Bevilacqua A., Dragotto J., Giuliani A., Bizzarri M. Myo-inositol and D-chiroinositol (40:1) reverse histological and functional features of polycystic ovary syndrome in a mouse model. J Cell Physiol. 2019;234(6):9387-9398. DOI: 10.1002/jcp.27623.
71. Nordio M., Basciani S., Camajani E. The 40:1 myo-inositol/ D-chiro-inositol plasma ratio is able to restore ovulation in PCOS patients: comparison with other ratios. Eur Rev Med Pharmacol Sci. 2019;23(12):5512-5521. DOI: 10.26355/eurrev_201906_18223.
72. Benelli E., Del Ghianda S., Di Cosmo C., Tonacchera M. A Combined Therapy with Myo-Inositol and D-Chiro-Inositol Improves Endocrine Parameters and Insulin Resistance in PCOS Young Overweight Women. Int J Endocrinol. 2016;2016:1-5. DOI: 10.1155/2016/3204083.
73. Abu-Zaid A., Baradwan S., Bukhari I.A. et al. The effect of alpha-lipoic acid supplementation on anthropometric, glycemic, lipid, oxidative stress, and hormonal parameters in individuals with polycystic ovary syndrome: a systematic review and meta-analysis of randomized clinical trials. Obstet Gynecol Sci. 2024;67(1):17-29. DOI: 10.5468/ogs.23206.
74. Kucukgoncu S., Zhou E., Lucas K.B., Tek C. Alpha-lipoic acid (ALA) as a supplementation for weight loss: results from a meta-analysis of randomized controlled trials. Obes Rev. 2017;18(5):594-601. DOI: 10.1111/ obr.12528.
75. Vajdi M., Abbasalizad Farhangi M. Alpha-lipoic acid supplementation significantly reduces the risk of obesity in an updated systematic review and dose response meta-analysis of randomised placebo-controlled clinical trials. Int J Clin Pract. 2020;74(6):e13493. DOI: 10.1111/ijcp.13493.
76. Genazzani A.D., Shefer K., Della Casa D. et al. Modulatory effects of alpha-lipoic acid (ALA) administration on insulin sensitivity in obese PCOS patients. J Endocrinol Invest. 2018;41(5):583-590. DOI: 10.1007/ s40618-017-0782-z.
77. Genazzani A.D., Prati A., Marchini F. et al. Differential insulin response to oral glucose tolerance test (OGTT) in overweight/obese polycystic ovary syndrome patients undergoing to myo-inositol (MYO), alpha lipoic acid (ALA), or combination of both. Gynecol Endocrinol. 2019;35(12):1088-1093. DOI: 10.1080/09513590.2019.1640200.
78. Fruzzetti F., Fidecicchi T., Palla G., Gambacciani M. Long-term treatment with a-lipoic acid and myo-inositol positively affects clinical and metabolic features of polycystic ovary syndrome. Gynecol Endocrinol. 2020;36(2):152-155. DOI: 10.1080/09513590.2019.1640673.
79. Cianci A., Panella M., Fichera M. et al. d-chiro-Inositol and alpha lipoic acid treatment of metabolic and menses disorders in women with PCOS. Gynecol Endocrinol. 2015;31(6):483-486. DOI: 10.3109/09513590.2015.1014784.
80. De Cicco S., Immediata V., Romualdi D. et al. Myoinositol combined with alpha-lipoic acid may improve the clinical and endocrine features of polycystic ovary syndrome through an insulin-independent action. Gynecol Endocrinol. 2017;33(9):698-701. DOI: 10.1080/09513590.2017.1313972.
81. Genazzani D.A. Effects of a Combination of Alpha Lipoic Acid and MyoInositol on Insulin Dynamics in Overweight/Obese Patients with PCOS. Endocrinol Metab Syndr. 2014;03(03). DOI: 10.4172/2161-1017.1000140.
82. Genazzani A.D., Santagni S., Rattighieri E. et al. Modulatory role of D-chiro-inositol (DCI) on LH and insulin secretion in obese PCOS patients. Gynecol Endocrinol. 2014;30(6):438-443. DOI: 10.3109/09513590.2014.897321.
83. Ivanova L.A. Influence of Thioctic Acid on the Hyperinsulinemia and Ovarian Volume in Female Patients with Polycystic Ovary Syndrome. Open JEndocr Metab Dis. 2015;05(04):37-40. DOI: 10.4236/ojemd.2015.54005.
84. Tabrizi R., Ostadmohammadi V., Lankarani K.B. et al. The effects of inositol supplementation on lipid profiles among patients with metabolic diseases: a systematic review and meta-analysis of randomized controlled trials. Lipids Health Dis. 2018;17(1):123. DOI: 10.1186/s12944-018-0779-4.
85. Capasso I., Esposito E., Maurea N. et al. Combination of inositol and alpha lipoic acid in metabolic syndrome-affected women: a randomized placebo-controlled trial. Trials. 2013;14:273. DOI: 10.1186/1745-621514-273.
86. Budin S.B., Kee K.P., Eng M.Y.S. et al. Alpha lipoic Acid prevents pancreatic islet cells damage and dyslipidemia in streptozotocin-induced diabetic rats. Malays J Med Sci. 2007;14(2):47-53. PMID: 22993491.
СВЕДЕНИЯ ОБ АВТОРАХ:
Иванов Илья Андреевич — к.м.н., научный сотрудник отделения гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0003-0751-7566.
Табеева Гюзяль Искандеровна — к.м.н., старший научный сотрудник отделения гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0003-1498-6520.
Сметник Антонина Александровна — к.м.н., президент Российского общества специалистов по гинекологической эндокринологии и менопаузе; заведующая отделением гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0002-0627-3902.
Контактная информация: Иванов Илья Александрович, e-mail: doctor.i.ivanov@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует.
Статья поступила 01.03.2024.
Поступила после рецензирования 28.03.2024.
Принята в печать 22.04.2024.
ABOUT THE AUTHORS:
Ilya A. Ivanov — C. Sc. (Med.), researcher of the Department of Gynecological Endocrinology, V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-0751-7566.
Gyuzyal' I. Tabeeva — C. Sc. (Med.), senior researcher of the Department of Gynecological Endocrinology, V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-14986520.
Antonina A. Smetnik — C. Sc. (Med.), President of the Russian Society of Experts in Gynecological Endocrinology and Menopause; Head the Department of Gynecological Endocrinology, V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-0627-3902.
Contact information: Ilya A. Ivanov, e-mail: doctor.i.ivanov@ yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Комментарии
ПРАКТИКА ПЕДИАТРА