О роли бактериальной микрофлоры в этиологии хронического аденоидита у детей
СтатьиОпубликовано в журнале:
Вопросы современной педиатрии /2014/ Том 13/ № 1
Д.А. Тулупов, Е.П. Карпова
Российская медицинская академия последипломного образования, Москва, Российская Федерация Представлен обзор результатов клинических исследований по изучению роли патогенной бактериальной флоры в этиологии хронического аденоидита у детей. Согласно литературным данным, основной причиной развития хронической патологии носоглотки у детей является вирусная инфекция. При этом роль бактериальной микрофлоры в развитии хронического аденоидита вторична, но весьма существенна. Основными бактериальными патогенами, выделяемыми из носоглотки детей с хроническим аденоидитом, являются Staphylococcus aureus, Haemophilus influenzae и Streptococcus pneumoniae, однако существует выраженная диссоциация в частоте выделения данных бактериальных патогенов по данным разных исследователей. Значительную роль в формировании персистенции данных патогенов в носоглотке при хроническом аденоидите играет способность бактерий к образованию биопленок. Бактериальные биопленки, а также факт обнаружения большого количества бактерий внутри ткани глоточной миндалины, обусловливают возникновение дискуссии о возможностях системной и топической антибактериальной терапии.
Ключевые слова: хронический аденоидит, бактериальная микрофлора, Staphylococcus aureus, Haemophilus influenzae, Streptococcus pneumoniae.
Хронический аденоидит (ХА) — полиэтиологическое заболевание с преобладающей симптоматикой постназального синдрома (post-nasal drip). В его основе лежит нарушение иммунных процессов глоточной миндалины. При этом отсутствует единое мнение о длительности воспалительного процесса, при котором указанные изменения можно считать хроническими. С учетом того, что оториноларингологи не рассматривают ХА как отдельную нозологическую форму, а выделяют лишь гипертрофию аденоидных вегетаций или, при наличии воспалительных изменений в носоглотке, хронический риносинусит, наиболее корректно говорить о ХА в случае сохранения клинической симптоматики заболевания более 12 нед [1].
Несмотря на высокую частоту встречаемости, эпидемиологических данных по патологии носоглотки у детей не так много, и все они достаточно противоречивы. Ввиду частого использования термина «хронический аденоидит» конкретные цифры о распространенности этой патологии можно найти только в русскоязычной литературе. Так, по данным отечественных авторов, доля детей с ХА составляет от 3 [2] до 50% [3] в общей детской популяции и до 70% в группе часто болеющих детей [4].
По современным представлениям, несмотря на главенствующую роль вирусов, в этиологии ХА достаточно большое значение придают хронической бактериальной инфекции. Согласно результатам последних исследований, одним из маркеров хронической бактериальной инфекции являются бактериальные биопленки. Биопленка (от англ. biofilm) представляет собой микробное сообщество, состоящее из клеток, которые прикреплены к поверхности или друг к другу и покрыты экзополисахаридным слоем (гликокаликсом), вырабатываемым самими микробами. По данным B. Winther и соавт., на поверхности удаленных аденоидов бактериальные биопленки были обнаружены в 8 из 9 случаев [5]. В работе итальянских оториноларингологов при исследовании 16 образцов небных миндалин и аденоидов и 24 образцов слизистой оболочки, взятой при вскрытии клеток решетчатого лабиринта у пациентов с хроническим риносинуситом, биопленки были обнаружены в 57,5 и 41,7% случаев, соответственно [6]. В отличие от ХА роль бактерий в гипертрофии аденоидных вегетаций дискутабельна. В частности, по данным J. Coticchia и соавт., у пациентов с ХА биопленки были обнаружены в 94,9% случаев, тогда как на образцах ткани глоточной миндалины, удаленной у пациентов с синдромом обструктивного апноэ сна, — только в 1,9% [7]. Способность бактериальных патогенов к образованию биопленок во многом обусловливает неэффективность антибактериальной терапии при попытке плановой санации носоглотки. При этом считают, что клинические признаки обострения хронического процесса связаны с увеличением количества планктонных форм бактерий, подавление роста которых можно считать обоснованием применению антибактериальных средств [8, 9].
Важным вопросом в настоящее время остается вид основного бактериального патогена при ХА у детей. По мнению одних исследователей, им является Streptococcus pneumoniae (пневмококк) [10, 11]. Согласно другим, главенствующие бактериальные патогены при ХА — это представители грамотрицательной флоры Haemophilus influenzae и Moraxella catarrhalis. По данным I. Brook и соавт., при исследовании материала c поверхности глоточной миндалины наиболее часто обнаруживали H. influenzae (64,4%), M. catarrhalis (35,6%) [12]. В другом исследовании у детей с ХА гемофильная палочка обнаружена в 66,7% случаев [13]. Однако наибольшее число авторов указывают на ведущую роль Staphylococcus aureus в развитии ХА у детей. К примеру, по данным C. D. Lin и соавт., S. aureus был наиболее часто выделяемым патогеном (21,2%) из носоглотки у детей с ХА [14]. По данным M. Emaneini и соавт. [15], частота идентификации S. aureus составила 23%. Согласно результатам отечественных исследований, частота обнаружения S. aureus при исследовании материала с поверхности глоточной миндалины составляет 32%, из ткани — 45%, что уступает только частоте выделения пневмококка [10].
По нашим данным, основным бактериальным патогеном при ХА является золотистый стафилококк, выделяемый с поверхности глоточной миндалины почти у 50% детей. В группе детей с гастроэзофагеальной рефлюксной болезнью частота высевания S. aureus с поверхности глоточной миндалины находится на уровне 70–75% [16]. Регулярный заброс кислого химуса в носоглотку при гастроэзофагеальной рефлюксной болезни приводит к нарушению работы механизмов местного иммунитета (в первую очередь мукоцилиарной системы), что создает благоприятные условия для колонизации и роста патогенной бактериальной микрофлоры (рис.).
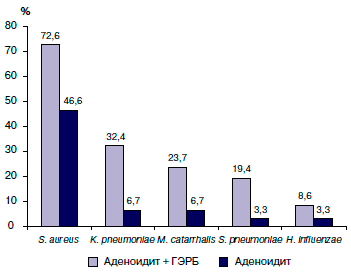
Рис. Частота высеваемости высокопатогенной микрофлоры с поверхности глоточной миндалины у детей с хроническим аденоидитом, ассоциированным и не ассоциированным с гастроэзофагеальной рефлюксной болезнью
Примечание. ГЭРБ — гастроэзофагеальная рефлюксная болезнь.
Согласно последним сведениям, роль грибковой микрофлоры в развитии хронической патологии носоглотки не подтверждена [17]. В отечественной литературе встречаются единичные работы, результаты которых свидетельствуют о вкладе микотической инфекции в развитие ХА. Так, по данным А. И. Мачулина, в 33,3% случаев у детей с ХА имеет место грибково-бактериальная ассоциация [18].
Убедительные фактические данные о значимой роли атипичных возбудителей (Chlamydophila pneumoniae, Mycoplasma pneumoniae) в развитии ХА в настоящее время отсутствуют [17]. Мнения зарубежных исследователей по этому вопросу достаточно противоречивы. Например, в работе G. P. Pintucci и соавт. при исследовании 55 образцов ткани глоточной и небных миндалин M. pneumoniae обнаружены в 10,9% случаев, C. pneumoniae — в 18,2% [19], а в исследовании L. Drago и соавт. в 44 образцах ткани аденоидов C. pneumoniae обнаружены только в 4,8% случаев, тогда как M. pneumoniae не обнаружены вовсе [20].
Вопрос о консервативном лечении ХА достаточно сложен, поскольку не существует каких-либо жестких стандартов его терапии. Лечение ХА, как и любого хронического заболевания, должно быть комплексным, с учетом этиопатогенеза воспалительного процесса [21].
Основным направлением современной фармакотерапии ринологической патологии в настоящее время принято считать противовоспалительную терапию. Наиболее эффективными из существующих средств с противовоспалительным эффектом являются глюкокортикоидные препараты. Так, накоплен клинический опыт применения мометазона фуроата в лечении неаллергической воспалительной ринологической патологии у детей и взрослых [1]. Однако патология носоглотки (гипертрофия аденоидных вегетаций и аденоидит) не входит в официально зарегистрированные показания к применению назального спрея мометазона фуроата.
Вторым по значимости при обсуждении схемы терапии обострений ХА является вопрос об этиотропном лечении. Учитывая главенствующую роль вирусов в развитии ХА, логичным решением было бы активное применение противовирусных средств в лечении и профилактике острых респираторных инфекций. Однако последний анализ рандомизированных клинических исследований показал сомнительную эффективность подавляющего большинства противовирусных препаратов в лечении, и особенно в профилактике острых респираторных инфекций [22].
Учитывая значимую роль патогенной бактериальной микрофлоры при обострении ХА (в особенности при гнойных его формах), необходимо обсудить вопрос о применении антибактериальных средств. При неосложненной форме аденоидита (и даже при гнойной форме, по мнению отечественных авторов) назначение системных антибактериальных лекарственных препаратов не является целесообразным [9, 23, 24]. По нашему мнению, показаниями к проведению системной антибактериальной терапии при ХА можно считать:
- осложненные формы гнойных аденоидитов (острый средний отит, острый бактериальный риносинусит);
- гнойный аденоидит с выраженным снижением качества жизни ребенка (нарушение сна) при неэффективности топической противовоспалительной терапии.
Как уже было сказано выше, при неосложненных формах обострения ХА в педиатрической практике предпочтение отдают антибактериальным препаратам для местного применения. Учитывая значимую роль S. aureus и Klebsiella pneumoniae как ведущих бактериальных патогенов при ХА у детей, большой интерес представляют топические антибактериальные препараты, имеющие в своей основе антибиотики аминогликозидного ряда. Среди трех назальных спреев — растворов антибиотиков, представленных на российском рынке, два содержат в качестве основного действующего вещества именно аминогликозиды. Так, назальный спрей монокомпонентного раствора фрамицетина Изофра обладает высокой активностью против основных бактерий, играющих роль в этиологии ХА. При этом раствор фрамицетина имеет высокий профиль безопасности применения, обусловленный крайне низкой системной биодоступностью, и является единственным в России назальным спреем раствора антибиотика, разрешенным к применению с первых дней жизни ребенка [25]. Не менее эффективен другой назальный спрей аминогликозидного антибиотика, представленный на российском фармрынке, — комплексный препарат раствора неомицина, полимиксина B, дексаметазона и фенилэфрина «Полидекса с фенилэфрином». Для пациентов с хроническим аденоидитом уникальность данного лекарственного средства заключается в комбинации антибактериального компонента (неомицин + полимиксин B) и дексаметазона — глюкокортикоида, обладающего сильнейшим противовоспалительным эффектом. Наличие в составе деконгестанта фенилэфрина позволяет использовать его даже в качестве монотерапии в течение первых дней обострения ХА на фоне острой респираторной инфекции. Важнейшим моментом является и тот факт, что Полидекса с фенилэфрином — единственный в России назальный спрей, содержащий глюкокортикоидный компонент, у которого в официальных показаниях упоминается патология носоглотки. Однако врачам необходимо помнить о высоком уровне системной биодоступности дексаметазона, что ограничивает длительность использования данного препарата (не более 7–10 сут) и обусловливает наличие определенных возрастных ограничений (запрещено применять у детей младше 2,5 лет) [26].
Таким образом, проблема хронических форм патологии носоглотки у детей является одной из наиболее актуальных в современной оториноларингологии и педиатрии, требующей дальнейшего изучения с целью определения единой клинически обоснованной тактики лечения. Вопрос о роли антибактериальных препаратов, как топических, так и системных, также требует дальнейших клинических исследований для разработки единых общепринятых стандартов с формулированием показаний к применению и схемы антибактериальной терапии при обострении хронического аденоидита у детей.
Список литературы
