Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
Внутрисуставное введение глюкозамина у пациентов с гонартрозом: результаты рандомизированного активно-контролируемого исследования с адаптивным дизайном.
СтатьиНосков Сергей Михайлович, д.м.н. проф. (1), Назарова Ольга Анатольевна, д.м.н. проф.(2), Писарев В.В., к.х.н. (3), Меркулов М.Е. (3).
1. Государственное автономное учреждение здравоохранения Ярославской области «Клиническая больница № 3»
2. Областное бюджетное учреждение здравоохранения «Ивановская клиническая больница имени Куваевых»
3. ООО "МЦ Пробиотек"
Цель исследования: Изучалась эффективность, безопасность и переносимость лекарственного препарата Эльбона® (глюкозамин) производства ООО «Эллара», Россия в качестве средства для локальной (внутрисуставной) терапии остеоартроза коленного сустава.
Пациенты и методы: В рандомизированном двухэтапном исследовании с активным контролем приняли участие 231 пациента с остеоартрозом одного или обоих коленных суставов. Задачами исследования было установление превосходства внутрисуставной терапии препаратом Эльбона® над внутримышечным введением препарата и подтверждение не меньшей эффективности внутрисуставной терапии глюкозамином в сравнении с внутрисуставным введением препарата Гиалган Фидия. Лечение в основной группе пациентов проводилось в следующем режиме: внутрисуставное введение препарата Эльбона® 1 раз в неделю в течение 6 недель еженедельно (6 внутрисуставных инъекций). Пациенты контрольной группы 1 получали препарат Эльбона® внутримышечно 3 раза в неделю в течение 6 недель, согласно инструкции по применению. Пациенты контрольной группы 2 получали внутрисуставные инъекции препарата Гиалган Фидия 1 раз в неделю, курсом из 5 инъекций по стандартной методике.
Результаты: окончательный анализ данных включал 2 первичные конечные точки эффективности: распределение долей пациентов, ответивших на проводимую терапию (сравнение внутрисуставного и внутримышечного введения препарата Эльбона) и изменение подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем (сравнение внутрисуставного введения препаратов Эльбона и Гиалган Фидия). Разница долей пациентов, ответивших на терапию, между внутрисуставным и внутримышечным введением препарата Эльбона к концу терапии составила 17,6%, левая граница 95%доверительного интервала находится правее границы превосходства, что подтверждает гипотезу исследования о том, что внутрисуставное введение глюкозамина превосходит внутримышечное по эффективности. Первичная точка для доказательства не меньшей эффективности: для расчета доверительных интервалов проводилось сравнение средних изменений подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем Для разности средних изменений подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем (Исследуемый препарат - препарат активного контроля = -1,606 мм со стандартной ошибкой среднего SE = 2,304), правая граница одностороннего 95%-го доверительного интервала составляет 2,208 мм, а граница двустороннего 95%-го доверительного интервала составила 2,948 мм. В обоих случаях (для одно- и двустороннего 95% ДИ) результаты находятся левее установленной границы не меньшей эффективности 10 мм. Таким образом, исследуемый препарат при внутрисуставном введении не уступает по эффективности Гиалган Фидия. Комплексный анализ данных безопасности, включая оценку нежелательных явлений, лабораторные исследования и влияние на жизненные показатели, не выявил статистически и клинически значимых различий между группами лечения, что позволяет сделать вывод о достаточной безопасности исследуемого препарата при использовании в качестве внутрисуставных инъекций.
Ключевые слова: Глюкозамин, гонартроз, внутрисуставное введение
Введение
Остеоартроз (остеоартрит, ОА) — одна из основных проблем здравоохранения практически во всех странах, что обусловлено прежде всего постоянным ростом заболеваемости [1]. Его распространенность увеличивается во всем мире по мере старения населения и увеличения факторов риска, таких как ожирение, что приводит к серьезной проблеме общественного здравоохранения и социально-экономическому бремени [2]. Тем не менее, ОА не является исключительной прерогативой пожилых людей, а также поражает лица молодого возраста, особенно тех, у кого есть факторы риска, такие как избыточная масса тела, метаболический синдром или травмы суставов [3]. На долю поражений коленного сустава приходится примерно 85% случаев ОА во всем мире [4]. Патофизиология ОА сложна и включает на различных уровнях взаимодействие между механическими, генетическими, метаболическими и воспалительными механизмами. Анатомически ОА характеризуется разрушением суставного хряща, ремоделированием субхондральной кости и вялотекущим воспалением синовиальной оболочки. На сегодняшний день для лечения ОА не существует однозначно эффективной терапии, модифицирующей заболевание, что можно объяснить недостаточным пониманием патогенеза и отсутствием достаточно чувствительного биомаркера, позволяющего поставить диагноз ОА на ранней бессимптомной фазе [2].
Непосредственной целью лечения пациента является уменьшение болевого синдрома и улучшение функции пораженного сустава.
Несмотря на противоречивые результаты исследований, есть многочисленные основания полагать, что препараты, содержащие глюкозамина сульфат, обладают значительным и клинически значимым эффектом при ОА [5]. Несколько рандомизированных контролируемых исследований показали симптоматический эффект, превосходящий плацебо [6] и не уступающий эффекту НПВП [7].
Доказанная эффективность глюкозамина сульфата при внутримышечном введении создала предпосылки для изучения его при локальном (внутрисуставном) применении.
Основной целью данного исследования являлось изучение эффективности, безопасности и переносимости лекарственного препарата Эльбона®, раствор для внутримышечного введения производства ООО «Эллара», Россия в качестве средства для локальной (внутрисуставной) терапии остеоартроза коленного сустава (гонартроз по критериям Altman R., II-III рентгенологическая стадия по Келлгрену).
Пациенты и методы
Исследование было проведено в 3 клинических центрах в Российской Федерации в соответствии с требованиями действующего законодательства РФ и ЕАЭС, этическими принципами Хельсинкской Декларации, трехсторонним соглашением по Надлежащей Клинической Практике (ICH GCP).
В исследование включались: мужчины или женщины в возрасте от 50 до 80 лет с гонартрозом одного или обоих суставов II-III рентгенологической стадии по Келлгрену, интенсивность болевого синдрома без приема анальгетических препаратов после прохождения 15 м по ровной поверхности по ВАШ должна была составлять >40 мм, но <90 мм на протяжении последних 2 недель.
Критериями невключения в исследование были: сохраненный потенциал деторождения у женщин, гиперчувствительность к любому компоненту исследуемых препаратов и НПВП, тяжелые аллергические реакции в анамнезе, язвенная болезнь либо другая патология с риском кровотечения; также не могли принимать участие пациенты с выраженным синовитом, тяжелыми сопутствующими заболеваниями, травматическими повреждениями структур коленных суставов; требующие хирургического лечения коленных суставов и с ранее проведенными реконструктивными операциями на коленных суставах; пациенты, получавшие менее чем за 6 месяцев до включения в исследование лечение препаратами гиалуроновой кислоты, другими хондропротекторами; также критерием невключения был сопутствующий прием глюкокортикостероидов, любые физиотерапевтические процедуры, затрагивающие область коленных суставов.
Дизайн исследования
Это было рандомизированное активно-контролируемое в параллельных группах двухэтапное исследование с адаптивным дизайном и последовательным переходом от фазы подбора оптимальной дозировки к фазе подтверждающего анализа эффективности.
Исследование предполагало 5 визитов, включая визит скрининга.
Лечение
Препарат Эльбона® в основной группе вводился в следующем режиме: внутрисуставное введение препарата 1 раз в неделю в течение 6 недель еженедельно (6 внутрисуставных инъекций). Пациенты контрольной группы 1 (группа пассивного контроля) получали препарат Эльбона® внутримышечно 3 раза в неделю в течение 6 недель, согласно инструкции к применению.
Пациенты контрольной группы 2 (группа активного контроля) получали препарат Гиалган Фидия (Hyalgan® Fidia) производства Фидия Фармацеутици С.п.А., Италия внутрисуставно 1 раз в неделю, курсом из 5 инъекций по стандартной методике.
Параметры эффективности и безопасности
Изучались 2 статистические гипотезы - превосходство внутрисуставной терапии глюкозамином над внутримышечной, что подтверждалось процентным превосходством пациентов-ответчиков; также было предусмотрено подтверждение не меньшей эффективности исследуемого препарата в сравнении с внутрисуставным введением Гиалган Фидия на основании изменения подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем.
Оценки эффективности также включали динамику альгофункционального индекса Лекена и индекса WOMAC на протяжении исследования; общее впечатление пациента и врача-исследователя о результатах лечения, потребность в дополнительном приеме НПВП (ибупрофен).
Анализ безопасности осуществлялся на протяжении всего исследования и включал оценку нежелательных явлений, лабораторных данных (общий и биохимический анализ крови, общий анализ мочи); показателей жизненно важных функций (АД, ЧСС), данные ЭКГ.
Статистика
Статистический анализ проводился при помощи программы R 3.5.
Для количественных переменных описательная статистика включала среднее значение, стандартное отклонение, медиану, минимальное и максимальное значения, число валидных случаев. Для качественных переменных было указано число наблюдений (или событий) в каждой терапевтической группе либо общее количество наблюдений. Доля, выраженная в процентах, считалась относительно количества пациентов в той или иной группе либо относительно полного размера соответствующей популяции.
Все рандомизированные пациенты, принявшие хотя бы одну дозу препарата, были включены в анализ безопасности. Все пациенты популяции безопасности, имеющие хотя бы одну оценку показателя эффективности на фоне приема препарата исследования, были включены в популяцию ITT (Intent-to-treat). Все пациенты популяции ITT, получившие запланированную терапию и имеющие оценки эффективности, были включены в популяцию По-Протоколу.
Критерий Шапиро-Уилка либо Колмогорова - Смирнова и графические методы применялись для выбора параметрических или непараметрических методов анализа.
Демографические характеристики были представлены для всех пациентов популяции безопасности. Все показатели эффективности анализировались в популяции По протоколу, поскольку она не отличалась от популяции ITT.
Для первичных переменных эффективности сравнивалась разница долей пациентов-ответчиков в группах оптимальной терапии по сравнению с пассивным контролем с построением 95% ДИ. Проверялась гипотеза исследования о том, что терапия исследуемым препаратом превосходит контрольную группу по эффективности.
Для изменения подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем тестирование гипотезы проводилось с помощью построения одно- и двустороннего 95%-ного доверительного интервала для разности средних значений первичной переменной в группе оптимальной терапии по сравнению с активным контролем. Заключение, что изучаемый препарат не уступает препарату сравнения делалось, если правая граница рассчитанного одностороннего 95%-ного доверительного интервала лежала левее границы не меньшей эффективности, равной 10 мм. Доверительный интервал рассчитывался с помощью дисперсионного анализа ANOVA для изменения оценок по шкале ВАШ на Визите 4 с терапией в качестве фактора.
Вторичные переменные эффективности - оценки интенсивности болевого синдрома в целевом суставе с помощью ВАШ, оценки функции суставов по WOMAC, оценки алгофункционального индекса Лекена рассматривались с помощью дисперсионного анализа ANOVA с повторяющимися измерениями. Показатели безопасности, а также их изменения были представлены с помощью описательной статистики по визитам и терапевтическим группам. Число и доля пациентов, у которых были зарегистрированы нежелательные явления после начала приема препарата, были табулированы по терапевтическим группам.
Вероятность ошибки I рода была установлена на уровне 5 % для всех статистических сравнений.
Распределение пациентов
Окончательный анализ данных охватывал данные 231 пациента, распределенных случайным образом в 3 группы лечения (Таблица 1).
Таблица 1.
Число пациентов, включенных в популяции для статистического анализа, по терапевтическим группам на этапе окончательного анализа.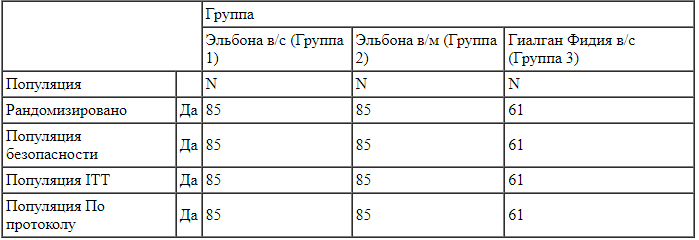 Результаты апостериорного расчета мощности исследования продемонстрировали, что для достижения 80% мощности сравнения указанное неравномерное распределение пациентов по терапевтическим группам является достаточным.
Результаты апостериорного расчета мощности исследования продемонстрировали, что для достижения 80% мощности сравнения указанное неравномерное распределение пациентов по терапевтическим группам является достаточным.
Средний возраст составил 62.65±7.82 года в Группе 1, 63.48±7.59 года в Группе 2 и 63.39±7.780 года в Группе 3.
Таблица 2.
Распределение демографических показателей по терапевтическим группам.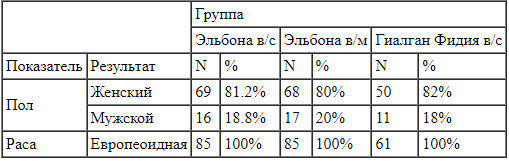 Дисперсионный анализ ANOVA с терапией в качестве фактора не выявил статистически значимых различий между терапевтическими группами по показателю Возраст (p=0,853).
Дисперсионный анализ ANOVA с терапией в качестве фактора не выявил статистически значимых различий между терапевтическими группами по показателю Возраст (p=0,853).
Критерий х2 не выявил статистически значимых различий распределения переменной «пол» (p=0,658.
Также группы лечения не различались статистически по другим базовым характеристикам (рост, масса тела, ИМТ).
Результаты
Распределение долей пациентов, ответивших на проводимую терапию, сравнивалось в группах внутрисуставного и внутримышечного введения препарата Эльбона.
Разница долей пациентов между исследуемым препаратом и пассивного контроля к концу терапии составила 17,6%, левая граница 95% доверительного интервала находится правее границы превосходства. , что подтверждает гипотезу о том, что внутрисуставное введение препарата Эльбона превосходит внутримышечное по эффективности.
Таблица 3.
Распределение долей пациентов, ответивших на проводимую терапию через 6 недель в сравнении с исходным уровнем.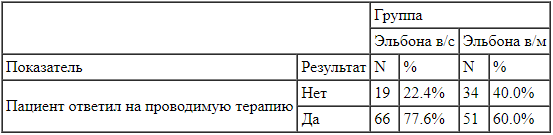 Для доказательства не уступающей эффективности между внутрисуставным введением препаратов Эльбона и Гиалган Фидия проводилось сравнение средних изменений подшкалы «боль» (на основании данных визуальноаналоговой шкалы) индекса WOMAC через 6 недель терапии.
Для доказательства не уступающей эффективности между внутрисуставным введением препаратов Эльбона и Гиалган Фидия проводилось сравнение средних изменений подшкалы «боль» (на основании данных визуальноаналоговой шкалы) индекса WOMAC через 6 недель терапии.
Таблица 4.
Дескриптивная статистика оценок подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем.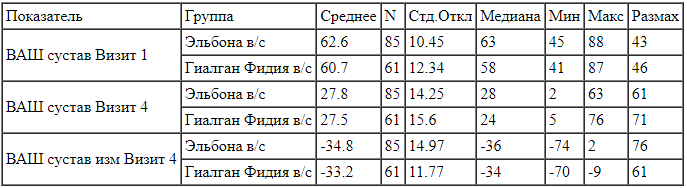 Для разности средних изменений подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем (Исследуемый препарат -препарат активного контроля = -1,606 мм со стандартной ошибкой среднего SE = 2,304) правая граница одностороннего 95%-го доверительного интервала составляет 2,208 балла, а граница двустороннего 95%-го доверительного интервала составила 2,948 балла. Граница не меньшей эффективности равняется 10 мм, согласно Протоколу исследования.
Для разности средних изменений подшкалы «боль» индекса WOMAC через 6 недель терапии в сравнении с исходным уровнем (Исследуемый препарат -препарат активного контроля = -1,606 мм со стандартной ошибкой среднего SE = 2,304) правая граница одностороннего 95%-го доверительного интервала составляет 2,208 балла, а граница двустороннего 95%-го доверительного интервала составила 2,948 балла. Граница не меньшей эффективности равняется 10 мм, согласно Протоколу исследования.
В обоих случаях (для одно- и двустороннего 95% ДИ) результаты находятся левее установленной границы не меньшей эффективности. Таким образом, принимается статистическая гипотеза, что по данной первичной переменной эффективности исследуемый препарат не уступает препарату сравнения.
Вторичные параметры эффективности
Динамика средних значений общей суммы индекса Лекена на протяжении исследования
На протяжении исследования средние значения общей суммы индекса Лекена снижались во всех трех группах с 11,8 ± 3,27 до 5,5 ± 2,53 баллов в группе исследуемого препарата, с 11,2 ± 3,33 до 5,9 ±3,17 баллов в группе пассивного контроля и с 11,2 ± 3,47 до 5,4 ± 2,53 баллов в группе активного контроля.
Динамика средних значений общей суммы индекса WOMAC
На протяжении исследования средние значения общей суммы индекса WOMAC снижались во всех трех группах с 42,2 ± 14,37 до 18,7 ± 10,59 баллов в группе исследуемого препарата, с 38,3 ± 16,56 до 19,5 ±13,08 баллов в группе пассивного контроля и с 41,0 ± 16,21 до 19,6 ± 10,58 баллов в группе активного контроля.
Общее клиническое впечатление
Результаты субъективных оценок улучшения состояния по мнению исследователей и пациентов представлены в таблицах 5 и 6, соответственно.
Таблица 5.
Оценка общего клинического впечатления исследователя по визитам и терапевтическим группам.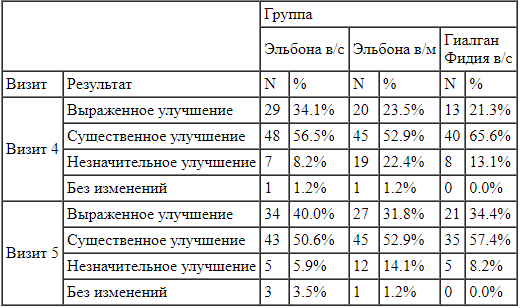 Таблица 6.
Таблица 6.
Оценка впечатления пациента об изменениях по визитам и терапевтическим группам.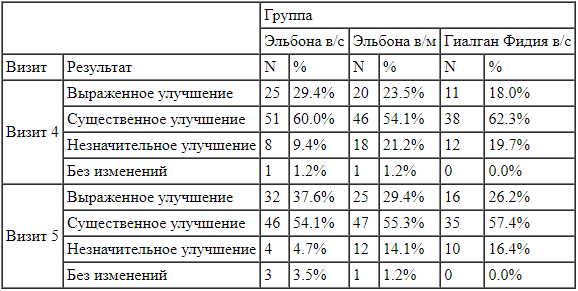 Несмотря на то, что в группе исследуемого препарата оценка общего клинического впечатления об изменениях была выше, чем в двух других группах, данные различия не были статистически значимы ни на одном из визитов (p>0,05, точный критерий Фишера) (Рисунок 1).
Несмотря на то, что в группе исследуемого препарата оценка общего клинического впечатления об изменениях была выше, чем в двух других группах, данные различия не были статистически значимы ни на одном из визитов (p>0,05, точный критерий Фишера) (Рисунок 1).
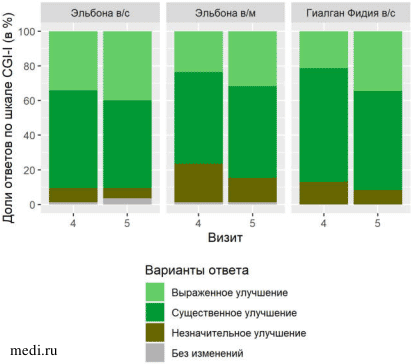 Рисунок 1. Распределение оценок общего клинического впечатления по визитам и терапевтическим группам.
Рисунок 1. Распределение оценок общего клинического впечатления по визитам и терапевтическим группам. Различия в субъективных оценках пациентов также не были статистически значимы ни на одном из визитов (p>0,05, точный критерий Фишера).
Потребность в дополнительном приеме НПВП (Ибупрофен)
Количество принятых в ходе исследования таблеток дополнительных анальгетических средств (ибупрофена) было просуммировано по визитам. Межгрупповое сравнение показателя проводилось при помощи непараметрического критерия Краскела-Уоллиса. Между сравниваемыми группами были выявлены статистически значимые различия (p=0,001).
В группе пассивного контроля (внутримышечное введение глюкозамина) пациенты чаще принимали ибупрофен в качестве вспомогательной терапии (Рисунок 2).
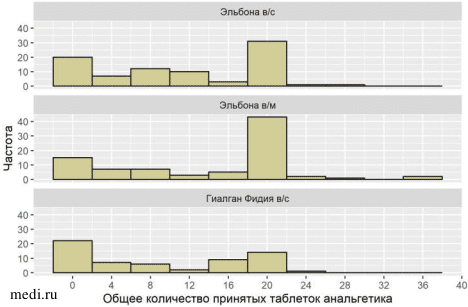 Рисунок 2. Частотное распределение числа принятых таблеток ибупрофена по терапевтическим группам.
Рисунок 2. Частотное распределение числа принятых таблеток ибупрофена по терапевтическим группам. Безопасность
Всего в исследовании было отмечено 4 НЯ у 4 (4,7%) пациентов группы внутрисуставного введения исследуемого препарата, 11 НЯ у 10 (11,8%) пациентов группы внутримышечного введения (пассивного контроля) и 6 НЯ у 5 (8,2%) пациентов группы Гиалган Фидия (активного контроля). Статистически значимой разницы между группами не выявлено (p=0,252, точный критерий Фишера). Все нежелательные явления, зарегистрированные в ходе исследования, не были серьезными, имели легкую степень тяжести и не повлекли за собой преждевременного исключения пациентов из исследования. Связь с применением препаратов исследования, по мнению исследователей, отсутствовала. Также ни одно из НЯ не требовало, по мнению исследователей, последующего наблюдения. Не было обнаружено отрицательной динамики лабораторных, жизненных показателей и параметров ЭКГ.
Обсуждение
Доказанная эффективность глюкозамина сульфата при внутримышечном введении создала предпосылки для изучения его при локальном (внутрисуставном) применении. Целесообразность и клиническая эффективность такого способа применения препарата доказана на экспериментальных моделях и в опубликованном двойном слепом исследовании [9], в котором принимали участие 55 пациентов с ОА коленных суставов. Было показано улучшение функционального состояния сустава и уменьшение болевого синдрома при еженедельном введении препарата на протяжении 5 недель.
На основании результатов ранее проведенного исследования 1-й фазы препарата Эльбона было продемонстрировано, что внутримышечный и внутрисуставной способы введения препарата характеризуются высокой степенью сходства показателей фармакокинетики. Индивидуальные и усреднённые профили фармакокинетических кривых имеют близкие формы, однако максимальные концентрации при внутрисуставном введении выше, чем при внутримышечном.
Заключение
По результатам окончательного анализа данных клинического исследования было продемонстрировано:
1. Превосходство внутрисуставного введения препарата Эльбона® 1 раз в неделю в течение 6 недель еженедельно (6 внутрисуставных инъекций) в сравнении с внутримышечным введением препарата 3 раза в неделю в течение 6 недель.
2. Не меньшая эффективность в сравнении с внутрисуставным введением Гиалган Фидия 1 раз в неделю, курсом из 5 инъекций по стандартной методике.
Проведенный комплексный анализ безопасности позволяет сделать вывод о достаточной безопасности исследуемого препарата при использовании в различных режимах терапии.
Таким образом, внутрисуставное введение препарата Эльбона® раствор для внутримышечного введения производства ООО «Эллара», Россия в режиме 1 раз в неделю в течение 6 недель еженедельно (6 внутрисуставных инъекций) является эффективным и безопасным методом локальной (внутрисуставной) терапии остеоартроза коленного сустава (гонартроз по критериям Altman R., II-III рентгенологическая стадия по Келлгрену).
Авторы заявляют об отсутствии конфликта интересов
Список литературы
1. Алексеева Л.И., Лила А.М. Базисная терапия остеоартрита: современный взгляд на применение препаратов глюкозамина и хондроитина. Современная ревматология. 2021;15(2):112-119. DOI: 10.14412/1996-7012-2021-2-112-119.
2. Conrozier T and Lohse T (2022) Glucosamine as a Treatment for Osteoarthritis: What If It's True?. Front. Pharmacol. 13:820971. doi: 10.3389/fphar.2022.820971
3. Kloppenburg, M., and Berenbaum, F. (2020). Osteoarthritis Year in Review 2019: Epidemiology and Therapy. Osteoarthr. Cartil. 28 (3), 242-248. doi:10.1016/j.joca.2020.01.002
4. Bruyere, O., Honvo, G., Veronese, N., Arden, N. K., Branco, J., Curtis, E. M., et al. (2019). An Updated Algorithm Recommendation for the Management of Knee Osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin. Arthritis Rheum. 49 (3), 337-350. doi:10.1016/j.semarthrit.2019.04.008
5. Gregori, D., Giacovelli, G., Minto, C., Barbetta, B., Gualtieri, F., Azzolina, D., et al. (2018). Association of Pharmacological Treatments with Long-Term Pain Control in Patients with Knee Osteoarthritis: A Systematic Review and Meta-Analysis. JAMA 320 (24), 2564-2579. doi:10.1001/jama.2018.19319
6. Noack, W., Fischer, M., Forster, K. K., Rovati, L. C., and Setnikar, I. (1994). Glucosamine Sulfate in Osteoarthritis of the Knee. Osteoarthr. Cartil. 2 (1), 51-59. doi:10.1016/s1063-4584(05)80006-8
7. Muller-Fassbender, H., Bach, G. L., Haase, W., Rovati, L. C., and Setnikar, I. (1994). Glucosamine Sulfate Compared to Ibuprofen in Osteoarthritis of the Knee. Osteoarthr. Cartil. 2 (1), 61-69. doi:10.1016/s1063-4584(05)80007-x
8. Gibson M, Li H, Coburn J, Moroni L, Nahas Z, Bingham C 3rd, Yarema K, Elisseeff J. Intra-articular delivery of glucosamine for treatment of experimental osteoarthritis created by a medial meniscectomy in a rat model. J Orthop Res. 2014 Feb;32(2):302-9. doi: 10.1002/jor.22445. Epub 2013 Nov 5. PMID: 24600703; PMCID: PMC8396408.
9. Vajaradul Y. Double-blind clinical evaluation of intra-articular glucosamine in outpatients with gonarthrosis. Clin Ther. 1981;3(5):336-43. PMID: 7008939.