Применение Пронорана в терапии болезни Паркинсона и умеренных когнитивных расстройств
СтатьиОпубликовано в журнале:
«CONSILIUM MEDICUM», ТОМ №12, № 2, с. 60-66
Д.К.Сичинава, Л.А.Цукурова, М.А. Барабанова
Краевая клиническая больница №1 им. проф. С.В.Очаповского, Кубанский государственный медицинский университет, Краснодар
В последние десятилетия XX века во всем мире отмечаются значительные изменения возрастной структуры населения. Развитие современной цивилизации приводит к увеличению продолжительности жизни, что сопряжено с неизбежным ростом доли лиц пожилого и старческого возраста в популяции. В настоящее время около 15% населения земного шара составляют лица пожилого и старческого возраста, т.е. более 400 млн человек [8, 10, 23]. В России, по данным последней переписи населения, проживают более 29 млн лиц старше трудоспособного возраста. В ближайшее время ожидается еще большее увеличение численности лиц старших возрастных групп при общем сокращении населения страны. Можно говорить о тенденции к «постарению» населения. В последние годы в России отмечаются отрицательные тенденции в показателях здоровья населения прежде всего за счет ухудшения демографической ситуации (показатели смертности превышают показатели рождаемости в 1,4 раза). Вследствие этого происходит сокращение численности населения с одновременным ростом количества пожилых людей. Так, по прогностическим данным Госкомстата России, ожидаемая численность населения Российской Федерации за период 1998-2015 гг. уменьшится на 8,6 млн человек [12]. Такая ситуация ставит новые задачи перед современной медициной, которые связаны с ростом «возрастзависимых» заболеваний. В настоящее время в нашей стране проживает 46 772 524 человека пожилого возраста. Особенностью данного возраста является наличие множественной сочетанной патологии. Так, на 1 больного в возрасте 50 лет и старше приходится от 1,7 до 3,6 заболевания, в то время как для лиц 70 лет и старше - 5-7 заболеваний. В частности, в неврологической практике возрастает роль нейродегенеративных заболеваний и когнитивных нарушений.
Болезнь Паркинсона (БП) является вторым по частоте нейродегенеративным заболеванием человека (после болезни Альцгеймера - БА), самым частым среди всех форм паркинсонизма (75%) и встречается практически повсеместно. Общая распространенность составляет 100-250 на 100 тыс. населения. По данным нашего эпидемиологического исследования, распространенность БП в Краснодарском крае составляет 114,4 на 100 тыс. населения. Число случаев болезни значительно возрастает в старших возрастных группах. Данные нашего исследования по Краснодарскому краю представлены в таблице. По различным публикациям [1, 7,14], среди лиц старше 60 лет заболевание встречается у 1%, а после 75 лет - у 3-5% и более. Согласно имеющимся данным, в 2007 г. в мире насчитывалось свыше 6 млн человек с БП. В нашей стране ориентировочное число пациентов составляет 200 тыс., причем ежегодно регистрируется не менее 20-25 тыс. новых случаев болезни. Следует подчеркнуть, что, несмотря на традиционные представления о «возрастзависимом» характере БП, молодые больные уже давно не являются редкостью: считается, что примерно каждый десятый пациент заболевает БП до 50 лет, а каждый двадцатый - до 40 лет. Мужчины болеют несколько чаще, чем женщины. Существенных расовых различий в структуре заболеваемости, по данным современных эпидемиологических исследований, не выявлено. Заболевание носит преимущественно спорадический характер, однако при наличии БП у ближайших родственников риск развития заболевания увеличивается в 2 раза. С наследственными факторами связано лишь небольшое количество случаев заболевания (5-10%).
Распространенность паркинсонизма и БП в Краснодарском крае в различных возрастных группах на 100 тыс. населения
| Возрастная группа, лет | Паркинсонизм | БП |
| 30-39 | 0 | 2,4 |
| 40-49 | 1,5 | 28,7 |
| 50-59 | 14,3 | 90,6 |
| 60-69 | 20,2 | 276,4 |
| 70-79 | 11,1 | 259,4 |
| ≥80 | 20,8 | 120,6 |
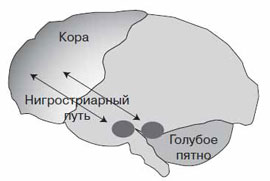
В основе заболевания лежит дегенерация нигростриарных нейронов черной субстанции и снижение уровня дофамина в базальных ганглиях, избыток глутамата и ацетилхолина, а также недостаточный синтез норадреналина и серотонина. Патоморфологические исследования при БП обнаруживают дегенерацию и депигментацию нигростриарных нейронов, нейронов голубого пятна и характерные внутриклеточные включения, являющиеся продуктами дегенерации белков - тельца Леви. Повреждение нигростриарных нейронов при БП происходит преимущественно по механизму апоптоза и связано с нарушением внутриклеточного метаболизма: окислительным стрессом, эксайтотоксичностью глутамата и аспартата, избыточным поступлением внутрь клеток ионов кальция, возрастанием активности внутриклеточных протеаз, нарушением митохондриального дыхания с энергетическим дефицитом нейронов [1, 2].
Клиническая картина БП характеризуется сочетанием брадикинезии с ригидностью и тремором покоя. В последующем к этим симптомам присоединяются постуральная неустойчивость и недвигательные нарушения (когнитивные расстройства, вегетативная недостаточность), существенно ухудшающие качество жизни пациента. В последние годы большое значению придается изучению преклинических (премоторных) проявлений БП, имеющих свое патоморфологическое (данные Braak) и нейровизуализационное (однофотонно-эмиссионная и позитронно-эмиссионная томография) подтверждение [33].
Преклинические симптомы БП: обонятельная дисфункция, запоры, депрессии и нарушение сна (REM-фаза).
К наиболее типичным критериям, исключающим БП, относятся повторные инсульты или черепно-мозговые травмы в анамнезе со ступенчатым прогрессированием симптомов паркинсонизма; появление симптомов на фоне приема нейролептиков и марганцевых производных (в том числе в составе суррогатных наркотических препаратов); окулогирные кризы; мозжечковые нарушения; надьядерный паралич взора; выраженные когнитивные нарушения; падения на ранних стадиях заболевания; отсутствие эффекта при назначении высоких доз (до 1 г в сутки) препаратов леводопы.
Нейровизуализационные исследования, за исключением однофотонно-эмиссионной и позитронно-эмиссионной томографии, не позволяют выявить объективные признаки БП. Они могут иметь важное значение для исключения других заболеваний, вызывающих симптоматический паркинсонизм [2, 3].
Наряду с БП одной из актуальных и значимых с медико-социальной точки зрения «возрастзависимых» проблем являются когнитивные расстройства - ухудшения познавательной способности человека, приводящие к снижению его адаптации в социальной сфере и быту [23. 29].
Под когнитивными функциями принято понимать наиболее сложные функции головного мозга, с помощью которых осуществляется процесс рационального познания мира и взаимодействия с ним [6, 8]. К когнитивным функциям относятся:
- восприятие (гнозис) - способность распознавать информацию, поступающую от органов чувств;
- память - способность запечатлевать, сохранять и в нужный момент воспроизводить усвоенную информацию;
- праксис - способность планировать и осуществлять сложные двигательные акты;
- речь - способность понимать и выражать мысли с помощью слова;
- мышление (интеллект) - способность анализировать информацию, выявлять сходства и различия, выносить суждения и умозаключения;
- внимание - способность поддерживать оптимальный для умственной деятельности уровень психической активности.
Когнитивные нарушения включают:
- дефицит внимания, его концентрации;
- нарушение способности быстро ориентироваться в меняющейся обстановке;
- снижение памяти, особенно на текущие события;
- замедленность мышления, быструю истощаемость при напряженной умственной работе;
- сужение крута интересов.
Спектр когнитивных нарушений включает 3 степени тяжести:
1.Легкая степень. Минимальный когнитивный дефицит - больной полностью ориентирован, хорошо выполняет психологические тесты, определяющие состояние оперативной памяти, контролирует свое поведение и эмоции, легко выполняет 2-3 сложные инструкции, но вместе с тем у него отмечается определенное снижение концентрации внимания, умственной работоспособности, запоминания нового материала.
2. Умеренная степень. Больной не путается во времени и пространстве; отмечается умеренное снижение оперативной памяти, при выполнении двусложных инструкций допускает ошибки.
3. Выраженная степень - деменции: отмечается разной степени нарушение памяти и интеллекта в сочетании с разной степенью социальной дезадаптации.
Когнитивные нарушения представляют собой полиэтиологический синдром [7], возможный при различных заболеваниях головного мозга. В пожилом возрасте наиболее частые причины когнитивных нарушений -БА, цереброваскулярные заболевания, деменция с тельцами Леви, лобно-височная лобарная дегенерация, БП и другие нейродегенеративные заболевания с преимущественным поражением подкорковых базальных ганглиев. На долю перечисленных заболеваний приходится около 80% выраженных когнитивных нарушений, встречающихся в гериатрической практике.
Когнитивные нарушения достаточно часто встречаются после инсульта, хотя после первого нарушения мозгового кровообращения редко достигают степени деменции. Частота деменции у больных, перенесших инсульт, достигает 26%, причем с возрастом она увеличивается. Наличие когнитивных нарушений отрицательно влияет на восстановление самообслуживания, бытовых и трудовых навыков, социальную и психологическую реабилитацию больных.
Наиболее часто когнитивные нарушения встречаются при хронических сосудистых заболеваниях головного мозга. Когнитивные нарушения являются ключевым проявлением дисциркуляторной энцефалопатии (ЦЭП) [13, 17, 18] и во многом определяют тяжесть состояния больных. Они могут служить важнейшим диагностическим критерием ДЭП и, возможно, являются наилучшим маркером для оценки состояния динамики заболевания. Коррекция когнитивных нарушений у больных ДЭП часто имеет решающее значение для улучшения качества жизни пациента и его родственников [3, 9, 29].
На ранней стадии ДЭП преобладают умеренные нейродинамические нарушения в виде замедленности, аспонтанности, снижения работоспособности, истощаемости, ослабления концентрации внимания. Тем не менее пациенты в целом хорошо справляются с нейропсихологическими тестами, не предусматривающими учета времени выполнения. Это соответствует легкой степени когнитивных нарушений.
При умеренных когнитивных нарушениях наряду с нейродинамическими развиваются и регуляторные расстройства (подкорково-лобный когнитивный синдром). В основе регуляторного дефекта лежат нарушения инициации, планирования, поэтапной реализации ментальных действий, когнитивной гибкости (способность к переключению) и контроля за достижением запланированного результата. Указанный когнитивный дефицит может способствовать снижению качества жизни больных. В силу особенностей кровоснабжения головного мозга наиболее уязвимыми отделами при хронической сосудистой мозговой недостаточности являются подкорковые базальные ганглии и глубинные отделы белого вещества головного мозга. Именно в данных отделах головного мозга в первую очередь развиваются характерные для сосудистой мозговой недостаточности патоморфологические изменения в виде лакунарных инфарктов и диффузных изменений белого вещества (лейкоареоз). Поражение указанных структур приводит к своеобразной клинической картине с доминированием когнитивных симптомов лобной дисфункции при относительно сохранной памяти на события жизни (рис. 1).
Рис. 1. Патоморфологические изменения головного мозга.
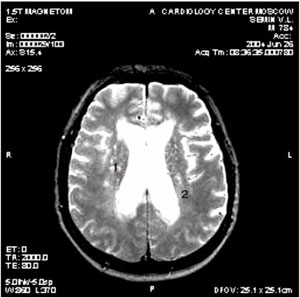
1 - лакунарные инфаркты; 2 - расширение боковых желудочков.
Дальнейшее прогрессирование когнитивного дефекта при ДЭП сопряжено с развитием деменции. Если на более ранних этапах заболевания доминируют проявления дисфункции подкорково-лобных систем, то по мере прогрессирования ДЭП происходит своего рода «кортикализация» когнитивного дефекта, в основе которой может лежать дальнейшее распространение патологического процесса за счет развития корковых микроинфарктов и атрофии или присоединения альцгеймеровского процесса.
Наиболее универсальный механизм развития когнитивных нарушений при различных вариантах сосудистого поражения мозга - разобщение корковых и подкорковых структур и, прежде всего, нарушение функции параллельных лобно-подкорковых кругов, которые обеспечивают не только двигательные, но и психические функции.
Когнитивные нарушения наряду с первичными неврологическими заболеваниями могут вызывать системные дисметаболические расстройства при соматических и эндокринных заболеваниях, экзогенных интоксикациях. Это делает проблему когнитивных нарушений весьма актуальной не только для неврологов, но и для терапевтов, эндокринологов, врачей других специальностей. Следует подчеркнуть, что дисметаболические когнитивные нарушения являются обратимыми при своевременной диагностике и лечении.
Концепция умеренных когнитивных расстройств (УКР) [3,4,16,19, 21, 22, 30, 31]:
- этап УКР обычно предшествует развернутой стадии деменции;
- УКР являются фактором риска развития деменции;
- считается, что в большинстве случаев в основе лежит БА;
- при УКР более значительные возможности терапии, чем при БА.
Под термином умеренные когнитивные расстройства (англ. «mild cognitive impairment») принято понимать нарушение одной или нескольких когнитивных функций, которое явно выходит за рамки возрастной нормы, но не вызывает дезадаптации в повседневной жизни, т.е. не приводит к деменции. В апреле 2004 г. на конференции по БА в Монреале были приняты диагностические критерии УКР:
- жалобы на когнитивные нарушения со стороны пациента или родственников (свидетельства родственников более надежны);
- ухудшение когнитивных способностей по сравнению с прежним уровнем (до начала заболевания);
- объективное подтверждение когнитивных нарушений с помощью клинических шкал и нейропсихологических методов исследования;
- отсутствие нарушений обычных для больного форм повседневной деятельности (при этом допускается возможность затруднений в сложных и необычных для больного видах деятельности);
- отсутствие деменции (в качестве свидетельства отсутствия деменции принято рассматривать результат краткой шкалы оценки психического статуса не менее 24 баллов).
УКР являются клинически гетерогенным состоянием, их принято разделять на монофункциональные (нарушение одной когнитивной функции) и полифункциональные (нарушение двух когнитивных функций и более). Монофункциональные УКР в свою очередь разделяются на амнестический тип (нарушение памяти) и неамнестический тип (нарушение какой-либо другой когнитивной функции, кроме памяти) УКР. Полифункциональные нарушения также разделяются на УКР с нарушениями и без нарушений памяти.
Неблагоприятными прогностическими факторами, которые ассоциируются с более высоким риском трансформации в деменцию, являются пожилой возраст, наличие нарушений памяти, низкие результаты нейропсихологических тестов, семейный анамнез когнитивных нарушений, носительство гена АПОЕ4, атрофия гиппокампа по данным магнитно-резонансной томографии (МРТ) головы.
Для установления синдромального диагноза когнитивных нарушений необходимо прежде всего подтвердить их наличие, исследовать выраженность и специфические особенности. С этой целью применяют нейропсихологические методы исследования. В качестве скрининга когнитивных нарушений в гериатрической практике широко используют такие методики, как краткая шкала оценки психического статуса (MMSE), тест рисования часов, тест «5 слов», батарея лобных тестов, исследование беглости речи методом литеральных ассоциаций и др. [4,10, 20, 23, 24, 27].
Диагноз когнитивных нарушений является показанием для проведения нейровизуализации - компьютерной томографии или МРТ. Целью данного исследования является, во-первых, исключение опухоли мозга или нормотензивной гидроцефалии, во-вторых, обнаружение при помощи МРТ определенных признаков, характерных для той или иной нозологической формы когнитивных нарушений. Так, признаком, подтверждающим диагноз БА, является атрофия гиппокампа, деменции с тельцами Леви - расширение задних рогов боковых желудочков, для сосудистой деменции характерны постишемические изменения и лейкоареоз [3, 8].
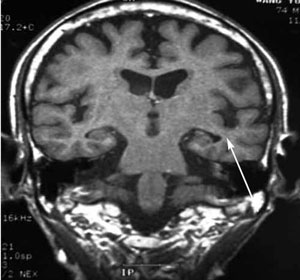
Наиболее частой находкой при МРТ головного мозга у пациентов с УКР является атрофия гиппокампа, которая может носить асимметричный характер (рис. 2).
Рис. 2. Атрофия гиппокампа.
Распространенность УКР достигает 10% среди лиц старше 65 лет, среди пациентов, обращающихся в клинику памяти, больные с УКР составляют около 40%. У 10-15% из них в течение года и у 70-80% в течение 5 лет развивается развернутая клиническая картина БА. У пациентов с УКР в 1,7 раза выше риск летального исхода и в 3,1 раза выше риск возникновения в последующем БА, чем у лиц такого же возраста без когнитивных нарушений [4,13, 24].
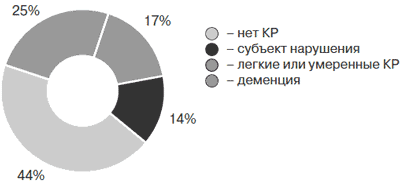
Оценке распространенности додементных форм когнитивных расстройств в популяции посвящено сравнительно небольшое число работ. В нашей стране наиболее серьезным исследованием в этой области, организованным кафедрой нервных болезней ММА им. И.М.Сеченова и проведенным в 30 регионах РФ силами 132 неврологов, стала Всероссийская программа «Прометей» [7]. Проведенный у 3000 больных амбулаторный скрининг (в каждом участвующем центре оценивали 25 впервые обратившихся пациентов старше 60 лет) носил двухэтапный характер: на первом этапе пациенты сами оценивали наличие или отсутствие у них жалоб на ухудшение памяти, а при наличии таковых проходили стандартное нейропсихологическое тестирование (шкала MMSE и тест рисования часов). Было установлено, что в данной возрастной группе субъективные расстройства памяти и умственной утомляемости имеют место у 83% пациентов (и более чем у 90% лиц старше 80 лет), а объективно подтверждаемые с помощью тестов когнитивные нарушения разной степени выраженности - у 68% пациентов. По тяжести выявленных когнитивных расстройств обследованные разделились следующим образом: деменция - 25%, умеренные и легкие когнитивные расстройства - 44%, субъективные жалобы при нормальном выполнении нейропсихологических тестов - 14%, отсутствие каких-либо расстройств в когнитивной сфере - 17% (рис. 3).
Рис. 3. Тяжесть выявленных когнитивных расстройств.
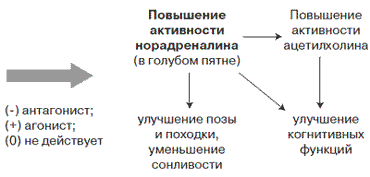
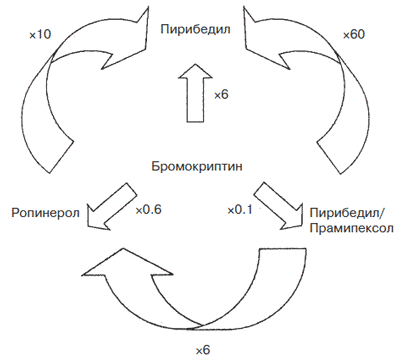
Терапия БП и УКР - две глобальные проблемы в неврологии. Исследования последних лет показали высокую эффективность применения современных неэрголиновых агонистов дофаминовых рецепторов, в частности, препарата Проноран (пирибедил). Проноран является агонистом D2/D3-рецепторов и антагонистом альфа-2-адренорецепторов. Он обладает низким сродством к серотониновым рецепторам. Таким образом, Проноран обладает оригинальным механизмом действия, восстанавливает норадренергическую и дофаминергическую передачу, тем самым эффективно воздействуя на моторные и немоторные проявления БП (рис. 4).
Рис. 4. Действие неэрголиновых агонистов дофаминовых рецепторов.
| Агонист дофамина | Тип рецептора |
 |
|||
| α2 | D2 | D3 | 5-HT | ||
| Проноран | - | + | + | 0 | |
| Прамипексол | + | + | + | 0 | |
| Ропинирол | 0 | + | + | 0 | |
Известно, что норадренергическая медиация играет важную роль в обеспечении когнитивной деятельности. В частности, лучшее запоминание эмоционально окрашенной информации связано, как полагают, с активацией норадренергической системы, поэтому наличие дополнительных норадренергических свойств Пронорана способствует усилению ноотропного эффекта данного препарата (рис. 5).
Рис. 5. Механизм действия Пронорана.
|
Проноран – агонист дофамина с a2-норадренергической активностью |
||
|
|
||
| D2/D3 | a2 | |
| Дофамин | Норадреналин | |
|
Чувствительные к леводопе |
Двигательные нарушения Когнитивные нарушения Другие |
Нечувствительные к леводопе |
Millan MJ et al. J Pharm Exp Ther 2001; 297: 876–87.
Adapted form Breffel Courbon C et al. CNS Drugs 1998; 10
В настоящее время группа неэрголиновых агонистов дофаминовых рецепторов, в том числе и Проноран, занимает ведущее место в терапии БП и рассматривается как базовая в обшей стратегии лечения БП на всех ее стадиях, особенно у пациентов молодого возраста, ориентированных на более длительную многолетнюю перспективу противопаркинсонической терапии [1—3].
Проноран эффективен в качестве монотерапии на ранних стадиях БП. Это было подтверждено результатами многоцентрового исследования под руководством проф. Rondot. В исследовании принимали участие 113 больных, страдающих сочетанной или дрожательной формой БП. Среди испытуемых были 66 мужчин и 47 женщин, средний возраст составил 53,1±0,6 года, средняя продолжительность заболевания составила 2 года. Тяжесть заболевания соответствовала I—III стадии по шкале Hoehn и Yahr. Проноран назначали в постепенно нарастающей дозе до 150-200 мг/сут. Максимальной дозы достигали к концу 3 -го месяца. Другие антипаркинсонические средства не использовали. В 90% случаев у больных, закончивших лечение, симптомы уменьшались на 30-50%. У 32 больных с преобладанием тремора, средний балл, отражающий выраженность тремора, снизился с 1,7 до 1,2 (29%,pПроноран в виде монотерапии у больных, не принимавших ранее леводопу так же эффективен в отношении брадикинезии и ригидности, как и в отношении тремора. Эффективность отмечается не только при дрожательных формах заболевания, но и при смешанных формах БП.
На развернутых стадиях при недостаточной эффективности леводопы добавление Пронорана позволяет ее повысить, что подтверждено результатами по крайней мере двух исследований [5, 26, 28].
Проф. Rascol изучал эффективность добавления к леводопе Пронорана в дозе 150 мг/сут в течение 6 мес. В международном рандомизированном двойном слепом контролируемом исследовании принимали участие 115 больных, у которых леводопа оказалась недостаточно эффективной. Спустя 4 мес при анализе всех больных, принявших участие в исследовании, выяснилось, что эффективность лечения в группе принимавших Проноран бьша выше. В этой группе улучшение наступило у 54% больных (в контрольной группе - у 37,7%;р=0,04). После 6 мес эффективность лечения в группе принимавших Проноран оставалась более высокой (61,8% по сравнению с 39,6%;р=0,02). Снижение балла по разделу «Двигательные нарушения» шкалы UPDRS было достоверно более выраженным в группе больных, принимавших Проноран (рРис. 6. Балл по разделу «Двигательные нарушения» шкалы UPDRS.
В исследовании Kwiecinski, Н.В.Федоровой и соавт. была подтверждена эффективность Пронорана в качестве дополнительного средства, назначаемого с леводопой.
Проноран в дозе 150 мг/сут в течение 6 мес назначали 237 больным, страдающим БП. У всех больных монотерапия леводопой оказалась недостаточно эффективной. Эффективность лечения определяли по разделу III шкалы UPDRS. Через 6 мес у больных, принимающих Проноран, суммарный балл по разделу III шкалы UPDRS существенно снизился. Различия с группой, принимавших плацебо, были статистически достоверными при анализе всех больных (р=0,009) и больных, выполнивших протокол исследования (р=0,00б). Более того, при приеме Пронорана существенно снижались баллы по подразделам раздела III (уменьшались тремор, ригидность, брадикинезия, расстройства позы и походки). Проноран вызывал мало побочных эффектов и хорошо переносился.
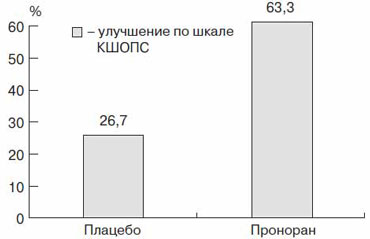
Особое место Проноран занимает в терапии легких и умеренных КР. Эффективность препарата при УКР объясняется его двойным механизмом действия, о чем сказано выше. Эффективность Пронорана оценивали в 14 клинических исследованиях, в которых участвовали более 7000 пациентов с возрастными нарушениями внимания и памяти [25, 27, 33]. Эффективность применения Пронорана при УКР была доказана в двойном слепом исследовании. В работе D.Nagaradja и SJayshree (2001 г.) продемонстрировано, что на фоне применения препарата когнитивное улучшение достигается в 2 раза чаще, чем на фоне плацебо. В ряде работ у больных с УКР на фоне приема Пронорана отмечены улучшение кратковременной и долговременной памяти и внимания, повышение уровня бодрствования (рис. 7) [7, 31-33].
Рис. 7. Применение Пронорана при УКР (D.Nagaragja и соавт., 2001); цифрами обозначено улучшение по шкале КШОПС (в %)
У пожилых пациентов с УКР на фоне ДЭП применение Пронорана сопровождается уменьшением расстройств, связанных с лобной дисфункцией, а также ряда субъективных неврологических проявлений, характерных для сосудистой мозговой недостаточности, - головной боли, головокружения, нарушений сна, утомляемости и др. У больных с синдромом УКР наибольшая эффективность Пронорана отмечена при дизрегуляторном типе когнитивных расстройств.
Эффективность Пронорана в терапии легких и умеренных когнитивных нарушений сосудистого характера показана в одном из первых отечественных исследований распространенности когнитивных нарушений среди неврологических пациентов - «Прометей» [7]. В этом исследовании Проноран применяли в дозе 50 мг в сутки в течение 3 мес у 574 пациентов, средний возраст б9,5±5,5 года. Критериями диагноза когнитивных нарушений, не достигающих выраженности деменции, были: а) результат шкалы КШОПС от 25 до 27 баллов при любом результате теста рисования часов; б) результат теста рисования часов менее 9 баллов при нормальном показателе КШОПС (28 баллов и более). Пациенты делились на три группы: в 1-ю группу вошли пациенты, которые не принимали в течение последних 2 нед сосудистые или ноотропные препараты, им Проноран назначали в дозе 50 мг 1 раз в день в виде монотерапии; во 2-й группе пациентов переводили с получаемых ранее сосудистых и ноотропных препаратов на Проноран в дозе 50 мг в день в виде монотерапии; пациентам 3-й группы, которые принимали в течение не менее 2 нед сосудистые и ноотропные препараты и при этом продолжали жаловаться на забывчивость, добавляли Проноран в дозе 50 мг в день. На фоне приема данного препарата отмечено статистически достоверное и клинически значимое уменьшение выраженности когнитивных нарушений. При этом монотерапия Пронораном оказалась так же эффективна, как и комбинация с сосудистыми и/или метаболическими препаратами [17]. Анализ динамики ней-ропсихологических показателей прошедших курс лечения пациентов свидетельствовал об уменьшении на фоне лечения общей тяжести когнитивных расстройств, улучшении амнестических и психомоторных функций во всех терапевтических группах. При терапии Пронораном отмечено уменьшение субъективных неврологических симптомов, таких как головная боль (у 94,7% больных), головокружение (у 87,5%), шум в голове (у 89,9%), нарушение сна (у 76,4%), утомляемость (у 98%), улучшение настроения (у 97,4%). Все участники программы отметили хорошую переносимость Пронорана. За 12 нед приема препарата отмены и корректировки дозы не потребовалось.
Таким образом, уникальный двойной механизм действия Пронорана позволяет успешно применять его для лечения БП в виде монотерапии на ранних стадиях и в рамках комбинированной терапии при развернутых стадиях БП, при легких и умеренных когнитивных нарушениях.
ЛИТЕРАТУРА
1. Артемьев Д.В., Обухова А.В. Современные подходы к лечению ранних стадий болезни Паркинсона. Cons Med 2008; 10 (7): 89–92.
2. Артемьев Д.В., Обухова А.В. Агонист дофаминовых рецепторов проноран в лечении ранних и развернутых стадий болезни Паркинсона. Неврол. журн. 2002; 5: 43–6.
3. Голубев В.Л., Садеков Р.А., Пилипович А. А. Проноран в лечении болезни Паркинсона. Лечение нервн. бол. 2002; 2 (7): 13–7.
4. Захаров В.В., Яхно Н.Н. Синдром умеренно когнитивных расстройств в пожилом и старческом возрасте. Рус. мед. журн. 2004; 10: 573–6.
5. 3ахаров В.В., Яхно Н.Н. Нарушения памяти. М.: ГЕОТАР-Мед, 2003.
6. Захаров В.В. Когнитивные нарушения в неврологической практике. Трудн. пациент. 2005.
7. Захаров В.В. Всероссийская программа исследований эпидемиологии и терапии когнитивных расстройств в пожилом возрасте («Прометей»). Неврол. журн. 2006; 2: 27–32.
8. Иллариошкин С.Н. Терапия паркинсонизма: возможности и перспективы. Cons Med 2009; 1.
9. Кадыков А.С., Шахпаронова Н.В. Перспективы нейропротекторной терапии в лечении когнитинвых нарушений. Cons Med 2007; 9/12.
10. Левин О.С. Cons Med 2006; 8: 106–12.
11. Левин О.С. Агонисты дофаминовых рецепторов в лечении болезни Паркинсона. Лечение нервн. бол. 2003; 4 (1): 14–7.
12. Левин О.С., Голубева Л.В. Гетерогенность умеренного когнитивного расстройства: диагностические и терапевтические аспекты. Cons Med 2006; 12: 106–10.
13. Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные нарушения при дисциркуляторной энцефалопатии. Неврол. журн. 2005; 11 (Прил. 1): 57–63.
14. Маркин С.П. Лечение расстройств сна у людей пожилого возраста с нарушением когнитивных функций. Cons Med 2009; 2.
15. Обухова А.В. Применение селективного агониста D2/D3-рецепторов пронорана (пирибедила) при терапии болезни Паркинсона. Неврол. журн. 2002; 3: 38–40.
16. Сичинава Д.К., Барабанова М.А. Эпидемиология паркинсонизма и болезни Паркинсона в Краснодарском крае. Руководство для врачей по материалам I Национального конгресса «Болезнь Паркинсона и расстрой- ства движения». 2008.
17. Яхно Н.Н., Захаров В.В., Локшина А.Б. Синдром умеренных когнитивных нарушений при дисциркуляторной энцефалопатии. Журн. неврол. и психиат. 2005; 105 (2): 13–7.
18. Яхно Н.Н. Когнитивные расстройства в неврологической клинике. Неврол. журн. 2005; 11 (Прил. 1): 4–12.
19. Федорова Н.В., Артемьева Е.Г. Применение пронорана – современного агониста дофаминовых рецепторов в лечении болезни Паркинсона (информационное письмо). М., 2003.
20. Яхно Н.Н., Захаров В.В., Локшина А.Б. Синдром умеренных когнитивных нарушений при дисциркуляторной энцефалопатии. Журн. неврол. и психиат. 2005; 105 (2): 13–7.
21. Яхно Н.Н., Захаров В.В. Легкие когнитивные расстройства в пожилом возрасте. Неврол. журн. 2004; 9 (1): 4–8.
22. Яхно Н.Н., Дамулин И.В., Преображенская И.С., Мхитарян Э.А. Болезнь Альцгеймера и деменция с тельцами Леви: некоторые аспекты клиники, диагностики и лече- ния. Рус. мед. журн. 2003; 1: 11 (100).
23. Яхно Н.Н. Неврол. журн. 2006; 11 (Прил. 1): 4–12.
24. Ahmadzadeh GH, Farhat A, Soltani D. Prevalence of cognitive dysfunction in old patients admitted in emergency room. Neurodegenerat Dis 2007; 4 (1): 124.
25. Bartoli G, Wichrowska E. Controlled clinical trial of piribedil in the treatment of cerebrovascular insufficiency. La Clin Ter 1976; 78 (2): 141–51.
26. Cagnotto A, Parotti L, Mennini T. In vitro affinity of piribedil for dopamine D3 receptor subtypes, an autoradiographic study. Eur J Pharmacol 1996; 10: 63–7.
27. DiCarlo A, Baldereschi M, Amaducci L et al. Cognitive impairment without dementia in older people: prevalence, vascular risk factors, impact on disability. The Italian Longitudinal Study on Aging. J Am Ger Soc 2000; 48: 775–82.
28. Goetz CG. Dopaminergic agonists in the treatment of Parkinson's disease. Neurology 1990; 40 (Suppl. 3): 50–4.
29. Graham JE, Rockwood K, Beattie EL et al. Prevalence and severity of cognitive impairment with and without dementia in an elderly population. Lancet 1997; 349: 1793–6.
30. DeCarli. The role of cerebrovascular disease in dementia. Neurologist 2003; 9: 123–36.
31. DiCarlo A, Baldereschi M, Amaducci L et al. Cognitive impairment without dementia in older people: prevalence, vascular risk factors, impact on disability. The Italian Longitudinal Study on Aging. J Am Ger Soc 2000; 48: 775–82.
32. Kurshner HS. Mild cognitive impairment: to treat or not to treat? Curr Neurol Neurosci Rep 2005; 5 (6): 455–7.
33. Nagaraja D, Jayashree S. Randomized study of the dopamine agonist piribedil in the treatment of mild cognitive impairement. Am J Psychiat 2001; 158: 1517–9.
34. Folstein MF, Folstein SE, McHugh PR. Mini-Mental State: a practical guidefor grading the mental state of patients for the clinician. J Psych Res 1975; 12: 189–98.
35. Tolosa E, Carles G. Diagdnosis and the premotor phase of Parkinson disease. Neurulogy 2009; 72 (Suppl. 2): 12–20.