Современные макролиды: роль и место в лечении внебольничных инфекций дыхательных путей
СтатьиОпубликовано в журнале:
«Consilium-Medicum» 2009 (материалы симпозиума в экстравыпуске)
Проф А.И.Синопальников
Государственный институт усовершенствования врачей МО РФ, Главный военный клинический госпиталь им. Н.Н.Бурденко, Москва
1. Первым из применяемых в клинической практике макролидов стал эритромицин, полученный в 1952 г. из почвенного грибка Streptomyces erythreus. В начале 1950-х годов эритромицин рассматривался в качестве альтернативы β-лактамам при лечении инфекций дыхательных путей, кожи и мягких тканей. Последующий опыт клинического применения эритромицина выявил его «слабые места»: относительно узкий спектр антимикробной активности, нестабильное всасывание, короткая продолжительность действия, лекарственные взаимодействия, нежелательные явления со стороны желудочно-кишечного тракта.
Разработка и внедрение в 1970–1980-е гг. «новых» макролидов, близких по структуре к эритромицину, но обладающих улучшенными фармакокинетическими и фармакодинамическими параметрами, а также более благоприятным профилем безопасности в корне изменили изначально сдержанное отношение к макролидным антибиотикам. Повышенному интересу к данному классу препаратов способствовало также установление клинического значения в патологии человека таких возбудителей, как Legionella spp., Mycoplasma spp., Chlamydia/Chlamy-dophila spp., Campylobacter spp.
В настоящее время среди макролидов наибольшей клинической популярностью пользуются кларитромицин и азитромицин.
Динамика назначения антибиотиков в США
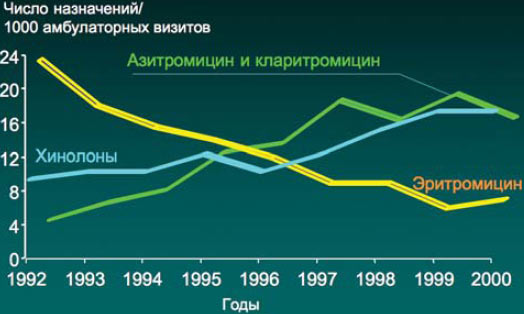
McCaigetai., 2003
2. Макролиды активны в отношении ключевых возбудителей инфекций нижних дыхательных путей, включающих грамположительных, ряд грамотрицательных, а также «атипичных» микроорганизмов. Они хорошо проникают внутрь клеток организма человека, где создают высокие концентрации, что имеет исключительное значение для лечения инфекционных заболеваний, вызываемых внутриклеточными возбудителями.
Важными особенностями макролидов являются их способность накапливаться в фагоцитах с последующим выделением в очаге инфекции под воздействием бактериальных стимулов и обратный активный захват «неутилизированного» микроорганизмами препарата. Максимальное накопление макролидов наблюдается в легочной ткани, жидкости, выстилающей слизистую оболочку бронхов и альвеолы, бронхиальном секрете, слюне, миндалинах и в меньшей степени среднем ухе.
Активность макролидов in vitro*
| Эритромицин | Кларитромицин | Азитромицин | |
| Грамположительные кокки | |||
| S. pneumoniae PS | 0,06 | 0,06 | 0,12 |
| S.pneumoniae PR | >32 | 32 | 32 |
| S.pyogenes | 0,12 | 0,12 | 0,12 |
| S.aureus MS | 2 | 1 | 2 |
| Грамотрицательные бациллы | |||
| M. catharrhalis | 0,25 | 0,25 | 0,25 |
| H. influenzae | 8 | 4 | 2 |
| Внутриклеточные возбудители | |||
| С. pneumoniae | 0,12 | 0,03 | 0,25 |
| M. pneumoniae | <0,01 | 0,012 | <0,01 |
| L. pneumophila | 2 | 0,25 | 2 |
* МПК, мг/л
Dorca et al, 2004
3. Макролиды имеют благоприятный профиль безопасности и остаются одними из наиболее хорошо переносимых антибактериальных препаратов.
Частота отмены антибактериальных препаратов из-за нежелательных явлений при инфекциях дыхательных путей
| Антибиотик | Частота отмены |
| Азитромицин | 0,8% |
| Амоксициллин/клавуланат | 2,3% |
| Кларитромицин | 1,0% |
| Эритромицин | 1,9% |
| Цефаклор | 1,3% |
| Пенициллин/амоксициллин | 0,6% |
*Достоверно чаще по сравнению с макролидами встречались НЯ, требовавшие преждевременного прекращения терапии
Iоаnnidis, et al., 2001
4. Внебольничная пневмония (ВП) и обострение хронической обстуктивной болезни легких (ХОБЛ) являются одними из наиболее частых показаний к назначению макролидных антибиотиков. Аргументированное позиционирование макролидов в терапии ВП базируется на высокой активности препаратов в отношении Streptococcus pneumoniae и «атипичных» возбудителей, а также учете известных факторов риска лекарственной устойчивости пневмококка (наличие сопутствующих заболеваний внутренних органов, предшествующая антибактериальная терапия).
Вопрос о том, какому из антибиотиков следует отдать предпочтение, вызывает определенные затруднения, поскольку исследования сравнительной эффективности амбулаторной антибактериальной терапии нетяжелой ВП без факторов риска терапевтической неудачи свидетельствуют о сопоставимой клинической эффективности и безопасности «новых» макролидов, респираторных фторхинолонов и β-лактамов.
Антибактериальная терапия при ВП у амбулаторных больных
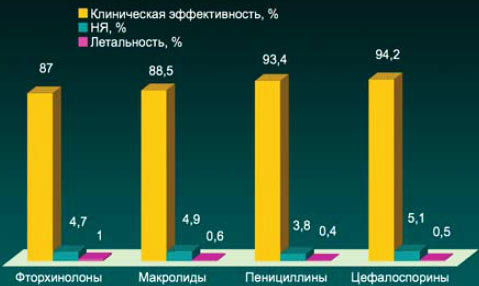
*13 РКИ, n=4314
N Malmon et al. ERJ 2008; 31:1068
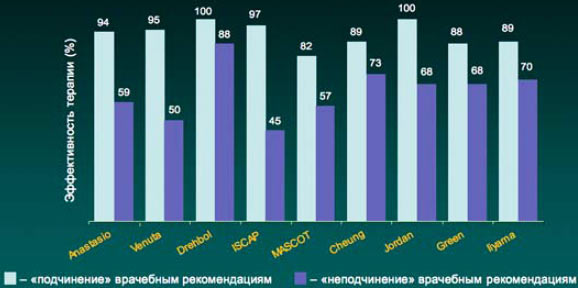
5. В настоящее время имеются доказательства связи между кратностью приема лекарственного средства и приверженностью пациента врачебным рекомендациям (комплаентность). Так, в частности, при однократном приеме препарата комплаентность составляет 98,3%, в то время как при 2–3-кратном приеме в сутки комплаентность составляла 75 и 63,3% соответственно (J Cockburn et al. BMJ 1987; 295: 814).
Прием антибиотика 1 раз в сутки позволяет достичь наибольшей комплаентности, что особенно важно при лечении пациента в амбулаторных условиях.
Результаты многочисленных исследований свидетельствуют, что в случае выполнения всех врачебных рекомендаций, в том числе и в отношении антибактериальной терапии, достигаемая терапевтическая эффективность существенно выше, чем при «неподчинении» пациента предписанному режиму лечения.
Комплаентность и эффективность антибактериальной терапии инфекций дыхательных путей
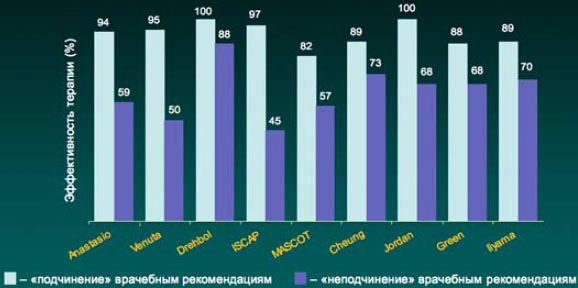
Cheung R et al. 198Bt Drebobl et al 1991, Venuta et al, 1998, Green et al 1969. Jordan et al. 1981, Ilyama et al. 2002, MASCOT 2002, ISCAF 2004
6. Новая лекарственная форма кларитромицина для приема внутрь с замедленным высвобождением характеризуется более длительным поддержанием терапевтических концентраций антибиотика в крови и тканях в отношении респираторных возбудителей, что позволяет принимать препарат 1 раз в сутки, а также лучшим профилем безопасности. На сегодняшний день привлекательность этой лекарственной формы в большинстве стран Европы столь очевидна, что частота назначения кларитромицина с замедленным высвобождением превосходит таковую традиционную форму антибиотика, которую необходимо принимать 2 раза/сут.
Лекарственные формы кларитромицина: частота применения, %
Data on file, Abbot. 2002
7. Если, как уже говорилось выше, при лечении нетяжелой ВП в амбулаторных условиях, как правило, не удается продемонстрировать очевидные преимущества в клинической эффективности между различными классами антибиотиков, то при лечении ВП в условиях стационара комбинированная терапия β-лактамами и макролидами превосходит монотерапию β-лактамами (уменьшение риска летального исхода, сокращение госпитального этапа лечения).
Имеются также доказательства того, что комбинированная терапия (β-лактам + макролид) более эффективна, чем монотерапия β-лактамами, в лечении тяжелой пневмококковой пневмонии, осложненной вторичной бактериемией.
Моно- vs. комбинированная антибактериальная терапия ВП в стационаре*
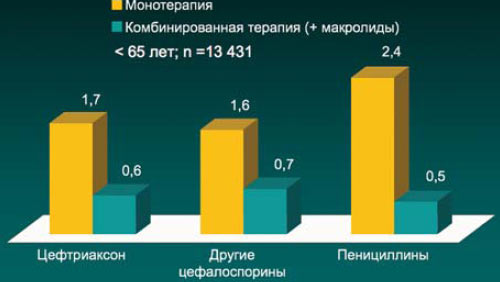
Различия летальности в сравниваемых группах достоверны
RB Brown et al. Chest 2003; 123; 1503
8. Согласно рекомендациям Российского респираторного общества и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (2009 г.), макролиды (кларитромицин, азитромицин) наряду с амоксициллином рассматриваются как препараты выбора при лечении нетяжелой ВП в амбулаторных условиях у пациентов без сопутствующих заболеваний и не принимавших в течение последних 3 мес. антибиотики. В случае госпитализации (по медицинским показаниям) больного с ВП макролиды в комбинации с β-лактамами также рассматриваются как одно из приоритетных направлений эмпирической антибактериальной терапии.
Эмпирическая антибактериальная терапия ВП у взрослых
| Клинический "сценарий" | Антибиотики выбора |
|
Лечение в амбулаторных условиях |
|
| Больные без сопутствующих заболеваний, не принимавшие последние 3 мес АМП |
Амоксициллин или Макролид* (внутрь) |
| Больные с сопутствующими заболеваниями или принимавшие последние 3 мес АМП |
Амоксициллин/клануланат ± макролид или Новый фторхинолон** (внутрь) |
|
Лечение в условиях стационара |
|
| Отделение общего профиля | b-Лактам + макролид (в/в*) или Новый фторхинолон** (в/в*) |
| Отделение интенсивной терапии | b-Лактам + макролид (в/в) или Новый фторхинолон** + цефалоспорин III*** |
*Кларитромицин, азитромицин; **моксифлоксацин. гемифлоксацин, левофлоксацин: ***цефтриаксон, цефотаксим
9. Ключевое место в развитии инфекционных обострений ХОБЛ занимают такие бактериальные возбудители, как Haemophilus influenzae и Streptococcus pneumoniae, удельный вес которых составляет 30–59 и 15–25% соответственно. Вопрос о целесообразности антибактериальной терапии инфекционных обострений ХОБЛ был окончательно решен в 1987 г., когда N.R.Anthonisen и соавт. было показано, что антибактериальная терапия эффективнее плацебо при лечении инфекционных обострений ХОБЛ. Авторами были выделены 3 типа обострения заболевания. Для І типа характерным являлось наличие трех ключевых клинических критериев обострения ХОБЛ: появление или усиление одышки, увеличение объема мокроты, появление гнойной мокроты или усиление ее гнойного характера. Именно для этой категории пациентов эффективность антимикробной терапии (по сравнению с плацебо) оказалась наиболее демонстративной. Наличие любых двух клинических признаков соответствует ІІ типу обострения заболевания. Наличие же только одного из перечисленных признаков соответствует ІІІ типу обострения ХОБЛ, при котором эффект от приема антибактериальных препаратов сопоставим с таковым плацебо.
Обострение ХОБЛ: антибиотики vs. плацебо
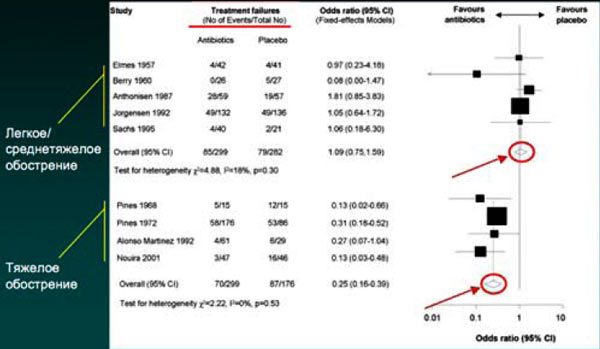
Puhan et al, 2007
10. В тех случаях, когда применение антибиотиков при обострении ХОБЛ признается целесообразным, при выборе того или иного препарата следует учитывать фенотип обострения ХОБЛ. С этой целью выделяют пациентов с простым (неосложненным) обострением ХОБЛ, для лечения которых рекомендуются амоксициллин или макролиды, активные в отношении H. influenzae (азитромицин, кларитромицин). В противоположность этому, при так называемом осложненном обострении заболевания, характеризующимся тяжелыми/крайне тяжелыми нарушениями бронхиальной проходимости, частыми обострениями (≥ 4 в год), наличием серьезных сопутствующих заболеваний и пр., рекомендуются респираторные фторхинолоны или ингибиторозащищенные β-лактамы.
Антибиотики при обострении ХОБЛ
| Фенотип обострения | Вероятные патогены | Антибиотики выбора |
| Простое | Haemophilus influenzae Haemophilus spp. Moraxetla catanbalts Streptococcus pneumoniae | Амоксициллин Макролиды** Цефалоспорины II-III поколения (в алфавитном порядке) |
| Осложненное" | + Klebsiella spp. Другие Enterobactariaceae Возрастание устойчивости к b-лактамам Pseudomonas spp, |
Фторхинолоны b-лактамы/ингибиторы b-лактамаз (в порядке предпочтения) |
Примечание. * Наличие ≥ 1 признака (ОФВ,Guidelines Canadian Tnomcic Society, 2008 update (с изменениями)
11. Дискуссионным моментом в определении места макролидов при инфекциях дыхательных путей является наличие уникальных неантимикробных эффектов этого класса антибиотиков, к которым относятся подавление смешанной инфекции и факторов вирулентности возбудителей, снижение адгезии бактерий к слизистой оболочке дыхательных путей, уменьшение продукции и улучшение реологических свойств бронхиального секрета, иммуномодулирующее действие.
Сегодня сложно достоверно оценить вклад многообразных иммуномодулирующих эффектов макролидов в достижение реального клинического эффекта, но и игнорировать их не следует.
Иммуномодулирующие эффекты
- Модулирующее влияние на нейтрофилы (фагоцитоз, хемотаксис, киллинг, апоптоз)
- Торможение окислительного взрыва и образования N0
- Ингибирование образования провоспалительных цитокинов (ИЛ-1, 6, 8, ФНО-а)
- Усиление продукции противовоспалительных цитокинов (ИЛ-2,4,10)
- Торможение выработки факторов вирулентности P.aeruginosa, P.mirabilis и адгезии микроорганизмов к слизистым дыхательных путей
