Эффективность и безопасность Мертенила (розувастатина) 40 мг/сут у пациентов с семейной гиперхолестеринемией
СтатьиОпубликовано в журнале:
Системные гипертензии №2 2014
М.Ю.Зубарева, П.П.Малышев, Т.А.Рожкова, В.В.Кухарчук
Отдел проблем атеросклероза ИКК им. А.Л.Мясникова ФГБУ РКНПК Минздрава России, Москва
Резюме
Семейная гиперхолестеринемия (СХГС) – это заболевание, обусловленное генетическими нарушениями, приводящими к значительному повышению концентрации холестерина (ХС) в крови и, как следствие, – к повышенному риску раннего развития ишемической болезни сердца. Розувастатин является наиболее мощным гиполипидемический препаратом из группы ингибиторов ГМГ-КоА редуктазы, разрешенным к клиническому применению в Российской Федерации.
Цель нашего исследования – изучить эффективность, безопасность и переносимость терапии Мертенилом (розувастатин) в максимальной дозе 40 мг/сут у пациентов с СХГС.
Материалы и методы. Исследование было проспективным открытым, длительностью 16 нед. В исследование были включены 40 пациентов, мужчин и женщин в возрасте от 18 и старше, с фенотипическим диагнозом СГХС. У 18 пациентов была обнаружена мутация Arg35000Gln гена APOB100. Мужчины составляли 40% общего числа пациентов. Средний возраст больных был 55,9 года, средний уровень ХС липопротеинов низкой плотности (ЛПНП) – 7,2 (1,2) ммоль/л. Пациенты не принимали статины до включения в исследование (в течение не менее чем 3 мес).
Результаты. Монотерапия розувастатином 40 мг/сут в течение 16 нед исследования способствовала снижению уровня ХС ЛПНП на 55,1% (р<0,001) и уровня АроВ-100 на 45,1% (р<0,001), снижение уровня триглицеридов составило -20,1% (р<0,01). Показатели активности аспартатаминотрансферазы, аланинаминотрансферазы и креатинкиназы через 16 нед терапии достоверно не отличались от исходных значений и не превышали 1,5 верхнего предела нормы. Через 16 нед терапии было выявлено снижение уровня высокочувствительного С-реактивного белка и мочевой кислоты от исходного (р<0,05). В течение всего периода терапии побочных явлений отмечено не было.
Заключение. Терапия Мертенилом (розувастатин) 40 мг/сут является доступным и эффективным методом лечения гетерозиготной СГХС.
Ключевые слова: семейная гиперхолестеринемия,розувастатин, Мертенил, терапия.
Efficacy and safety of Mertenil (rosuvastatin) 40 mg in patients with familial hypercholesterolemia
M.Yu.Zubareva, P.P.Malyshev, T.A.Rozhkova, V.V.Kuharchuk
Summary
Familial hypercholesterolemia (FH) is an inherited disease that results in high levels of total cholesterol, causing the risk of early ischemic heart disease (IHD). Rosuvastatin is the high-potency hypolipidemic agent of HMG-CoA reductase inhibitors which is approved for clinical use.
The goal of our research is to study efficacy, safety Mertenil (rosuvastatin) acceptability of maximal course dose of 40 mg in patients with phenotypic FH.
Materials and methods. The 16-week open study was prospective. The study included 40 men and women at the age of 18 years and older with phenotypic FH. 18 patients had the Arg3500Gln mutation in APOB100 gene. Men accounted for 40% of total number of patients. The average age of patients was 55,9 years and average LDL cholesterol (LDL-c) level was 7,2 (1,2) mmol/l. Patients did not accept statins before the inclusion in this study (for a period no less than 3 months).
Results. Rosuvastatin40 mg monotherapy 16 weeks study contributed to decrease LDL-c by 50% (р<0,001) and ApoB-100 by 45,1% (p<0,001), TG by 20,1% (р<0,01). Aspartate aminotransferase, alanintransferase and creatinekinase activity were not statistically significant from the base values and were not exceed 1,5 superior normal limit after 16-weeks study Through 16 weeks of therapy the identified reduction of hsCRP and uric acid were observed (p<0,05). Side-effects were not observed throughout the period of treatment.
Conclusion. Therapy of Mertenil (rosuvastatin) 40 mgis available and effective in treatment of heterozygous FH.
Key words: familial hypercholesterolemia, rosuvastatin, Mertenil,pharmacotherapy
Сведения об авторах
Зубарева Марина Юрьевна – канд. мед. наук, мл. науч. сотр. лаб. клин. липидологии отд. проблем атеросклероза ИКК им. А.Л.Мясникова ФГБУ РКНПК.
Малышев Павел Прокопьевич – д-р мед. наук, ст. н. сотр. отд. проблем атеросклероза ИКК им. А.Л.Мясникова ФГБУ РКНПК.
Рожкова Татьяна Алексеевна – канд. мед. наук, науч. сотр. лаб. клин. липидологии отд. проблем атеросклероза ИКК им. А.Л.Мясникова ФГБУ РКНПК.
Кухарчук Валерий Владимирович – чл.-кор. РАМН, д-р мед. наук, рук. отд. проблем атеросклероза ИКК им. А.Л.Мясникова ФГБУ РКНПК
Семейная гиперхолестеринемия (СГХС) или аутосомно-доминантная гиперхолестеринемия (ГХС) – это заболевание, обусловленное генетическими нарушениями, приводящими к значительному повышению концентрации холестерина (ХС) в крови и как следствие – повышенному риску раннего развития ишемической болезни сердца (ИБС). У пациентов с СГХС, не получающих терапии, риск развития ИБС примерно в 20 раз выше, а риск развития острого инфаркта миокарда у мужчин до 40 лет в 24 раза выше, чем в общей популяции [1]. При отсутствии терапии мужчины с СГХС имеют 50% риск возникновения коронарного события (фатального и нефатального) до 50 лет, женщины – 30% риск до 60 лет. Средний возраст возникновения ИБС при СГХС у мужчин – 40-45 лет, у женщин – на 10 лет позже [2].
По данным отечественных авторов, частота ИБС среди пациентов с нелеченой гетерозиготной СГХС в возрасте 24 лет и старше составила 61,5%, а продолжительность жизни была существенно снижена, особенно у мужчин (медиана – 53 года при 95% доверительном интервале 49,2-56,8) [3, 4].
С учетом того, что гетерозиготная СГХС встречается у 1 из 300-500 человек, а в некоторых популяциях распространенность может достигать 1:100 (евреи-ашкенази, французские канадцы в Квебеке и др.), это заболевание является одним из наиболее распространенных врожденных метаболических нарушений [2].
Считается, что ежегодно в мире около 200 тыс. больных с СГХС погибают от сердечных приступов [5]. Согласно международным и национальным рекомендациям [2, 6-8]:
- все пациенты с СГХС относятся к группе высокого риска сердечно-сосудистых заболеваний – ССЗ (стандартные шкалы для оценки сердечно-сосудистого риска у этой категории пациентов неприменимы);
- медикаментозное лечение СГХС у взрослых пациентов надо начинать ингибиторами гидроксиметилглютарил-коэнзи-А-редуктазы (ГМГ-КоА-редуктазы) как можно раньше после постановки диагноза, в максимально переносимых дозах;
- при этом следует добиваться снижения уровня ХС липопротеинов низкой плотности (ЛПНП) до 50% и более от исходного значения или целевого уровня ХС ЛПНП.
Статины являются основным классом лекарственных средств, которые применяются для лечения пациентов с ГХС и атеросклерозом. По результатам многочисленных рандомизированных исследований было показано достоверное снижение сердечно-сосудистой и общей смертности независимо от пола, возраста, исходного уровня ХС у разных категорий больных (класс 1, уровень А) [9].
Рандомизированных исследований, в которых бы результаты гиполипидемической терапии у больных с СГХС оценивались по конечным точкам, не существует, однако были проведены клинические исследования, в которых результаты терапии оценивались по суррогатным точкам, таким как динамика атеросклероза в коронарных артериях, толщина комплекса интима-медиа в сонных артериях, проба с реактивной гиперемией [10-19]. Все эти исследования продемонстрировали несомненную эффективность назначения статинов больным с СГХС (класс 1, уровень С).
Розувастатин является наиболее мощным ингибитором ГМГ-КоА-редуктазы, разрешенным к клиническому применению в Российской Федерации. По данным контролируемых клинических исследований программы GALAXY, включившей более 170 тыс. пациентов, уровень ХС ЛПНП при приеме розувастатина в дозах 10-40 мг/сут снижается на 45-57% от исходных значений. Следовательно, розувастатин может быть препаратом выбора при лечении пациентов с СГХС [20].
Цель нашего исследования – изучить эффективность, безопасность и переносимость терапии Мертенилом (розувастатин) 40 мг/сут у пациентов с СГХС.
Материалы и методы
Систематический скрининг гетерозиготной СГХС был проведен у пациентов с диагнозом «гиперлипопротеинемия типа IIa», направленных для консультации в ФГБУ Российский кардиологический научно-производственный комплекс. Клинический диагноз гетерозиготной формы СГХС основывался на международных критериях MED-PED (Make Early Diagnosis – Prevent Early Death), которые учитывают данные анамнеза пациента, семейного анамнеза, результаты медицинского осмотра и уровень ХС ЛПНП плазмы [21]. В дальнейшем у пациентов с установленным фенотипическим диагнозом СГХС была проведена молекулярная диагностика мутации Arg3500Gln гена APOB100.
Таким образом, в исследование были включены пациенты с гетерозиготной СГХС – мужчины и женщины в возрасте от 18 лет и старше. Критериями исключения из исследования являлись активные заболевания печени, а также острый инфаркт миокарда, операция аортокоронарного шунтирования/транслюминальной баллонной коронарной ангиопластики и нестабильная стенокардия в течение 3 мес до скрининга. Критериями исключения были и иные, кроме перечисленных, заболевания или состояния больного, которые, по мнению исследователя, могли внести затруднения в интерпретацию результатов исследования.
Дизайн исследования
Исследование было проспективным открытым. Фаза активной терапии длилась 16 нед.
После проведения клинико-лабораторных методов обследований пациенты, отвечающие критериям включения и давшие устное информированное согласие на участие в программе, были включены в исследование. Промежуточный визит 2 (для титрования дозы препарата с 20 до 40 мг) был проведен через 4 нед от исходного визита. В ходе второго визита были оценены безопасность и переносимость терапии розувастатином, даны рекомендации по увеличению дозы исследуемого препарата до 40 мг/сут. На заключительном визите 3, проведенном через 16 нед от исходного, были оценены эффективность и безопасность терапии Мертенилом 40 мг/сут.
Клиническая характеристика пациентов
В исследование были включены 40 больных (мужчин и женщин) с гетерозиготной СГХС, причем у 18 пациентов была обнаружена мутация Arg35000Gln гена APOB100. Мужчины составляли 40% общего числа пациентов. Средний возраст больных составил 55,9 года. Пациенты не принимали ингибиторы ГМГ-КоА-редуктазы до включения в исследование (в течение не менее чем 3 мес). Примерно у 1/3 (31%) пациентов был установлен диагноз ИБС, и у 17,5% пациентов установлен диагноз компенсированного сахарного диабета 2-го типа. Индекс массы тела был в среднем 26,1 кг/м², что соответствует избыточной массе тела. Атеросклероз брахиоцефальных артерий (по данным УЗДГ) был выявлен у всех пациентов без исключения. Диагноз артериальной гипертензии был установлен примерно у 1/2 включенных больных. Примерно 1/4 (27,5%) пациентов курили при включении в исследование. Исходные биохимические показатели пациентов представлены в табл. 1.
Таблица 1. Исходные биохимические показатели пациентов, включенных в исследование (n=40)
| Показатель | Значение М (SD) |
| Возраст, лет | 55,9 (9,9) |
| Мужской пол, n (%) | 16 (40) |
| ОХС, ммоль/л | 9 (1,3) |
| ХС ЛПНП, ммоль/л | 7,2 (1,2) |
| ХС ЛПВП, ммоль/л | 1,3 (0,2) |
| ТГ, ммоль/л | 1,2 (0,2) |
| АпоА-1, мг/дл | 135 (18,3) |
| АпоВ, мг/дл | 159 (29) |
| Вч-СРБ, мг/дл | 0,34 (0,03; 0,62)* |
| АСТ, Ед/л | 33 (19; 36) |
| АЛТ, Ед/л | 23 (15; 52) |
| КК, Ед/л | 170,6 (100,3) |
| Глюкоза, ммоль/л | 5,13 (0,91) |
* Значение представлено Ме (lq; hq).
Биохимические методы исследования
Взятие крови для лабораторных анализов проводилось из локтевой вены в интервале между 09:00 и 11:00 ч утра натощак. Определение уровня общего ХС (ОХС), триглицеридов (ТГ) и ХС липопротеинов высокой плотности (ЛПВП) определяли стандартными ферментативными методами. Содержание ХС ЛПНП было вычислено по формуле Фридвальда: ХС ЛПНП=ОХС-(ТГ/2,2+ХС ЛПВП), где ТГ/2,2=ХС ЛПОНП (липопротеины очень низкой плотности). Детекция мутации R3500Q гена APOB100 была проведена с помощью аллель-специфической полимеразной цепной реакции.
Статистические методы обработки результатов
В исследовании использовались следующие методы статистического анализа: определение необходимых объемов выборок при планировании исследования, проверка правильности распределения количественных признаков. Различия в изучаемой группе оценивались непараметрическим критерием Вилкоксона. Выборочные параметры, приводимые в таблицах, имеют следующие обозначения: М – среднее, s – стандартное отклонение, Ме – медиана; (1q; uq) – интерквартильный размах; n – объем анализируемой подгруппы; р – достигнутый уровень значимости. Критическое значение уровня значимости принималось равным 0,05. Доля пропущенных значений составила 0,5%. Анализ данных проводился с помощью программы Statistica 6.0 (StatSoft, USA).
Результаты
Динамика показателей, липидного профиля и уровня апобелков плазмы при терапии розувастатином 40 мг/сут (0-16 нед)
Изменение уровней липидов у пациентов с СГХС как следствие «агрессивной» терапии розувастатином 40 мг/сут в течение 3 мес показано в табл. 2, на рис. 1. Монотерапия розувастатином в течение 16 нед исследования оказала выраженное достоверное влияние на уровень ОХС и ХС ЛПНП (-45,3 и -55,1% соответственно). Статистически достоверное снижение уровня ТГ составило -20,1%, уровень ХС ЛПВП почти не изменился: -1,5% (недостоверно – нд).
Таблица 2. Эффект монотерапии розувастатином 40 мг/сут на уровни липидов и апобелков плазмы в течение 16 нед. Средние значения(n=40)
| Показатель | Значение М (SD) | Значение М (SD) | Статистическая значимость, p |
| Исходно | 16 нед терапии | ||
| ОХС, ммоль/л | 9 (1,3) | 4,9 (0,68) | <0,001 |
| ХС ЛПНП, ммоль/л | 7,2 (1,2) | 3,24 (0,7) | <0,001 |
| ХС ЛПВП, ммоль/л | 1,3 (0,2) | 1,2 (0,2) | нд |
| ТГ, ммоль/л | 1,2 (0,2) | 0,94 (0,07) | <0,01 |
| АпоА-1, мг/дл | 135 (18,3) | 132,5 (17) | нд |
| АпоВ, мг/дл | 159 (29) | 89,3 (17,5) | <0,001 |
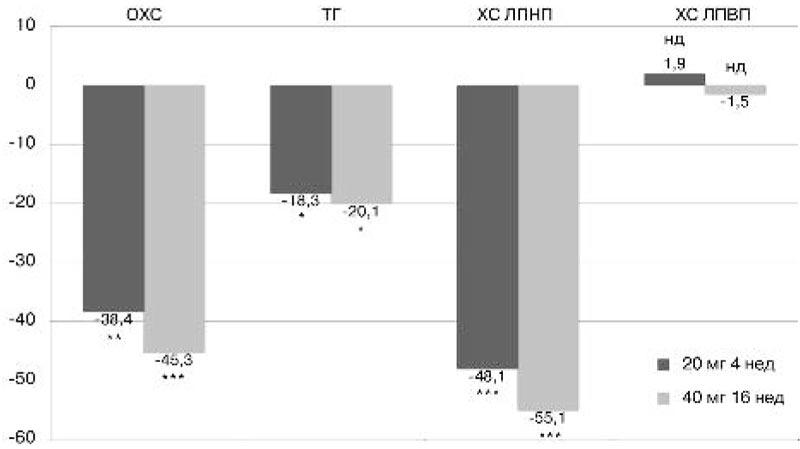 Рис. 1. Динамика (%) уровней липидов (ммоль/л) при монотерапии розувастатином 20 и 40 мг/сут в течение 16 нед.
Рис. 1. Динамика (%) уровней липидов (ммоль/л) при монотерапии розувастатином 20 и 40 мг/сут в течение 16 нед.
* Различия с исходными значениями достоверны при р<0,05; ** р<0,01; ** р<0,001.
Динамика уровней АроА-1 и АроВ-100 в группе пациентов на терапии розувастатином 40 мг/сут в течение 16 нед представлена на рис. 2.
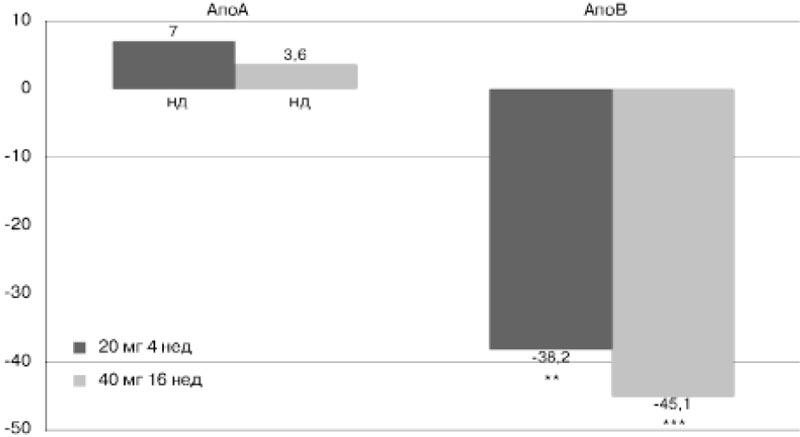 Рис. 2. Динамика (%) уровней АpоА-1 и АpоВ-100 (мг/дл) при терапии розувастатином 20 мг/сут (4 нед) и 40 мг/сут в течение 16 нед.
Рис. 2. Динамика (%) уровней АpоА-1 и АpоВ-100 (мг/дл) при терапии розувастатином 20 мг/сут (4 нед) и 40 мг/сут в течение 16 нед.
** Различия с исходными значениями достоверны при р<0,01; *** р<0,001.
Безопасность и переносимость терапии розувастатином 40 мг/сут в течение 16 нед
Показатели активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) в монотерапии розувастатином 20 мг/сут через 4 нед и 40 мг/сут через 16 нед терапии достоверно не отличались от исходных значений и не превышали 1,5 верхнего предела нормы (табл. 3) Активность креатининкиназы (КК), измеренная в ходе заключительного визита, была повышена в двух случаях (у пациентов с исходно повышенным показателем), однако значения не превышали двух верхних пределов нормы. Аналогично за 16 нед терапии розувастатином не отмечено достоверных изменений в средних значениях билирубина, глюкозы и креатинина. Через 16 нед терапии было выявлено статистически значимое снижение уровня высокочувствительного С-реактивного белка (вч-СРБ) и мочевой кислоты от исходных значений (см. табл. 3). Побочных явлений в течение периода терапии отмечено не было.
Таблица 3. Влияние терапии Мертенилом (40 мг/сут) на показатели безопасности терапии статинами и уровни вч-СРБ в течение 16 нед (n=40). Средние значения М (s)
| Показатели | 0 нед | 16 нед | Статистическая значимость, p |
| АЛТ, Ед/л | 23 (15; 52) | 29 (25; 32) | нд |
| АСТ, Ед/л | 33 (19; 36) | 27 (26; 32) | нд |
| КК*, Ед/л | 170,6 (100,3) | 161,4 (72,8) | нд |
| Глюкоза*, ммоль/л | 5,13 (0,91) | 5,0 (0,6) | нд |
| вч-СРБ, мг/дл | 0,34 (0,03; 0,62) | 0,13 (0,05; 0,19) | 0,029 |
| Креатинин, мкмоль/л | 71,5 (8,3) | 69,9 (5,6) | нд |
| Мочевая кислота*, мкмоль/л | 307,8 (81,5) | 267,8 (76,26) | 0,03 |
* Значения представлены Me (lq; hq).
Обсуждение
Основной целью нашего исследования была оценка гиполипидемической эффективности препарата Мертенил (розувастатин) в максимальной дозе 40 мг/сут у пациентов с гетерозиготной СГХС.
У пациентов с гетерозиготной СГХС, не принимающих лечения, уровень ХС ЛПНП плазмы, как правило, составляет 5-12 ммоль/л. У пациентов, включенных в наше исследование, средний уровень ХС ЛПНП был 7,2 (1,2) ммоль/л. Примерно у 1/2 пациентов была обнаружена мутация Arg35000Gln гена APOB100. Мутация АроВ-100 – один их двух наиболее распространенных вариантов мутаций, способных формировать фенотип, соответствующий СГХС, в англоязычной литературе упоминается как «семейный дефект лиганда ApoB» (FDB) [22, 23]. У носителей мутаций гена APOB100 отмечается более низкий уровень ХС ЛПНП, чем при типичной СГХС, вызванной мутациями рецептора к ЛПНП [24, 25]. Однако считается, что клиническое разграничение этих двух вариантов мутаций при СГХС невозможно, поскольку они имеют большое сходство [26].
Терапия розувастатином 40 мг/сут в течение 16 нед способствовала снижению уровня ХС ЛПНП на 55,1%. Соответственно, в нашем исследовании динамика показателей липидного профиля при терапии розувастатином 40 мг/сут была подобна таковой в крупных рандомизированных исследованиях как у пациентов с высоким риском ССЗ (программа GALAXY), так и у пациентов с гетерозиготной СГХС [27-29].
По данным статистического анализа, у пациентов, включенных в исследование, средний исходный уровень АроА-1 (впрочем, как и уровень ХС ЛПВП) был в пределах нормы 135 (18,3) мг/дл, тогда как средний уровень АроВ-100, напротив, значительно превышал нормальные значения для этой категории пациентов 159 (29) мг/дл при рекомендуемом уровне 80 мг/дл и меньше.
Через 16 нед терапии уровень АроВ-100 подобно уровню ХС ЛПНП достоверно снизился на 45,1% (р<0,001).
С учетом того, что препарат розувастатин, как было показано ранее, является наиболее эффективным на сегодняшний день гиполипидемическим средством, в ходе исследования тщательно контролировались показатели безопасности терапии статинами. Однако так же, как и в широкомасштабных рандомизированных исследованиях с использованием максимальной разрешенной к применению дозы розувастатина 40 мг/сут, переносимость и безопасность этого статина у пациентов с СГХС была удовлетворительной. В течение всего 16-недельного периода терапии побочных явлений отмечено не было. Показатели активности АСТ, АЛТ, КК и средние значения уровня билирубина, глюкозы и креатинина в монотерапии розувастатином 40 мг/сут через 16 нед терапии достоверно не отличались от исходных значений. При этом в ходе заключительного визита было выявлено значимое снижение уровня нелипидного биохимического маркера риска вч-СРБ от исходных значений. При этом уровень снижения вч-СРБ при терапии Мертенилом был подобен таковому при терапии оригинальным розувастатином (результаты исследований JUPITER и ANDROMEDA [30, 31].
Отмеченное через 16 нед терапии розувастатином 40 мг значимое снижение уровня мочевой кислоты как одного из факторов риска ССЗ также может способствовать дополнительному снижению кардиоваскулярного риска у этой категории пациентов [32].
Заключение
Снижение риска ССЗ – основная цель терапии больных с СГХС. Учитывая, что СГХС является одним из наиболее распространенных врожденных метаболических нарушений с повышенным риском раннего развития ССЗ, такие пациенты часто встречаются в практике терапевтов, кардиологов, ревматологов и дерматологов. В условиях практического здравоохранения все без исключения пациенты с выявленной ГХС должны быть оценены на наличие диагностических критериев гетерозиготной СГХС (если уровень ОХС>7,5 ммоль/л или уровень ХС ЛПНП >4,9 ммоль/л). В случае установления клинического диагноза необходимо направить пациента на консультацию липидолога и как можно раньше начинать терапию статинами в максимально переносимых дозах с целью снижения уровня ХС ЛПНП≥50% от исходного значения или достижения целевого уровня ХС ЛПНП.
Важно отметить, что несмотря на распространенность этого заболевания, СГХС остается недостаточно диагностированной и изученной, особенно у детей [33]. Так, по некоторым оценкам, СГХС диагностируется примерно у 20% пациентов, и лишь небольшая часть из них получает адекватную терапию. У большинства людей СГХС не диагностируется или выявляется только после возникновения первого коронарного события. Притом, что для установления диагноза СГХС не требуется проведения сложных инструментальных исследований. Генетическое исследование обычно не требуется для постановки диагноза, его проведение целесообразно, если диагноз сомнителен. Следует отметить, что отрицательный генетический тест не исключает наличия СГХС, поскольку примерно у 20% пациентов с СГХС не обнаруживается мутаций даже при исчерпывающем применении современных методов.
Ненадлежащая диагностика ведет к тому, что данных из контролируемых исследований по эффективности долговременной терапии статинами у пациентов с СГХС недостаточно. Результаты когортных наблюдательных исследований у пациентов с СГХС в Европе показали, что постоянная терапия статинами способствует снижению многократно повышенного риска ССЗ до его уровня в популяции. Кроме того, в метаанализе 14 рандомизированных плацебо-контролируемых исследований с применением статинов (n=90тыс.) было выявлено, что относительный риск ССЗ снижался на 23% как у пациентов с исходным уровнем ХС ЛПНП >4,5 ммоль/л, так и у пациентов с уровнем ХС ЛПНП <4,5 ммоль/л [34]. Последующий метаанализ, в который было включено 12 дополнительных исследований, показал, что высокие дозы статинов снижают риск ССЗ эффективнее, чем средние дозы, независимо от исходного уровня ХС ЛПНП [35].
В нашем исследовании розувастатин (Мертенил) применялся в максимальной разрешенной к клиническому использованию дозе 40 мг/сут. В результате через 16 нед пациенты с гетерозиготной СГХС достигли рекомендованной цели лечения – снижения исходного уровня ХС ЛПНП ≥50%. Терапия Мертенилом (розувастатином), по данным отечественных и зарубежных исследователей, в высоких дозах хорошо переносится больными, и побочные эффекты в виде повышения уровня печеночных ферментов и КК наблюдаются редко. Необходимо указать также, что розувастатин не метаболизируется через изоформу CYP3A4 цитохрома P-450 и обладает гидрофильными свойствами. Такие свойства дают розувастатину преимущества при необходимости назначения препарата в высоких дозах у пациентов с коморбидной патологией и необходимостью приема комплексной медикаментозной терапии. Отметим, что в нашем исследовании у пациентов с СГХС побочных эффектов не наблюдалось.
На основании всего изложенного можно сделать вывод, что терапия Мертенилом 40 мг/сут является доступным и эффективным методом лечения гетерозиготной СГХС.
Литература
- Wiesbauer F, Blessberger H, Azar D et al. Familial-combined hyperlipidaemia in very young myocardial infarction survivors. Eur HeartJ2009; 30:1073-9
- Wierzbicki AS, Humphries SE, Minhas R on behalf of the Guideline Development G. Familial hypercholesterolaemia: summary of NICE guidance.BMJ2008;337: a1095.
- Малышев П.П., Рожкова Т.А., Соловьева Е.Ю. и др. Развитие ишемической болезни сердца при гетерозиготной форме семейной гиперхолестеринемии. Кардиоваск. терапия и профилактика. 2006; 5 (5): 5-13.
- Кухарчук В.В., Малышев П.П., Мешков А.Н. Семейная гиперхолестеринемия в России: генетическая и фенотипическая характеристика. Терапевт. арх. 2009; 9:23-8.
- Civeira F. International Panel on Management of Familial Hypercholesterolemia. Guidelines for the diagnosis and management of heterozygous familial hypercholesterolemia. Atherosclerosis 2004; 173: 55-68.
- Hopkins PN, Toth PP, BaUantyne CM, Rader DJ. National Lipid Association Expert Panel on Familial Hypercholesterolemia. Familial hypercholesterolemias: prevalence, genetics, diagnosis and screening recommendations from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol 2011; 5: S9-17.
- Watts GF, Sullivan DR, van Bockxmeer FM et al. A model of care for familial hypercholesterolaemia: key role for clinical biochemistry. Clin Biochem Rev 2012; 33: 25-31.
- Nordestgaard BG, Chapman MJ, Humphries SE et al. European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease. Eur HeartJ 2013; 3-4:3478-90.
- Национальное общество по изучению атеросклероза (НОА). Российское кардиологическое общество (РКО). Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации, V пересмотр. М., 2012.
- Smilde TJ, Wissen S, Wollersheim H et al. Effect of aggressive versus conventional lipid lowering on atherosclerosis progression in familial hypercholesterolaemia (ASAP): a prospective, randomised, doubleblind trial. Lancet 2001; 357: 577-81.
- Jongh S, Ose L, Szamosi T et al Efficacy and safety of statin therapy in children with familial hypercholesterolemia: a randomized, double-blind,placebo-controlled trial with simvastatin. Circulation 2002; 106: 2231-7.
- Avis HJ, Hutten BA, Gagne C et al. Efficacy and safety of rosuvastatin therapy for children with familial hypercholesterolemia. J Am Coli Cardiol 2010; 55:1121-6.
- Avis HJ, Vissers MN, Stein EA et al. A systematic review and metaanalysis of statin therapy in children with familial hypercholesterolemia. Arterioscler Thromb VascBiol 2007; 27:1803-10.
- Versmissen J, Oosterveer DM, Yazdanpanah M et al Efficacy of statins in familial hypercholesterolaemia: a long term cohort study. BMJ 2008;337: a2423.
- Neil A, CooperJ, Betteridge J et al Reductions in all-cause, cancer, and coronary mortality in statin-treated patients with heterozygous familial hypercholesterolaemia: a prospective registry study. Eur Heart J 2008; 29: 2625-33.
- Kastelein JJ, Akdim F, Stroes ES et al Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008; 358: 1431-43.
- Scientific Steering Committee on behalf of the Simon Broome Register Group. Mortality in treated heterozygous familial hypercholesterolaemia: implications for clinical management. Atherosclerosis 1999; 142:105-12.
- Mohrschladt MF, Westendorp RG, Gevers Leuven JA, Smelt AH. Cardiovascular disease and mortality in statin-treated patients with familial hypercholesterolemia. Atherosclerosis 2004; 112:329-35.
- Neil HA, Hammond T, Mant D, Humphries SE. Effect of statin treatment for familial hypercholesterolaemia on life insurance: results of consecutive surveys in 1990 and 2002. BMf 2004; 328:500-1.
- Fabbri G,Maggioni A Cardiovascular risk reduction: what do recent trials with rosuvastatin tell us?Adv Ther 2009; 26 (5): 469-87.
- Williams RR, Hunt SC, Schumacher MC et al Diagnosing heterozygous familial hypercholesterolemia using new practical criteria validated by molecular genetics. Am J Cardiol 1993; 72:171-6.
- Innerarity TL, Mahley RW, Weisgraber KH et al Familial defective apolipoprotein B-100: a mutation of apolipoprotein B that causes hypercholesterolemia. J Lipid Res 1990; 31:1337-49.
- Whitfield AJ, Barrett PH, van Bockxmeer FM, BurnettJR. Lipid disorders and mutations in the APOB gene. Clin Chem 2004; 50:1 "725-32.
- Ejarque I, RealJT, Martinez-Hervas S et al Evaluation of clinical diagnosis criteria of familial ligand defective apoB 100 and lipoprotein phenotype comparison between LDL receptor gene mutations affecting ligand-binding domain and the R3500Q mutation of the apoB gene in patients from a South European population. Transl Res 2008; 151: 162-7.
- Малышев П.П., Мешков А.Н., Котова Л.А., Кухарчук В.В. Семейный дефект аполипопротеина В-100: молекулярная основа заболевания и клинико-биохимические особенности пациентов. Кардиоваск. терапия и профилактика. 2007; 6 (6): 40-5.
- Myant NB. Familial defective apolipoprotein B-100: a review, including some comparisons with familial hypercholesterolaemia. Atherosclerosis 1993; 1004:1-18.
- Pitt B, Loscalzo J, Monyak J et al Comparison of lipid-modifying efficacy of rosuvastatin versus atorvastatin in patients with acute coronary syndrome (from the LUNAR study). Am J Cardiol 2012; 109 (9): 1239-46.
- Leiter LA, Rosenson RS, Stein E et al. POLARIS study investigators. Efficacy and safety of rosuvastatin 40 mg versus atorvastatin 80 mg in high-risk patients with hypercholesterolemia: results of the POLARIS study. Atherosclerosis 2007; 194 (2): e154-64.
- CRESTOR: Product monograph. cma.ca/crestor_product monographpdf.pdf.
- Ridker PM, Danielson E, Fonseca FAH et alfor the JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N EnglJ Med 2008; 359: 2195-207.
- Betteridge DJ, Gibson M. Effect of rosuvastatin on LDL-C and CRP levels in patients with type 2 diabetes: results of ANDROMEDA study Atheroscler (Suppl.) 2004; 5:107-8.
- Alderman MH. Serum Uric Acid As a Cardiovascular Risk Factor for Heart Disease. Curr Hypertens Rep 2001; 3:184-9.
- Goldberg AC, Hopkins PN, Toth PP et al. Familial Hypercholesterolemia: Screening, Diagnosis and Management of Pediatric and Adult Patients. Clinical Guidance from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol 2011; 5 (35): S1-S8.
- Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056participants in 14 randomised trials of statins. Lancet 2005; 366:1267-78.
- Cholesterol Treatment Trialists Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010; 376: 1670-81.
