Триметазидин модифицированного высвобождения в лечении пациентов с тяжелым течением хронической ишемической болезни сердца: от теории к реальной клинической практике
СтатьиОпубликовано в журнале:
«Consilium medicum. Кардиосоматика», 2014, Том 5, №1, с. 11-17 А.В. Барсуков, Д.В. Глуховской
ФГБВОУ ВПО Военно-медицинская академия им. С.М.Кирова Минобороны России, Санкт-Петербург
Резюме. В статье рассмотрены современные представления о роли цитопротекторной терапии у лиц с ишемической болезнью сердца. Особое внимание уделено обоснованию применения триметазидина модифицированного высвобождения (ТМЗ МВ) при тяжелом многососудистом поражении коронарного русла в сочетании с систолической дисфункцией левого желудочка. Приведено описание клинического случая с акцентом на возможность включения в схему консервативного лечения ТМЗ МВ у полиморбидного пациента пожилого возраста с тяжело протекающей ишемической болезнью сердца.
Ключевые слова: ишемическая болезнь сердца, многососудистое поражение, систолическая дисфункция, медикаментозное лечение, триметазидин модифицированного высвобождения.
Сведения об авторах
Барсуков Антон Владимирович – д-р мед. наук, проф., зам. нач. каф. госпитальной терапии ФГБВОУ ВПО Военно-медицинская академия им. С.М.Кирова Минобороны России
Глуховской Дмитрий Владимирович – канд. мед. наук, асс. каф. госпитальной терапии ФГБВОУ ВПО Военно-медицинская академия им. С.М.Кирова Минобороны России
Trimetazidine modified release in treatment of patients with the serious course of chronic ischemic heart disease: from the theory to real clinical practice
A.V.Barsukov, D.V.GlukhovskoyMilitary medical academy named after S.M.Kirov, Saint-Petersburg
Summary. The paper considers modern conceptions about the role of citoprotective therapy in persons with ischemic heart disease. Special attention is given to the justification of Trimetazidine modified release (TMZ MV) application in patients with severe multi-vessel coronary lesions in conjunction with left ventricular systolic dysfunction. There described the clinical case with emphasis on possibility of inclusion in conservative treatment scheme of TMZ MB to poly morbid elderly patient with severe isc-hemic heart disease.
Key words: ischemic heart disease, multivessel lesion, systolic dysfunction, drug treatment, Trimetazidine modified release.
Несмотря на успехи в современной терапевтической практике, ишемическая болезнь сердца (ИБС) продолжает оставаться лидирующим «поставщиком» смертности во всем мире. Существуют доказательства того, что нарушения энергетического метаболизма, в частности, выражающиеся в увеличении оксидации жирных кислот (ЖК), могут способствовать усугублению ишемической дисфункции поврежденного миокарда [4, 16].
На протяжении последних десятилетий препараты метаболического действия привлекают внимание врачей-клиницистов с позиции их применения у пациентов с заболеваниями сердца. Под «метаболической терапией» в кардиологии следует понимать фармакологическое воздействие, направленное на улучшение энергетического метаболизма кардиомиоцита посредством вмешательства в процессы образования и переноса энергии в нем без влияния на перфузию сердечной мышцы (величину коронарного кровотока) и гемодинамические условия ее функционирования (силу и частоту сердечных сокращений – ЧСС, пред- и постнагрузку). Препаратом, официально зарегистрированным в 80 странах мира, включая Европу, в качестве антиангинального средства метаболического действия, является триметазидин (ТМЗ) – 1-(2, 3, 4-триметоксибензил) пиперазина дигидрохлорид [11].
В соответствии с существующими в настоящее время представлениями ТМЗ обеспечивает увеличение толерантности кардиомиоцитов к ишемии за счет подавления метаболизма ЖК и вторично – стимуляции метаболизма глюкозы [18]. Считается твердо доказанной способность миокардиального цитопротектора ТМЗ в монотерапии и в комбинации с любым из антиангинальных средств уменьшать количество приступов стенокардии, потребность в нитропрепаратах короткого действия, улучшать переносимость физических нагрузок. У пациентов с хронической ИБС этот препарат увеличивает коронарный резерв, продолжительность физической нагрузки до появления изменения сегмента ST [3, 6, 28]. Кроме того, длительное лечение ТМЗ модифицированного высвобождения (МВ) может положительно влиять на прогноз больных, перенесших острый инфаркт миокарда, при котором высока вероятность появления хронической сердечной недостаточности (ХСН) [17]. Антиишемические и другие кардиопротективные эффекты не ассоциированы с изменениями ЧСС и артериального давления.
ТМЗ может с успехом быть использован в лечении пациентов разного возраста, лиц с нарушениями углеводного обмена, при сопутствующей ХСН. В национальном многоцентровом исследовании ПРИМА у лиц со стенокардией напряжения препарат Предуктал МВ отчетливо подтвердил свои антиангинальные свойства, а также способствовал уменьшению проявлений ХСН, снижению ее функционального класса [1]. Сообщается о способности ТМЗ к уменьшению сократительной дисфункции миокарда у лиц с ИБС. Так, в исследовании T.El-Kady и соавт. (2005 г.) установлено, что назначение больным с многососудистым поражением коронарного русла ТМЗ, в отличие от плацебо, сопровождалось достоверным улучшением показателя перфузии миокарда (по данным сцинтиграфии с 99mTc-MIBI) и увеличением его сократимости [10].
По мере развития сердечной недостаточности нарушения энергетического метаболизма сказываются на функциональном состоянии миокарда. Снижается способность кардиомиоцитов к извлечению энергии, получаемой при метаболизме ЖК. Существенно, что ЖК представляют собой основной источник энергии в здоровом сердце. Ослабление транспортной (механической) функции сердца усугубляется неэффективностью утилизации ЖК кардиомиоцитами [16, 23].
Дилатация и гипертрофия миокарда, часто наблюдаемые при ХСН, характеризуются универсальными изменениями биохимизма в кардиомиоцитах. В этом контексте доказано увеличение скорости окисления свободных ЖК на фоне угнетения окисления глюкозы, ослабление Са2+ аденозинтрифосфатазы (АТФазы) саркоплазматического ретикулума и перегрузка ионами Са2+ кардиомиоцитов, нарушение синтеза и транспорта АТФ, увеличение продукции свободных радикалов кислорода, активация фосфолипаз и протеаз, процессов воспаления и апоптоза [27, 32, 35]. Важное значение в реализации структурно-функциональных нарушений в сердце при ХСН имеют избыточная симпатическая стимуляция, гиперактивность циркулирующей и локальной интракардиальной ренин-ангиотензин-альдостероновой системы, повышенная продукция провоспалительных цитокинов [5, 8, 15, 19, 26]. На фоне хронической гиперкате-холаминемии наблюдается возрастание интенсивности липолиза, а следовательно, увеличение поступления в системный кровоток свободных ЖК и их захват кардиомиоцитами [34, 36]. У пациентов с ишемическим генезом ХСН существенную роль может играть феномен гибернирующего миокарда, состоящий в выключении части сократительного миокарда из активного функционирования в результате длительного снижения коронарного кровотока. Для гибернирующего миокарда характерны повышенная активность анаэробного гликолиза, перекисного окисления липидов, апоптоза [14, 31]. Потенциально сохраненная жизнеспособность кардиомиоцитов в зоне выраженного хронического нарушения метаболизма предрасполагает к применению препаратов, способных оптимизировать энергетический метаболизм кардиомиоцита.
Фармакологические эффекты ТМЗ, выражающиеся в способности воздействовать на универсальные интракардиальные механизмы декомпенсации сердца, обосновывают его применение в лечении пациентов с ХСН преимущественно ишемического генеза. К сожалению, немногочисленность долгосрочных данных в пользу лечения ТМЗ, основанных на достижении твердых конечных точек, таких как общая и сердечно-сосудистая смертность, затрудняет повсеместное признание этого относительно нового препарата. Установлено, что кардиопротективные свойства ТМЗ связаны с уменьшением оксидативного стресса, подавлением воспалительных и апоптозных процессов, улучшением эндотелиальной функции [9, 33, 37]. Этот препарат модулирует митохондриальный метаболизм в интересах поддержания энергетического баланса и жизнеспособности в поврежденном миокарде. Передовые научные исследования свидетельствуют о том, что ТМЗ способен обеспечить защиту уязвимого, лишенного кислорода, но потенциально жизнеспособного миокарда. С патогенетической точки зрения ТМЗ рассматривается как эффективное средство лечения ХСН. В соответствии с патогенетической гипотезой энергетического голодания недостаточная обеспеченность АТФ, лежащая в основе сократительной дисфункции миокарда, предрасполагает к применению ТМЗ, позволяющего трансформировать улучшение энергетического обмена в кардиомиоцитах в механическую эффективность сердечной функции и регресс клинических проявлений [21]. Сочетание энергетического эффекта с другими свойствами препарата (восстановление фосфорилирования, подавление воспаления, оксидативного повреждения и апоптоза, улучшение коронарной микроциркуляции) препятствует развитию структурно-функционального и электрического ремоделирования сердца [7, 20–22]. Противовоспалительные свойства ТМЗ подтверждены исследованиями, указывающими на способность препарата уменьшать уровень высокочувствительного С-реактивного белка [25, 37].
В метаанализе 17 опубликованных исследований, включающих данные по 955 больным с ХСН, применение ТМЗ сопровождалось увеличением фракции выброса (ФВ) левого желудочка (ЛЖ), уменьшением конечного диастолического объема ЛЖ, повышением толерантности к физической нагрузке у пациентов с ХСН как ишемического, так и неишемического генеза. Наиболее существенным результатом этого метаанализа оказалось то, что применение ТМЗ ассоциировалось с относительным уменьшением общей смертности на 71% и риска кардиоваскулярных событий на 58% [13].
Данные 16 рандомизированных контролируемых исследований с вовлечением 884 пациентов с ХСН были объединены в метаанализ с целью оценки эффективности ТМЗ [38]. Назначение этого препарата ассоциировалось с относительным уменьшением числа госпитализаций по кардиальным причинам на 57% (p=0,03), общей смертности – на 53% (p=0,27). Терапия, содержавшая ТМЗ, способствовала увеличению ФВ ЛЖ на 6,46% (p=0,0001) и продолжительности времени выполнения дозированной физической нагрузки на 63,75 с (p=0,0001), уменьшению конечного диастолического размера ЛЖ на 6,05 мм (p=0,0001), снижению уровня В-типа натрийуретического пептида на 203,4 пкг/мл (p=0,0002).
Данные о высокой клинической эффективности ТМЗ, полученные в приведенных двух метаанализах, подтвердились и в крупном когортном исследовании (669 больных) по применению этого препарата у больных с ХСН ишемической этиологии. Лечение ТМЗ с большой достоверностью снижало риск смерти и обострения ХСН на 11,4% и продлевало жизнь без осложнений на 7,8 мес [12].
Основные позитивные эффекты ТМЗ при сердечной недостаточности обусловлены главным образом влиянием на функциональное состояние ЛЖ, что клинически выражается в увеличении толерантности к физической нагрузке и уменьшении потребности в госпитализациях по кардиальным причинам. Снижение концентрации мозгового натрийуретического пептида в сыворотке крови является важным свидетельством уменьшения левожелудочковой дисфункции. ТМЗ характеризуется нейтральностью в отношении показателей кровяного давления и ЧСС. Вместе с тем отмеченное уменьшение ЧСС в покое на 2,6 уд/мин может свидетельствовать об улучшении сократительной способности миокарда в целом [38]. Высокая клиническая эффективность ТМЗ МВ при ХСН подтверждена и в российских многоцентровых программах ПРИМА и ПРЕАМБУЛА [1].
Поскольку основную долю случаев ХСН в настоящее время составляют пациенты пожилого возраста, важно обратить внимание на возможность (в принципе весьма низкую) возникновения актуальных для этого контингента потенциальных побочных эффектов: тремора рук, замедления движений, ухудшения равновесия, нарушения речи [29, 30]. В отечественных рекомендациях по диагностике и лечению ХСН (2013 г.) подчеркивается, что назначение ТМЗ МВ должно быть рассмотрено у больных с ХСН ишемической этиологии в дополнение к основным средствам лечения декомпенсации для устранения симптомов, нормализации гемодинамики (и роста ФВ ЛЖ) и возможного снижения риска смерти и повторных госпитализаций (класс рекомендаций IIA, уровень доказательности В) [2]. Польза ТМЗ, доказанная в лечении пациентов с ХСН ишемического происхождения, не противоречит использованию этого препарата в терапии больных со сниженной сократительной функцией ЛЖ иного происхождения, однако требует подтверждения в специально спланированных контролируемых исследованиях.
Описание клинического случая
Из анамнеза известно, что пациент С. (мужчина, возраст на текущий период – 73 года) в возрасте 55 лет (1995 г.) стал отмечать периодические сжимающие боли в области сердца при интенсивной, а в последующем при умеренной физической нагрузке. В этот период за медицинской помощью не обращался, существенного значения болевому синдрому не придавал. В возрасте 58 лет (1998 г.) перенес трансмуральный нижний инфаркт миокарда, в связи с чем прошел все этапы лечения и реабилитации. Тогда же отказался от курения, к которому был ранее пристрастен. На протяжении последующих 8 лет качество жизни было удовлетворительным, регулярной терапии ИБС пациент не получал. В 2007 г. (в возрасте 67 лет) в связи с рецидивом стенокардии напряжения больной был обследован с выполнением коронаро-ангиографии, ангиографии магистральных сосудов головы, по результатам которых определены показания к реваскуляризации миокарда и оперативному лечению стеноза правой общей сонной артерии. Тогда же была выполнена операция коронарного шунтирования в условиях искусственного кровообращения (маммарокоронарный анастомоз с передней межжелудочковой артерией и аутовенозный аортокоронарный шунт с задней межжелудочковой артерией), а также правосторонняя эндартерэктомия. В последующем пациент находился под динамическим наблюдением кардиолога, регулярно принимал b-адреноблокатор, антиагрегант, ингибитор ангиотензин-превращающего фермента, периодически – статин. В марте 2010 г. в связи с возобновлением болевого синдрома в грудной клетке, усилением одышки при умеренных физических нагрузках, появлением отеков на нижних конечностях был повторно комплексно обследован в условиях кардиохирургического стационара, где наряду с нагрузочными тестами и эхокардиографией (Эхо-КГ) выполнена кардиовентрикулография, в результате чего принято решение о выполнении коронарного решунтирования (огибающей артерии, диагональной ветви левой коронарной артерии), пластики (имплантации опорного кольца) митрального клапана в связи с его относительной недостаточностью. Ретроспективно был заподозрен боковой инфаркт миокарда, перенесенный ориентировочно за 1 мес до госпитализации. После завершения оперативного лечения пациент был выписан под наблюдение кардиологом с продолжением применения базисной кардиотропной терапии.
В поле зрения авторов настоящей статьи пациент оказался в ноябре 2010 г., когда был в плановом порядке госпитализирован в кардиологическое отделение клиники терапии им. Н.С.Молчанова. В этот период в клинической картине больного доминировали явления недостаточности общего кровообращения (ХСН IIБ-стадии, III функционального класса) на фоне низкой сократительной способности ЛЖ (ФВ 28%). По данным однофотонной эмиссионной томографии миокарда, выполненной в покое и с нагрузкой внутривенным введением АТФ, выявлены глубокие, преимущественно статические, нарушения перфузии миокарда в бассейнах правой и огибающей коронарных артерий (рис. 1). В этот период наблюдался доминирующий синусовый ритм (с ЧСС 60–80 уд/мин, чередующихся с частыми эпизодами предсердного ритма; частота сокращения желудочков – ЧСЖ 50–60 в минуту). Отмечена склонность к гипотензии (артериальное давление 100–110/60–65 мм рт. ст.). Из сопутствующей патологии было обращено внимание на хроническую болезнь почек III стадии, представленную вторичной нефропатией атеросклеротического генеза (скорость клубочковой фильтрации – СКФCKD-EPI 48 мл/мин, уровень калия сыворотки 4,8 моль/л), хроническую обструктивную болезнь легких (ХОБЛ) III стадии вследствие длительного анамнеза курения (объем форсированного выдоха за 1-ю секунду – ОФВ1 48% от должного). Уровень общего холестерина (ХС) составлял 3,5 ммоль/л, липопротеинов низкой плотности (ЛПНП) – 2,68 ммоль/л (без гиполипидемической терапии), глюкозы сыворотки – 5,2 ммоль/л. С учетом особенностей клинических, лабораторно-инструментальных данных, характера сопутствующей патологии в этот период была сформулирована тактика ведения больного, нацеленная на сдерживание прогрессирования сердечной недостаточности (карведилол, спиронолактон, фозиноприл в малых дозах, фуросемид – в зависимости от выраженности отеков, варфарин – под контролем международного нормализованного отношения – МНО, ТМЗ МВ, тиотропия бромид). От назначения статинов было решено воздержаться вследствие тяжелой сердечной недостаточности и нахождения атерогенных липидов в пограничном диапазоне значений.
Рис. 1. Однофотонная эмиссионная компьютерная томография (на основе сцинтиграфии миокарда с Tc99) у пациента С.
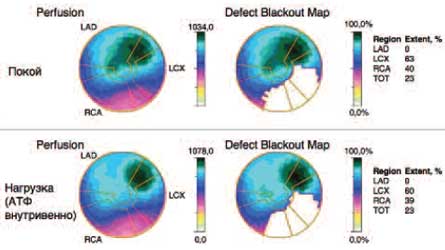
Отчетливо виден статический дефект перфузии в зоне кровоснабжения правой (RCA) и огибающей (LCX) коронарных артерий.
На протяжении последующих трех лет пациент регулярно принимал назначенную терапию с очень высоким комплаенсом, обеспеченным тщательным контролем со стороны супруги. В ходе краткосрочных госпитализаций в клинику госпитальной терапии с периодичностью 2–3 раза в 1 год, обусловленных постепенным нарастанием симптомов ХСН, осуществлялись подходы к интенсификации терапии в виде курса внутривенных инфузий петлевых диуретиков, препаратов метаболического действия, производилась коррекция доз лекарственных средств с учетом особенностей сердечного ритма, функционального состояния почек, бронхиального дерева. Обсуждались показания для проведения кардиоресинхронизирующей терапии, однако в связи с доминирующим предсердным ритмом, наличием протеза митрального клапана, отсутствием должных критериальных признаков диссинхронии миокарда по данным серии ультразвуковых исследований специалисты-аритмологи воздержались от такового метода инвазивного лечения.
В динамике четырехлетнего наблюдения заслуживали внимание данные электрокардиографических исследований (ЭКГ), свидетельствовавших о преобладании предсердного ритма, наличии умеренной желудочковой эктопии, Эхо-КГ с оценкой ФВ ЛЖ (30–40%), лабораторных исследований, свидетельствовавших о низкой СКФ (25–40 мл/мин по формуле CKD-EPI), оценки функции внешнего дыхания (ОФВ1 в диапазоне 46–58%).
В период очередной госпитализации в ноябре 2013 г., обусловленной усилением явлений левожелудочковой недостаточности, был выполнен курс должной интенсивной терапии, проведена скрининговая оценка состояния основных систем организма. Приводим некоторые данные клинического и лабораторно-инструментального обследования пациента С. в этот период.
Объективно на момент завершения интенсивной терапии декомпенсации сердечной недостаточности: акроцианоз губ, кончиков пальцев, набухание и пульсация шейных вен. Удовлетворительного питания (индекс массы тела 22,4 кг/м2). Частота дыхания – 18 в минуту, пульс – 60 в минуту, ритмичный, артериальное давление 100 и 65 мм рт. ст. По средней линии – постстернотомический рубец. Границы сердца расширены вправо и влево на 1,5 см кнаружи от срединно-ключичной линии, выслушиваются ослабление I тона и систолический шум над верхушкой, патологический III тон, акцент II тона над легочной артерией, шум трикуспидальной недостаточности. Над легкими – ясный легочный звук с коробочным оттенком, притупление перкуторного звука справа ниже угла лопатки, дыхание жесткое, рассеянные пневмосклеротические единичные свистящие хрипы в двух легких, справа в нижних отделах (в проекции притупления перкуторного звука) дыхание ослаблено. Размеры печени по Курлову – 12, 10, 9 см, признаков асцита нет. Пульсация на сосудах нижних конечностей (a. tibialis posterior, a. poplitea) сохранена. В проекции общих сонных и почечных артерий патологические шумы не выслушиваются. Отеков нижних конечностей нет. Со стороны других органов и систем существенных отклонений не выявлено.
Клинический анализ крови: гемоглобин – 128 г/л, лейкоциты 4,9?109/л, СОЭ 5 мм/ч; общий анализ мочи: плотность – 1012, следы белка, эритроциты и лейкоциты единичные в поле зрения. Биохимическое исследование крови: ХС – 3,82 ммоль/л, триглицериды – 0,83 ммоль/л, ХС ЛПНП – 2,14 ммоль/л, ХС липопротеинов высокой плотности – 1,04 ммоль/л, креатинин – 150 мкмоль/л (СКФCKD-EPI – 39 мл/мин), общий белок – 79 г/л, калий – 5,25 ммоль/л, натрий – 137 ммоль/л, аланинаминотрансфераза – 40 ед/л, глюкоза венозной сыворотки натощак – 5,3 ммоль/л, N-концевой мозговой натрийуретический пептид значимо повышен – 890 пг/мл, МНО – 2,12 ед.
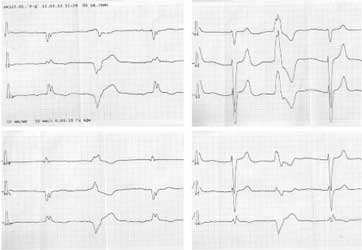
ЭКГ: Р’ 0,08 c, Р’Q 0,18 с, QRS 0,14 с, QT 0,38 с. Предсердный ритм с ЧСЖ 68 в минуту, на фоне которого отмечается желудочковая экстрасистолия; полная блокада левой ножки предсердно-желудочкового пучка с преимущественным блокированием задней ветви; рубцовые изменения в переднебоковой области ЛЖ (рис. 2).
Рис. 2. ЭКГ пациента С. со сложными нарушениями ритма, проводимости, рубцовыми изменениями.
Эхо-КГ: объем левого предсердия увеличен (Vлп=78,7 мл, индекс объема левого предсердия – 36 мл/м2), толщина межжелудочковой перегородки – 9,6 мм; толщина задней стенки ЛЖ – 11,6 мм; конечный диастолический размер ЛЖ – 64 мм; ФВ (по Симпсону) ЛЖ – 38%; индекс массы миокарда ЛЖ – 209 г/м2; диаметр правого желудочка – 34 мм; давление в легочной артерии – 40 мм рт. ст.; признаки наличия протезированного кольца митрального клапана; регургитация на митральном и пульмональном клапанах 2-й степени, на трикуспидальном клапане – 2-й степени; диффузное снижение глобальной сократимости миокарда.
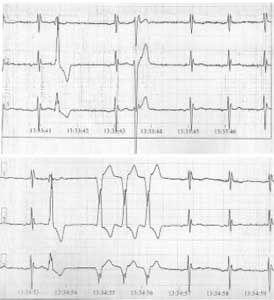
Холтеровское мониторирование ЭКГ: доминирующий предсердный ритм с ЧСЖ 49–76 в минуту, средняя ЧСЖ (сутки/день/ночь) – 64/65/61 в минуту. Зарегистрированы следующие нарушения ритма и проводимости: частые политопные, полиморфные желудочковые экстрасистолы (всего 2857 эпизодов), неустойчивые пароксизмы мономорфной желудочковой тахикардии (9 эпизодов); одиночные наджелудочковые экстрасистолы (всего 77 эпизодов); рис. 3.
Рис. 3. Фрагмент холтеровского мониторирования ЭКГ у пациента С. Визуализируются желудочковые нарушения сердечного ритма высоких градаций.
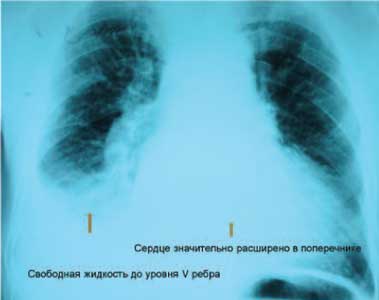
Рентгенография органов грудной полости: диффузный пневмосклероз, эмфизема легких, правосторонний гидроторакс (справа до уровня передней пластинки V ребра), увеличение размеров сердца в поперечнике (рис. 4).
Рис. 4. Рентгенография грудной клетки пациента С. Заслуживают внимания кардиомегалия, признаки правостороннего гидроторакса.
Исследование функции внешнего дыхания (до/после пробы с бронхолитиком): жизненная емкость легких (ЖЕЛ) – 43/42%, ОФВ1 – 39/42%, ОФВ1/ЖЕЛ – 94/102.
Ультразвуковое исследование органов брюшной полости и почек: печень не увеличена, желчный пузырь, поджелудочная железа, селезенка без значимой патологии. Почки расположены в типичном месте, нормальной подвижности, контуры ровные; правая почка 9,0/4,5 см, левая почка 9,5/5,9 см, паренхима неоднородная, конкрементов нет.
В ходе обследования был установлен диагноз: Генерализованный атеросклероз. ИБС. Атеросклероз аорты и коронарных артерий. Атеросклеротический и постинфарктный (1998, 2010 гг.) кардиосклероз. Сложные нарушения ритма и проводимости: предсердный ритм, частая полиморфная желудочковая экстрасистолия, неустойчивые пароксизмы желудочковой тахикардии, полная блокада левой ножки предсердно-желудочкового пучка с преимущественным блокированием задней ветви. Операции коронарного шунтирования (2007 г.) и решунтирования (2010 г.), пластики митрального клапана на опорном кольце в условиях искусственного кровообращения (2010 г.). Атеросклероз сонных артерий. Каротидная эндартерэктомия справа (2007 г.). ХСН IIБ-стадии, III>II функционального класса. Легочная гипертензия 1-й степени. Хроническое субкомпенсированное легочное сердце. Хроническая болезнь почек III стадии (СКФCKD-EPI 39 мл/мин). Нефропатия атеросклеротического генеза. ХОБЛ III стадии. Дыхательная недостаточность 1-й степени.
Приведенный клинический случай являет собой пример тяжелой коморбидной патологии с трудным принятием однозначных врачебных решений по применению тех или иных фармакологических препаратов. Кажущееся противоречие в некоторых лечебных подходах (карведилол и ХОБЛ, карведилол и предсердный ритм, карведилол и склонность к гипо-тензии, спиронолактон и почечная дисфункция) применительно к тяжелой ХСН в сочетании с бронхолегочной патологией, почечной дисфункцией с точки зрения формальной логики компенсируется удовлетворительными результатами реальной клинической практики ведения трудного пациента с исходно неблагоприятным долговременным прогнозом. Осторожное продолжительное применение (с регулярной коррекцией доз) карведилола, фозиноприла, спиронолактона, варфарина не оказало неблагоприятного влияния на показатели сердечно-сосудистой, дыхательной, выделительной систем. В перечне базисных препаратов лечения нашего пациента также представлен ТМЗ МВ (Предуктал МВ), показанный к применению с учетом имеющегося многососудистого поражения коронарного русла и дисфункции миокарда ишемического генеза. Отсутствие гемодинамических, бронхоконстрикторных эффектов Предуктала МВ, а также нахождение СКФ в диапазоне, достоверно превышающем 15 мл/мин, позволило назначать данный препарат в дозе 70 мг/сут на протяжении трехлетнего периода. Представленный случай имеет целью акцентировать внимание на расширении применения в реальной клинической практике средств с высокой патогенетической обоснованностью и минимальным набором потенциальных побочных эффектов. Одним из таких лекарственных препаратов служит оригинальный ТМЗ МВ, сегодня официально рекомендуемый для лечения пациентов с тяжелым хроническим течением ИБС.
ЛИТЕРАТУРА
1. Васюк Ю.А., Шальнова С.А., Школьник Е.Л. и др. Исследование ПРИМА. Сравнение клинического эффекта триметазидина MB у мужчин и женщин. Кардиология. 2011; 51 (6): 11–5.
2. Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр). Сердечная недостаточность. 2013; 14 (7): 379–472.
3. Ciapponi A, Pizarro R, Harrison J. Trimetazidine for stable angina. Cochrane Database Syst Rev 2005; 4: CD003614.
4. Clarke B, Wyatt KM, McCormack JG. Ranolazine increases active pyruvate dehydrogenase in perfused normoxic rat hearts: evidence for an indirect mechanism. J Mol Cell Cardiol 1996; 28 (2): 341–50.
5. Cohn JN, Levine TB, Olivari MT et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med 1984: 311 (13): 819–23.
6. Danchin N, Marzilli M, Parkhomenko A et al. Efficacy comparison of trimetazidine with therapeutic alternatives in stable angina pectoris: a network meta-analysis. Cardiology 2011; 120 (2): 59–72.
7. Deleiris J, Boucher F. Rationale for trimetazidine administration in myocardial-ischemia reperfusion syndrome. Eur Heart J 1993; 14 (Suppl. G): 34–40.
8. Dell’Halia L, Sabri A. Activation of the renin-angiotensin system in hypertrophy and heart failure. Heart Failure. Ed. D.Mann. Philadelphia: Saunders 2004: 129–44.
9. Di Napoli P, Chierchia S, Taccardi AA et al. Trimetazidine improves post-ischemic recovery by preserving endothelial nitric oxide syntha-se expression in isolated working rat hearts. Nitric Oxide-Biol Ch 2007; 16 (2): 228–36.
10. El-Kady T, El-Sabban K, Gabaly M et al. Effects of trimetazidine on myocardial perfusion and the contractile response of chronically dysfunctional myocardium in ischemic cardiomyopathy: a 24-month study. Am J Cardiovasc Drugs 2005; 5: 271–8.
11. Fox K, Garcia MA, Ardissino D et al. Guidelines on the management of stable angina pectoris: the Task Force of the European Society of Cardiology. Eur Heart J 2006; 27 (11): 1341–81.
12. Fragasso G, Rosano G, Baek SH et al. Effect of partial fatty acid oxidation inhibition with trimetazidine on mortality and morbidity in heart failure: results from an international multicentre retrospective cohort study. Int J Cardiol 2013; 163 (3): 320–5.
13. Gao D, Ning N, Niu X et al. Trimetazidine: a meta-analysis of randomised controlled trials in heart failure. Heart 2011; 97 (4): 278–86.
14. Hasegawa K, Iwai-Kanai E, Sasayama S. Neurohormonal regulation of myocardial cell apoptosis during the development of heart failure. J Cell Physiol 2001; 186 (1): 11–8.
15. Imamura Y, Ando H, Ashihara T, Fukuyama T. Myocardial adre-nergic nervous activity is intensified in patients with heart failure without left ventricular volume or pressure overload. J Am Coll Cardiol 1996; 28 (2): 371–5.
16. Ingwall JS. Energy metabolism in heart failure and remodelling. Cardiovasc Res 2009; 81 (3): 412–9.
17. Iyengar SS, Rosano GM. Effect of antianginal drugs in stable angina on predicted mortality risk after surviving a myocardial infarction: a preliminary study (METRO). Am J Cardiovasc Drugs 2009; 9 (5): 293–7.
18. Kantor PF, Lucien A, Kozak R et al. The antianginal drug trimeta-zidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial longchain-ketoacyl coenzyme A thiolase. Circ Res 2000; 86 (5): 580–8.
19. Kaye D, Lefkovits J, Jennings G et al. Adverse consequence of high sympathetic nervous activity in the failing human heart. J Am Coll Cardiol 1995; 26 (5): 1257–63.
20. Kiyosue T, Nakamura S, Arita M. Effects of trimetazidine on action potentials and membrane currents of guinea-pig ventricular myocy-tes. J Mol Cell Cardiol 1986; 18 (2): 1301–11.
21. Lee L, Horowitz J, Frenneaux M. Metabolic manipulation in isc-haemic heart disease, a novel approach to treatment. Eur Heart J 2004; 25 (8): 634–41.
22. Levin ER, Gardner DG, Samson WK. Mechanisms of disease – Nat-riuretic peptides. New Engl J Med 1998; 339: 321–8.
23. Lopaschuk GD, Ussher JR, Folmes CD et al. Myocardial Fatty Acid Metabolism in Health and Disease. Physiol Rev 2010; 90 (1): 207–58.
24. Management of stable angina pectoris. Recommendations of the Task Force of the European Society of Cardiology Eur Heart J 1997; 18: 314–413.
25. Mann DL. Inflammatory mediators and the failing heart: past, present, and the foreseeable future. Circ Res 2002; 91 (11): 988–98.
26. Mann DL. Activation of inflammatory mediators in heart failure. Heart Failure. Philadelphia: Saunders 2004: 159–80.
27. Margulies KB, Houser SR. Myocyte abnormalities in human heart failure. Heart Failure Philadelphia: Saunders 2004: 41–98.
28. Marzilli M, Klein WW. Efficacy and tolerability of trimetazidine in stable angina: a meta-analysis of randomized, double-blind, controlled trials. Coron Artery Dis 2003; 14 (2): 171–9.
29. Masmoudi K, Masson H, Gras V et al. Extrapyramidal adverse drug reactions associated with trimetazidine: a series of 21 cases. Fundam Clin Pharmacol 2011.
30. Montastruc JL, Sommet A, Olivier P et al. Drugs, Parkinson’s disease and parkinsonian syndroms: recent advances in pharmacovigi-lance. Therapie 2006; 61 (1): 29–38.
31. Narula J, Pandley P, Arbustini E et al. Apoptosis in heart failure: Release of cytochrome c from mitochondria and activation of caspa-se-3 in human cardiomyopathy. Proc Natl Acad Sci USA 1999; 96 (14): 8144–9.
32. Opie LH. The metabolic vicious cycle in heart failure. Lancet 2004; 364 (9447): 1733–4.
33. Ruixing Y, Wenwu L, Al-Ghazali R. Trimetazidine inhibits cardio-myocyte apoptosis in a rabbit model of ischemia-reperfusion. Transl Res 2007; 149 (3): 152–60.
34. Schonfeld P, Wojtczak L. Fatty acids as modulators of the cellular production of reactive oxygen species. Free Radic Biol Med 2008; 45 (3): 231–41.
35. Stanley WC, Lopaschuk GD, Hall JL et al. Regulation of myocardial carbohydrate metabolism under normal and ischaemic conditions – Potential for pharmacological interventions. Cardiovasc Res 1997; 33 (2): 243–57.
36. Wallhaus TR, Taylor M, Degrado TR. Myocardial free fatty acid and glucose use after carvedilol treatment in patients with congestive heart failure. Circulation 2001; 103 (20): 2441–6.
37. Williams FM, Tanda K, Kus M et al. Trimetazidine inhibits neutrop-hil accumulation after myocardial-ischemia and reperfusion in rabbits. J Cardiovasc Pharmacol 1993; 22 (6): 828–33.
38. Zhang L, Lu Y, Jiang H et al. Additional use of Trimetazidine in patients with chronic heart failure: a meta-analysis. J Am Coll Cardiol 2012; 59 (10): 913–22.
