Фенотип хронической обструктивной болезни легких с частыми обострениями и современная противовоспалительная терапия
СтатьиЗ.Р.Айсанов, Е.Н.Калманова, О.Ю.Стулова
ФГБУ "НИИ пульмонологии" ФМБА России: 105077, Москва, ул. 11-я Парковая, 32, корп. 4;
ГБОУ ВПО РНИМУ им. Н.И.Пирогова: 117997, Москва, ул. Островитянова, 1
Ключевые слова: хроническая обструктивная болезнь легких, обострения, фенотип, ингибиторы фосфодиэстеразы-4.
Phenotype Of Chronic Obstructive Pulmonary Disease With Frequent Exacerbations And Current Anti-inflammatory Therapy
Z.R.Aisanov, E.N.Kalmanova, O.Yu.Stulova
Key words: chronic obstructive pulmonary disease, exacerbations, phenotype, phosphodiesterase-4 inhibitors.
Хроническая обструктивная болезнь легких (ХОБЛ) сегодня является одной из основных причин заболеваемости и смертности во всем мире (около 210 млн больных, 3 млн смертей (5 % всех смертей) ежегодно). По некоторым прогнозам, к 2030 г. ХОБЛ займет 3-е место среди ведущих причин смертности [1—3].
В течении ХОБЛ часто отмечаются эпизоды клинической нестабильности, которые определяются как обострения. Прогрессирование заболевания в значительной степени связано с обострениями, которые в соответствии с GOLD (Global Initiative for Chronic Obstructive Lung Disease) определяются как "события при естественном течении заболевания, которые характеризуются изменением базального уровня одышки, кашля и / или выделения мокроты, выходят за рамки межсуточных колебаний, возникают остро и могут потребовать изменения плановых назначений" [1].
Основными симптомами обострения являются появление или усиление одышки, кашля и / или отделения мокроты, а также изменение цвета и / или вязкости мокроты [4]. Тяжесть обострения может быть классифицирована на основании изменения симптомов или применения препарата, обычно используемого для лечения обострений [5]. Обострения обычно связаны с бактериальными и / или вирусными инфекциями дыхательных путей и повышением уровня загрязненности воздуха [1] и сопровождаются увеличением уровня маркеров воспаления в дыхательных путях и системном кровотоке, а так же повышением скорости падения легочной функции, которая наиболее выражена у пациентов с частыми обострениями. Процесс восстановления больного после тяжелого обострения может растянуться на период до нескольких недель [6—9].
Фенотип ХОБЛ с частыми обострениями
В соответствии с данными из различных источников считается, что пациент, страдающий ХОБЛ, переносит в среднем от 1 до 4 обострений в год [10]. Однако среди больных ХОБЛ есть лица, которые вовсе не имеют обострений, и вместе с тем есть пациенты, течение болезни у которых характеризуется частыми обострениями.
В исследовании ECLIPSE (Evaluation of COPD Longitudinally to Ldentify Predictive Surrogate Endpoints) с участием 2 138 пациентов [11], у 23 % больных не отмечалось каких-либо обострений в течение 3 лет, в то время как 12 % участников исследования демонстрировали ≥ 2 обострений в год в течение 3-летне-го периода. Склонность к обострениям в течение всего периода исследования оставалась довольно стабильной характеристикой: около 60 % пациентов, перенесших ≥ 2 обострений в 1-й год, продолжали иметь частые обострения в течение 2-го года наблюдения. Из этих 60 % больных ХОБЛ, которые демонстрировали частые обострения в течение 2 лет подряд, около 70 % пациентов продолжали иметь частые обострения (рис. 1).
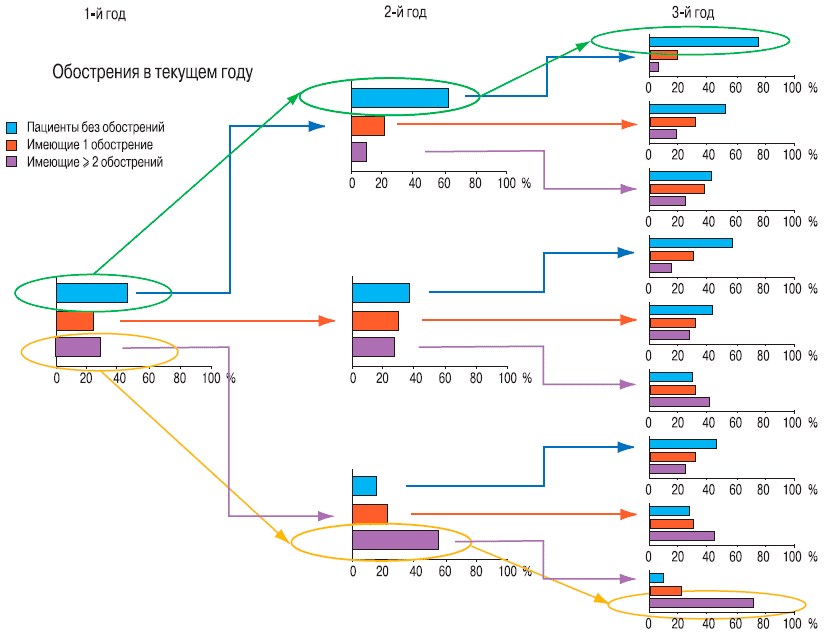
Рис. 1. История предыдущих обострений — наиболее мощный фактор прогноза будущих эпизодов, независимо от стадии ХОБЛ (1 679 пациентов завершили 3-летнее исследование). Проценты обозначают долю пациентов с отсутствием обострений, с 1 обострением, с ≥ 2 обострений [11]
Учитывая стабильность такой характеристики, как количество перенесенных обострений в исследуемой популяции, можно было предположить, что она обусловлена индивидуальной склонностью (или восприимчивостью) к частым обострениям пациентов, формирующих эту популяцию [12, 13]. Эта особенность, а так же высокий риск заболеваемости и смертности у данной группы пациентов [14—21], являются основанием для выделения отдельного фенотипа "с частыми обострениями" ('frequent ехасеr-bator" phenotype), или пациентов с ХОБЛ, склонных к частым обострениям. Предлагаемый условный пороговый уровень количества обострений, перенесенных в течение календарного года, который позволял бы рассматривать пациента как склонного к частым обострениям, в разное время варьировался. В настоящее время к пациентам с ХОБЛ, склонным к частым обострениям, принято относить больных с ≥ 2 эпизодами обострений в течение календарного года [1, 11].
Важным критерием для выявления фенотипа с частыми обострениями, помимо регистрации ≥ 2 обострений в течение года, является то, что эти обострения должны быть разделены во времени периодом ≥ 4 нед. после окончания лечения предыдущего обострения или 6 нед. от начала предыдущего обострения — в тех случаях, когда его лечение не проводилось. Этот критерий используется для того, чтобы можно было разделить предыдущее обострение, лечение которого не принесло успеха, и новый эпизод ухудшения течения заболевания [12].
После окончательного выявления пациента с фенотипом частых повторных обострений необходим поиск дополнительных факторов, влияющих на частоту эпизодов, таких как присутствие хронической бронхо-легочной инфекции и / или наличие бронхоэктазов. Важным представляется использование современной противовоспалительной терапии наряду с антибактериальной в лечении этой категории пациентов.
Факторы риска частых обострений
В настоящее время выделяются различные факторы риска, предрасполагающие к частым обострениям у больных ХОБЛ, главными среди них являются следующие [14—19]:
Степень тяжести обструктивных нарушений (или их физиологического эквивалента — ограничения воздушного потока), несомненно, является одним из основных факторов, значимость которого хорошо известна [14, 16, 22—24]. Однако, хотя корреляционная связь между показателем ОФВ1 и количеством обострений в течение года и существует, она характеризуется низким уровнем и отсутствием достоверности. Установлено, что около 40 % пациентов с ХОБЛ тяжелого и крайне тяжелого течения (III—IV стадии) вовсе не имеют обострений, которые бы регистрировались за период наблюдения, в то время как около 20 % больных со среднетяжелым течением ХОБЛ (II стадия) склонны демонстрировать частые обострения [14, 22]. Это является косвенным подтверждением того, что и другие факторы играют важную роль в возникновении частых эпизодов обострения заболевания. И среди этих факторов именно история предыдущих обострений, перенесенных пациентом, является главной и доминирующей причиной и косвенным подтверждением того, что формируется индивидуальная склонность к обострениям, которая будет определять в будущем специфику течения заболевания у конкретного пациента [14, 16, 19, 25-29].
Хроническая гиперсекреция
Среди различных факторов, определяющих частоту эпизодов обострения, именно наличие продуктивного кашля с выделением мокроты в наибольшей степени связано с высоким риском повторных обострений [25, 30]. Было показано, что отношение шансов (ОШ) развития обострения возрастало в 3,7 раз у пациентов с хроническим кашлем, сопровождающимся выделением мокроты. Это значительно выше, чем ОШ развития обострения для таких факторов, как табакокурение (ОШ — 1,01 на 1 ед. пачек / лет) и показатель ОФВ1 (ОШ — 0,98). Была так же показана тесная взаимосвязь между хронической гиперсекрецией и наличием ≥ 2 обострений в предшествующий год (ОШ — 1,54) [10]. Кроме того, среди пациентов с частыми обострениями у 55 % отмечался хронический кашель с мокротой, и только у 22 % не было клинических проявлений гиперсекреции [25]. При этом риск госпитализаций был достоверно выше у пациентов с проявлениями хронической гиперсекреции. Связь между хронической гиперсекрецией и частыми обострениями была стабильной и не зависела от других факторов риска повторных обострений, таких как сниженный ОФВ1, возраст, наличие сопутствующих сердечно-сосудистых заболеваний или активное табакокурение, что является подтверждением роли гиперсекреции как важнейшего среди маркеров обострения.
Одной из важных характеристик, с которыми связана гиперсекреция, является риск респираторной инфекции, и эта связь во многом объясняет появление частых обострений при гиперсекреции. То же самое можно сказать и о наличии бронхоэктазов, которые часто встречаются при различной степени тяжести течения ХОБЛ и связаны с гиперпродукцией мокроты, хронической инфекцией дыхательных путей и повторными обострениями [31,32].
Частые повторные обострения
Долгое время обострения ХОБЛ рассматривались, как эпизоды клинической декомпенсации заболевания большей или меньшей продолжительности, чьи последствия ограничены продолжительностью самих эпизодов. Но сегодня известно, что значительная часть пациентов не восстанавливаются после обострения полностью, и это является причиной последствий как легочного, так и системного характера. В случае частых повторных обострений эти последствия могут накапливаться и оказывать взаимный кумулятивный эффект.
Была показана тесная взаимосвязь между частотой обострений и снижением качества жизни, связанным со здоровьем (health-related quality of life — HRQL) [14, 16, 33—35], а так же внелегочными проявлениями, такими как депрессия, миопатия, инфаркт миокарда и гастро-эзофагеальная рефлюксная болезнь [15, 29, 36]. Скорость снижения легочной функции у больных с частыми обострениями выше, чем у лиц с отсутствием повторных обострений, в среднем на 8 мл в год [37]. И наконец, как следствие всего вышеперечисленного было показано, что по мере возрастания частоты обострений повышается и риск летального исхода, независимо от исходной тяжести заболевания [16, 18].
Важным в понимании влияния частоты обострений ХОБЛ на течение заболевания и судьбу больного является недавно проведенное широкомасштабное когортное исследование в канадской провинции Квебек [38]. Исходно в него были включены 1 410 211 человек, которым в течение периода с 1990 по 2005 г. назначались какие-либо респираторные препараты. Исследуемую когорту, течение заболевания у которых анализировалось в течение 17-летнего периода, окончательно сформировали 73 106 пациентов, перенесших перед включением в исследование хотя бы 1 обострение ХОБЛ, потребовавшее госпитализации.
Во время периода наблюдения было показано, что риск последующего обострения возрастает по мере увеличения их количества в анамнезе (рис. 2). Так, например, после 2-го тяжелого обострения риск возникновения следующего за ним (3-го) эпизода в 3 раза выше, чем после 1-го, а после 10-го эпизода риск возникновения следующего за ним тяжелого обострения выше более чем в 25 раз, по сравнению с риском после 1-го обострения.
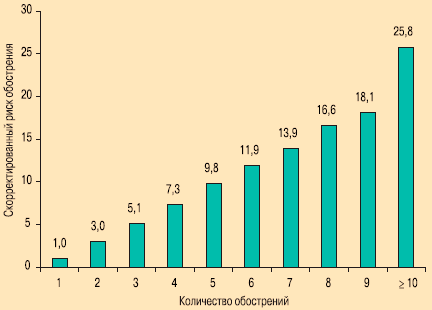
Рис. 2. Связь между количеством перенесенных обострений и риском возникновения последующих эпизодов [38]
Вместе с тем время между следующими друг за другом тяжелыми обострениями стремительно сокращается с каждым новым эпизодом обострения (рис. 3). После 1-го обострения медиана времени до следующего эпизода составляет в среднем 5,4 года, а после 9-го этот временной показатель сокращается до уровня < 4 мес. (т. е. приблизительно в 16 раз).
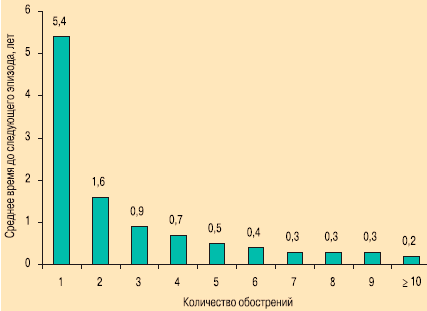
Рис. 3. Взаимосвязь сокращения периода между обострениями и количества ранее перенесенных эпизодов обострения [38]
Риск летальности так же возрастает по мере увеличения количества перенесенных обострений (рис. 4). Так, к примеру, летальность после 2-го тяжелого обострения в 1,9 раз выше, чем после 1-го, в то время как после 10-го эпизода смертность еще более возрастает и превышает этот же показатель после 1-го тяжелого обострения в 4,5 раза. Эта тенденция прослеживалась четко, и представленные данные не зависели от других факторов, которые могли бы на них повлиять (возраст, пол, время года, наличие сопутствующих заболеваний).
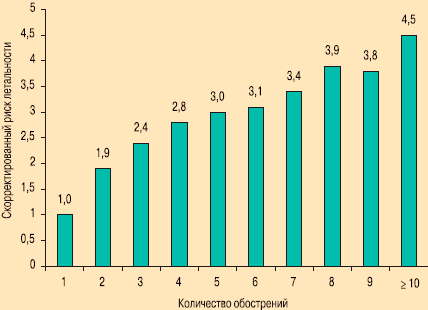
Рис. 4. Зависимость риска летальности больных ХОБЛ от количества перенесенных обострений [38]
Таким образом, совершенно ясно, что больные ХОБЛ с частыми обострениями представляют собой особую группу пациентов с высоким риском заболеваемости и смертности, требующих особого внимания и более интенсивного терапевтического подхода.
Терапия пациентов с частыми обострениями и ингибиторы ФДЭ-4
Способность влиять на частоту и выраженность обострений показали различные методы терапевтических вмешательств, такие как вакцинация против гриппа, прекращение табакокурения, фармакотерапия с использованием базисного применения длительно действующих бета-2-агонистов (ДДБА), длительно действующих антихолинергических препаратов (ДДАХ) и ингаляционных глюкокортикостероидов (иГКС) [1].
Влияние рофлумиласта на склонность к обострениям
Рофлумиласт (ингибитор фосфодиэстеразы 4-го типа) является первым представителем принципиально нового класса препаратов, нацеленных на лечение специфичного для ХОБЛ воспаления. Анализ ранее проведенных исследований показал, что наибольшая эффективность рофлумиласта отмечается у пациентов с ХОБЛ с клиническими проявлениями хронического бронхита и частыми обострениями. Было показано, что рофлумиласт клинически значимо снижает частоту обострений и достоверно улучшает показатели респираторной функции [39, 40]. Эффективность рофлумиласта проявлялась в большей степени у пациентов, получавших сопутствующую терапию ДДБА, ДДАХ и иГКС [41, 42].
Ключевым механизмом эффективности рофлумиласта является подавление воспаления в дыхательных путях, а так же системного воспаления, что было показано как на животных моделях, так и у пациентов с ХОБЛ, и представляется наиболее важным в лечении больных с частыми обострениями [43].
В изменении представлений об эффективности рофлумиласта у больных ХОБЛ с фенотипом частых обострений важными представляются данные недавно опубликованного объединенного анализа 52-недельных двойных слепых плацебо-контролируемых исследований М2-124 и М2-125 с включением пациентов с ХОБЛ III и IV стадии с клиническими проявлениями хронического бронхита [44]. Основные результаты, полученные при проведении этих 2 похожих по своему дизайну исследований, были ранее подробно изложены в предшествующих публикациях [39]. Критерии включения основывались на данных ранее проведенных исследований, в которых было показано, что пациенты с тяжелым и крайне тяжелым течением ХОБЛ, симптомами хронического бронхита и обострениями в анамнезе лучше всего отвечают на терапию рофлумиластом.
Общая характеристика пациентов
Суммарные данные пациентов, включенных в анализ, представлены в табл. 1. На основании данных анамнеза пациенты (n = 3 091) были рандомизированы следующим образом: 2 261 (73 %) — больные с нечастыми обострениями, 830 (27 %) — с частыми обострениями ХОБЛ. Возраст пациентов составлял от 40 до 92 лет (в среднем — 63,8 лет); среди них мужчин было 76 %. Средние показатели легочной функции в группах рофлумиласта и плацебо были сопоставимы (1,01 л (33,0 %) и 1,02 л (33,4 %) соответственно). Большинство (61 % — в группе рофлумиласта и 64 % — в группе плацебо) составляли больные ХОБЛ тяжелого течения (III степень по критериям GOLD). Сопутствующую терапию ДДБА после вступления в лечебный период в группе рофлумиласта получали 49 %, в группе плацебо — 51 %, т. е. приблизительно половина больных; коротко действующие антихолинергические препараты (КДАХ) — 38 % и 40 % соответственно. Прием иГКС во время исследования не разрешался, но 42 % в каждой из групп принимали их до включения в исследование. Следует отметить, что для пациентов с частыми обострениями в анамнезе была более характерна сопутствующая терапия ДДБА и прием иГКС до включения в исследование.
Таблица 1
Объединенный анализ данных исследований М2-124 и М2-125 (общая характеристика пациентов)
|
Показатели |
Объединенная популяция |
Частые обострения |
Нечастые обострения | |||
|
Рофлумиласт, n = 1 537 |
Плацебо, n = 1 554 |
Рофлумиласт, n = 1 124 |
Плацебо n = 1 137 |
Рофлумиласт, n = 413 |
Плацебо, n = 417 | |
| Возраст, лет | 63,0 ±9,3 | 63,9 ±9,1 | 63,7 ±9,2 | 64,0 ±9,1 | 63,8 ±9,8 | 63,4 ±9,3 |
| Мужчины, n (% курильщиков) | 1 150 (74,8) | 1 186 (76,3) | 853 (75,9) | 877(77,1) | 297 (71,9) | 309 (74,1) |
| Курение, пачек/лет | 48,4 ±25,2 | 46,9 ±23,3 | 49,0 ±25,0 | 47,0 ±23,4 | 46,6 ±25,8 | 46,6 ±23,1 |
| Пред-бронходилатационный ОФВ1, л | 1,0 ±0,4 | 1,0 ±0,4 | 1,0 ±0,4 | 1,0 ±0,4 | 1,0 ±0,4 | 1,0 ±0,3 |
| Пост-бронходилатационный ОФВ1, л | 1,1 ±0,4 | 1,1 ±0,4 | 1,1 ±0,4 | 1,1 ±0,4 | 1,1 ±0,4 | 1,1 ±0,4 |
| Пред-бронходилатационный ОФВ1, % долж. | 33,0 ±10,3 | 33,4 ±10,6 | 32,7 ±10,3 | 33,8 ±10,3 | 33,9 ±10,4 | 32,1+11,1 |
|
Пост-бронходилатационный ОФВ1 / ФЖЕЛ, % |
42,3 ± 11,2 | 42,0 ±10,9 | 41,8 ± 11,0 | 42,1 ±10,8 | 43,5 ±11,6 | 41,6+11,2 |
|
Тяжесть ХОБЛ, n % | ||||||
| тяжелая | 943 (61,4) | 989 (63,6) | 697 (62,0) | 750 (66,0) | 246 (59,6) | 239 (57,3) |
| очень тяжелая | 463 (30,1) | 440 (28,3) | 336 (29,9) | 289 (25,4) | 127 (30,8) | 151 (36,2) |
| Сопутствующая терапия ДДБА* | 749 (48,7) | 793 (51,0) | 523 (46,5) | 546 (48,0) | 226 (54,7) | 247 (59,2) |
| Сопутствующая терапия КДАХ** | 588 (38,3) | 616 (39,6) | 443 (39,4) | 448 (39,4) | 145 (35,1) | 168 (40,3) |
| Предшествующая терапия и ГКС*** | 650 (42,3) | 657 (42,3) | 460 (40,9) | 462 (40,6) | 190 (46,0) | 195 (46,8) |
Рофлумиласт и частота обострений
При проведении терапии рофлумиластом в течение 52 нед. у 32 % пациентов с частыми обострениями в анамнезе по прежнему сохранялись частые обострения, однако в группе плацебо процент пациентов с частыми обострениями был более высоким (40,8 %). Риск сохранения частых обострений в группе рофлумиласта, по сравнению с плацебо, был достоверно ниже (относительный риск (ОР) — 0,799; 95%-ный доверительный интервал (ДИ) — 0,67—0,96; р = 0,0148) (рис. 5). Среди пациентов с нечастыми обострениями в предшествующем году 17,5 % и 22,9 % в группах рофлумиласта и плацебо соответственно перешли в группу с частыми обострениями (ОР — 0,768, 95%-ный ДИ - 0,65-0,91; р = 0,018). Это означает, что риск перехода в группу пациентов с частыми обострениями достоверно ниже при лечении рофлумиластом.
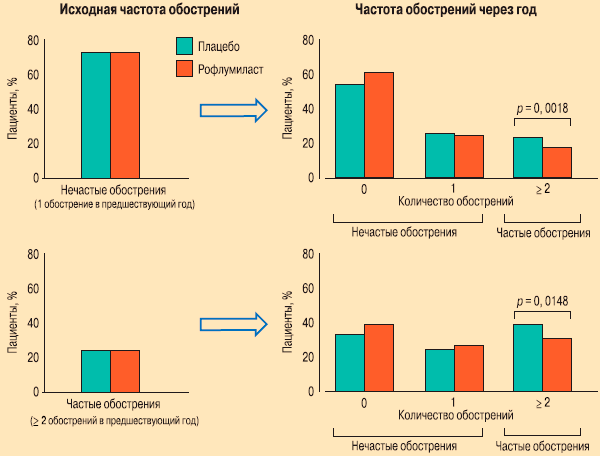
Рис. 5. Изменение частоты обострений при назначении рофлумиласта в общей популяции больных ХОБЛ независимо от стадии
Важным является то, что среди пациентов с исходно частыми обострениями при терапии рофлумиластом только у 3,4 % в 1-й год отмечалось ≥ 2 тяжелых обострений (т. е. приводящих либо к госпитализации, либо к смерти), в то время как в группе плацебо таких пациентов было почти вдвое больше — 6,5 % (ОР — 0,534; 95%-ный ДИ - 0,28, 1,00; р = 0,0516).
Кроме того, снижение числа пациентов с частыми обострениями в группе рофлумиласта не зависело от того, проводилась ли сопутствующая терапия ДДБА и предшествующее лечение иГКС (табл. 2).
Таблица 2
Частота обострений ХОБЛ в 1-й год у пациентов с частыми обострениями в анамнезе (стратификация по использованию сопутствующей терапии иГКС и ДДБА)
|
Сопутствующая терапия ДДБА |
Частота обострений в 1 -й год, % | |||||
|
Нечастые обострения (0-1 обострение) |
Частые обострения (≥ 2 обострений) | |||||
| Рофлумиласт | Плацебо | Р | Рофлумиласт | Плацебо | Р | |
| Да | 66,8 | 58,7 | 0,0073* | 33,2 | 41,3 | 0,0764 |
| Нет | 69,6 | 60,0 | 0,0891 | 30,5 | 40,0 | 0,0998 |
|
Сопутствующая терапия иГКС | ||||||
| Да | 61,1 | 55,9 | 0,0046* | 38,9 | 44,1 | 0,2950 |
| Нет | 74,0 | 62,2 | 0,1032 | 26,0 | 37,8 | 0,0191* |
При дополнительном анализе в соответствии со степенью тяжести ХОБЛ было показано, что среди больных с частыми обострениями и тяжелой обструкцией (III степень тяжести по критериям GOLD) (группа рофлумиласта — 246 пациентов, плацебо — 239) значительно меньшее число пациентов, принимавших рофлумиласт — 65 (26,4 %), по-прежнему демонстрировали частые обострения в 1-й год лечения, по сравнению с группой плацебо — 93 (38,9 %) (ОР - 0,683; 95%-ный ДИ - 0,53, 0,89; р = 0,0042) (рис. 6). Среди больных с крайне тяжелой ХОБЛ (IV степень по критериям GOLD) и частыми обострениями в предшествующий год (группа рофлумиласта — 127 пациентов, плацебо — 151) количество пациентов с частыми обострениями после 1-го года лечения рофлумиластом составило 54 (42,5 %), что незначительно отличалось от результатов группы пациентов, получавших в качестве терапии плацебо — 64 (42,4 %) (ОР — 1,012; 95%-ный ДИ - 0,77, 1,33; р = 0,931) (рис. 7).
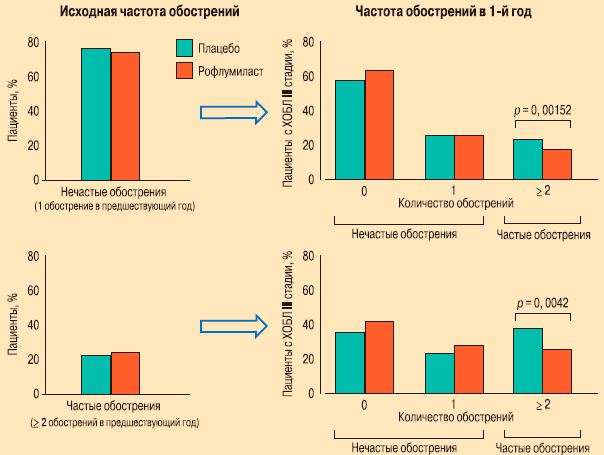
Рис. 6. Изменение частоты обострений при назначении рофлумиласта у пациентов с ХОБЛ III стадии
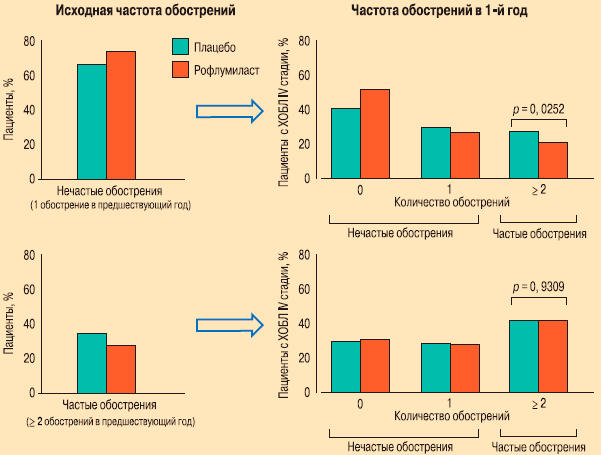
Рис. 7. Изменение частоты обострений при назначении рофлумиласта у пациентов с ХОБЛ IV стадии
Обсуждение результатов объединенного анализа
В новых классификациях GOLD 2011 и 2013 гг., где впервые был реализован интегральный мультиинструментальный подход к оценке ХОБЛ, история предыдущих обострений служит ключевым критерием того, насколько высок риск развития новых обострений в будущем [1]. В соответствии с этой классификацией больные ХОБЛ с выраженной симптоматикой, тяжелой и крайне тяжелой обструкцией, ≥ 2 обострениями в анамнезе в течение предшествующего года классифицируются как пациенты с высоким риском развития обострений. Именно эта категория больных требует лечения, способного снижать частоту обострений.
Рофлумиласт ранее продемонстрировал способность снижать частоту обострений у больных с бронхитическим типом ХОБЛ и частыми обострениями [39]. Однако результаты настоящего исследования показывают так же способность препарата изменять фенотип пациентов. Течение заболевания у больных ХОБЛ с частыми обострениями приобретает более стабильный характер. Под влиянием терапии происходит практическое переключение и модификация индивидуальных фенотипов пациентов, в результате чего они становятся менее склонными к частым эпизодам обострений.
Проведенный анализ в целом показал, что лечение рофлумиластом больных с клиническими проявлениями хронического бронхита и тяжелой степенью обструкции позволяло снижать показатель частоты обострений. Кроме того, рофлумиласт продемонстрировал способность снижать риск сохранения склонности к частым среднетяжелым и тяжелым обострениям в 1-й год на 20 % по сравнению с плацебо (ОР — 0,799; р = 0,0148), независимо от сопутствующей терапии ДДБА и предшествующего приема иГКС.
Различия с результатами ECLIPSE
В то же время большинство пациентов с нечастыми обострениями, принимавших плацебо (77,1 %), таки оставались не склонными к частым обострениям во время лечебного периода. Однако большинство пациентов с частыми обострениями (59,2 %), принимавших плацебо не демонстрировали склонности к частым эпизодам, несмотря на отсутствие активной терапии (рис. 2). Эти данные в некоторой степени похожи на результаты, недавно полученные в исследовании ECLIPSE, когда > 80 % пациентов с нечастыми обострениями и около 60 % — с частыми не меняли свою исходную склонность к обострениям в течение 1-го года, подтверждая концепцию о стабильности этих фенотипов (особенно фенотипа больных ХОБЛ с нечастыми обострениями).
Тем не менее необходимо отметить, что в исследовании ECLIPSE около 40 % пациентов с частыми обострениями перешли в группу с нечастыми обострениями в течение 1 года, что очень похоже на результаты полученные в ходе настоящего исследования. Это подчеркивает, что на склонность к обострениям может влиять такой фактор (важность которого неоднократно подтверждалась, но он по-прежнему недооценивается), как регулярное ведение и тщательное наблюдение за пациентами в условиях клинического исследования.
Однако некоторое различие в результатах, полученных при проведении настоящего исследования и исследования ECLIPSE, могут объясняться следующими различиями в дизайне исследований:
Все вышеперечисленное говорит о том, что различие в результатах объясняется тем, что в исследования включались, по сути, разные популяции больных ХОБЛ.
Важность результатов настоящего анализа состоит в том, что было показано, как противовоспалительный эффект рофлумиласта, влияя на частоту обострений, стабилизирует течение заболевания, что представляется клинически значимым с точки зрения как пациентов, так и врачей.
Лечение больных ХОБЛ в обозримом будущем должно базироваться на достижении 2 основных целей: скорейшем воздействии на симптомы заболевания и одновременном снижении будущих рисков [1, 45]. Рофлумиласт, способный оказывать влияние на частоту обострений, может также снижать будущие риски, независимо от способности влиять на текущую симптоматику.
Количество больных с IV стадией ХОБЛ и частыми обострениями, включенных в исследование, было относительно небольшим (рофлумиласт — 127, плацебо — 151), поэтому к результатам о недостаточной эффективности рофлумиласта в отношении влияния на частоту обострений у больных этой подгруппы следует подходить с осторожностью ввиду ее малочисленности. Тем не менее данные результаты в какой-то степени подтверждают тезис о необходимости вмешательства на более ранних стадиях заболевания с целью снижения будущих рисков [46].
В настоящее время установлено, что больные ХОБЛ с легкой и средне-тяжелой степенью тяжести бронхиальной обструкции могут переносить частые обострения. И эти пациенты рассматриваются как больные с "активной", но не "тяжелой" формой ХОБЛ [47]. Пациенты с частыми обострениями выделяются в особый фенотип [48], отражающий высокий уровень активности заболевания, независимый от тяжести, базирующейся на показателе ОФВ1. В исследовании ECLIPSE было показано, что 22 % больных со II стадией ХОБЛ страдали частыми обострениями [48]. Это подчеркивает необходимость проведения в будущем исследований пациентов с ранними стадиями заболевания с целью изучения эффективности раннего вмешательства для предотвращения обострений.
Среди побочных эффектов, которые ранее неоднократно были описаны [39, 41], следует отметить, что частота встречаемости пневмонии не отличалась в обеих группах. Учитывая повышенный риск развития пневмонии при использовании иГКС [49], эти данные представляются значимыми при выборе противовоспалительных препаратов, особенно у больных ХОБЛ, склонных к частым обострениям.
Некоторым ограничением настоящего анализа можно считать данные по количеству обострений, перенесенных в предшествующий исследованию год, т. к. они базируются на записях в амбулаторных картах и опросах больных. В связи с этим некоторые обострения могут быть не зарегистрированы и упущены, особенно, если они не приводили к госпитализации. Однако если подобная недооценка истории обострений и имела место, то была одинаковой в сравниваемых группах. Кроме того, настоящий анализ показал, что история предшествующих исследованию обострений хорошо прогнозирует количество обострений в исследуемый период, подтверждая, что данный метод сбора информации достаточно надежен [48, 50].
В заключение необходимо отметить, что результаты объединенного анализа 2 исследований впервые показали способность противовоспалительной терапии рофлумиластом коренным образом модифицировать течение заболевания (или фенотип) больных ХОБЛ в отношении обострений, переводя пациентов, склонных к частым обострениям, в категорию пациентов с более стабильным течением заболевания.
ЛИТЕРАТУРА
1. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of COPD. Updated 2013.
2. World Health Organization. Chronic Obstructive Pulmonary Disease Fact Sheet. 2012.
3. Celli B.R., Macnee W. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS / ERS position paper. Eur. Respir. J. 2004; 23 (6): 932—946.
4. Donaldson G.C., Wedzicha J.A. COPD exacerbations. 1: Epidemiology. Thorax 2006; 61 (2): 164—168.
5. Pauwels R., Calverley P., Buist A.S. et al. COPD exacerbations: the importance of a standard definition. Respir. Med. 2004; 98 (2): 99-107.
6. Seemungal T.A., Donaldson G.C., Bhowmik A. et al. Time course and recovery of exacerbations in patients with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2000; 161 (5): 1608-1613.
7. Hurst J.R., Perera W.R., Wilkinson T.M. et al. Systemic and upper and lower airway inflammation at exacerbation of chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2006; 173: 71-78.
8. Wedzicha J.A., Seemungal T.A. COPD exacerbations: defining their cause and prevention. Lancet 2007; 370: 786—796.
9. Perera W.R., Hurst J.R., Wilkinson T.M. et al. Inflammatory changes, recovery and recurrence at COPD exacerbation. Eur. Respir. J. 2007; 29 (3): 527-534.
10. Miravitlles М., Guerrero Т., Mayordomo C. et al. Factors associated with increased risk of exacerbation and hospital admission in a cohort of ambulatory COPD patients: a multiple logistic regression analysis. Respiration 2000; 67: 495—501.
11. Hurst J.R., Vestbo J., Anzueto A. et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N. Engl. J. Med. 2010; 363: 1128-1138.
12. Soler-Cataluna J.J., Rodriguez-Roisin R. Frequent chronic obstructive pulmonary disease exacerbators: how much real, how much fictitious? COPD 2010; 7: 276—284.
13. Tashkin D.P. Frequent exacerbations of chronic obstructive pulmonary disease — a distinct phenotype? N. Engl. J. Med. 2010; 363: 1183-1184.
14. Seemungal T.A.R., Donaldson G.C., Paul E.A. et al. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 1998; 157: 1418-1422.
15. Quint J.K, Baghai-Ravary R., Donaldson G.C., Wedzicha J.A. Relationship between depression and exacerbations in COPD. Eur. Respir. J. 2008; 32: 53-60.
16. SolerJ.J., Sanchez L., Roman P. et al. Risk factors of emergency care and admissions in COPD patients with high consumption of health resources. Respir. Med. 2004; 98: 318-329.
17. Soler J.J., Sanchez L., Latorre M. et al. The impact of COPD on hospital resources: the specific burden of COPD patients with high rates of hospitalization. Arch. Bronconeumol. 2001; 37: 375-381.
18. Soler-Cataluna Martinez-Garcia M.A., Roman Sanchez P. et al. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax 2005; 60: 925-931.
19. Esteban C., Quintana J.M., Aburto M. et al. Predictors of mortality in patients with stable COPD. J. Gen. Intern. Med. 2008; 23: 1829-1834.
20. Soler-Cataluna J.J., Martinez.-Garcia M. A., Sanchez L. et al. Severe exacerbations and BODE index: two independent risk factors for death in male COPD patients. Respir. Med. 2009; 103: 692-699.
21. Alfageme I., Reyes N., Merino M. et al. The effect of airflow limitation on the cause of death in patients with COPD. Chron. Respir. Dis. 2010; 7: 135—145.
22. Dewan N.A., Rafique S., Kanwar B. et al. Acute exacerbation of COPD: factors associated with poor outcome. Chest 2000; 117: 662-671.
23. Bhowmik A., Seemungal T.A.R., Sapsford R.J., Wedzicha J.A. Relation of sputum inflammatory markers to symptoms and lung function changes in COPD exac- erbations. Thorax 2000; 55: 114-120.
24. Miravitlles M., Marin A., Monso E. et al. Colour of sputum is a marker of bacterial colonization in COPD. Respir. Res. 2010; 11: 58.
25. Burgel P.R., Nesme-Meyer P., Chanez P. et al. Cough and sputum production are associated with frequent exacerbations and hos- pitalizations in COPD subjects. Chest 2009; 135: 975-982.
26. Patel I.S., Seemungal T.A.R., Wiks M. et al. Relationship between bacterial colonisation and the frequency, character, and severity of COPD exacerbations. Thorax 2002; 57: 759-764.
27. Tumkaya M., Atis S., Ozge C. et al. Relationship between airway colonization, inflammation and exacerbation frequency in COPD. Respir. Med. 2007; 101: 729-737.
28. Wan E.S., DeMeo D.L., Hersh C.P. et al. Clinical predictors of frequent exacerbations in subjects with severe chronic obstructive pulmonary disease (COPD). Respir. Med. 2011; 105: 588-594.
29. Decramer M., Gosselink R., Troosters T. et al. Muscle weakness is related to utilization of health care resources in COPD patients. Eur. Respir J. 1997; 10: 417—423.
30. Donaldson G.C., Hurst J.R., Smith C.J. et al. Increased risk of myocardial infarction and stroke following exacerbation of chronic obstructive pulmonary disease. Chest 2010; 137: 1091-1097.
31. Miravitlles M. Cough and sputum production as risk factors for poor outcomes in patients with COPD. Respir. Med. 2011; 105: 1118-1128.
32. Martinez-Garcia M.A., Soler-Cataluna J.J., Donat Y. et al. Factors associated with bronchiectasis in chronic obstructive pulmonary disease patients. Chest 2011; 140: 1130—1137.
33. Patel I.S., Vlahos I, Wilkinson T.M.A. et al. Bronchiectasis, exacerbation indices, and inflammation in chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2004; 170: 400-407.
34. Bourbeau J., Ford G., Zackon H. et al. Impact on patients health status following early identification of a COPD exacerbation. Eur. Respir. J. 2007; 30: 907—913.
35. Doll H., Miravitlles M. Quality of life in acute exacerbations of chronic bronchitis and chronic obstructive pulmonary disease: a review of the literature. Pharmacoeconomics 2005; 23: 345-363.
36. Donaldson G.C., Hurst J.R., Smith C.J. et al. Increased risk of myocardial infarction and stroke following exacerbation of chronic obstructive pulmonary disease. Chest 2010; 137: 1091-1097.
37. Bhowmik A., Seemungal T.A.R., Sapsford R.J., Wedzicha J.A. Relation of sputum inflammatory markers to symptoms and lung function changes in COPD exacerbations. Thorax 2000; 55: 114-120.
38. Suissa S., Dell'aniello S., Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax 2012; 67: 957—963.
39. Calverley P.M., Rabe K.F., Goehring U.M. et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet 2009; 374 (9691): 685—694.
40. Fabbri L.M., Calverley P.M., Izquierdo-Alonso J.L. et al. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with longacting bronchodilators: two randomised clinical trials. Lancet 2009; 374(9691): 695—703.
41. Bateman E.D., Rabe K.F., Calverley P.M. et al. Roflumilast with long-acting beta2-agonists for COPD: influence of exacerbation history. Eur. Respir. J. 2011; 38 (3): 553—560.
42. Rennard S.I., Calverley P.M., Goehring U.M. et al. Reduction of exacerbations by the PDE4 inhibitor roflumilast — the importance of defining different subsets of patients with COPD. Respir. Res. 2011; 12: 18.
43. Grootendorst D.C., Gauw S.A., Verhoosel R.M. et al. Reduction in sputum neutrophil and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD. Thorax 2007; 62 (12): 1081-1087.
44. Wedzicha J.A., Rabe K.F., Martinez. F.J. et al. Efficacy of roflumilast in the chronic obstructive pulmonary disease frequent exacerbator phenotype (e-publication on journal.publications.chestnet.org).
45. Postma D., Anzueto A., Calverley P. et al. A new perspective on optimal care for patients with COPD. Prim. Care Respir. J. 2011; 20 (2): 205-209.
46. Rabe K.F., Wedzicha J.A. Controversies in treatment of chronic obstructive pulmonary disease. Lancet 2011; 378 (9795): 1038-1047.
47. Agusti A., Vestbo J. Current controversies and future perspectives in chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2011; 184: 507-513.
48. Hurst J.R., Vestbo J., Anzueto A. et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N. Engl. J. Med. 2010; 363 (12): 1128-1138.
49. Singh S., Amin A.V., Loke Y.K. Long-term use of inhaled corticosteroids and the risk of pneumonia in chronic obstructive pulmonary disease. Arch. Intern. Med. 2009; 169: 219-229.
50. Quint J.K., Donaldson G.C., Hurst J.R. et al. Predictive accuracy of patient-reported exacerbation frequency in COPD. Eur. Respir. J. 2011; 37: 501-507.
