Эффективность и переносимость препаратов железа. Что важнее? Существует ли оптимальное решение?
СтатьиОпубликовано в журнале:
Поликлиника 2/2014
Н.И. Стуклов, д.м.н., профессор кафедры госпитальной терапии РУДН, руководитель курса гематологии и клинической базы кафедры
М.Ю. Кунина, врач гематолог ООО Клиники «Будь здоров»
Е.Н. Семенова, учебный мастер кафедры госпитальной терапии РУДН Эффективность терапии железодефицитной анемии определяется не только биодоступностью железа из препарата, но также зависит от приверженности к лечению самого больного, на что существенным образом влияет переносимость препарата и стоимость лечения. Эффективность препаратов, содержащих двухвалентное железо доказана в многочисленных исследованиях (степень доказательности 1А) и не вызывает сомнения. Препараты на основе трехвалентного железа лучше переносятся, но не всегда эффективны и требуют более длительных курсов лечения. Благодаря уникальному составу (глюконат железа II + глюконат меди + глюконат марганца), препарат Тотема («Laboratoire Innotech International», Франция) позволяет быстро восстанавливать концентрацию гемоглобина и депо железа и при этом обладает хорошей переносимостью. Более того, Тотема может применяться в более низких дозах, чем сульфат железа без потери эффективности лечения. Медь и марганец входят в активные центры белков, обеспечивающих активный транспорт железа в кишечнике и быструю утилизацию, поступившего в кровь железа, тканями. Они входят в состав основных белков антиоксидантной защиты. Также марганец участвует в синтезе гемоглобина, регулирует поступление железа в митохондрии. Сравнение результатов трех мета-анализов показало, что Тотема обладает лучшей переносимостью (частота побочных эффектов 10,4%), чем сульфат железа II (34,1% и 20,4%; р<0,005) и сравнимой переносимостью по отношению к препаратам трехвалентного железа (полимальтозный комплекс гидроксида железа III (14,9%; 0,1<р<0,25), протеин сукцинилат железа III (9,4%; 0,75<р<0,9)). Более того, при приеме Тотема в 19 раз реже возникают запоры, чем при приеме сульфата железа II и в 10 раз реже, чем при приеме полимальтозного комплекса гидроксида железа III, что очень важно для беременных женщин, часто страдающих запорами, особенно в III триместре беременности. При этом Тотема относится к средней ценовой категории, что делает его оптимальным для терапии большого количества пациентов.
Ключевые слова: лечение анемии, железа глюконат, железа сульфат, полимальтозный комплекс гидроксида железа, протеинсукцинилат железа, дефицит железа, глюконат меди, глюконат марганца, Тотема.
Введение
Актуальность проблемы ранней диагностики и адекватного лечения железодефицитной анемии (ЖДА) у любого человека и тем более у беременной женщины переоценить невозможно. Биологическая роль железа велика: оно участвует в окислительновосстановительных процессах, росте и старении тканей, механизмах иммунитета, кроветворении, снабжении органов и тканей кислородом, функционировании множества ферментов. Дефицит железа и, тем более, манифестная его стадия – ЖДА является причиной снижения работоспособности и повышения эмоциональной лабильности, раздражительности у взрослых, увеличения частоты острых респираторных заболеваний, вызывает задержку роста и развития детей [1]. ЖДА у беременных может приводить к повышению частоты гестозов, преждевременных родов, пиелонефрита, плацентарной недостаточности, отставания роста и развития, внутриутробной гибели плода; инфекционным осложнениям, повышенной кровопотери в родах и послеродовый период, слабости родовой деятельности [1]. Недостаточное депонирование железа в антенатальном периоде является одной из причин развития железодефицитных состояний у грудных детей, что в дальнейшем приводит к снижению у этих детей интеллектуального развития, работоспособности и нарушениям поведения [1]. Важнейшими задачами научной медицины и практического здравоохранения сегодня являются ранняя диагностика, лечение и профилактика ЖДА особенно у женщин репродуктивного возраста и беременных с целью получения здорового поколения в будущем.
В современной медицине большое внимание уделяется личности самого больного, его платежеспособности и дисциплинированности, а также его пониманию роли и влияния болезни на жизненное функционирование и качество жизни. Зачастую неустойчивый эффект от проводимого лечения складывается из боязни принимать какие-либо препараты во время беременности, плохой переносимости назначенного препарата или нехватки денег на лечение. Также возможно из-за несерьезного отношения пациента к своему здоровью, непонимания последствий железодефицита, как для себя, так и для здоровья новорожденного. Поэтому важно не только информировать пациента о последствиях железодефицитного состояния, но и подобрать оптимальный для каждого конкретного больного препарат, а для этого необходимо понимать от чего зависит эффективность и переносимость препаратов железа, и сколько будет стоить выбранное лечение.
Все пероральные препараты железа (ПЖ) принципиально можно разделить на препараты двухвалентного и трехвалентного железа, так как именно это в первую очередь определяет их биодоступность и соответственно скорость восстановления гемоглобина, эритроцитарных индексов и депо железа, а также переносимость терапии (Рис. 1). Соли двухвалентного железа показывают лишь незначительные различия между собой по эффективности всасывания железа. Соли трехвалентного железа всасываются хуже (уровень доказательности 1А) [4] , Это связано с различиями в механизме всасывания. Доказано, что в кишечнике железо всасывается в двухвалентном состоянии. Для этого трехвалентное железо пищи с помощью медь-зависимой ферроредуктазы на апикальной мембране энтероцитов или под действием витамина С, восстанавливается до двухвалентного и через марганец-зависимые белки-транспортеры двухвалентных металлов (ДМТ1-белки) поступает в энтероцит. Затем, через белок ферропортин на базальной мембране поступает в кровь, где с помощью медь-зависимых феррооксидаз (гефестин – на базальной мембране, связан с ферропортином; церулоплазмин – в плазме) окисляется до трехвалентного состояния чтобы связаться с транспортным белком – трансферрином [2]. Биодоступность двухвалентных солей железа в несколько раз выше, чем трехвалентных [4, 5, 6], так как они свободно диффундируют через каналы ДМТ1-белков и ферропортин. Поэтому препараты содержащие в составе двухвалентное железо, оказывают быстрый эффект и нормализуют уровень гемоглобина в среднем через 2 недели – 2 месяца, а нормализация депо железа происходит уже через 3–4 месяца от начала лечения, в зависимости от тяжести анемии и дозировки препарата. Всасывание железа из препаратов трехвалентного железа более медленное, так как необходим активный (энергозависимый) транспорт с участием феррооксидаз. Поэтому препараты, содержащие железо в трехвалентном состоянии требуют более длительного применения, а в случае дефицита меди в организме, будут неэффективны вовсе [2]. Нормализация гемоглобина при лечении препаратами трехвалентного железа наступит только спустя 2–4 месяца, а нормализация показателей депо железа через 5–7 месяцев от начала терапии.
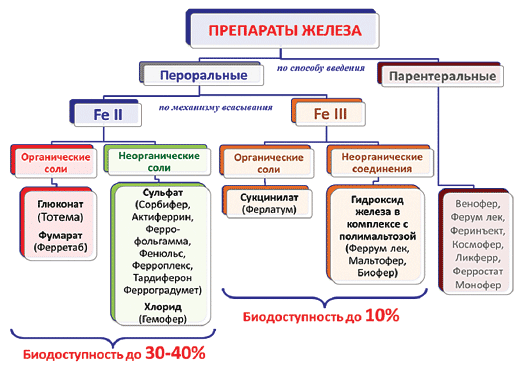
Рис. 1. Классификация препаратов железа зависит от используемой дозировки. Чем выше доза.
Степень доступности железа отражается и на частоте побочных эффектов. Уменьшить побочные действия пероральных таблетированных ПЖ на желудочно-кишечный тракт можно, принимая железо с едой, но за счет уменьшения всасывания, или можно использовать формы с замедленным высвобождением [5], так же с потерей эффективности, так как часть препарата будет высвобождаться в нижних отделах кишечника, где железо практически не всасывается. Несмотря на рекомендации ВОЗ по применению для лечения ЖДА препаратов двухвалентного железа, как более эффективных, препараты с низкой биодоступностью на основе трехвалентного железа, активно применяются благодаря их лучшей переносимости [8, 9]. Однако это не всегда оправдано, поскольку есть данные о неэффективности применения полимальтозного комплекса гидроксида железа III (ПКГЖ), даже при длительном лечении (от 4 до14 месяцев), у значительного количества пациентов (75 (31%) из 241) [10]. Последующий перевод этих пациентов на препараты двухвалентного железа приводил к яыстрой нормализации гемоглобина [10, 11].
Частота нежелательных явлений зависит не только от степени абсорбции, но и от характеристик самой соли. Так органические соли (глюконат, фумарат) обладают лучшей переносимостью, чем неорганические (сульфат) [2, 3, 13]. Форма выпуска солевых препаратов тоже играет важную роль в переносимости (Таблица 1). Жидкие формы имеют лучшую всасываемость (до 40%), благодаря равномерному распределению по слизистой и большей поверхности всасывания, при этом, создаются меньшие локальные концентрации железа, поэтому жидкие препараты железа лучше переносятся, чем таблетированные формы [3]. Для препаратов гидроксида железа в комплексе с полимальтозой форма выпуска не имеет значения, так как гидроксид железа – это нерастворимое соединение (основной компонент «ржавчины»). Полимальтоза образует многоядерные комплексы с гидроксидным осадком, поддерживая размер частиц порядка 55 кДа и предотвращая дальнейшее наращивание ядер. По этой причине, препараты на основе гидроксида железа в комплексе с полимальтозой (ГПК) рекомендуется принимать с пищей, что улучшает их биодоступность до 8–10 % [5].
Таблица 1. Сравнительная характеристика различных форм выпуска препаратов двухвалентного железа
| Форма выпуска железосодержащего препарата | Преимущества | Недостатки | |
| твердые формы | таблетки, капсулы (Фенюльс, Актиферрин, Гемофер, Хеферол, Ферро-фольгамма) | удобно применять у взрослых оболочка маскирует неприятный вкус соли железа биодоступность выше, чем при замедленном высвобождении | нельзя делить дозу нельзя применять у детей биодоступность ниже, чем у жидких форм, и хуже переносимость, так как локальное высвобождение большого количества железа негативно влияет на слизистую |
| таблетки с замедленным высвобождением (Сорбифер дурулес, Тардиферон, Ферретаб, Ферроградумет) | биодоступность меньше зависит от приема пищи, по сравнению с обычными таблетками или жидкостями удобно применять у взрослых лучше переносимость по сравнению с обычными таблетками | часть препарата высвобождается в нижних отделах кишечника, где железо не всасывается, поэтому меньшая биодоступность, по сравнению с обычными таблетками (при приеме натощак) и жидкими формами нельзя делить дозу нельзя применять у детей | |
| жидкие формы | питьевой раствор, сироп, капли (Тотема, Актиферрин, Гемофер, Фенюльс) | равномерно распределяется по слизистой, обеспечивая большую поверхность всасывания и меньшие локальные концентрации, поэтому лучше всасывается и более безопасна дозу можно делить удобно применять и у детей, и у взрослых можно развести в любимом соке | больше требований к вкусу препарата выше вероятность окрашивания эмали зубов (лучше принимать через трубочку) с осторожностью применять у диабетиков, из-за наличия в составе сахаров. |
Переносимость и эффективность препаратов также тем сильнее эффект и хуже переносимость. Рекомендуемая доза элементарного железа для лечения железодефицита составляет 100–200 мг в день. Более высокие дозы не должны назначаться, так как всасывание достигает предела, а побочные эффекты усиливаются (1А). [4] Дополнительные компоненты также влияют на эффективность и переносимость ПЖ. Некоторые комбинации способствуют лучшему всасыванию (витамин С, D,L-серин, медь, марганец) и улучшают переносимость (медь, марганец), другие решают проблемы сочетанного дефицита (витамин В12, фолиевая кислота, медь), приводящего к анемии (Таблица 2).
Таблица 2. Наиболее часто встречающиеся комбинации в составе антианемических препаратов
| Состав препарата | Дополнительные функции | Торговое наименование | |
| монопрепараты железа | – | Хеферол, Ферроградумет, Мальтофер, Ферум лек, Биофер, Гемофер | |
| комбинированные препараты железа | + витамин С | увеличение всасывания железа | Сорбифер дурулис, Тардиферон, Фенюльс 100, Ферроплекс, Фенюльс, Ферро-фольгамма |
| + D,L -серин | увеличение всасывания железа | Актиферрин | |
| + фолиевая кислота | лечение фолиеводефицитных анемий | Ферретаб, Ферро-фольгамма, Актиферрин композитум, Гино-Тардиферон, Мальтофер Фол, Ферлатум Фол, | |
| + витамин В12 | лечение В12-дефицитных анемий | Ферро-фольгамма, Ферровит, Фенюльс-цинк | |
| + медь | увеличение всасывания и утилизации железа; лечение рефрактерных железодефицитных анемий, связанных с дефицитом меди антиоксидантное действие | Тотема | |
| + марганец | инициирует созревание транспортных белков железа; участие в трансферрин-опосредованном транспорте железа внутрь клеток; улучшение синтеза гемоглобина (регуляция уровня железа в митохондриях); антиоксидантная защита митохондрий | Тотема | |
Наиболее частыми нежелательными явлениями при приеме железосодержащих препаратов являются диспепсии (запоры, тошнота, рвота, диарея, боль в животе). Механизм возникновения запора связан с тем, что железо связывает в кишечнике сероводород, являющийся физиологическим стимулятором перистальтики. Кроме того, при взаимодействии сульфата железа с сероводородом образуется нерастворимый сульфид железа, оседающий на слизистой оболочке кишечника и препятствующий её раздражению, способствующему перистальтике [12]. Это может стать серьезным препятствием при лечении анемии у беременных, поскольку они и без того часто страдают запорами, особенно в III триместре. Потемнение эмали зубов, также связывают с взаимодействием (особенно при длительном приеме) железа с сероводородом, который может содержаться в полости рта (при кариесе зубов и др.). Поэтому, после приема препаратов железа следует тщательно полоскать рот, а жидкие препараты принимать через трубочку. Что касается тошноты и рвоты, то, как правило, эти явления наиболее выражены в первые дни лечения препаратами и после адаптации организма к поступлению большого количества железа могут уменьшиться или исчезнуть вовсе.
Отдельно необходимо рассмотреть механизмы повреждающего действия железа на слизистую ЖКТ и другие ткани. Известно, что ионы Fe2+ способны активировать реакции образования свободных радикалов в биологических системах. Эти процессы присутствуют в норме и играют важную роль в ряде жизненно важных процессов, например, в механизме иммунной защиты. Так реакция образования свободных радикалов при участии железа и перекиси водорода, используется фагоцитирующими клетками (макрофаги, нейтрофилы, моноциты) для повреждения чужеродных клеток. В нормальных условиях свободно-радикальные процессы нейтрализуются системой антиоксидантов, наиболее важными составляющими которой являются Cu-Zn-супероксиддисмутаза, Mnсупероксиддисмутаза (в митохондриях), каталаза, глютатион-пероксидаза, глютатион, токоферолы и β-каротин. Церрулоплазмин (содержит 6-8 ионов меди) и трансферрин образуют антиоксидантную систему сыворотки крови, действие которой основано на окислении ионов Fe2+ и связывании Fe3+, а также на взаимодействии этих белков с кислородными радикалами. Существует три типа свободно-радикальных реакций с участием железа: при взаимодействии 2-х валентного иона железа с перекисью водорода (присутствует во всех клетках и средах, особенно в очагах воспаления); при взаимодействии Fe2+ с кислородом (в норме один эритроцит производит в среднем 107 суперокисленных анионов в день), а также при контакте с органическими гидроперекисями (гидродиоксидами) в частности с гидрооксидами липидов мембран с образованием гидроксида и липоксидрадикала [15, 16]. Интересным фактом, обнаруженным в последнее время, является то, что хотя процесс активации перекисного окисления липидов (ПОЛ) запускается ионами Fe2+, присутствие ионов Fe3+ ускоряет реакции ПОЛ, причем максимальная скорость реакции наблюдалась при соотношении Fe2+/ Fe3+=1 [15]. При снижении антиоксидантной защиты происходит сдвиг в сторону избыточного накопления свободных радикалов и их повреждающее действие на клетки. Так, при дефиците железа происходит снижение активности гем-содержащего фермента каталазы, а при снижении гемоглобина также страдает обеспечение тканей кислородом. В условиях гипоксии все элементы электрон-транспортной цепи находятся в восстановленном состоянии из-за отсутствия терминального акцептора электронов – кислорода. В этих условиях активируется восстановление Fe3+ и активизация ПОЛ [15].
Что же происходит при лечении анемии препаратами содержащими только железо? (Рисунок 2.) При поступлении большого количества железа из препаратов, снижается синтез антиоксидантного фермента Mn-супероксиддисмутазы, так как железо конкурирует с марганцем за участок связывания на уровне транскрипции этого фермента [16]. Учитывая, что на фоне предшествующего дефицита железа, уже снижена активность каталазы, а на фоне гипоксии повышено ПОЛ, то дополнительное снижение антиоксидантной защиты приводит к активному повреждению тканей, контактирующих с ионами железа, а это в первую очередь слизистые ЖКТ, печень и молодые эритроциты.
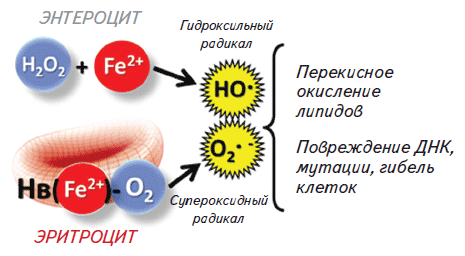
Рис. 2. Проблемы, возникающие при лечении ЖДА препаратами, содержащими только железо
Единственным антианемическим препаратом, содержащим сразу три синергидных элемента (Fe, Cu, Mn) является Тотема (производитель «Лаборатория Иннотек Интернасиональ» Франция) способный не только восполнить недостающее при анемии железо, но и усилить антиоксидантную защиту. Высокий лечебный эффект Тотема связан с несколькими особенностями препарата – это жидкая форма, улучшающая распределение препарата по слизистой кишечника, и наличие металлов меди и марганца, которые играют важную роль в метаболизме железа и входят в активные центры супероксиддисмутаз. Наличие меди и марганца в препарате Тотема не только увеличивает биодоступность железа, что позволяет снизить эффективную дозу, но также нормализует усвоение железа тканями и блокирует образование свободных радикалов, как за счет быстрой элиминации 2-х валентных ионов железа с помощью церулоплазмина (медь-зависимая феррооксидаза), так и за счет активации антиоксидантной защиты (в составе супероксиддисмутаз) (Рис. 3).
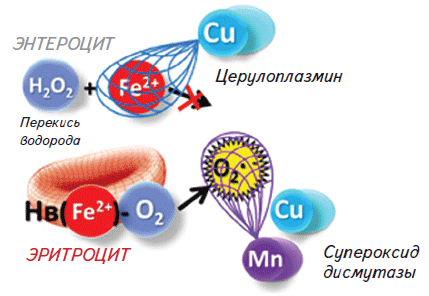
Рис. 3. Роль меди и марганца в антиоксидантной защите
Результаты сравнения эффективности лечения жидким глюконатом Fe II в комбинации с глюконатом Cu и Mn (Тотема) и таблетированной формы с замедленным высвобождением сульфата железа II в комбинации с витамином С (Сорбифер дурулес)
В исследование принимало участие 19 женщин с железодефицитной анемией, развившейся в результате хронической кровопотери на фоне аденомиоза и гиперплазии эндометрия. Лечение проводилось на фоне основного заболевания при продолжающейся кровопотере. Пациентки были разделены на две группы, сопоставимые по возрасту, заболеванию, и тяжести анемии. 1-я группа (11 женщин, средний возраст 33+7 лет) получала комбинацию глюконата железа+медь+марганец по 2 ампулы в день, что соответствует дозе 100 мг Fe в сутки. 2-я группа (8 женщин, средний возраст 34+8 лет) – комбинацию сульфата железа с витамином С по 2 таблетки в день, что соответствует дозе 200 мг Fe в сутки. Результаты исследования представлены на рисунке 4. Было показано, что в обеих группах показатели гемоглобина и сывороточного железа через 1 и 3 месяца терапии были сопоставимы, несмотря на различие применяемых дозировок, при этом показатели ферритина через 3 месяца лечения достоверно отличаются (р=0,05) , причем в 1-ой группе, применявшей низкие дозы препарата Тотема они выше (20,5+11,9 мкг/л) по сравнению с группой применявшей высокие дозы препарата Сорбифер Дурулес (12,6+3,9 мкг/л).
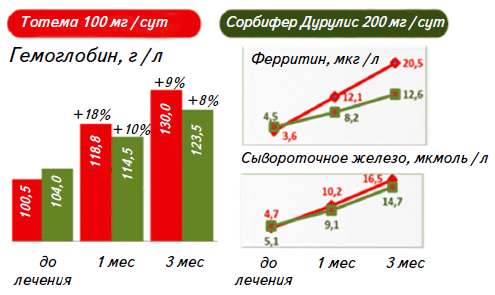
Рис. 4. Сравнение эффективности применения низ их доз жидкого препарата глюконата железа II, меди и марганца и высоких доз таблетированного сульфата железа II с витамином С при лечении ЖДА легкой степени тяжести [17] β. Сравнение результатов исследований безопасности применения различных железосодержащих препаратов. Различие в переносимости Тотема и ПМКЖ и ПСЖ – не достоверно (0,1<р<0,25 и 0,75<р<0,9 соответственно), а в сравнении с сульфатом железа достоверно (р<0,005)
Результаты сравнения переносимости препаратов железа по данным трех мета-анализов
Проведенный нами мета-анализ 30 исследований (1077 пациентов) показал хорошую переносимость Тотема [12]. Полученная средняя частота нежелательных явлений составила 10,4% (112 пациентов). Побочные явления, в основном, были представлены легкими, непродолжительными диспепсическими реакциями (8,5%), не требующими отмены препарата. Реже встречались аллергические реакции в виде необильной сыпи – 0,7% и потемнение эмали зубов – 1,0%. Только 1,1% пациентов были вынуждены отказаться от дальнейшего приема Тотема.
Сравнение данных безопасности применения препарата Тотема с величинами, полученными в мета-анализе пяти сравнительных исследований полимальтозного комплекса гидроксида железа III (289 пациентов) и сульфата железа II (208 пациентов) [8], и в мета-анализе трех сравнительных исследований протеинсукцинилата железа III (890 пациентов) и сульфата железа II (634 пациента) [9] показало, что Тотема обладает лучшей переносимостью, чем сульфат железа II (34,1% и 20%; р<0,005) и сравнимой переносимостью по отношению к препаратам трехвалентного железа (полимальтозный комплекс гидроксида железа III (14,9%; 0,1 < р < 0,25), протеин сукцинилат железа III (9,4%; 0,75<р<0,9). (Рис.5)
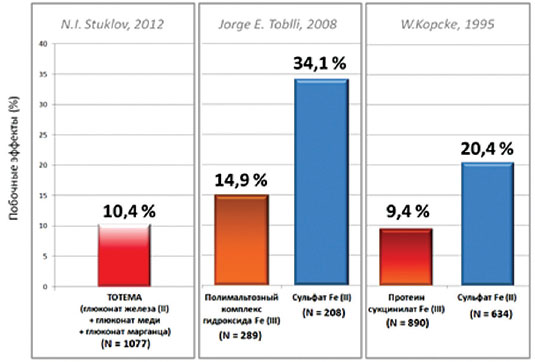
Рис. 5. Сравнение результатов исследований безопасности применения различных железосодержащих препаратов. Различие в переносимости Тотема и ПМКЖ и ПСЖ – не достоверно (0,1<р<0,25 и 0,75<р<0,9 соответственно), а в сравнении с сульфатом железа достоверно (р<0,005)
Отдельно сравнивали частоту запоров, поскольку это очень важно для беременных, которые довольно часто страдают запорами (особенно в III триместре) и данный побочный эффект может значительно снизить комплаэнтность, а также провоцировать обострение геморроя. Частота запоров при применении Тотема (24 исследования, 841 пациент) достоверно отличалась и составила всего 0,83% (р Препарат Тотема выпускается в жидкой форме (питьевой раствор в ампулах). Для жидких форм очень важны вкусовые качества лекарства, так как это может существенно сказаться на приверженности пациентов к лечению, учитывая необходимость длительного (три и более месяцев) приема. Поэтому дополнительно было проведено исследование органолептических свойств Тотема. При опросе 131 взрослого больного неприятный вкус выявлен только у 11 (8,4%) больных, причем при сравнении с аналогичным исследованием у 35 беременных не получено статистических отличий, только 4 (11,4%) отметили неприятный вкус препарата. Что касается детской аудитории, то выявлено только 3 ребенка и подростка с задокументированным отрицательным отзывом на вкусовые качества препарата Тотема, что составило 2,4% из 104 пациентов.
Выбирая препарат немаловажно учитывать стоимость лечения. Необходимо чтобы пациент смог довести лечение до конца, поэтому и расчеты стоимости надо проводить с учетом длительности курса, а также рекомендованных производителем дозировок. Если сравнить средний курс лечения наиболее часто применяемых препаратов в минимальной лечебной дозировке (в соответствии с инструкцией к конкретному препарату), то получается, что лечение сульфатом железа II в разы дешевле, чем лечение препаратами железа III, а глюконат железа, меди и марганца (препарат Тотема) имеет среднюю ценовую категорию (Таблица 3). Оптимальный выбор складывается из совокупности критериев: эффективности (как быстро нормализуются показатели гемоглобина и депо железа), переносимости (влияет на приверженность к лечению) и стоимости всего курса терапии.
Таблица 3. Сравнение стоимости курсов лечения наиболее часто используемых препаратов. По данным сайта www.medlux.ru по состоянию на 14 февраля 2014 г.
| Торговое наименование препарата/ страна производитель | Форма выпуска | Рекомендуемая лечебная доза в сутки | Средняя длительность курса до нормализации ДЕПО железа | Средняя цена упаковки ((min+max)/2) | Среднее количество упаковок на курс лечения анемии | Средняя стоимость курса лечения |
| Фенюльс, Индия | капсулы № 30 | 2 капсулы | 3 месяца | 129 р. | 6 | 774 р. |
| капсулы № 10 | 71 р. | 18 | 1 278 р. | |||
| Сорбифер Дурулис, Венгрия | таблетки с замедленным высвобождением № 50 | 2 таблетки | 375 р. | 4 | 1 500 р. | |
| таблетки с замедленным высвобождением № 30 | 302 р. | 6 | 1 812 р. | |||
| ТОТЕМА, Франция | питьевой раствор в ампулах № 20 | 2–4 ампулы | 285 р. | 9 | 2 565 р. | |
| Феррум лек, Словения | таблетки жевательные 100 мг №30 | 2–3 таблетки | 6 месяцев | 360 р. | 12 | 4 320 р. |
| сироп 50 мг/5 мл, фл.100 мл №1 | 20–30 мл | 142 р. | 36 | 5 112 р. | ||
| Мальтофер, Швейцария | таблетки жевательные 100 мг №30 | 2–3 таблетки | 350 р. | 12 | 4 200 р. | |
| р-р для приема внутрь во флаконах № 10 | 2–3 флакона | 485 р. | 36 | 17 460 р. | ||
| Ферлатум, Испания | р-р для приема внутрь во флаконах № 20 | 2 флакона | 855 р. | 18 | 15 390 р. | |
| р-р для приема внутрь во флаконах № 10 | 656 р. | 36 | 23 616 р. |
Заключение
Выбор ПЖ для лечения ЖДА с учетом индивидуальных особенностей пациента – задача непростая. В конечном итоге эффективность лечения ЖДА зависит не только от биодоступности применяемого препарата, но и от приверженности пациента к лечению. В свою очередь приверженность снижается при плохой переносимости препарата. Так широко применяемые сульфаты, часто вызывают запоры, что может послужить отказом от назначенной терапии, особенно у беременных. Стоимость препаратов трехвалентного железа значительно выше, но из-за низкой эффективности лечение должно продолжаться не менее полугода, а иногда и год, что делает лечение еще более дорогим, и также может послужить причиной отказа от терапии. Уникальный состав препарата Тотема (глюконат железа II, меди и марганца) обеспечивает высокую эффективность лечения, как у сульфата железа II; хорошую переносимость, как у ГПК и сукцинилата железа III и при этом Тотема имеет оптимальную стоимость. Все это может обеспечить хорошую комплаентность пациентов. Более того, мультиэлементный препарат Тотема в 10 раз реже вызывает запоры, чем полимальтозный комплекс железа и в 19 раз реже, чем сульфаты. Это может быть очень важным фактором при выборе железосодержащего препарата для лечения ЖДА у большинства пациентов, особенно беременных женщин, которые довольно часто страдают запорами.
Рекомендации производителя по использованию жидкой формы глюконата железа II, меди и марганца (Тотема)
Для минимизации вероятности появления нежелательных явлений при приеме препарата Тотема желательно выполнять следующие рекомендации:
- принимать препарат за 30 минут до начала приема пищи или спустя 2 часа после еды,
- для лучшего всасывания и снижения возможных нежелательных явлений со стороны желудочнокишечного тракта рекомендуется разбавлять содержимое ампулы в минимум 100 мл воды или сока,
- начинать прием препарата (первые 1–2 дня) с минимальных доз 50 мг (1 ампула), затем постепенно увеличивать дозу до необходимой лечебной 100–200 мг (зависит от тяжести дефицитного состояния и переносимости) и принимать в лечебной дозе до нормализации уровня гемоглобина. Далее перейти на профилактическую дозировку до нормализации показателей депо железа. Полный курс лечения, как правило, составляет 2–4 месяца в зависимости от первоначальной тяжести железодефицита или до достижения уровня ферритина более 30 мкг/л.
- по возможности принимать препарат через трубочку или споласкивать ротовую полость сразу после приема препарата, чтобы снизить вероятность окрашивания эмали зубов.
Литература
- Коноводова Е.Н. Железодефицитные состояния: когда и кому назначать Тотему? // Поликлиника. 2012; 5: 1-5
- Громова О.А., Торшин И.Ю., Хаджидис А.К. Анализ молекулярных механизмов воздействия железа (II), меди, марганца в патогенезе железодефицитной анемии. // Клиническая фармакология и фармаэкономика. 2010; 1: 1-9.
- Goddard A.F., James M.W., Mclntyre A.S., Scott B.B. Guidelines for the management of iron deficiency anaemia. // British Society of Gastroenterology. 2011.
- UK guidelines on the management of iron deficiency in pregnancy British Committee for Standards in Haematology. July 2011.
- Harju E. Clinical Pharmacokinetics of Iron Preparations // Clin.Pharmacokinet. 1989; 17(2): 69-89.
- Palacios Santiago. Ferrous versus Ferric Oral Iron Formulations for the Treatment of Iron Deficiency: AClinical Overview. // The Scientific World Journal. 2012; Vol.2012, Article ID 846824
- Nielsen P., Gabbe E.E., Ficher R., Heinrich Н.С. Bioavailability of iron from oral ferric polymaltose in humans // Arzneimittel-Forschung/ Drug Research. 1994; 44(6): 743-8.
- Jorge E.Toblli, Reto Brignoli Полимальтозный комплекс гидроксида железа (III) при железодефицитной анемии. Обзор и метаанализ. // Анемия. Журнал рабочей группы по анемии. 2008; Приложение к №1: 95-104.
- Kopcke W., Sauerland M.C. Мета-анализ данных эффективности и переносимости железа протеинсукцинилата при лечении пациентов с железодефицитной анемией разной степени тяжести. // Arzneimittel- Forchung/Drug Research. 1995; 45(II), 11: 1211-6.
- GuillermoJ. Ruiz-Arguelles, Angeles Diaz-Hernandez, Carlos Manzano, GuillermoJ. Ruiz-Delgado. Ineffectiveness of oral iron hydroxide polymaltose in iron-deficiency anemia // Hematology. June 2007; 12(3): 255-256.
- Mehta BC. Iron (III) hydroxide polymaltose isineffective iv treatment of iron deficiency anemia. // Medical Image. 2001; 25: 36-7.
- Стуклов Н.И., Мета-анализ данных переносимости питьевой формы глюконата железа (II), меди и марганца (препарат Тотема) при лечении железодефицитной анемии у детей и взрослых. // Земский врач. 2012; 4(15): 11-20.
- Casparis D., Del Carlo P., Braconi F., Grossi A., Merante D., Gafforio L. Effectiveness and tolerability of oral liquid ferrous gluconate in irondeficiency anemia in pregnancy and in the immediate poste-partum period: comparison with other liquid or solid formulations containing bivalent or trivalent iron. // Minerva Ginecol. 1996; Nov, 48(11): 511-8
- Машковский М.Д. Пособие для врачей. Лекарственные Средства. // Харьков «Торсинг». 1997; Том 2: 156-161
- Владимиров Ю.А. и соавт., Свободные радикалы в живых системах. // ВИНИТИ Итоги науки и техники. Москва. 1991; Биофизика, Том 29: 1-250
- Davis C., Greger J.L., Longitudinal changes of manganese-dependant superoxide dismutase and other indexes of manganese and iron in women. // Am. J. Clin. Nutr. 1992; 55: 747-752
- Семенова Е., Кунина М., Стуклов Н., Роль меди и марганца в метаболизме железа. // Врач. 2013; №12: 47-52
