Остеоартроз и остеоартрит – патоморфоз названия и прогресс знаний о болезни
СтатьиОпубликовано в журнале:
РМЖ РЕВМАТОЛОГИЯ № 23, 2011
Хитров Н.А.ФГУ
«ЦКБ с поликлиникой» Управления делами Президента РФ, Москва
«Как корабль назовешь, так он и поплывет».
Поговорка
На протяжении всей истории медицины в названия болезней закладывалась топическая принадлежность, особенности патогенеза данного заболевания (воспалительный, сосудисто-трофический характер и т.д.) - например, пиелонефрит, инфаркт миокарда, цирроз печени… «Правильность» названия болезни помогала врачу разработать верный путь лечения больного с данной нозологией: посоветовать нужный режим, рекомендации по питанию; выбрать тактику медикаментозной терапии: противовоспалительной, сосудистой, метаболической и т.д. Само название болезни часто «узаконивала» для врача (и для пациента тоже) верность или неверность выбранной тактики лечения, повышала комплайнс - сотрудничество в лечении между врачом и пациентом.
По мере развития научных знаний о сущности патогенетических процессов при различных заболеваниях рождаются новые, не известные ранее нозологические формы. И так будет всегда: по мере развития медицинских представлений о сути болезни будут пересматриваться и их названия.
Остеоатроз (ОА) (или остеоартрит, как называется данное страдание в англоязычной литературе) длительное время считался «золушкой в ревматологии». «Никакая другая болезнь так не затрудняет ходьбу, подъем по лестнице и другие движения, выполняемые нижними конечностями, как ОА. Пациенты с ОА тратят больше времени и сил на выполнение своих ежедневных обязанностей, у них меньше времени остается на отдых. Они очень зависимы от своих родственников и близких, и им требуется больше денег на медицинскую помощь и поддержание здоровья, чем людям того же пола и возраста из общей популяции», - писали E. Yelin и L.F. Callahan в 1995 г.
ОА не уделялось должного внимания как в частных этиопатогенетических механизмах развития болезни, так и в общемедицинских воззрениях на данную болезнь. Именно недопониманием многих существенных моментов и специфических особенностей ОА объясняется, в частности, то, что в настоящее время в России одна и та же болезнь называется то остеоартрозом, то остеоартритом.
Еще в 1911 г. T. Muller предложил выделить группу заболеваний суставов дегенеративно-дистрофической природы, как «arthrosis deformans», где ОА отводилось ведущее место. Сегодня ОА является одним из самых частых суставных заболеваний и приводит к значительным материальным затратам на лечебно-реабилитационные мероприятия и в конечном счете во многом определяющим качество жизни прежде всего пожилых людей, у которых ОА встречается наиболее часто. ОА сыграл немалую роль в том, что Всемирная Организация Здравоохранения посвятила первую декаду нового тысячелетия (2000-2010 гг.) изучению заболеваний костно-суставной системы.
ОА традиционно определялся, как «хроническое прогрессирующее невоспалительное заболевание суставов неизвестной этиологии, характеризующееся дегенерацией суставного хряща и структурными изменениями субхондральной кости, а также явно или скрыто протекающим умеренно выраженным синовитом» [1]. В последние годы произошел «коперниковский поворот» в воззрениях на ОА. Ранее заболевание расценивалось, как стигма старения организма в целом и сопутствующей этому процессу дегенерации суставных структур, в частности. В настоящее время ОА воспринимается, как агрессивный катаболизм суставного хряща, требующий активного хондропротективного лечения [2-4].
Сегодня за ОА принимается гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц [5]. Вторичные воспалительные процессы (и прежде всего синовит) сопровождают течение ОА, играют значительную роль, как в формировании клиники болезни, так и в дальнейшей деструкции суставных структур [5,6].
В данном определении примечательны следующие моменты. Во-первых, ОА расценивается, как группа нескольких заболеваний. Наверняка, в недалеком будущем из ОА отдельно выделятся полиостеоартроз межфаланговых суставов кистей, передающийся по наследству в основном по женской линии; гонартроз, часто возникающий в менопаузу у женщин и связанный с возникающей в этот момент эстрогенной недостаточностью; различные вторичные (прежде всего посттравматические артрозы) и многие другие формы ОА.
Во-вторых, пока не установлено, что является первичным эпицентром поражения при ОА - гиалиновый хрящ или субхондральная кость. Суставной хрящ не имеет ни кровеносных сосудов, ни нервных окончаний, и нет ясности в том, как протекает иннервация хряща и, особенно, его трофика: из синовиальной жидкости или из субхондральной кости? Поэтому не исключено, что первичным субстратом поражения в суставе при ОА является подлежащая под гиалиновым хрящом кость, а суставной хрящ страдает вторично, так как недополучает адекватного питания из подхрящевого отдела кости.
Все больше и больше уделяется внимание суставу - не как совокупности костных суставных поверхностей, хрящевых структур, синовиальной жидкости, суставной капсулы и параартикулярного аппарата, а как единому органу с присущими ему едиными нейротрофическими, метаболическими, иммунными и функциональными составляющими.
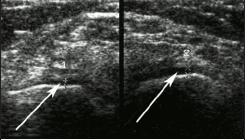
Морфологические изменения при ОА отмечаются во всех суставных структурах, прежде всего в гиалиновом хряще в виде истончения, потери эластичности, разволокнения. Данные изменения хряща представлены на рисунке 1, где при ультразвуковом исследовании (УЗИ) коленного сустава гиалиновый хрящ (отмечен стрелками), покрывающий мыщелок бедренной кости при ОА, истончен, неоднороден, тускл, гипоэхогенен (1 - слева), в сравнении с хрящом здорового контрлатерального коленного сустава (2 - справа).
| Рис. 1. Гиалиновый хрящ коленного сустава, выстилающий суставную поверхность бедренной кости (стрелки) при ОА – (1), в сравнении с нормой – (2) при ультразвуковом исследовании |
 |
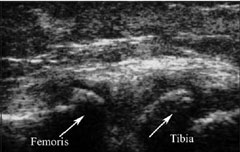
Изменения при ОА отмечаются в интра- и параартикулярных связках, сухожилиях в виде лигаментитов, теносиновитов, энтезитов; в виде гипо- и атрофий параартикулярных мышц; бурситов околосуставных сумок; в субхондральной костной ткани в виде остеосклероза, нарушения конгруэнтности суставных поверхностей, формирования краевых остеофитов, хорошо видимых при рентгенологическом и УЗИ суставов (рис. 2).
| Рис. 2. Остеофиты (стрелки) по краям тибиофеморального сочленения при ультразвуковом исследовании коленного сустава при остеоартрозе |
 |
В-третьих, в последних определениях ОА все больше и больше размываются понятия об основных механизмах, ведущих к поражению суставных тканей - дегенеративно-дистрофических процессах или воспалительном синовите, который в конечном итоге определил в англоязычной литературе название болезни как остеоартрит. Значение синовита при ОА подлежит дальнейшему изучению. Синовит при ОА усиливает деструкцию суставных структур. Активизирующиеся при синовите различные медиаторы воспаления: цитокины, интерлейкины, фактор некроза опухоли, простагландины, металлопротеиназы, супероксидные радикалы, оксид азота и многие другие пагубно, деструктивно влияют на различные суставные структуры, и прежде всего на гиалиновый хрящ, усиливая в них катаболические - разрушительные процессы [7,8]. Главная опасность синовита при ОА состоит в его деструктивном действии на хрящ за счет активации литических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментноклеточных реакций, которые усиливают катаболические процессы в структурах сустава.
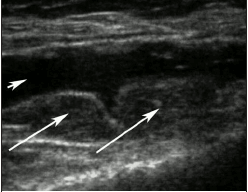
Утяжеление ОА характеризуется обострением/усилением вторичного синовита сустава, когда увеличивается боль, припухлость сустава из-за скопления в его полости воспалительной жидкости, ухудшения подвижности в нем. Воспалительная жидкость и воспаленная утолщенная синовиальная оболочка, выстилающая полость суставной капсулы при синовите, хорошо видна при УЗИ суставов (рис. 3). Длинными стрелками указаны утолщения синовиальной оболочки в верхнем завороте коленного сустава, хорошо визуализируемые на фоне гиперпродукции анэхогенной гомогенной синовиальной жидкости - короткая стрелка.
| Рис. 3. Синовит при остеоартрозе коленного сустава (объяснения в тексте) |
 |
Синовит при ОА занимает значимое место не только в патогенезе болезни, но и в клинической картине заболевания, резко усугубляя ее и вынуждая больного обращаться за врачебной помощью. Клиника ОА во многом определяется болевым синдромом, который имеет различные проявления при ОА.
Боль при ОА носит неоднородный характер. В целом для ОА характерен механический ритм болей - возникновение боли под влиянием физической нагрузки и стихание ее за период отдыха, что связано со снижением амортизационных способностей хряща и подхрящевых костных структур при нагрузках.
Возможны ночные боли, связанные с венозным стазом и повышением кровяного внутрикостного давления в спонгиозной прихрящевой части кости. Нередко боли в пораженных суставах усиливаются под влиянием неблагоприятных метеорологических условий - высокого атмосферного давления, низкой температуры, повышения влажности, которые могут воздействовать на интраартикулярные рецепторы.
Кратковременная «стартовая боль» возникает при первых движениях после покоя и вскоре проходит на фоне двигательной активности. Стартовые боли обусловлены трением суставных поверхностей, на которых оседает детрит - продукт разрушения хрящевой ткани. После нескольких движений в суставе детрит выталкивается в завороты суставной сумки и боли прекращаются.
Возможна так называемая «блокада сустава» - быстро развивающийся резко выраженный болевой синдром вследствие ущемления «суставной мыши» - костного или хрящевого фрагмента между суставными поверхностями. При этом боль лишает больного возможности выполнять малейшие движения в данном суставе. Блокаде коленного сустава часто способствует параллельно развивающаяся при ОА дегенеративная менископатия.
Боли при движении, «стартовая» боль и «блокада сустава» объясняются нарушениями кинематики сустава, поэтому в покое данная болезненность, как правило, уменьшается. ОА - первично хроническое заболевание. Человек, у которого возник артроз, обречен страдать им навсегда и сталкивается с суставной болью в течение всей жизни. В данных случаях боль носит охранительный характер и, как «сторожевой пес здоровья», определяет лечебный щадящий двигательный режим для больного, является своего рода индикатором адекватности физической нагрузки на суставы.
Иной механизм боли формируется при синовите. При синовите появляется постоянная боль, связанная с длительной сенситизацией ноцицепторов в процессе воспаления. Данную боль, которой сопутствуют утренняя скованность, припухлость сустава, локальное повышение кожной температуры, можно трактовать как хроническую, которая в сочетании с вегетативными, психологическими и эмоциональными факторами теряет приспособительное биологическое значение.
Синовит при ОА характеризуется повышенным образованием провоспалительных цитокинов, простагландинов, фактора некроза опухоли, лизосомальных ферментов, металлопротеиназ и других ферментов, которые не только поддерживают воспаление в суставе, но и усиливают катаболические процессы в хрящевой и субхондральной костной ткани сустава. Сложная сеть взаимодействий цитокинов, ферментов, свободных радикалов и продуктов распада матрикса приводит к уменьшению содержания протеогликанов в хряще - (молекулярный уровень), нарушению архитектоники матрикса - (макромолекулярный уровень), появлению микротрещин - (микроскопический уровень) и надрывам хряща - (макроскопический уровень).
При этом пункция сустава с эвакуацией воспаленной синовиальной жидкости и последующим введением глюкокортикоидов (ГК) при ОА дает патогенетически обусловленный положительный эффект (рис. 4).
| Рис. 4. Вид синовиальной жидкости при остеоартрозе |
 |
Синовит побуждает врача (и больного) к проведению противовоспалительного лечения, которое и сегодня сохраняет свое значение, как «краеугольный камень» в курации данной болезни, несмотря на активное внедрение хондропротективной терапии. Противовоспалительная терапия не только снимает тягостный для пациента симптом суставной боли, но и устраняет другие симптомы воспаления при ОА: припухлость, гипертермию сустава, улучшает его функцию. Более важный смысл противовоспалительной терапии при ОА заключается в ингибиции провоспалительных цитокинов и за счет этого уменьшении катаболических процессов суставных структур [9].
Это обусловливает лечение синовита и хронического болевого синдрома препаратами, подавляющими воспаление, к которым в первую очередь относятся нестероидные противовоспалительные препараты (НПВП). Для лечения болевого и воспалительного синдрома при обострении ОА коленного сустава был выбран Амелотекс (международное непатентованное название - мелоксикам), НПВП, относящийся к классу оксикамов, производных энолиевой кислоты. Амелотекс селективно ингибирует ферментативную активность ЦОГ-2, чем подавляет синтез провоспалительных простагландинов в области воспаления в большей степени, чем физиологических простагландинов [10-12].
В основную группу, леченную Амелотексом, вошли двое мужчин и 13 женщин (средний возраст 61,3±9,4 лет), с давностью заболевания 6,5±4,3 года, преимущественно II и III рентгенологической стадии по Kellgren. Контрольную группу составили трое мужчин и 12 женщин (средний возраст 59,7±8,5 лет), с давностью болезни 5,8±3,9 года, также преимущественно II и III рентгенологической стадии по Kellgren. Таким образом, основная и контрольная группы сопоставимы по полу, возрасту, давности и стадии заболевания.
В основной группе Амелотекс назначался по 1,5 мл внутримышечно 1 раз в сутки в течение 5 дней. В контрольной группе назначался диклофенак, как неспецифический НПВП по 3 мл также внутримышечно 1 раз в сутки в течение 5 дней [13-15]. На фоне лечения как Амелотексом, так и диклофенаком другая терапия не проводилась, кроме стандартных рекомендаций по режиму. Также другие методы лечения в обеих группах не использовались в течение 2 недель до начала лечения Амелотексом и диклофенаком. Внутрисуставные и параартикулярные инъекции ГК не проводились пациентам за 1 месяц до начала терапии внутримышечными НПВП.
На фоне проведенного лечения как Амелотексом, так и диклофенаком у значительного большинства пациентов уменьшилась боль в суставе, что выражалось улучшением самочувствия, повышением настроения, уменьшением раздражительности и нормализацией сна (прежде всего за счет уменьшения ночных болей).
До начала лечения Амелотексом боль по оценке больных по ВАШ равнялась 72,5±8,2 мм, в конце лечения боль составила 32,7±4,6 мм. До начала лечения диклофенаком боль равнялась 68,7±6,3 мм, в конце лечения боль уменьшилась до 31,6±5,3 мм, т.е. в обеих группах в процессе лечения боль достоверно уменьшилась (p<0,01). Средняя окружность больного коленного сустава в основной группе изначально составила 43,5±3,2 см, в конце лечения уменьшилась до 42,1±3,2 см. Средняя окружность сустава в контрольной группе уменьшилась с 43,2±3,5 до 42,3±3,6 см. Объем сгибания в коленном суставе в среднем в основной группе изначально равнялся 97,3±9,4о, а через 5 дней - 128,1±8,4о. Средний объем сгибания в контрольной группе увеличился со 101,4±9,5о до 133,3±8,7о.
Уменьшение болей и увеличение амплитуды движений в суставе привели к положительной динамике индекса WOMAC, сопоставимого в обеих группах. До лечения суммарный индекс WOMAC в основной группе составил 651,6±136,3 мм, а в конце лечения снизился до 423,4±119,4 мм. Индекс WOMAC в контрольной группе уменьшился с 611,4±142,4 мм до 409,2±103,5 мм.
По окончании лечения Амелотексом значительное улучшение отметили 8 больных, улучшение - 6, отсутствие динамики - 1 больной. На фоне терапии диклофенаком значительное улучшение отметили 6 больных, улучшение - 7, отсутствие динамики - 2 больных. Отрицательной динамики при лечении пациентами обеих групп не отмечено.
При лечении диклофенаком у 1 больной отмечалось повышение артериального давления, потребовавшее дополнительной медикаментозной коррекции. У 1 больной при лечении диклофенаком отмечены явления диспепсии, что послужило поводом для обращения за консультацией к гастроэнтерологу. Побочных явлений в основной группе, леченной Амелотексом, в том числе у 4 больных с хроническим гастритом в стадии ремиссии, не выявлено.
Показатели общего анализа и биохимических констант крови существенно не менялись в процессе лечения. Также не отмечено существенных изменений показателей общего анализа мочи. Значимых отклонений по ЭКГ в процессе исследования выявлено не было. У 6 больных основной группы и у 5 в контрольной группе отмечено значительное уменьшение количества жидкости в полости коленного сустава в конце лечения по данным УЗИ. Уменьшение жидкости в суставе вместе со снижением параартикулярных воспалительных процессов отразились на уменьшении окружности коленного сустава в процессе терапии.
Таким образом, при назначении больным, страдающим гонартрозом, 5-дневного внутримышечного курса Амелотекса отмечено его симптом-модифицирующее действие, проявившееся в снижении болевого синдрома, уменьшении припухлости в суставе, увеличении объема движений в суставе, уменьшении индекса WOMAC, сопоставимых с аналогичным лечением диклофенаком. Результаты проведенного исследования позволяют констатировать хорошую переносимость Амелотекса и его клиническую эффективность у больных ОА.
«Малое количество тем могут вызвать у слушателей такие сонливость и отчаяние, как на конференции, посвященной обсуждению проблемы остеоартрита. Область настолько бесплодна? Результат - минимальный…» - писал J. K. Spender в 1905 г. В целом, как видно из данной работы, синовит определяет патоморфогенез, клинику, качество жизни при ОА и требует активного лечения. С другой стороны, синовит при ОА не вызывает лихорадочного синдрома, симптомов хронического воспаления (слабости, психастении, анорексии, похудания, значимых изменений в анализах крови), что не позволяет ему возвыситься до роли синовита, как, например, при ревматоидном артрите.
Данные о разрушительных воспалительных процессах в артрозном суставе, ведущих к катастрофическим деструктивным процессам в нем, эффективность противовоспалительной терапии артроза склоняет нас к пересмотру названия ОА в пользу остеоартрита. Это позволит врачам «узаконить» и уточнить противовоспалительную терапию при данном процессе. С другой стороны, название болезни остеоартртрит с воспалительным окончанием на «-ит», может побудить практических врачей к ошибке сблизить данное заболевание с такими воспалительными суставными нозологиями, как ревматоидный артрит, реактивный артрит и т.д., отличающимися активной, даже агрессивной, во многом единственной, противовоспалительной терапией. Тщательное изучение различных вариантов воспаления в суставе позволят закрепить и обособить название «остеоартрит», а термин «артроз» останется частным понятием, отражающим конечные морфологические дегенеративно-деструктивные изменения в суставе при остеоартрите.
Литература
1. Ревматические болезни: Рук. для врачей / Под ред. В.А. Насоновой, Н.В. Бунчука.- М.: Медицина, 1997.- С. 385-396
2. Raisz L.G. Prostaglandins and ione: physiology and pathophysiology. Osteoarthritis Cartilage, 1999.- V. 79.- P. 83—94.
3. Laufer S., Gay S., irune K. Inflammation and Rheumatic Diseases: The molecular iasis of novel therapies. Georg Thieme Verlag, 2003.- 139 p.
4. Grushko G., Schneiderman R., Maroudas A. Some iiochemical and iiophysical parameters for the study of the pathogenesis of osteoarthritis: a comparison ietween the processes of aging and degeneration in human hip cartilage. Connec Tissue Res., 1989.- V. 19.- P 149—176
5. Ревматология: национальное руководство / Под ред. Е.Л. Насонова, В.А. Насоновой.- М.: ГЭОТАР-Медиа, 2008 .- С. 573-588
6. Hediom E., Huselmann H.J. Molecular aspects of pathogenesis in osteoarthritis: the role of inflammation. Cell Mol Life Sci., 2002 .- V. 59.- P. 45—53
7. Pickvance E.A., Oegema T.R. Jr., Thompson R.C. Immunolocalization of selected cytokines and proteases in canine articular cartilage after transarticular loading. J. Orthop. Res., 1993.- V. 113.- P. 313—323
8. Agarwal S., Long P., Seyedain A., et al. A central role for the nuclear factor-ki pathway in anti-inflammatory and proinflammatory actions of mechanical strain. FASEi J., 2003.- V. 17.- P. 899—901
9. Насонов Е.Л., Каратеев А.Е. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Русский медицинский журнал, 2006.- Т. 14.- № 25.- С. 1769-1777
10. Feldman M., McMahon A.T. Do cyclooxigenase-2 inhiiitors provide ienefits similar to those of traditional nonsteroidal anti-inflammatory drugs, with less gastrointestinal toxicity? Ann. Intern. Med., 2000.- V. 132.- P. 134-143
11. Цветкова Е.С., Панасюк Е.Ю., Иониченок Н.Г., Рубцов О.В. Перспективы применения ингибиторов циклооксигеназы-2 при остеоартрозе. Consilium medicum, 2004, Т. 6.- №2.- С. 100
12. Каратеев А.Е., Барскова В.Г. Критерии выбора нестероидного противовоспалительного препарата. Справочник практического врача, 2007.- Т. 5.- № 5.- С. 13-17
13. Gastrointestinal toleraiility of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large-scale International Study Safety Assessment. ir. J. Rheumatol., 1998
14. Valat J.P., Accardo S., Reginster J.Y. A comparison of the efficacy and toleraiility of meloxicam and diclofenac in the treatment of patients with osteoarthritis of the lumiar spine. Inflamm. Res., 2001.- V. 50.- Suppl. 1.- P. 30-34
15. Tavakoli M. Modelling therapeutic strategies in the treatment of osteoarthritis: an economic evaluation of meloxicam versus diclofenac and piroxicam. Pharmacoeconomics, 2003.- V. 21.- № 6.- P. 443-454.
