Обработка данных в исследованиях биоэквивалентности воспроизведенных лекарственных средств (на примере анализа отчета об исследовании биоэквиваленности Сперидана - рисперидона, воспроизведенного компанией Актавис, и оригинального рисперидона
Статьи
Г.В.Раменская, В.Г.Кукес
Филиал "Клиническая фармакология" HЦ БМТ РАМН, Москва
Процедура проведения исследований биоэквивалентности воспроизведенных (генерических) лекарственных средств и статистический анализ результатов регламентируется Методическими указаниями МЗиСР РФ "Проведение качественных клинических исследований биоэквивалентности лекарственных препаратов". Требования, описанные в разделе "статистическая обработка результатов", в основном соответствуют требованиям, описанным в евpопейских ("Investigation of Bioavailability and Bioequivalence" - Commission of the European Communities, III/54/89-EN, December 1991; "Note for Guidance on the Investigation of Bioavailability and Bioequivalence" - The European Agency for the Evaluation of Medical Products, Committee for Proprietary Medicinal Products, July 2001) и американских ("In vivo bioequivalence guidances" - U.S. Pharmacopeia 24-NF 19, Supplement 2, 2000; "Statistical Approaches to Establishing Bioequivalence" - U.S. Department of Health and Human Services Food and Drug Administration, Center for Drug Evaluation and Research, January 2001) документах [1].
Статистическая обработка результатов исследования является основным этапом на пути принятия решения об эквивалентности (или неэквивалентности) препаратов. Долгое время наиболее распространенным статистическим тестом в исследованиях по биоэквивалентности был дисперсионный анализ (ANOVA), а также F-тест. В настоящее время этот подход используется не для принятия решения о биоэквивалентности, а для проверки статистически значимого влияния различных факторов на вариацию данных: различия между препаратами; межиндивидуальные различия; последовательность приема препаратов; периоды исследования [2].
Процедура статистического сравнения состоит в вычислении параметрических двусторонних 90% доверительных интервалов (ДИ) для отношений соответствующих средних значений параметров исследуемого препарата и препарата сравнения. Препараты считаются биоэквивалентными, если границы оцененного ДИ AUC(0-t) или AUC(0-inf) находятся в пределах 80-125%, а для показателей Cmax и Cmax/AUC, характеризующихся большей вариабельностью, эти пределы составляют 75-133%.
Статистическое сравнение может быть также выполнено при помощи проверки двух односторонних тестов (предпочтительно, по методу Schuirmann’а), каждый на 5% уровне значимости.
Анализ параметра tmax следует проводить с помощью непараметрических процедур. В этом случае рассчитывают непараметрические двусторонние 90% ДИ [1, 2].
Так в исследовании относительной биодоступности и биоэквивалентности препарата "Сперидан" в таблетках, содержащих 2 мг рисперидона (производитель "Actavis", Iceland), в сравнении с оригинальным рисперидоном (производитель "Janssen Cilag GmbH", Germany) для подтверждения биоэквивалентности использованы все указанные критерии и подходы (параметрические и непараметрические тесты, ANOVA, Schuirmann’s test). Исследование выполнено в исследовательских центрах CEPHA s.r.o., Pilsen, Czech Republic (клиническая часть) и QUINTA-ANALYTICA s.r.o., Prague, Czech Republic (аналитическая и статистическая часть) с соблюдением принципов, заложенных в Хельсинкской декларации.
Рисперидон является современным антипсихотическим средством, относящимся к группе так называемых атипичных нейролептиков. Препарат рекомендован пациентам с шизофренией как с лечебными, так и с профилактическими целями. Фармакокинетические особенности препарата дают возможность применять его 1 раз в сутки, что упрощает схему дозирования и делает его удобным в использовании. Результаты клинических исследований с рисперидоном достаточно полно опубликованы [3-5].
Исследование биоэквивалентности данных препаратов было проведено на 28 здоровых добровольцах обоего пола в возрасте 18-50 лет по открытой перекрестной рандомизированной схеме. Испытуемые получали один из препаратов в 8 ч утра, однократно, в дозе 2 мг (1 таблетка), через 2 нед испытуемые по аналогичной процедуре получали другой препарат в соответствии с планом рандомизации. С целью определения динамики концентрации рисперидона и его метаболита 9-гидроксирис-перидона в плазме крови пробы крови отбирали до и через 0,25, 0,5, 0,75, 1, 1,33, 1,66, 2, 2,5, 3, 4, 5, 6, 8, 10, 12, 16, 24, 30, 36, 48, 72, 96 и 120 ч после приема препарата. Во всех образцах определяли концентрацию рисперидона и его метаболита методом ВЭЖХ с масс-селективным детектором. Для статистической обработки результатов использовали программу SAS®.
Все испытуемые удовлетворительно перенесли исследование. Каких-либо нежелательных лекарственных реакций после однократного приема изучаемых препаратов не зарегистрировано. На рис. 1 и 2 представлены полученные значения динамики концентрации рисперидона и его метаболита в плазме крови испытуемых. Как видно из представленных данных, фармакокинетический профиль препарата "Сперидан" (рисперидон) и оригинального препарата практически совпадает, а значения концентраций статистически достоверно не различаются для каждого момента времени. Следует отметить, что концентрация рисперидона и его метаболита в плазме крови подвержена значительным межиндивидуальным колебаниям (разброс значений составляет более 100%). Данный разброс, возможно, связан с индивидуальными особенностями метаболизма рисперидона.
Рис. 1. Усредненная динамика концентрации рисперидона в плазме крови испытуемых после однократного перорального приема 2 мг изучаемых препаратов.
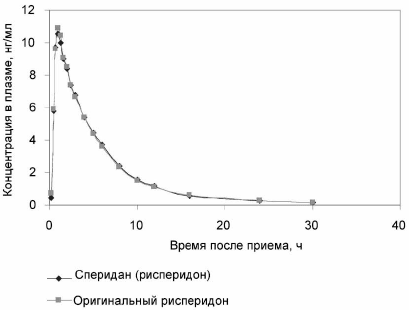
Рис. 2. Усредненная динамика концентрации 9-гидроксирис-перидона в плазме крови испытуемых после однократного перорального приема 2 мг изучаемых препаратов.
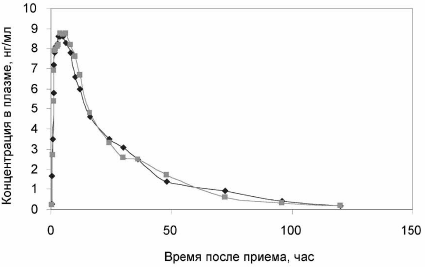
В табл. 1-4 представлены средние значения основных фармакокинетических параметров рисперидона и его метаболита после однократного перорального приема изучаемых препаратов. Максимальная концентрация рисперидона достигалась в среднем через 1,02 ч и 0,98 ч после приема препаратов и составляла 11,69±5,78 нг/мл и 11,18±5,63 нг/мл для оригинального препарата (рисперидон) и сперидана (рисперидон) соответственно. Максимальная концентрация метаболита рисперидона достигалась в среднем через 4,46 и 4,26 ч после приема и составляла 9,32±2,93 нг/мл и 9,72±3,14 нг/мл для оригинального препарата (рисперидон) и сперидана (рисперидон) соответственно.
Таблица 1.
Средние значения фармакокинетических параметров рисперидона после однократного перорального приема 2 мг (нормальное распределение)
| Параметр | Оригинальный рисперидон | Сперидан (рисперидон) |
90% ДИ, % |
Mean Ratio, % |
| AUC(0-t), нг х ч/мл | Mean | 60,56 | 61,64 | 94,58-108,98 | 101,78 |
| SD | 65,46 | 69,16 |
| CV, % | 108,09 | 112,21 |
| AUC(0-inf), нг х ч/мл | Mean | 62,41 | 63,57 | 94,51-109,19 | 101,85 |
| SD | 67,67 | 72,02 |
| CV, % | 108,43 | 113,30 |
| C max, нг/мл | Mean | 11,69 | 11,18 | 87,39-103,80 | 95,59 |
| SD | 5,78 | 5,63 |
| CV, % | 49,39 | 50,39 |
| t max, ч | Mean | 1,02 | 0,98 | 80,85-110,42 | 95,64 |
| Max | 3,00 | 1,67 |
| Min | 0,50 | 0,50 |
| Median | 1,00 | 1,00 |
| t1/2, ч | Mean | 4,12 | 4,28 | 98,15-109,59 | 103,87 |
| SD | 6,61 | 7,13 |
| CV, % | 160,46 | 166,69 |
| kel, 1/ч | Mean | 0,269 | 0,271 | 96,50-104,62 | 100,56 |
| SD | 0,105 | 0,111 |
| CV, % | 38,79 | 41,09 |
Примечание. Mean - среднее арифметическое; SD - стандартное отклонение; CV - коэффициент вариации, =SD/Mean*100; Max и Min - максимальное и минимальное значение из полученных; Median - медиана.
Таблица 2.
Средние значения фармакокинетических параметров рисперидона после однократного перорального приема 2 мг (логнормальное распределение)
| Параметр | Оригинальный рисперидон |
|
Сперидан (рисперидон) |
90% ДИ, % | Mean Ratio, % |
| AUC(0-t), нг х ч/мл | GMean | 42,80 | | 42,35 | 92,86-105,43 | 98,95 |
| GSD | 0,79 | | 0,83 |
| CVres, % | | 13,99 | |
| AUC (0-int), нг х ч/мл | GMean | 44,24 | | 43,85 | 93,26-105,32 | 99,11 |
| GSD | 0,78 | | 0,82 |
| CVres, % | | 13,40 | |
| C max, нг/мл | GMean | 10,34 | | 9,87 | 86,24-105,72 | 95,49 |
| GSD | 0,53 | | 0,53 |
| CVres, % | | 22,62 | |
| Cmax/AUC(0-inf), 1/ч | GMean | 0,2334 | | 0,225 | 90,84-102,19 | 96,34 |
| GSD | 0,406 | | 0,420 |
| CVres, % | | 12,97 | |
Примечание. GMean и GSD - среднее и стандартное отклонение после логарифмической трансформации данных.
Таблица 3.
Средние значения фармакокинетических параметров 9-гидроксирисперидона после однократного перорального приема 2 мг (нормальное распределение)
| Параметр | Оригинальный рисперидон | Сперидан (рисперидон) |
90% ДИ, % |
Mean Ratio, % |
| AUC(0-t), нг х ч/мл | Mean | 228,69 | 237,17 | 98,55-108,86 | 103,71 |
| SD | 64,65 | 73,06 |
| CV, % | 28,27 | 30,81 |
| AUC(0-inf), нг х ч/мл | Mean | 239,73 | 249,32 | 99,12-108,88 | 104,00 |
| SD | 67,35 | 75,41 |
| CV, % | 28,10 | 30,25 |
| Cmax, нг/мл | Mean | 9,32 | 9,72 | 98,33-110,28 | 104,31 |
| SD | 2,93 | 3,14 |
| CV, % | 31,49 | 32,25 |
| tmax, ч | Mean | 4,46 | 4,26 | 84,73-106,14 | 95,43 |
| Max | 12,00 | 12,00 |
| Min | 1,33 | 1,00 |
| Median | 4,00 | 4,00 |
| t1/2, ч | Mean | 27,03 | 30,21 | 99,59-123,91 | 111,75 |
| SD | 8,54 | 9,38 |
| CV, % | 31,60 | 31,03 |
| kel, 1/ч | Mean | 0,028 | 0,025 | 81,60-98,49 | 90,05 |
| SD | 0,008 | 0,008 |
| CV, % | 29,67 | 33,25 |
Примечание. Mean - среднее арифметическое; SD - стандартное отклонение; CV - коэффициент вариации, =SD/Meanx100; Max и Min - максимальное и минимальное значение из полученных; Median - медиана.
Таблица 4.
Средние значения фармакокинетических параметров 9-гидроксирисперидона после однократного перорального приема 2 мг (лог-нормальное распределение)
| Параметр | Оригинальный рисперидон |
|
Сперидан (рисперидон) |
90% ДИ, % | Mean Ratio, % |
| AUC(0-t), нг х ч/мл | GMean | 217,11 | | 224,78 | 98,84-108,45 | 103,53 |
| GSD | 0,36 | | 0,36 |
| CVres, % |
|
10,20 |
|
| AUC (0-inf), нг х ч/мл | GMean | 228,58 | | 237,41 |
99,44-108,48 | 103,86 |
| GSD | 0,34 | | 0,34 |
| CVres, % |
|
9,57 |
|
| Cmax, нг/мл | GMean |
8,61 | |
8,9 | 98,88-109,42 | 104,02 |
| GSD |
0,49 |
|
0,49 |
| CVres, % |
|
11,14 |
|
| Cmax/AUC(0-inf), 1/ч | GMean | 0,038 | | 0,038 | 97,37-103,01 | 100,15 |
| GSD | 0,292 | | 0,307 |
| CVres, % |
|
6,19 |
|
Примечание. GMean и GSD - среднее и стандартное отклонение после логарифмической трансформации данных.
Значения всех определяемых параметров статистически достоверно не различались. Дисперсионный анализ значений AUC0-t, Cmax, Cmax/AUC0-t, проведенный после их логарифмического преобразования, не выявил статистически значимых различий между препаратами. Границы оцененного 90% ДИ находятся в допустимых пределах (80-125% для AUC(0-t) и AUC(0-inf) и 75-133% для Cmax и Cmax/AUC(0-inf)).
Таким образом, статистически доказано, что изученные препараты - Сперидан (рисперидон) и оригинальный рисперидон - являются биоэквивалентными по степени и скорости всасывания.
ЛИТЕРАТУРА 1. Методические указания МЗиСР РФ "Проведение качественных клинических исследований биоэквивалентности лекарственных препаратов".М., 2004.
2. Бондарева И.Б. Статистический анализ данных исследований биоэквивалентности. Клин. фармакокинет. 2004; 1: 14-22.
3. Применение атипичного антипсихотика рисполепта в стационарной и амбулаторной терапии больных шизофренией (часть 1). Иванов М.В., Мазо Г.Э., Вовин Р.Я., Костерин Д.Н. Обозрение психиатрии и мед. психол. им. ВМБехтерева, 2004; 1.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)