Нарушения памяти и внимания в пожилом возрасте
Статьи Опубликовано в журнале:«ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ»; № 2; 2006; стр. 58-62.
Н.Н. Яхно, В.В. Захаров, А.Б. Локшина
Кафедра нервных болезней Московской медицинской академии им. И.М. Сеченова
Memory And Attention Impairment In The Elderly
N.N. Yakhno, V.V. Zakharov, A.B. Lokshina
Сейчас в мире проживает около 400 000 человек старше 65 лет и ожидается, что в ближайшее время их число возрастет [3]. Указанная демографическая тенденция характеризуется иногда как тенденция к «постарению населения». Она отмечается в большинстве европейских стран, в том числе в России. В нашей стране она связана в основном с уменьшением средней продолжительности жизни и высокой смертностью среди лиц молодого и среднего возраста.
Одним из наиболее частых неврологических симптомов в пожилом возрасте является снижение памяти. В 2004— 2005 гг. в 33 городах 30 регионов России было проведено эпидемиологическое исследование Прометей. Оно показало, что не менее чем у 80% лиц старше 60 лет, по разным причинам обратившихся к неврологам, имеются жалобы на снижение памяти. При этом следует иметь в виду, что учитывались лишь активные (без наводящих вопросов врача), самостоятельно высказываемые жалобы на забывчивость, приводящую к реальным затруднениям в повседневной жизни или служившую основанием для назначения медикаментозного лечения. Сказанное свидетельствует о том, что неврологам практически ежедневно приходится сталкиваться в своей практике с клинически значимыми мнестическими расстройствами у пациентов пожилого возраста.
Причины нарушений памяти в пожилом возрасте. Снижение памяти является неспецифическим симптомом, который отмечается при многих заболеваниях головного мозга.
Пожилой возраст, безусловно, предрасполагает к развитию нарушений мнестической функции. Это связано с целым рядом вызываемых старением изменений. Во-первых, в процессе физиологического старения головной мозг претерпевает ряд структурных, нейрофизиологических и нейрохимических сдвигов, которые уже сами по себе могут быть причиной ослабления памяти, внимания и других когнитивных функций. Во-вторых, с возрастом уменьшается нейрональная пластичность — способность нейронов головного мозга изменять свои функциональные свойства в зависимости от меняющихся условий внешней среды. Это приводит к уменьшению компенсаторных возможностей головного мозга при различных патологических состояниях. И наконец, пожилой возраст является сильным и независимым фактором риска развития разного рода сосудистых и дегенеративных заболеваний, которые сопровождаются нарушением памяти [9, 12].
Экспериментально-психологические исследования, проведенные в 60-70-х годах XX века, показали, что результативность выполнения нейропсихологических тестов с возрастом постепенно снижается, в том числе и у лиц без клинически явной церебральной патологии. Такое снижение начинается достаточно рано — в 30—40 лет. В наибольшей степени это касается быстроты реакции на внешние стимулы и способности длительное время концентрировать внимание. Поэтому мышление у пожилых лиц становится замедленным по сравнению со здоровыми лицами молодого и среднего возраста. Пожилым людям, как правило, требуется больше времени для выполнения различных когнитивных заданий, они быстрее устают. С возрастом уменьшается и объем оперативной памяти, что сказывается на способности к обучению и усвоению новых знаний и навыков. И еще один когнитивный симптом, типичный для пожилых, — трудности перехода с предыдущего этапа когнитивной деятельности на следующий. Поэтому пожилые люди менее склонны менять стратегию своего поведения и соответственно, они становятся более консервативными [9, 12, 19].
Как показывает качественный нейропсихологический анализ изменений когнитивной сферы у большинства пожилых людей, в их основе лежит нарушение нейродинамики когнитивных процессов, что традиционно связывают с дисфункцией глубинных отделов головного мозга. Консерватизм, формирующийся ввиду трудности смены алгоритма действий, т.е. определенная интеллектуальная инертность, может также рассматриваться как нейропсихологический симптом вторичной дисфункции лобных отделов головного мозга. Легкая лобная дисфункция в пожилом возрасте выявляется также с помощью методов современной функциональной нейровизуализации [16, 36].
Выраженность возрастного физиологического ухудшения когнитивных функций индивидуальна. При так называемом «успешном старении» человек полностью или почти полностью сохраняет мнестический и интеллектуальный потенциал и даже в самом преклонном возрасте ничуть не уступает молодым в памяти и других когнитивных способностях. Предполагается, что к «успешному старению» предрасполагают конституциональные особенности индивидуума, здоровый образ жизни, интенсивная интеллектуальная деятельность в молодые и средние годы жизни. В других случаях возрастные изменения когнитивных функций могут быть более выраженными, вызывать субъективное беспокойство, а порой — объективные трудности в повседневной жизни. Такие пациенты регулярно обращаются к неврологам и другим специалистам с жалобами на повышенную забывчивость или другие когнитивные нарушения [19, 25, 26].
В 1994 г. Международной психогериатрической ассоциацией при ВОЗ был предложен термин «возрастное когнитивное снижение» (англ. аging-аssociated сognitive decline) для определения понятия ослабления памяти и внимания возрастного характера [26]. Тогда же были разработаны диагностические критерии этого состояния.
Диагностические критерии связанного со старением когнитивного снижения, разработанные Международной психогериатрической ассоциацией ВОЗ
Критерии включения
1. Когнитивные нарушения, отражаемые в жалобах пациента или его ближайшего окружения.
2. Постепенное развитие нарушений и их наличие в течение минимум 6 мес.
3. Нарушения в одной из следующих сфер: памяти, внимания, мышления, речи, зрительно-пространственной ориентировки.
4. Результаты нейропсихологических тестов минимум на одно стандартное отклонение ниже нормы, разработанной для данной возрастной группы.
Критерии исключения:
- наличие умеренного когнитивного расстройства по критериям МКБ-10;
- наличие соматической патологии, способной привести к когнитивным нарушениям;
- органическая патология головного мозга;
- выраженные эмоциональные и поведенческие расстройства: депрессия, тревога, делирий и др.;
- употребление психоактивных веществ.
Согласно указанным критериям, о синдроме «возрастного когнитивного снижения», не связанном очевидным образом с каким-либо установленным соматическим, неврологическим или психическим заболеванием можно говорить в случаях ухудшения одной или нескольких когнитивных способностей, отклоняющихся от среднестатистических показателей для данной возрастной группы, превышающих их, но не достигающих выраженности деменции.
Таким образом, синдром «возрастного когнитивного снижения» занимает промежуточное положение между нормальным старением и патологическими изменениями, обусловленными органическим поражением головного мозга. По эпидемиологическим данным, распространенность «возрастного когнитивного снижения» составляет не менее 40% среди лиц старше 50 лет [25, 26].
Однако в повседневной клинической практике провести грань между «физиологическим» и «патологическим» ухудшением когнитивных способностей в пожилом возрасте весьма сложно, а нередко вообще не представляется возможным. Это связано, в частности, с тем, что у большинства пожилых лиц имеется одно или несколько хронических соматических или неврологических заболеваний, из которых многие потенциально могут оказывать отрицательное влияние на когнитивные функции.
Наиболее часто к когнитивным нарушениям в пожилом возрасте приводит сердечно-сосудистая патология. Так, неврологам хорошо известен синдром дисциркуляторной энцефалопатии (ДЭ). Этим термином принято обозначать органическое поражение головного мозга, которое формируется в результате повторных острых нарушений мозгового кровообращения и/или его хронической недостаточности. Диагноз ДЭ базируется на наличии анамнестических, клинических и инструментальных признаков сосудистой мозговой недостаточности. Приводим соответствующие диагностические критерии.
Диагностические критерии ДЭ
1. Наличие признаков поражения головного мозга (клинических, анамнестических, инструментальных).
2. Наличие признаков острой или хронической церебральной дисциркуляции (клинических, анамнестических, инструментальных).
3. Наличие причинно-следственной связи между нарушениями гемодинамики и развитием клинической, нейропсихологической, психиатрической симптоматики.
4. Клинические и параклинические признаки прогрессирования сосудистой мозговой недостаточности.
К сказанному нужно добавить, что обязательным условием установления диагноза ДЭ является уточнение причинно-следственной связи между вявляемыми симптомами и сосудистым поражением мозга [1, 3, 11].
Различают несколько стадий ДЭ.
I стадия заболевания характеризуется преимущественно субъективными неврологическими симптомами, такими как головная боль, несистемное головокружение, шум или тяжесть в голове, повышенная утомляемость, расстройства сна. Клинический анализ природы указанных симптомов свидетельствует, что часто в их основе лежит незначительное (легкое) снижение фона настроения. Столь распространенные в начальных стадиях сосудистой мозговой недостаточности эмоциональные нарушения можно рассматривать как характерное проявление дисфункции лобных долей головного мозга. В свою очередь лобная дисфункция при ДЭ закономерно возникает в результате ишемического поражения подкорковых базальных ганглиев или глубинных отделов белого вещества головного мозга [1, 24].
Предполагается, что эмоциональные нарушения при ДЭ I стадии имеют органический субстрат. Однако очевидно, что снижение фона настроения с соматическими симптомами депрессии, такими как хроническая головная боль напряжения, расстройства сна и утомляемость, могут быть обусловлены актуальной жизненной ситуацией, в том числе у пожилых лиц. Поэтому диагноз ДЭ не может базироваться только на субъективных симптомах, даже при наличии выраженной сердечно-сосудистой патологии. Для установления обоснованного диагноза ДЭ любой стадии необходимо объективное клиническое или инструментальное подтверждение поражения головного мозга сосудистой этиологии [1, 3].
Как уже отмечалось, нарушения памяти и других когнитивных функций являются важной составной частью клинической картины ДЭ. По нашим данным, когнитивные нарушения, выходящие за пределы возрастной нормы, встречаются у 83,7% пациентов с ДЭ I стадии. При этом у 51,1% пациентов они достигали выраженности синдрома умеренных когнитивных нарушений, а у 32,6% были расценены как легкие. И при легких, и при умеренных когнитивных нарушениях сосудистой этиологии на первый план в клинической картине выходили нейропсихологические симптомы дисфункции глубинных структур головного мозга и лобных долей, а именно замедленность когнитивных процессов (брадифрения), трудности концентрации внимания, снижение объема оперативной памяти, инертность и импульсивность [8, 13, 14].
Следует отметить, что в целом качественные особенности сосудистых когнитивных нарушений аналогичны нейропсихологическим характеристикам «возрастного когнитивного снижения», что в еще большей степени затрудняет дифференциальную диагностику этих клинических синдромов. Однако с практических позиций дифференциальная диагностика возрастного и сосудистого легкого когнитивного снижения не столь актуальна, так как в обоих случаях может применяться единый терапевтический подход, включающий воздействие на церебральную микроциркуляцию и метаболические процессы, нейротрансмиттерные системы и лечение сопутствующих сердечно-сосудистых заболеваний.
II стадия ДЭ характеризуется уменьшением значимости субъективных симптомов и нарастанием выраженности объективных неврологических нарушений. Однако выраженность когнитивных изменений, как правило, остается легкой или умеренной. В проведенных нами исследованиях умеренные когнитивные нарушения выявлялись в этой стадии у 55,6% пациентов, легкие — у 33,3% [8, 13, 14]. В последующем при неблагоприятном течении основного патологического процесса возможна трансформация умеренных когнитивных нарушений в сосудистую деменцию.
III стадия ДЭ — формирование сосудистой деменции [1, 2, 11].
Следует имет в виду, что, помимо возрастных и сосудистых когнитивных нарушений, жалобы на снижение памяти могут отражать и начало дегенеративного заболевания головного мозга, например болезнь Альцгеймера (БА). Особенностью мнестических расстройств у таких больных являются распространение нарушений памяти на недавние и отдаленные события жизни, их прогрессирующий характер, сочетание мнестических расстройств с трудностями пространственной ориентировки и дисфазическими, постепенное формирование зависимости от посторонней помощи. Нарушения памяти являются также облигатным симптомом других форм деменции, таких как деменция с тельцами Леви, деменция при болезни Паркинсона, посттравматической деменции и др. [3, 5].
Важно отметить, что нарушения памяти в пожилом возрасте далеко не всегда связаны с первичным поражением головного мозга. Очень часто они возникают вторично в результате системных дисметаболических нарушений. Наибольшее негативное влияние на память оказывают такие патологические состояния, как гипотиреоз, дефицит витамина В12 и фолиевой кислоты, заболевания печени и почек, хроническая гипоксия. Неблагоприятно воздействуют на память и иные когнитивные функции также многие лекарственные препараты — холинолитики, трициклические антидепрессанты, нейролептики, бензодиазепины и некоторые другие. Очевидно негативное влияние на когнитивные функции злоупотребление алкоголем [5].
Диагностический алгоритм при нарушениях памяти
При жалобах на снижение памяти и умственной работоспособности необходима объективизация и оценка их тяжести с помощью нейропсихологических методов исследования.
Наиболее простыми методиками, которые могут использоваться с этой целью, являются краткая шкала оценки психического статуса (Mini-Mental State Examination — MMSE) [21] и тест рисования часов [27]. По данным упоминавшегося выше эпидемиологического исследования Прометей, эти методики подтверждают наличие когнитивных нарушений у 83% пожилых пациентов с жалобами на снижение памяти. Важно также, что указанные методики позволяют не только констатировать факт когнитивных нарушений, но и количественно оценить их выраженность. Когнитивные нарушения делят на тяжелые (деменцию) и умеренные (англ. mild cognitive impairment — MCI).
Тяжелые когнитивные нарушения (деменция)— это выраженные нарушения памяти, которые в сочетании с расстройством других когнитивных функций приводят к полной дезадаптации пациента в повседневной жизни. Согласно сплошным эпидемиологическим исследованиям, деменция отмечается не менее чем у 5% лиц старше 65 лет [2, 15]. Самыми распространенными ее причинами являются БА, сосудистая мозговая недостаточность, деменция с тельцами Леви, болезнь Паркинсона, другие дегенеративные неврологические заболевания, черепно-мозговая травма и др.
Умеренные когнитивные нарушения (УКН) представляют собой клинически очерченный синдром мнестических и/ или других когнитивных расстройств, которые явно выходят за пределы возрастной нормы, но не достигают выраженности деменции и не вызывают дезадаптации в повседневной жизни. По некоторым данным, УКН имеются у 12—17% лиц пожилого возраста [20, 23]. Нередко со временем они трансформируются в деменцию. Так, по данным R. Petersen и соавт. [29—32], риск развития БА у пациентов с синдромом УКН составляет 10—15% в год при среднестатистическом риске для популяции пожилых людей только 1—2% в год. Кроме БА, при УКН повышен риск развития сосудистой деменции, деменции с тельцами Леви и других форм деменции. Таким образом, синдром УКН в большинстве случаев связан с более ранними стадиями церебральных заболеваний, которые впоследствии приводят к деменции [22, 30-33].
С нашей точки зрения, синдромы тяжелых и умеренных когнитивных нарушений не охватывают всего спектра когнитивных расстройств при неврологических заболеваниях. Исследования, проведенные в клинике нервных болезней им. А.Я. Кожевникова [14], свидетельствуют о том, что наряду с клинически очерченными синдромами тяжелых и умеренных когнитивных нарушений у части больных с различными неврологическими заболеваниями выявляются наиболее легкие когнитивные нарушения, которые, не формируя четкого клинического синдрома, обнаруживаются лишь при детальном исследовании высших мозговых функций. Такие легкие когнитивные нарушения выявляются у трети пациентов с ДЭ и у половины пациентов с болезнью Паркинсона [4, 6, 8, 14].
Поскольку диагностика легких когнитивных нарушений требует детального и углубленного нейропсихологического тестирования, выявление данного симптомокомплекса в рамках широких эпидемиологических исследований весьма затруднительно.
По нашему опыту, легкие когнитивные нарушения носят преимущественно нейродинамический характер. При этом в их основе могут лежать как физиологические возрастные изменения головного мозга, так и самые начальные проявления различных патологических процессов.
Особую группу составляют пациенты с жалобами на снижение памяти, не подтверждаемыми при использовании объективных методов. По данным исследования Прометей, их доля достигает 17%. В этих случаях велика вероятность так называемых функциональных нарушений памяти. Повышенная озабоченность по поводу минимальной или кажущейся забывчивости весьма характерна для расстройств тревожно-депрессивного ряда. Такие пациенты жалуются в основном на то, что не помнят, куда что-то положили, зачем пришли в комнату, забывают имена знакомых актеров и других хорошо известных людей и пр. Подобная забывчивость характерна в большей или меньшей степени и для подавляющего большинства здоровых людей, но при этом она не приводит к существенным затруднениям в повседневной жизни.
Однако отсутствие объективного подтверждения мнестических расстройств в каких-то случаях может объясняться минимальной выраженностью нарушений в самых наиболее ранних стадиях органического поражения головного мозга. Поэтому пациенты с субъективными нарушениями памяти нуждаются в динамическом наблюдении в течение по меньшей мере 6—12 мес, при этом целесообразно применение препаратов с предполагаемыми нейропротективными свойствами.
После объективизации и оценки выраженности когнитивных расстройств необходимо определить их причину, т.е. установить нозологический диагноз с учетом нейропсихологических особенностей такого рода нарушений, наличия и характера очаговых неврологических симптомов, анамнеза заболевания, результатов инструментальных исследований.
Основные причины когнитивных нарушений
I. Нейродегенеративные заболевания
1. Болезнь Альцгеймера
2. Деменция с тельцами Леви
3. Фронтотемпоральная дегенерация
4. Первичная прогрессирующая афазия
5. Кортико-базальная дегенерация
6. Заболевания с преимущественным поражением подкорковых базальных ганглиев
6.1. Болезнь Паркинсона
6.2. Прогрессирующий надъядерный паралич
6.3. Хорея Гентингтона
6.4. Другие дегенеративные поражения базальных ганглиев
II. Сосудистые заболевания головного мозга
1. Последствия единичного инсульта в «стратегической» зоне
2. Мультиинфарктное состояние
3. Сосудистая деменция, связанная с хронической церебральной ишемией
4. Болезнь Бинсвангера
III. Смешанные (сосудисто-дегенеративные) когнитивные нарушения
IV. Дисметаболические энцефалопатии
1. Алкоголизм
2. Гипоксическая энцефалопатия
3. Соматогенные нарушения:
— гипоксемия (при дыхательной недостаточности)
— печеночная энцефалопатия
— почечная энцефалопатия
— гипогликемическая энцефалопатия
4. Гипотиреоз
5. Дефицитарные состояния (дефицит витаминов В1, В12, фолиевой кислоты, белков)
6. Интоксикации солями металлов (алюминий, цинк, медь)
7. Интоксикации лекарственными препаратами (холинолитики, барбитураты, бензодиазепины, нейролептики, соли лития и др.)
8. Гепатолентикулярная дегенерация
V. Нейроинфекции и демиелинизирующие заболевания
1. ВИЧ-ассоциированная энцефалопатия
2. Губчатый энцефалит (болезнь Крейцфельдта — Якоба)
3. Прогрессирующие панэнцефалиты
4. Последствия острых и подострых менингоэнцефалитов
5. Прогрессивный паралич
6. Рассеяный склероз
7. Мультифокальная лейкоэнцефалопатия
VI. Черепно-мозговая травма
VII. Опухоль головного мозга
VIII. Ликвородинамические нарушения Нормотензивная (арезорбтивная) гидроцефалия
Фармакотерапия при когнитивных нарушениях
Лечение таких пациентов основывается прежде всего на результатах всесторонней оценки состояния соматического здоровья и требует коррекции терапии имеющихся заболеваний. Как уже указывалось, расстройства памяти и внимания не всегда связаны со структурным поражением головного мозга, но могут иметь и дисметаболическую природу. Своевременная диагностика и коррекция системных дисметаболических расстройств способствует нормализации когнитивных функций. Даже в стадии деменции у 5% пациентов когнитивные расстройства носят обратимый характер [2, 5].
Патогенетическое значение в терапии когнитивных нарушений и профилактике развития деменции имеет лечение сердечно-сосудистых заболеваний. Доказано, что контроль за уровнем артериальной гипертензии, особенно если возможно достижение значений АД 110—120/70—80 мм рт.ст., достоверно уменьшает риск развития сосудистой деменции и БА. Однако приближение к этим значениям должно быть постепенным, ибо слишком быстрая нормализация давления может ухудшать церебральную перфузию и приводить к усугублению мнестико-интеллектуальных расстройств. Наличие гемодинамически значимого атеросклероза является показанием к назначению антиагрегантов, а в отдельных случаях к применению методов сосудистой хирургии. Соответствующей терапии требуют гиперлипидемия, сахарный диабет, нарушение сердечного ритма. Следует убедить пациента отказаться от курения, бороться с ожирением и гиподинамией [2, 5, 27].
Выбор патогенетической терапии когнитивных нарушений определяется их выраженностью и этиологией. При тяжелых формах (деменции), связанных с БА, дегенеративным процессом с тельцами Леви или с сосудистой мозговой недостаточностью, наиболее эффективны ингибиторы ацетилхолинэстеразы (галантамин, ривастигмин, ипидакрин) и обратимый блокатор NMDA-рецепторов мемантин. Их применение способствует ослаблению когнитивных нарушений, регрессу поведенческих расстройств, повышению адаптации в повседневной жизни, улучшению качества жизни пациента с деменцией и его родственников. Заметим, что при легких и умеренных когнитивных нарушениях применение ингибиторов ацетилхолинэстеразы и мемантина на сегодняшний день не имеет надлежащей доказательной базы [2, 27].
При легких и умеренных когнитивных нарушениях сосудистой этиологии патогенетически оправданно применение препаратов, улучшающих церебральную микроциркуляцию, — ингибиторов фосфодиэстеразы (эуфиллин, пентоксифиллин, винпоцетин, экстракт гинкго билобы), блокаторов кальциевых каналов (нимодипин, циннаризин, флюнаризин), а-адреноблокаторов (ницерголин, пирибедил). Их назначают курсами по 2—3 мес 1—2 раза в год. В то же время следует заметить, что такое прерывистое назначение сосудистых препаратов пока не имеет серьезного научного обоснования [1—3, 5].
У пациентов с легкими и умеренными когнитивными расстройствами любой этиологии широко применяются препараты метаболического действия — пирацетам, другие производные пирродолина, а также пептидергические и аминокислотные — церебролизин, глицин, семакс, актовегин и пр. Как и в отношении сосудистых препаратов, общепринятым является прерывистое назначение метаболических лекарственных средств, что, с нашей точки зрения, не всегда патогенетически оправданно [1—3, 5].
Весьма перспективным подходом к терапии легких и умеренных когнитивных нарушений в пожилом возрасте является применение дофаминергических препаратов. В серии исследований [16, 36] показано, что ослабление памяти и внимания у пожилых лиц с высокой степенью достоверности коррелирует с активностью дофаминергической системы. В настоящее время для коррекции легких и умеренных когнитивных нарушений в пожилом возрасте активно используется проноран (пирибедил), сочетающий свойства агониста дофаминовых рецепторов и блокатора пресинаптических α2-адренорецепторов. Адреноблокирующее действие этого препарата лежит в основе его эффективности в отношении церебральной микроциркуляции. Иными словами, он является как нейротрансмиттерным, так и сосудистым препаратом и потому может использоваться и при «чистых» возрастных нарушениях, и при легких и умеренных когнитивных расстройствах сосудистой этиологии.
Проноран давно с успехом применяется при болезни Паркинсона в качестве монотерапии и в комбинации с препаратами леводопы [10]. Давно отмечена его эффективность также при хронических цереброваскулярных расстройствах и связанных с возрастом когнитивных нарушениях. Многочисленные контролируемые исследования с участием около 7000 пациентов из разных стран мира, свидетельствуют о значительном положительном эффекте пронорана в отношении таких когнитивных расстройств, как снижение памяти, концентрации внимания, умственной работоспособности [17, 18, 28, 34, 35]. Лечение пропораном способствует также уменьшению выраженности субъективных симптомов ДЭ, таких как головная боль, несистемные головокружения, шум и тяжесть в голове, повышенная утомляемость. Кроме того, проноран является нейропротектором, предотвращим нарастание нейродегенеративных изменений дофаминергических нейронов.
В 2003 г. в клинике нервных болезней им. А.Я. Кожевникова была проведена оценка эффективности пронорана при ДЭ с когнитивными нарушениями. Он применялся у 29 пациентов с ДЭ I или II стадии (средний возраст 68,4±6,4 года) по таблетке (50 мг) один раз в день. Продолжительность наблюдения составила 3 мес; в дальнейшем в случае клинически значимого положительного эффекта проноран рекомендовался для дальнейшего применения. Эффективность лечения оценивалась с помощью ряда нейропсихологических шкал. Результаты исследования показали, что терапия пронораном способствует достоверному (p<0,05) улучшению когнитивных функций в целом и особенно в сфере памяти и формально-логических операций. На рисунке представлены данные, полученные при использовании шкалы деменции Маттиса. Объективные показатели совпадали с впечатлениями пациентов: большинство из них отметили на фоне лечения уменьшение забывчивости, повышение умственной работоспособности. Как и в международных исследованиях, мы также отметили регресс выраженности субъективных симптомов ДЭ — головной боли, тяжести в голове, утомляемости. Это дает надежные основания для применения пронорана у больных ДЭ I и II стадии при наличии когнитивных нарушений [7].
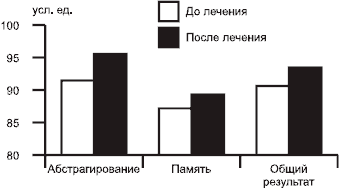
Когнитивные функиии по шкале деменции Маттиса до и после терапии пронораном.
Следует заметить, что в качестве препарата для лечения когнитивных расстройств проноран применяется в меньших дозах, чем для лечения болезни Паркинсона — обычно это 50 мг/сут в один прием. При недостаточной эффективности может быть целесообразным увеличение дозы до 100 мг/сут (по 50 мг в два приема); дальнейшее ее увеличение нецелесообразно.
Таким образом, когнитивные нарушения в пожилом возрасте имеют разные выраженность и этиологию и связаны как с естественными инволютивными изменениями головного мозга, так и с разнообразными органическими поражениями головного мозга. Лечение таких нарушений должно быть комплексным и включать коррекцию дисметаболических расстройств, воздействие на микроциркуляцию, церебральный метаболизм и нейротрансмиттерную недостаточность, являющуюся основой когнитивных расстройств. Применение такого комплексного подхода способствует уменьшению выраженности произошедших нарушений и, вероятно, снижает темп их прогрессирования.
ЛИТЕРАТУРА
1. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте: Автореф. дис. ... д-ра мед. наук. М 1997.
2. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция. Под ред. Н.Н. Яхно. М 2002.
3. Дамулин И.В, Парфенов В.А, Скоромец А.А., Яхно Н.Н. Нарушения кровообращения в головном и спинном мозге. В кн.: Болезни нервной системы. Руководство для врачей. Под ред. Н.Н. Яхно, Д.Р. Штульмана. М: Медицина 2003; 1: 231—302.
4. Захаров В.В. Когнитивные нарушения при болезни Паркинсона и симптоматическом паркинсонизме: Автореф. дис. ... д-ра мед. наук. М 2003.
5. Захаров В.В., Яхно Н.Н. Нарушения памяти. М: ГэотарМед 2003.
6. Захаров В.В., Ярославцева Н.В., Яхно Н.Н. Когнитивные нарушения при болезни Паркинсона. Неврол журн 2003; 8: 2: 11—16.
7. Захаров В.В., Локшина А.Б. Применение препарата проноран (пирибедил) при легких когнитивных расстройствах у пожилых больных с дисциркуляторной энцефалопатией. Неврол журн 2004; 2: 30—35.
8. Локшина А.Б. Легкие и умеренные когнитивные нарушения при дисциркуляторной энцефалопатии: Автореф. дис. ... канд. мед. наук. М 2005.
9. Маньковский Н.Б., Минц А.Я. Старение и нервная система. Киев 1972.
10. Обухова А.В. Применение селективного агониста D2/D3-рецепторов пронорана (пирибедила) при терапии болезни Паркинсона. Неврол журн 2002; 3: 38—40.
11. Шмидт Е.В. Классификация сосудистых поражений головного и спинного мозга. Журн невропатол и психиат 1985; 85: 9: 192— 203.
12. Яхно Н.Н., Лавров А.Ю. Изменения центральной нервной системы при старении. Нейродегенеративные болезни и старение (Руководство для врачей). Под ред. И.А. Завалишина, Н.Н. Яхно. С.И. Гавриловой. М 2001; 242—261.
13. Яхно Н.Н., Захаров В.В., Локшина А.Б. Синдром умеренных когнитивных нарушений при дисциркуляторной энцефалопатии. Журн неврол и психиат 2005; 105: 2: 13—17.
14. Яхно Н.Н, Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные расстройства при дисциркуляторной энцефалопатии. Клин геронтол 2005; 11: 38—39.
15. Amaducci L., Andrea L. The epidemiology of the dementia in Europe. In: A. Culebras, J. Matias Cuiu, G. Roman (eds). New concepts in vascular dementia. Barselona: Prous Science Publishers 1993; 19— 27.
16. Bdckman L, Ginovart N, Dixon R. et al. Age-related cognitive deficits mediated by changes in the striatal dopamine system. Am J Psychiat 2000; 157: 635—637.
17. Bartoli G, Wichrowska E. Controlled clinical trial of piribedil in the treatment of cerebrovascular insufficiency. La Clin Ter 1976; 78: 2: 141—151.
18. Bille J., Bukiwsky J.V., De Ferron A. et al. Decline cerebral et therapeutique: une etude clinique multicenrique de Trivastal 50 retard en Neuro-Geriatrie. Psych Med 1986; 18: 609—626.
19. Ciocon J.O., Potter J.F. Age-related changes in human memory: normal and abnormal. Norm Abnorm Geriat 1988; 43: 10: 43—48.
20. DiCarlo A., Baldereschi M., Amaducci L. et al. Cognitive impairment without dementia in older people: prevalence, vascular risk factors. impact on disability. The Italian Longitudinal Study on Aging. J Am Geriat Soc 2000; 48: 775—782.
21. Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State: a practical guidefor grading the mental state of patients for the clinician. J Psych Res 1975; 12: 189—198.
22. Golomb J., Kluger A., Garrard P., Ferris S. Clinician s manual on mild cognitive impairment. London: Science Press 2001.
23. Graham J.E., Rockwood K., Beattie E.L. et al. Prevalence and severity of cognitive impairment with and without dementia in an elderly population. Lancet 1997; 349: 1793—1796.
24. Hershey L.A., Olszewski W.A. Ischemic vascular dementia. In: Handbook of Demented Illnesses. Ed. by J.C. Morris. New York: Marcel Dekker 1994; 335—351.
25. Larrabee G.J., Crook T.H. Estimated prevalence of age associated memory impairment derived from standardized tests of memory function. Int Psychogeriat 1994; 6: 1: 95—104.
26. Levy R. Aging-associated cognitive decline. Int Psychogeriat 1994; 6: 63—68.
27. Lovenstone S., Gauthier S. Management of dementia. London: Martin Dunitz 2001.
28. Nagaraia D., Jayashree S. Randomised study of the dopamine receptor agonist piribedil in the treatment of mild cognitive impairment. Am J Psychiat 2001; 158: 9: 1517—1519.
29. Petersen R.S., Smith G.E., Waring S.C. et al. Aging, memory and mild cognitive impairment. Int Psychogeriat 1997; 9: 37—43.
30. Petersen R.S., Smith G.E., Waring S.C. et al. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999; 56: 303—308.
31. Petersen R.S. Current concepts in mild cognitive impairment. Arch Neurol 2001; 58: 1985—1992.
32. Petersen R.C., Stevens J.C., Ganguli M. et al. Practice parameter. Early detection of dementia: mild cognitive impairment (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2001; 56: 1133—1142.
33. Ritchie K., Artero S., Touchon J. Classification criteria for mild cognitive impairment: a population-based validation study. Neurology 2001; 56: 37—42.
34. Scholing W.E. Controlled trial of trivasal retard 50 and comparision with trivasal 20 in the treatment of clinical and mental signs of neurovascular disease. Sci Med 1977; 4: 4—8.
35. Scholing W.E. A double-blind study using psychometric tests Trivastal versus a reference compound. Temp Med 1982; 114.
36. Volkow N., Wang G., Fowler J. et al. Parallel loss of presynaptic and postsynaptic dopamine markers in normal aging. Ann Neurol 1998; 44: 1:143—147.
