Коррекция дефицита железа: исторические и современные аспекты
СтатьиОпубликовано в журнале:
«Вопросы практической педиатрии», 2014, т. 9, №4, с. 2-7 И.Н.Захарова, Е.Б.Мачнева
Российская медицинская академия последипломного образования, Москва, Российская Федерация
Дефицит железа остается одной из актуальных проблем педиатрии. Железо применялось в медицине еще задолго до объяснения механизмов его действия в организме человека. Многие литературные источники указывают на применение соединений железа для лечения целого ряда болезней, в том числе анемии. Однако по мере углубления знаний о метаболизме и функциях этого металла в организме человека менялись и схемы лечения, а также лекарственные формы железа. В настоящее время открыты многие новые механизмы поддержания баланса и обмена железа в организме. Показана значительная роль других металлов, таких как марганец и медь, в метаболизме железа. Также проведены исследования и доказана эффективность и безопасность комплексных препаратов, содержащих железо, медь и марганец, для лечения железодефицитных состояний у детей и взрослых. Ключевые слова: дети, дефицит железа, железо, марганец, медь, метаболизм, Тотема
Correction of iron deficiency: background and current aspects
I.N.Zakharova, E.B.MachnevaRussian Medical Academy of Post-Graduate Education, Moscow, Russian Federation
Iron deficiency remains one of the topical paediatric problems. Iron was used in medicine long before the mechanisms of its action in the human body were explained. Many authors pointed to the use of iron compounds for treatment of a number of diseases, including anaemia. As knowledge about the metabolism and functions of this metal in the human body was deepening, schemes of treatment and therapeutic forms of iron were also changing. At present, many new mechanisms of maintaining iron balance and metabolism in the body have been discovered. A significant role of other metals, such as manganese and copper, in iron metabolism has been demonstrated. Also, research work has been performed and the effectiveness and safety of complex drugs containing iron, copper and manganese for treatment of iron-deficiency conditions in children and adults have been proven. Key words: children, iron deficiency, iron, manganese, copper, metabolism, tothema
Дефицит железа остается одной из наиболее распространенных проблем педиатрии. По данным ВОЗ, железодефицитные состояния (ЖДС) занимают первое место среди 38 наиболее распространенных заболеваний человека, поскольку ими страдает более половины населения Земли [1]. Согласно современным представлениям, железо является эссенциальным микроэлементом, поскольку входит в структуру белков, участвует в работе ферментативных систем, обеспечивающих системный и клеточный аэробный метаболизм, а также окислительно-восстановительный гомеостаз организма. Железо, являясь структурным компонентом целого ряда ферментов, участвует в транспорте электронов (цитохромы, железосеропротеиды), кислорода (миоглобин, гемоглобин), а также в окислительно-восстановительных реакциях (оксидазы, гидроксилазы, супероксиддисмутаза) [2] (табл. 1).
Таблица 1. Железосодержащие белки организма и их функции [2]
| Белок | Локализация | Функция |
| Гемоглобин | Эритроциты | Перенос кислорода к тканям |
| Миоглобин | Мышцы | Накопление кислорода |
| Железосодержащие белки | Большинство митохондрий (цитохромы и др.) клеток | Производство энергии в клетках (АТФ) |
| Трансферрин | Кровь | Транспортировка железа |
| Ферритин/гемосидерин | Железосодержащие ферменты (каталазы, пероксидазы, ксантиноксидазы) | Депо железа |
| Печень, селезенка, костный мозг |
Везде | Разнообразные функции в метаболизме |
Накопленные данные о метаболизме и транспорте железа в организме человека помогли разработать оптимальные лекарственные формы препаратов для коррекции дефицита железа. Лечение железодефицитных состояний должно проводиться как можно раньше. Последствия дефицита железа могут оказать неблагоприятное воздействие на организм человека, поскольку железосодержащие белки представлены во всех органах и тканях, а нарушение их функций приводит к нарушению целого ряда жизненно важных процессов. В настоящее время изучены механизмы и последствия латентного дефицита железа и железодефицитной анемии на организм ребенка [3, 4]. Дефицит железа у детей раннего возраста оказывает негативное влияние на процессы формирования центральной нервной системы, что может иметь отдаленные последствия, поскольку железо входит в состав ферментов (гидроксилаза, тирозингидроксилаза) и участвует в синтезе нейротрансмиттеров (серотонин, норэпинефрин, допамин) [5–7]. В период младенчества наличие железодефицитной анемии способствует замедлению темпов психомоторного развития, а в школьный период – ухудшению познавательных способностей и плохой успеваемости в школе. Многочисленные научные исследования продемонстрировали, что дети, страдавшие анемией до 2-летнеговозраста, имеют когнитивные нарушения и снижение успеваемости в школе в возрасте от 4 до 19 лет [8–10].
В исследованиях на животных показано, что дефицит железа во внутриутробном и неонатальном периоде у грызунов не влияет на общий размер головного мозга. Однако у них наблюдается уменьшение размеров гиппокампа, отвечающего за обучение и память [11]. Обнаружено снижение дендритных разветвлений в гиппокампе, сохраняющееся в зрелом возрасте [12]. Железо участвует в синтезе миелина, а сидеропения в перинатальный период нарушает синтез и изменяет его состав [13]. Дефицит железа способствует снижению памяти, способности к обучению и концентрации внимания, а также к задержке речевого развития и снижению физической активности [9, 14, 15]. Все вышеизложенное должно привлекать педиатров к проблеме железодефицитных состояний для проведения своевременной их коррекции.
Железо c древнейших времен использовалось для изготовления орудий труда, оружия, посуды, украшений. История применения железа для терапии железодефицитных состояний началась задолго до объяснения механизмов его действия. Первые сведения о целительных свойствах железа найдены у персидского врача Melampus (4000 до н.э.), который давал препараты железа морякам, потерявшим много крови от ранений во время сражений. Сына царя Аргоса лекарь лечил вином, в котором длительное время находился ритуальный жертвенный меч. Гиппократ и Диоскуридис предписывали пить вино, в которое предварительно клали железные предметы. Древние греки для восполнения дефицита железа рекомендовали есть яблоки, которые заранее протыкали ржавыми гвоздями, а римские легионеры пили воду, в которой охлаждали свои железные доспехи, чтобы «черпать» свою силу. Терапевтическое применение железа описывается Гиппократом (460–377 до н.э.), которого называют отцом современной медицины. Полагают, что Гиппократ был первым, кто использовал соли железа как кровоостанавливающее средство. Он писал, что «те болезни, при которых лекарства не помогают, лечит железо, те, которые железо не может вылечить, лечит огонь, а те, которые огонь не может вылечить, могут считаться неизлечимыми». В Аюрведе железо рекомендуется для лечения 55 хронических заболеваний, включая анемию [17].
Впервые для лечения анемии начал применять железо в клинической практике Sydenham (1624–1689) [16]. Врач Monarde жил в XVI веке в Севилье и считал, что железо в качестве лекарства можно использовать для лечения облысения, угревой сыпи, раневых поверхностей, свищей, рожи, паронихия, вагинальных выделений, цистита, геморроя, подагры, туберкулеза, диареи, чрезмерного слезотечения, рвоты, слабости, отеков, лихорадки [18]. Lemery и Geoffry в 1713 г. представили прямые доказательства того, что железо присутствует в крови человека. Позднее роль железа в организме человека была доказана в экспериментальных условиях (в опытах на собаках) Colette (1897), который показал, что дефицит железа в пище и/или потери железа из организма провоцируют развитие специфического заболевания – железодефицитной анемии. Доктор Стивен Карри в 1840 г. доказал наличие железа в молекуле гемоглобина [17]. В 1925 г. Thivolle с соавт. опубликовали данные о существовании негемового железа в сыворотке крови и предположили, что это циркулирующая транспортная форма. В последующие годы был обнаружен транспортный белок трансферрин, было установлено, что железо отделяется от него при низком значении рН в желудочно-кишечном тракте (ЖКТ). В 1937 г. Laufberger впервые выделил ферритин из селезенки лошади. В 1937 г. McCance и Widdowson, обобщив экспериментальные данные, показали, что фекалии содержат некоторое количество железа, количество которого меняется в зависимости от характера пищи. В моче очень мало железа, а уровень его практически не зависит от концентрации в пище. Авторы подтвердили, что организм человека может накапливать железо, транспортировать его в организме, а для поддержания здоровья детей и взрослых нужно потреблять железо из природных продуктов питания. Было показано, что есть характерные гендерные различия между содержанием железа у мужчин и женщин, а гипохромные анемии можно вылечить путем введения железа [18]. В 1932 г. Locke с соавт. описали анемии у больных с инфекционными, воспалительными и онкологическими заболеваниями. В 1958 г. Клем Финч опубликовал первые статьи, посвященные абсорбции железа в организме человека, и разработал способ оценки эритроидной функции костного мозга у человека [17]. Эволюция представлений врачей о значении и метаболизме железа в организме человека продолжается до настоящего времени, разрабатываются наиболее оптимальные лекарственные формы препаратов железа. Согласно современным представлениям, железо является незаменимым микроэлементом, участвующим в биохимических процессах организма человека. С другой стороны, свободное, нехелатированное железо образует опасные гидроксильные радикалы, которые могут вызвать гибель клеток [19]. Этот феномен продолжает изучаться, что открывает новые возможности для более эффективного и безопасного лечения железодефицитных состояний. Особого внимания заслуживают данные об участии других металлов (меди, марганца, цинка) в гомеостазе железа.
Всасывание железа наиболее интенсивно происходит в энтероцитах двенадцатиперстной кишки (рис. 1). Клетки-предшественники энтероцитов получают информацию о потребностях организма в железе, а апикальная мембрана дифференцированных энтероцитов специализируется на транспорте гема и закисного железа в клетку. Существует три пути этого транспорта, но наиболее изучен путь поступления железа посредством двухвалентного транспортера металла (ДМТ-1). В кислой среде желудка железо получает необходимые протоны, затем с помощью ферроредуктазы (медьсодержащий фермент) щеточной каймы происходит восстановление окисной формы железа в закисную. ДМТ-1 транспортирует закисное железо и другие двухвалентные металлы (марганец, медь, кобальт, цинк, кадмий и свинец) из просвета кишечника в энтероцит. Экспрессия ДМТ-1 регулируется запасами железа в организме, а также элементарным железом. Затем железо экспортируется в плазму с помощью ферропортина, расположенного на базолатера ной стороне энтероцита. Часть абсорбированного железа может депонироваться в энтероците в виде ферритина. Связывание железа с трансферрином плазмы требует его предварительного окисления до трехвалентного железа, которое происходит при участии трансмембранного протеина гефестина – энзима, наполовину гомологичного церулло-плазмину и принадлежащему к семейству мультимедных оксидаз. Существует механизм всасывания гемового железа, который не до конца изучен, но, по последним данным, зависит от белка переносчика гема (HCP-1) [19].
Рис. 1. Абсорбция железа из пищи в двенадцатиперстной кишке.
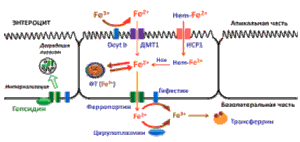
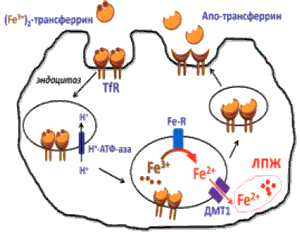
После связывания железа с трансферрином происходит доставка его к тканям. Клетки различных тканей поглощают железо благодаря трансферриновым рецепторам. Внекле точный двухвалентный трансферрин связывается с трансферриновыми рецепторами и путем эндоцитоза попадает в клетку. Железо в эндосомах освобождается от трансферрина путем уменьшения рН, а затем транспортируется через мембрану с помощью специального белка. Как только железо выходит из эндосом, оно попадает в компартмент клетки, известный как внутриклеточный пул железа. Апоферритин, связанный с трансферриновым рецептором, высвобождается путем экзоцитоза. Железо, которое попадает в клетку, используется либо для метаболизма, либо депонируется в виде ферритина. Пред полагается, что железо внутриклеточного пула модулирует активность железо-регуляторных белков 1 и 2 (IRP-1 и IRP-2). Процессы окисления и восстановления железа в эндосомах при отщеплении трансферрина, а также транспортировки его через мембраны клеточных органелл происходят при участии медь- и марганецсодержащих белков [19, 20]. Рецептор-опосредованный процесс поглощения железа клетками организма и его распределение внутри клеток представлен на (рис. 2).
Рис. 2. Рецептор-опосредованный захват железа клеткой из трансферрина. TfR – рецептор трансферрина; Fe-R – эндосомальная Сu-НАДН-зависимая редуктаза железа (STEAP); ДМТ1 – Mn-зависимый переносчик двухвалентных металлов; ЛПЖ – лабильный пул железа.
Учитывая особенности абсорбции железа в кишечнике, а также процессы поглощения железа клетками организма с участием ферментов и транспортных медь- и марганецсодержащих белков, можно предположить, что для оптимального всасывания железа в кишечнике необходимо достаточное поступление меди и марганца. В настоящее время все особенности обмена железа учитываются при создании препаратов для эффективного и наиболее безопасного лечения железодефицитных состояний. Например, существует опыт применения препарата Тотема в лечении железодефицитных состояний у детей и взрослых, который содержит соли не только железа, но и марганца и меди (табл. 2).
Таблица 2. Состав препарата Тотема [21]
| Раствор для приема внутрь | 10 мл |
| Железо (глюконат) | 50 мг |
| Марганец (глюконат) | 1,33 мг |
| Медь (глюконат) | 0,7 мг |
В исследовании, проведенном А.Г.Румянцевым и соавт. (2006), показано, что применение препарата Тотема позволило нормализовать гематологические показатели в течение одного месяца и показатели метаболизма железа в течение 3 мес у всех пациентов с железодефицитными состояниями разной степени тяжести. Применение комплексного препарата Тотема, содержащего соли железа, меди и марганца у детей с ЖДС в отсутствие микроэлементоза, не привело к превышению содержания микроэлементов в крови, что свидетельствует о безопасности применения препарата при отсутствии данных о микроэлементном статусе пациента. Побочные эффекты препарата Тотема были незначительными, а токсические эффекты от применения препарата отсутствовали [22].
А.Н.Квезерели-Коладзе с соавт. (2012) провели исследование, целью которого явилась оценка эффективности препарата Тотема при лечении железодефицитной анемии у детей раннего возраста с сопутствующим дефицитом меди. Под наблюдением находилось 42 пациента с ЖДА в возрасте от 4 мес до 3 лет. В ходе исследования было установлено, что ЖДА у детей раннего возраста часто протекает с сопутствующим дефицитом меди и церулоплазмина, особенно у недоношенных и детей с продолжительной диареей в анамнезе. Препарат Тотема при этом является эффективным антианемическим препаратом при лечении ЖДА у детей раннего возраста с сопутствующим дефицитом меди. Тотема одновременно восполнял дефицит железа и меди, препятствуя формированию железорезистентной анемии, вызванной недостатком меди [23].
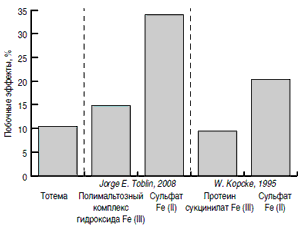
Н.И.Стуклов (2012) провел мета-анализ 30 открытых проспективных исследований (n = 1077), посвященных сравнению переносимости жидкой формы глюконата железа II, меди и марганца (Тотема) с двухвалентными и трехвалентными препаратами железа (рис. 3). Он показал, что частота нежелательных реакций на прием препарата в среднем составила 10,4% (112 пациентов). Побочные явления в основном были представлены легкими, непродолжительными диспепсическими реакциями (8,5%), не требующими отмены препарата. Аллергические реакции в виде необильной сыпи были отмечены в 0,7%, потемнение эмали зубов – в 1,0%. Отказаться от дальнейшего приема препарата Тотема были вынуждены лишь 1,1% пациентов [24].
Рис. 3.Сравнение результатов исследований безопасности при-менения различных железосодержащих препаратов [24].
Препарат Тотема выпускается в жидкой лекарственной форме, при приеме содержимое ампул растворяют в воде (с сахаром или без). Нельзя растворять препарат в спиртсодержащих жидкостях, а также в чае, кофе, молоке, желательно принимать натощак. Препарат разрешен к применению у детей, начиная с 3-х месячного возраста. Детям раннего возраста его назначают в дозе 5–7 мг элементарного железа в сутки на кг массы тела в 2–3 приема, подросткам назначают по 150 мг/сут. Обычно препарат применяется в терапевтической дозе до нормализации уровня гемоглобина, а в поддерживающей (2–3 мг/кг/сут) – в течение последующих 2 мес [25].
Таким образом, несмотря на то, что соединения железа применялись для лечения заболеваний более тысячи лет, знания о его функциях и метаболизме в организме человека постоянно пополняются новыми данными. Учитывая современные представления об обмене железа, очевидным является тот факт, что в нем участвуют и другие металлы (марганец, медь). Проведенные исследования эффективности и безопасности комплексного препарата Тотема, содержащего соединения железа, меди и марганца, показывают целесообразность его назначения для лечения ЖДС как у детей, так и у взрослых.
ЛИТЕРАТУРА References
1. Feeding and nutrition of infants young children. Guidelines for the WHO European Region, with emphasis on the former Soviet countries. WHO Regional Publications, European Series, 87. WHO, 2000, updated reprint 2003.
2. Эллиот В, Эллиот Д. Биохимия и молекулярная биология. М.: Издательство НИИ Биомедицинской химии РАМН, 2000.
3. Коровина НА, Заплатников АП, Захарова ИН. Железодефицитные анемии у детей. М.: Изд-во Посад, 1998.
4. Кузьмина ЛА. Гематология детского возраста. М.: МЕДпресс-информ, 2001.
5. Lozoff B, Jimenez E, Smith JB. Double burden of iron deficiency in infancy and low socioeconomic status: a longitudinal analysis of cognitive test scores to age 19 years. Arch Pediatr Adolesc Med. 2006;160(11):1108-13.
6. McCann JC, Ames BN. An overview of evidence for a causal relation between iron deficiency during development and deficits in cognitive or behavioral function. Am. J Clin Nutr. 2007;85(4):931-45.
7. Youdim MBH, Green AR. Iron deficiency and neurotransmitter synthesis and function. Proc Nutr Soc. 1978;37:173-9.
8. Захарова ИН, Горяйнова АН, Мачнева ЕБ, Дмитриева ЮА, Мозжухина МВ. Дефицит железа у детей раннего возраста и способы его коррекции. Вопросы современной педиатрии. 2013;2(12):52-8.
9. Коровина НА, Захарова ИН, Свинцицкая ВИ. Дефицит железа и когнитивные расстройства у детей. Лечащий врач. 2006;5:69.
10. Lozoff B, Beard J, Connor J, Barbara F, Georgieff M, Schallert T. Long-lasting neural and behavioral effects of iron deficiency in infancy. Nutr Rev. 2006;64(Suppl):34-43.
11. Cusick SE, Georgieff MK. Nutrient Supplementation and Neurodevelopment. Arch Pediatr Adolesc Med. 2012;166(5):481-2.
12. Jorgenson LA, Wobken JD, Georgieff MK. Perinatal iron deficiency alters apical dendritic growth in hippocampal CA1 pyramidal neurons. Dev Neurosci. 2003;25:412-20.
13. Kwik-Uribe CL, Gietzen D, German JB, Golub MS, Keen CL. Chronic marginal iron intakes during early development in mice result in persistent changes in dopamine metabolism and myelin composition. J Nutr. 2000;130:2821-30.
14. Lozoff B, Jiminez E, Wolf AW. Long term development outcome of infants with iron deficiency. N Eng J Med. 1991;325:687-94.
15. Roncagliolo M, Garrido M, Walter T, Peirano P, Lozoff B. Evidence of altered central nervous system development in infants with iron deficiency anemia at 6 mo: delayed maturation of auditory brainstem responses. Am J Clin Nutr. 1998;68:683-90.
16. Russel L. Haden. Historical aspects of iron therapy in anemia. JAMA. 1938;111(12):1059-61.
17. Panda AK, Mishra S, Mohapatra SK. Iron in Ayurvedic Medicine. Journal of Advances in Developmental Research. 2011;2(2):287-93.
18. Beutler E. History of Iron in Medicine. Blood cells, Molecules and Diseases. 2002;29(3):297-308.
19. Павлов АД, Морщакова ЕФ, Румянцев АГ. Эритропоэз, эритропоэтин, железо. Молекулярные и клинические аспекты. М.: ГЭОТАР-Медиа; 2011.
20. Громова ОА, Торшин ИЮ, Хаджидис АК. Анализ молекулярных механизмов воздействия железа (II), меди, марганца в патогенезе железодефицитной анемии. Клиническая фармакология и фармаэкономика. 2010;1:1-9.
21. Регистр Лекарственных Средств России. РЛС–2013.21 (Электронная Энциклопедия Лекарств). ООО «РЛС-Патент», 2013.
22. Румянцев АГ, Ковригина ЕС, Царегородцев АД, Кешишян ЕС, Савкова РФ, Инюшкина ЕВ. Клиническое изучение эффективности и переносимости препарата Тотема в лечении железодефицитных состояний у детей раннего возраста (III фаза). Отчет по клиническому исследованию по протоколу Th№ 1/5PR. ФГУ ФНКЦ детской гематологии, онкологии и иммунологии; ФГУ МНИИ педиатрии и детской хирургии Росздрава; ГУЗ Московский областной онкологический центр, 2006.
23. Квезерели-Коладзе АН, Мтварелидзе ЗГ. Применение препарата Тотема при лечении железодефицитной анемии у детей раннего возраста. Современная педиатрия. 2012;3(31):1-4.
24. Стуклов НИ. Мета-анализ данных переносимости питьевой формы глюконата железа (II), меди и марганца (препарат Тотема) при лечении железодефицит-ной анемии у детей и взрослых. Земский врач. 2012;4(15):11-20.
25. Анмут СЯ, Санеева ОБ, Чупрова АВ. Применение препарата Тотема в лечении железодефицитной анемии у детей. Педиатрия. 2001;2:68-70.
1. Feeding and nutrition of infants young children. Guidelines for the WHO European Region, with emphasis on the former Soviet countries. WHO Regional Publications, European Series, 87. WHO, 2000, updated reprint 2003.
2. Elliot V, Elliot D. Biokhimiya i molekulyarnaya biologiya. Moscow: Izdatelstvo NII Biomeditsinskoy khimii RAMN, 2000. (In Russian).
3. Korovina NA, Zaplatnikov AP, Zakharova IN. Zhelezodefitsitnyye anemii u detey. Moscow: Izd-vo Posad, 1998. (In Russian).
4. Kuzmina LA. Gematologiya detskogo vozrasta. Moscow: MEDpress-inform, 2001. (In Russian).
5. Lozoff B, Jimenez E, Smith JB. Double burden of iron deficiency in infancy and low socioeconomic status: a longitudinal analysis of cognitive test scores to age 19 years. Arch Pediatr Adolesc Med. 2006;160(11):1108-13.
6. McCann JC, Ames BN. An overview of evidence for a causal relation between iron deficiency during development and deficits in cognitive or behavioral function. Am. J Clin Nutr. 2007;85(4):931-45.
7. Youdim MBH, Green AR. Iron deficiency and neurotransmitter synthesis and function. Proc Nutr Soc. 1978;37:173-9.
8. Zakharova IN, Goriaynova AN, Machneva EB, Dmitrieva JA, Mozzhukhina MV. Iron Deficiency in Young Children and Methods of its Correction. Voprosy sovremennoy pediatrii. 2013;2(12):52-8. (In Russian).
9. Korovina NA, Zakharova IN, Svintsitskaya VI. Defitsit zheleza i kognitivnyye rasstroystva u detey. Lechashchiy vrach. 2006;5:69. (In Russian).
10. Lozoff B, Beard J, Connor J, Barbara F, Georgieff M, Schallert T. Long-lasting neural and behavioral effects of iron deficiency in infancy. Nutr Rev. 2006;64(Suppl):34-43.
11. Cusick SE, Georgieff MK. Nutrient Supplementation and Neurodevelopment. Arch Pediatr Adolesc Med. 2012;166(5):481-2.
12. Jorgenson LA, Wobken JD, Georgieff MK. Perinatal iron deficiency alters apical dendritic growth in hippocampal CA1 pyramidal neurons. Dev Neurosci. 2003;25:412-20.
13. Kwik-Uribe CL, Gietzen D, German JB, Golub MS, Keen CL. Chronic marginal iron intakes during early development in mice result in persistent changes in dopamine metabolism and myelin composition. J Nutr. 2000;130:2821-30.
14. Lozoff B, Jiminez E, Wolf AW. Long term development outcome of infants with iron deficiency. N Eng J Med. 1991;325:687-94.
15. Roncagliolo M, Garrido M, Walter T, Peirano P, Lozoff B. Evidence of altered central nervous system development in infants with iron deficiency anemia at 6 mo: delayed maturation of auditory brainstem responses. Am J Clin Nutr. 1998;68:683-90.
16. Russel L. Haden. Historical aspects of iron therapy in anemia. JAMA. 1938;111(12):1059-61.
17. Panda AK, Mishra S, Mohapatra SK. Iron in Ayurvedic Medicine. Journal of Advances in Developmental Research. 2011;2(2):287-93.
18. Beutler E. History of Iron in Medicine. Blood cells, Molecules and Diseases. 2002;29(3):297-308.
19. Pavlov AD, Morshchakova YeF, Rumyantsev AG. Eritropoez, eritropoetin, zhelezo. Molekulyarnyye i klinicheskiye aspekty. Moscow: GEOTAR-Media; 2011. (In Russian).
20. Gromova OA, Torshin IYu, Khadzhidis AK. Analiz molekulyarnykh mekhanizmov vozdeystviya zheleza (II), medi, margantsa v patogeneze zhelezodefitsitnoy anemii. Klinicheskaya farmakologiya i farmaekonomika. 2010;1:1-9. (In Russian).
21. Registr Lekarstvennykh Sredstv Rossii. RLS–2013.21 (Elektronnaya Entsiklopediya Lekarstv). OOO «RLS-Patent», 2013. (In Russian).
22. Rumyantsev AG, Kovrigina YeS, Tsaregorodtsev AD, Keshishyan YeS, Savkova RF, Inyushkina YeV. Klinicheskoye izucheniye effektivnosti i perenosimosti preparata Totema v lechenii zhelezodefitsitnykh sostoyaniy u detey rannego vozrasta (III faza). Otchet po klinicheskomu issledovaniyu po protokolu Th№ 1/5PR. FGU FNKTs detskoy gematologii, onkologii i immunologii; FGU MNII pediatrii i detskoy khirurgii Roszd-rava; GUZ Moskovskiy oblastnoy onkologicheskiy tsentr, 2006. (In Russian).
23. Kvezereli-Koladze AN, Mtvarelidze ZG. Primeneniye preparata Totema pri lechenii zhelezodefitsitnoy anemii u detey rannego vozrasta. Sovremennaya pediatriya. 2012;3(31):1-4. (In Russian).
24. Stuklov NI. Meta-analiz dannykh perenosimosti pityevoy formy glyukonata zheleza (II), medi i margantsa (preparat Totema) pri lechenii zhelezodefitsitnoy anemii u detey i vzroslykh. Zemskiy vrach. 2012;4(15):11-20. (In Russian).
25. Anmut SA, Saneeva ОВ, Chuprova AV. Usage of tot'hema in treatment of pediatrie iron deficient anemia. Pediatriya. 2001;2:68-70. (In Russian).
Комментарии
ПРАКТИКА ПЕДИАТРА
