Грандаксин в неврологической практике (мультицентровое исследование)
Статьи Опубликовано в журнале Журнал неврологии и психиатрии 2009; 9:44-48 Г.М. Дюкова, Е.В. Саксонова, В.Л. ГолубевКафедра нервных болезней факультета послевузовского профессионального образования Московской медицинской академии им. И.М. Сеченова
В клинической практике невролога часто встречаются расстройства, в генезе которых существенную роль играет психогенный фактор. Подобные нарушения проявляют себя, как правило, эпизодическими или хроническими головными болями, слабостью и утомляемостью, нарушениями сна, головокружениями, одышкой, жалобами со стороны сердечно-сосудистой системы, нарушениями терморегуляции и потоотделения, диспептическими и прочими расстройствами, объединяемыми общим термином "синдром вегетативной дистонии". Так, в одном из исследований [9] при анализе 20 самых часто ставящихся диагнозов у 7836 амбулаторных больных неврологического профиля было установлено, что доминировали такие его формулировки: "головные боли напряжения", "мигрень", "конверсионная истерия" и "обмороки", "гипервентиляционный синдром" и "депрессия". Согласно современной терминологии эти клинические формы могут быть обозначены такими общими терминами, как "психовегетативный синдром" (ПВС) или "медицински необъяснимые симптомы". A.M. Вейном и соавт. [2] было выявлено, что у подобных больных за яркими вегетативно-соматическими жалобами могут быть скрыты эмоционально-аффективные расстройства (тревожные, депрессивные, ипохондрические и др.).
ПВС может предшествовать или сопровождать различные соматические и неврологические заболевания - например, сосудистые, дегенеративные заболевания ЦНС, радикулопатии и нейропатии, эпилепсию, рассеянный склероз и т.д. При этом нередко степень инвалидизации пациента и нарушение качества жизни в значительной мере обусловлены не столько тяжестью основного заболевания, сколько выраженностью ПВС. Именно поэтому терапия этих расстройств является актуальной задачей невролога.
При выборе тактики лечения больных с первичным или сопутствующим ПВС перед неврологом встают проблемы, связанные со следующими обстоятельствами: частое отсутствие у больного осознания имеющихся у него эмоциональных расстройств и готовность обсуждать и тем более устранять их; неготовность пациента к лечению антидепрессантами при хроническом течении заболевания; отсроченный эффект антидепрессантов только к 3-4-й неделе, т.е. к моменту выписки больного, что не позволяет в короткий период пребывания в стационаре добиться существенного улучшения; опасность того, что в случае приема антидепрессанта после выписки из стационара и окончания контакта с врачом больные нередко прерывают лечение, не добившись очевидного и стабильного эффекта, что приводит к подрыву веры в излечение, дискредитации антидепрессанта и хронизации заболевания.
В связи с вышесказанным, вопросы рационального ведения больных с ПВС остаются актуальной проблемой практикующего невролога. Основными лекарствами для лечения подобных больных являются сосудистые, метаболические, ноотропные и витаминные препараты. Применение психотропных препаратов, в частности транквилизаторов из группы бензодиазепинов (седуксен, феназепам, клоназепам, альпразолам и др.), чревато развитием зависимости при длительном применении (в том числе и после выписки), а в случае быстрой отмены - обострением симптоматики.
В связи с вышеперечисленными обстоятельствами, актуальным представляется поиск препарата, эффективно купирующего психовегетативные расстройства, но при этом не обладающего недостатками, присущими типичным бензодиазепинам [3-6]. Таким препаратом может служить бензодиазепиновый транквилизатор Грандаксин.
Грандаксин (тофизопам) впервые появился в середине 70-х годов (он выпускался венгерским фармацевтическим заводом EGIS) [7,10]. Главной особенностью тофизопама является место расположения нитрогенной группы. Если у традиционных бензодиазепинов нитрогенная группа находится в положении 1-4, то у тофизопама она расположена в положении 2-3, в связи с чем его обычно обозначают как 2-3-бензодиазепин. Как и все транквилизаторы бензодиазепинового ряда, он использует в качестве основного действующего вещества неспецифический тормозной медиатор - ГАМК, именно это обусловливает широкий спектр тормозящих влияний как на эмоциональную сферу (уменьшение тревоги, страха, напряжения), так и на вегетативные функции организма (вегето-стабилизирующий эффект). В то же время, являясь нетипичным транквилизатором, тофизопам обладает следующими уникальными свойствами: к нему не развивается физическая зависимость; он не обладает седативными и миорелаксирующими эффектами; не потенцирует действие алкоголя; не ухудшает когнитивные функции (в частности, не нарушает внимание); не обладает кардиотоксическим эффектом (напротив, показано благоприятное влияние на коронарный кровоток и потребность миокарда в кислороде); оказывает умеренное стимулирующее действие и поэтому относится к группе "дневных" транквилизаторов. [8].
Подобные качества Грандаксина предопределили широкое использование его в неврологической практике. В частности, препарат применяют при психовегетативных расстройствах невротического генеза [1], при их сочетании с цереброваскулярными заболеваниями, в том числе и у пожилых пациентов с соматическими и когнитивными расстройствами. В амбулаторной практике его применяют при лечении стрессовых расстройств, расстройств адаптации, при необходимости проведения лечения без отрыва от профессиональной деятельности. Кроме всего прочего, у Грандаксина отмечен благоприятный профиль переносимости.
Целью настоящего исследования было определение эффективности Грандаксина при лечении больных с психовегетативными расстройствами при добавлении его в стандартную схему терапии.
Материалы и методы
Работа проводилась в формате мультицентрового исследования. В ней приняли участие неврологические клиники из 11 городов России.1
1 В исследовании участвовали Г.М. Дюкова (Москва), Е.Л. Пугачева (Санкт-Петербург), С.С. Павленко (Новосибирск), СП. Маркин (Воронеж), В.Ф. Филатов (Ярославль), В.А. Рыбак (Волгоград), А.П. Рачин (Смоленск), А.Ю. Савченко (Омск), Ю.В. Тринитатский (Ростов-на-Дону), М.В. Родиков (Красноярск), Л.Б. Новикова (Уфа).
Критериями включения пациентов были: возраст от 18 до 55 лет, проведение лечения как в стационарных, так и в амбулаторных условиях, суммарный показатель по субъективной вегетативной анкете - более 15 баллов, по объективной вегетативной анкете - более 25 баллов, уровень реактивной тревоги по тесту Спилбергера - не менее 30 баллов, информированное согласие на участие в исследовании.
Критерии исключения: наличие острого или обострения тяжелого хронического неврологического и/или соматического заболевания (тяжелые нарушения функции почек и/или печени, недавно перенесенный инфаркт миокарда и др.), одновременный прием психотропных препаратов, беременность и период кормления.
Для исследования психовегетативных функций были использованы следующие инструменты: шкала тревоги Спилбергера для оценки ситуационной или реактивной (РТ) и личностной (ЛТ) тревоги; тест Бека для определения уровня депрессии (ДБ); оценка степени выраженности вегетативной дисфункции как по субъективным (ВДС), так и по объективным (ВДО) показателям; анкета гипервентиляции (АГ); анкета сна, отражающая субъективную удовлетворенность сном (АС); шкала общего клинического впечатления (CGI); дифференцированная оценка частоты и выраженности побочных эффектов (шкала UKU).
Диагностика ПВС основывалась на клиническом и анкетном выявлении полисистемных вегетативных, эмоционально-аффективных и мотивационных расстройств.
Всего были обследованы 272 пациента, но результаты обследования 52 больных не вошли в окончательную обработку по следующим причинам: несоответствие критериям включения пациентов; незавершение курса лечения, не связанное с побочным действием препарата; неправильное заполнение протоколов; прием во время исследования других психотропных препаратов.
Таким образом, полученные результаты основывались на данных обследования 220 пациентов с психовегетативным синдромом. Их диагнозы по МКБ-10 относились к следующим 4-м группам расстройств:
- расстройство вегетативной (автономной) нервной системы (G90,G90.8,G90.9);
- невротические, связанные со стрессом и соматоформные расстройства (F4), в том числе другие тревожные расстройства (F41), расстройства адаптации со смешанной тревожной и депрессивной реакцией (F43.22), соматоформные расстройства (F45), другие невротические расстройства (F48), неврастения (F48.0);
- тревожное расстройство органической природы (F06.4);
- эмоциональные нарушения (R45).
Вся группа состояла из пациентов, средний возраст которых был около 40 лет, преимущественно женщин, большинство из которых состояли в браке и работали. Средняя длительность настоящего обострения была 20-23 мес. У 35% больных наряду с ПВС были и другие заболевания (дисциркуляторная энцефалопатия, вертебробазилярная недостаточность, мигрень без ауры, цервикалгии и люмбалгии), и у 65% в клинической картине был только ПВС.
Включенные в исследование пациенты были разделены на 2 группы: основная (140 больных) и контрольная (80 больных). Пациентам основной группы в дополнение к традиционной терапии (сосудистой, метаболической, ноотропной и др.) был назначен транквилизатор Грандаксин. Пациенты контрольной группы принимали стандартное лечение сосудисто-метаболическими препаратами без добавления Грандаксина. Прием каких-либо психотропных препаратов на момент исследования в обеих группах исключался, при этом допускался прием седативных препаратов растительного происхождения. Грандаксин применялся в суточной дозе 150 мг (по 1 таблетке 3 раза в сутки - утром, днем и вечером). В случае нарушений сна - 2 таблетки утром и 1 таблетка днем. Длительность терапии и протокольного наблюдения - 28 дней. Назначенная доза сохранялась до конца протокольного наблюдения. Контроль осуществлялся через 14 и 28 дней. По окончании терапевтической фазы программы оценивалась динамика состояния пациентов и фиксировались побочные эффекты лечения.
Обработка результатов проводилась с использованием пакета статистических программ Statistica 6.
Результаты
Анализ социодемографических и клинических особенностей больных до начала лечения: пациенты основной и контрольной групп достоверно не различались по полу, возрасту, профессиональной занятости, семейному статусу, наличию психотравмирующей ситуации, длительности заболевания, основному и сопутствующему диагнозу.
На начальном этапе исследования они также достоверно не различались по уровню тревожности, депрессии, выраженности объективных и субъективных вегетативных расстройств, гипервентиляции, а также в оценке по шкале CGI. Однако в основной группе качество сна было достоверно хуже в сравнении с контрольной группой. Таким образом, сравниваемые группы были, в основном, сопоставимы по социо-демографическим факторам и клиническим проявлениям заболевания.
Результаты лечения
Анализ динамики эмоциональных расстройств на фоне лечения. Уже ко 2-й неделе лечения в обеих группах достоверно снизились как реактивная, так и личностная тревога, однако степень этих изменений была существенно больше в основной группе, т.е. в группе лечившихся Грандаксином. Подобные изменения отмечались и на 4-й неделе терапии. Таким образом, если в начале лечения основная и контрольная группы достоверно не различались по уровню тревоги, то уже ко 2-й неделе и особенно к 4-й оба типа тревоги в группе пациентов, принимающих Грандаксин, стали значительно ниже, чем в контрольной. На рис. 1 и 2 представлена динамика показателей реактивной и личностной тревоги на 3 этапах терапии: 1) на момент начала лечения (РТ-1, ЛТ-1); 2) через 2 нед лечения (РТ-2, ЛТ-2); 3) через 4 нед терапии (РТ-3, ЛТ-3).
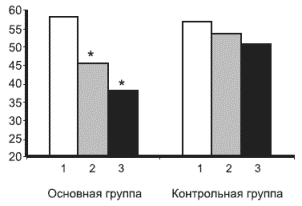
Рис. 1. Динамика реактивной тревоги в начале лечения, через 2 и 4 нед терапии в основной и контрольной группах
В каждой группе столбцов: 1-й - РТ-1, 2-й - РТ-2, 3-й - РТ-3 (объяснение в тексте)
Здесь и на рис. 2: *- достоверность различий между основной и контрольной группами (р<0,0004-0,0).
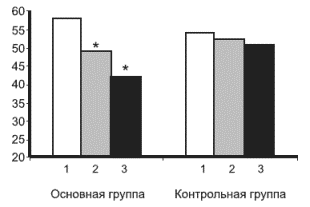
Рис. 2. Динамика личностной тревоги в начале лечения, через 2 и 4 нед терапии в основной и контрольной группах
В каждой группе столбцов: 1 -й - ЛТ-1, 2-й - ЛТ-2: 3-й - ЛТ-3 (объяснение в тексте)
Перед началом лечения уровень депрессии был практически одинаков в обеих группах и составлял 19-20 баллов (т.е. умеренно-сильная депрессия). Ко 2-й неделе лечения показатели депрессии достоверно снизились как в основной, так и в контрольной группах, однако степень этих изменений была в основной группе существенно больше. В основной группе депрессия составила 12 баллов, т.е. стала мягкой степени, а в контрольной - 17 баллов т.е. мягко-умеренной степени. Подобные изменения стали особенно выражены к 4-й неделе, когда в основной группе депрессия достигла 8 баллов, снизившись до нормы, а в контрольной - 15 баллов, т.е. оставалась на границе мягкой и умеренной. На рис. 3 показана степень изменений в эмоциональной сфере (тревога и депрессия) в основной и контрольной группах к 4-й неделе лечения.
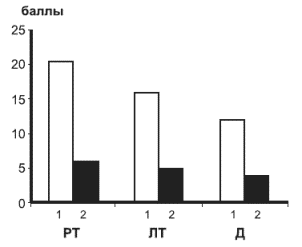
Рис. 3.. Степень изменений реактивной (РТ) и личностной (ЛТ) тревоги и депрессии (Д) в основной (I) и контрольной (II) группах к 4-й неделе терапии Различия между основной и контрольной группами: РТ - р<0,003; ЛТ - р<0,005; Д - р<0,0004
Исследование вегетативной сферы. Уровень вегетативной дистонии оценивался с помощью анкеты субъективных и объективных нарушений. Средние показатели выраженности вегетативной дисфункции в основной и контрольной группах в начале лечения достоверно не различались, однако уже ко 2-й неделе и особенно к 4-й оба показателя в основной группе стали значительно ниже, чем в контрольной.
На рис. 4 отражен показатель изменений вегетативной дистонии в основной и контрольной группах.
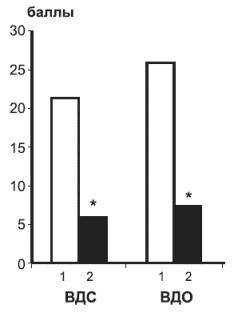
Рис. 4. Динамика изменений выраженности вегетативной дистонии в основной (I) и контрольной (II) группах по анкете субъективных (ВДС) и объективных (ВДО) нарушений, баллы
Различия между основной и контрольной группами: ВДС - р<0,0005, ВДО - р<0,0003
Поскольку исходно уровень гипервентиляционных расстройств был несколько выше в основной группе, чем в контрольной, то даже при большом и достоверном его снижении ко 2-й неделе разница между группами была на уровне тенденций к достоверности. Но уже к 4-й неделе лечения в основной группе этот показатель существенно снизился и различия между двумя группами стали высоко достоверными.
Исследование сна. При фоновом исследовании субъективные качественные показатели сна в основной группе были достоверно хуже, чем в контрольной группе. Уже ко 2-й неделе лечения этот показатель значительно и достоверно повысился в основной группе (показатели качества сна инвертированы, т.е. чем ниже показатель, тем хуже сон), в контрольной группе его повышение не было столь значительным, и поэтому достоверная разница между группами исчезла. К 4-й неделе лечения отмечено дальнейшее повышение показателя качества сна в основной группе (т.е. сон улучшался), а в контрольной это улучшение было менее выраженным, и в конце 4-й недели разница между группами была высоко достоверной. На рис. 5 показана динамика изменений (дельта) качества сна в основной и контрольной группах.
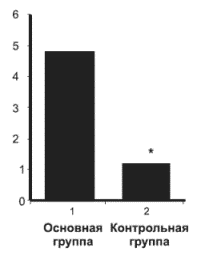
Рис. 5. Качество сна по АС (баллы) на 4-й неделе терапии в основной (I) и контрольной (II) группах
Различия между основной и контрольной группами р<0,005
Таким образом, если в начале лечения больные основной группы спали значительно хуже, чем контрольной, то к концу периода наблюдений их субъективная оценка качества сна была достоверно лучше, чем у больных контрольной группы.
Клинические изменения в процессе лечения. До начала лечения, а затем через 2 и 4 нед лечащий врач на основании осмотра больного регистрировал в протоколе общее клиническое впечатление о состоянии больного, оценивая его в баллах от 1 до 7, причем большему баллу соответствует большая выраженность заболевания. В начале лечения средний бал по CGI достоверно не различался в исследованных группах, однако уже ко 2-й неделе и особенно к концу лечения этот показатель в основной группе был достоверно меньше, чем в контрольной.
Анализ эффективности лечения в зависимости от наличия сопутствующей патологии показал, что у пациентов, отягощенных неврологической патологией (79 больных), эффективность лечения с добавлением Грандаксина была идентична таковой у пациентов, клиника которых укладывалась исключительно в рамки ПВС.
Исследование безопасности Грандаксина
В целом переносимость препарата по отчетам пациентов оценена как хорошая. Нежелательные эффекты, оцененные с помощью шкалы UKU, наблюдались лишь на начальной стадии лечения у 10% пациентов, которые отмечали сонливость, сухость во рту, головную боль, сердцебиение, повышенную потливость, увеличение или снижение массы тела. Однако столь высокий процент неприятных ощущений на фоне терапии можно объяснить неспецифичностью используемого метода, поскольку с его помощью регистрировались симптомы, которые клинически невозможно разграничить с проявлениями ПВС.
Заключение
Проведенное мультицентровое исследование, в котором приняли участие 220 пациентов, позволило установить следующее:
- Лечение больных с ПВС по стандартной схеме с включением сосудистых, метаболических и ноотропных препаратов в течение 4 нед достоверно улучшает как показатели эмоционального статуса (тревога и депрессия), так и симптомы вегетативной дисфункции.
- Добавление к стандартной терапии больных с ПВС Грандаксина позволило достоверно быстрее и в значительно большей степени улучшить состояние больных, нормализовать психовегетативный дисбаланс и улучшить качество сна.
- Проведенное лечение оказало положительное влияние не только на субъективные ощущения, но и на объективные показатели, зафиксированные врачом (объективная регистрация вегетативной дисфункции и шкала CGI).
- Добавление Грандаксина в схему лечения оказало положительное влияние на качество сна, что позволяет рекомендовать его пациентам, страдающим психовегетативными расстройствами в сочетании с инсомническими нарушениями.
Хорошая переносимость препарата и редукция возможных нежелательных явлений в ходе лечения позволяет применять препарат в дозе 150 мг в сутки пациентам как с психовегетативным симптомокомплексом, так и с сопутствующей соматической и неврологической патологией.
Таким образом, введение в схему традиционной терапии больных с психовегетативными расстройствами препарата Грандаксин может существенно повысить эффективность лечения. Речь идет о больных как с ведущим, так и с сопутствующим ПВС при хронических неврологических заболеваниях (сосудистых, дегенеративных, демиелинизирующих и др.). В проведенном исследовании это доказывается существенным снижением выраженности эмоциональных расстройств, вегетативной стабилизацией и улучшением качества сна. Более раннее наступление положительного эффекта лечения (уже на 2-й неделе) повышает веру больного в выздоровление. Безопасность препарата и хорошая переносимость позволяют рекомендовать его в качестве базовой составляющей схемы лечения значительной части неврологических больных.
Литература
1. Артеменко А.Р., Окнин В.Ю. Грандаксин в лечении психовегетативных расстройств. Леч нервн болезней 2001;2:1:24-27.
2. Вейн A.M. (ред.) Вегетативные расстройства. Клиника, диагностика, лечение. М 1998; 752.
3. Дюкова Г.М. Грандаксин в клинической практике. Леч нервн болезней 2005:2:16:25-29.
4. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. Том 2. М: Медицина1991; 700.
5. Мержеевски С, Домбровски Р. Анксиолитики (производные бензодиазепинов). Новости фармац и мед 1994;4:71-76.
6. Мосолов С.Н. Основы психофармакологии. М: Восток 1996; 288.
7. Ронаи Ш, Орос Ф., Болла К. Применение Грандаксина в амбулаторной практике. Венгер фармакотер 1975;23:4-10.
8. Bond A., Lader М.А. Comparison of the psychotropic profiles of tofisopam and diazepam. Eur J Clin Pharmacol 1982;22:2:137-142.
9. Perkin G. An analysis of 7836 successive new outpatient referrals. J Neurol Neurosurg Psychiat 1989;52:447-448.
10. Szegi J., Somogyi M, Papp E. Excerpts from the clinical-pharmacologic and clinical studies of Grandaxin. Acta Pharm Hung 1993;63:2:91-98.
