Особенности антиишемического эффекта триметазидина MB в комбинации с метопрололом у больных со стенокардией
СтатьиОпубликовано в журнале:
«Consilium medicum. Кардиосоматика», 2013, Том 4, №1, с. 6-20 П.Ю. Бардыбахин, Е.В. Бочкарева, И.В. Ким
ФГБУ Государственный научно-исследовательский центр профилактической медицины Минздрава РФ
Резюме. Влияние триметазидина МВ на переносимость физической нагрузки и показатели углеводного обмена изучено у 28 больных со стабильной стенокардией напряжения, принимающих метопролол. Назначение триметазидина МВ приводило к существенному усилению антиангинального и антиишемического эффекта терапии. Наиболее значимое улучшение показателей наблюдалось у больных с отсутствием антиишемического эффекта при приеме метопролола. В этой подгруппе больных пороговая продолжительность нагрузки увеличилась на 77,1±18,1 с (pСведения об авторах
Бардыбахин Павел Юрьевич – врач-кардиолог, сотр. Научно-практического центра интервенционной кардиоангиологии
Бочкарева Елена Викторовна – д-р мед. наук, рук. лаб. медикаментозной профилактики в первичном звене здравоохранения ФГБУ ГНИЦ ПМ Минздрава РФ.
Ким Ирина Витальевна – аспирант ФГБУ ГНИЦ ПМ Минздрава РФ
Features of anti-ischemic efficacy of trimetazidine MR, assigned in combination with metoprolol in patients with angina
P.Yu.Bardybakhin, E.V.Bochkareva, I.V.KimState Research Center for Preventive Medicine, Ministry of Health of the Russian Federation
Summary. We studied the influence of trimetazidine MR on exercise tolerance and carbohydrate metabolism in 28 patients with stable effort angina, treated with metoprolol. The addition of trimetazidine MR to ongoing therapy with metoprolol substantially enhanced the antianginal and anti-ischemic efficacy of treatment. The most significant improvement was observed when the monotherapy with metoprolol wasn’t effective. In this subgroup of patients the threshold exercise duration increased by 77,1±18,1 s (p
По данным международного многоцентрового исследования Angina Treatment Patterns (ATP) Survey, 59,8% больных со стенокардией в нашей стране находятся на комбинированной антиангинальной терапии, в состав которой входят b-адреноблокаторы (БАБ) [1]. Одновременно с этим около 1/3 больных (27,7%) получают так называемые коронарные препараты, в том числе триметазидин МВ (ТМЗ МВ). В России этот препарат принимают около 12% больных с сердечно-сосудистыми заболеваниями [2]. ТМЗ МВ рекомендован Европейским обществом кардиологов в 2006 г. [3] и Всероссийским научным обществом кардиологов в 2008 г. [4] в качестве антиангинального препарата метаболического действия для терапии больным со стабильной стенокардией напряжения. При этом указывается, что ТМЗ МВ – единственный миокардиальный цитопротектор, имеющий достаточную доказательную базу для использования в качестве антиангинального средства.
БАБ оказывают выраженный антиангинальный и антиишемический эффект (АИЭ) несколько реже, чем препараты других групп [5, 6]. Так, по данным парных нагрузочных тестов, неселективный БАБ пропранолол в разовой дозе 40–80 мг был эффективен лишь у 45–67% больных со стабильной стенокардией напряжения, тогда как антагонисты кальция и нитраты были эффективны значительно чаще [5]. Более низкая эффективность БАБ при стенокардии может быть связана с наличием у препаратов этой группы нежелательных метаболических эффектов. БАБ вызывают торможение процессов липолиза [7–9] и развитие инсулинорезистентности тканей [10], что в совокупности может снижать доступность двух основных энергетических субстратов, свободных жирных кислот и глюкозы для обеспечения энергетических потребностей миокарда, в том числе при ишемии.
Недостаточная частота развития желаемого антиангинального эффекта при приеме БАБ служит одной из причин назначения их в комбинации с препаратами других групп, при этом сочетание с ТМЗ МВ относится к наиболее рациональным, поскольку действие ТМЗ МВ не связано с изменениями системной гемодинамики [11]. Дополнительным преимуществом ТМЗ МВ является нейтральное [11, 12] или положительное [13] влияние на показатели углеводного обмена, что особенно важно при комбинированном применении с БАБ, способствующими развитию инсулинорезистентности тканей [10].
С практической точки зрения важной особенностью действия ТМЗ МВ является его высокая эффективность в тех случаях, когда монотерапия БАБ, несмотря на выраженные изменения системной гемодинамики, не оказывает необходимого (требуемого, желаемого) АИЭ. По данным фармакодинамических исследований, назначение ТМЗ МВ оказывало значительный аддитивный эффект у больных со стенокардией с отсутствием АИЭ при приеме пропранолола и существенно не влияло на показатели переносимости физической нагрузки (ФН) при наличии выраженного АИЭ этого БАБ [6]. До настоящего времени не установлено, наблюдается ли указанная закономерность при комбинации ТМЗ МВ с другими БАБ, в частности кардиоселективным препаратами.
Цель исследования: оценить влияние ТМЗ МВ на переносимость ФН, уровень в крови глюкозы, инсулина и показатели инсулинорезистентности у больных со стабильной стенокардией напряжения в зависимости от АИЭ одного из наиболее часто применяемых кардиоселективных БАБ метопролола (МП).
Материал и методы
Обследованы 28 мужчин 46–68 лет с верифицированной ишемической болезнью сердца и стабильной стенокардией напряжения II–III функционального класса, не принимающие БАБ. Все больные имели положительные результаты теста с ФН на тредмиле, сопровождавшегося приступом стенокардии средней интенсивности и/или снижением сегмента ST ишемического типа глубиной 1 мм и более (vST?1 мм). Нагрузки проводили по протоколу, принятому в ФГБУ ГНИЦ ПМ для фармакодинамических исследований антиангинальных препаратов. Интервал времени от начала нагрузки до появления vST?1 мм принимали за пороговую продолжительность нагрузки (Тпорог).
В исследование не включали больных с сахарным диабетом типа 1 и 2, противопоказаниями к приему БАБ и проведению ФН, с тяжелыми сопутствующими заболеваниями, сердечной недостаточностью, перенесенным инсультом, инфарктом миокарда давностью менее 6 мес, неконтролируемой гипертонией, а также при невозможности полной отмены всей предшествующей медикаментозной терапии, за исключением сублингвальных таблеток нитроглицерина.
Исследуемые препараты: ТМЗ МВ (Предуктал МВ, Лаборатории Сервье, Франция) 35 мг, МП 50 и 100 мг.
Индивидуальный АИЭ МП в разовой дозе 50 и 100 мг оценивали методом парных ФН [11, 12]. В один и тот же день больной выполнял 2 нагрузки: 1-я – до приема препарата, 2-я – через 2 ч после приема. Препарат обладал АИЭ, если Тпорог увеличивалась на 120 с и более при 2-й нагрузке по сравнению с 1-й. Если увеличение Тпорог (?Тпорог) составляло менее 120 с, АИЭ отсутствовал. Парный тест с дозой МП 100 мг проводили только при неэффективности 50 мг препарата и отсутствии противопоказаний к увеличению дозы.
Значение ?Тпорог?120 с в качестве критерия эффективности препарата было принято в связи с тем, что, по данным фармакодинамических исследований, указанный показатель в 2 раза превышает эффект плацебо у данной категории больных в пределах ±2s (±2SD) [5], что при регулярном приеме обеспечивает снижение в 2 раза и более частоты приступов стенокардии на фоне повседневной активности больного.
Выбранную дозу МП (50 мг – 24 больным, 100 мг – 4 пациентам) назначали 2 раза в день на протяжении 1 мес, затем больные продолжали прием прежней дозы МП в комбинации с ТМЗ МВ по 35 мг 2 раза в день в течение 1 мес. В конце периодов монотерапии МП и его комбинации с ТМЗ МВ проводили контрольные ФН через 2 ч после приема очередной дозы.
Гемодинамический эффект оценивали с учетом показателя ?%, характеризующего степень изменения частоты сердечных сокращений (ЧСС), систолического (САД), диастолического артериального давления (ДАД), двойного произведения (ДП) на фоне препарата(ов) относительно исходного уровня и рассчитанного по формуле:
?ЧСС% (АД, ДП) = [ЧСС2 (АД2, ДП2) – ЧСС1 (АД1, ДП1)]/ЧСС1 (АД1, ДП1)?100%, где 1 – до приема, 2 – через 2 ч после приема.
Формула для расчета ДП, являющегося эквивалентом поглощения кислорода миокардом:
САД?ЧСС/100 (условных единиц).
Показатели углеводного обмена – уровень глюкозы и инсулина – определяли в сыворотке крови натощак. Концентрацию глюкозы измеряли автоматизированным глюкозооксидазным методом, концентрацию инсулина – радиоиммунологическим методом (Insuline IRMA, Immunotech, Czech Republic). Инсулинорезистентность тканей оценивали по индексу HOMA2-IR (Homeostatic Model Assessment) с использованием компьютерной программы HOMA model, учитывающей концентрацию глюкозы и инсулина натощак [15]. Индекс HOMA2-IR позволяет получить более правильную, незавышенную оценку инсулинорезистентности по сравнению с индексом HOMA1-IR, рассчитанным по формуле [15]. Значения HOMA2-IR примерно в 1,5 раза ниже значений HOMA1-IR [16].
Статистическую обработку данных проводили с использованием стандартных методов параметрической и непараметрической статистики (Statistica 7): определения средних значений показателей (М), стандартного отклонения (SD) для показателей ФН, медианы (Ме) и межквартильного интервала (25–75%) для показателей углеводного обмена. Достоверность различий результатов ФН оценивали с помощью парного t-критерия Стьюдента, динамику углеводных показателей – по критериям Вилкоксона и Манна–Уитни. Значения pРезультаты и обсуждение
По результатам парных ФН больные были распределены в 2 группы: у 16 пациентов препарат был эффективен, ?Тпорог составляло 211,7±80,4 с. У 12 больных АИЭ МП отсутствовал, d?Тпорог составляло 46,6±34,0 с (см. рисунок). Указанные группы больных до лечения не различались по функциональному классу стенокардии, Тпорог, ЧСС и АД.
Через 1 мес приема МП в каждой из групп больных сохранялся уровень переносимости ФН, достигнутый при приеме разовой дозы (см. рисунок). Эффекта кумуляции или привыкания к действию препарата не отмечено.
Влияние МП и его комбинации с ТМЗ МВ на пороговую продолжительность ФН у больных со стабильной стенокардией напряжения в зависимости от наличия и отсутствия АИЭ при приеме разовой дозы МП.
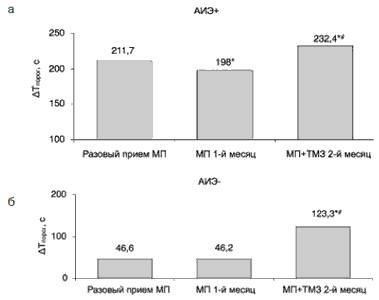
Примечание. АИЭ+ - наличие АИЗ (n-16); АИЭ- - отсутствие АИЭ (n=12); *p
На фоне комбинированного применения МП и ТМЗ МВ показатель ?Тпорог в группах больных с наличием и отсутствием АИЭ БАБ увеличился по сравнению с периодом монотерапии, соответственно, на 33,8±13,7 и 77,1±18,1 с (pЧастота приступов стенокардии у больных с наличием АИЭ МП уменьшилась через 1 мес с 7,3±2,5 до 3,2±1,9 в неделю (p0,05). При приеме комбинации препаратов в группе больных с наличием АИЭ МП дальнейшего урежения ангинозных приступов не наблюдалось, их частота составила 3,9±2,1 в неделю (p>0,05). У больных с отсутствием АИЭ МП частота приступов стенокардии после начала приема ТМЗ МВ уменьшилась до 5,0±2,3 в неделю (p=0,028 vs периода монотерапии).
Разовый прием МП сопровождался существенным снижением уровня АД и урежением ЧСС, причем по степени изменения указанных параметров группа больных с наличием АИЭ МП не имела преимуществ по сравнению с группой без АИЭ. Так, при разовом приеме МП у больных с наличием и отсутствием АИЭ ?ЧСС% в покое составляло, соответственно, 23,8±1,7 и 19,6±10,6% (p>0,05), ?САД% – 7,3±7,9 и 14,9±6,3% (p=0,025), ?ДП% – 29,7±6,4 и 31,6±11,5% (p>0,05). При нагрузке различий между группами также не было выявлено. На фоне регулярного приема МП дальнейших изменений показателей гемодинамики не наблюдалось. Таким образом, отсутствие АИЭ при приеме МП в обследованной группе больных не было связано с недостаточно выраженным влиянием препарата на гемодинамические параметры, что указывает на возможную роль метаболических эффектов в развитии данного феномена.
Исследование показателей углеводного обмена в определенной мере подтвердило данное предположение. До лечения группы с наличием и отсутствием АИЭ МП не различались по уровню в крови натощак глюкозы, инсулина и показателю HOMA2-IR (см. таблицу). Однако через 1 мес у больных с отсутствием АИЭ МП наблюдалось снижение концентрации глюкозы в крови натощак (р=0,026), тогда как у больных с наличием АИЭ данный показатель не изменялся (см. таблицу), что, по-видимому, было связано со снижением продукции глюкозы в печени на фоне блокады адренергической активности [17]. В каждой из групп не было выявлено статистически значимых изменений концентрации в крови инсулина и HOMA2-IR, по-видимому, указанная продолжительность приема БАБ являлась недостаточной для развития инсулинорезистентности тканей. У больных с отсутствием АИЭ МП выявленное снижение уровня глюкозы в крови не сопровождалось развитием гипогликемии, наблюдавшиеся показатели концентрации относились к диапазону нормальных значений. Однако можно предположить, что снижение концентрации глюкозы в крови ниже привычных для больного значений при одновременном уменьшении доступности свободных жирных кислот могло оказывать неблагоприятное влияние на обеспечение энергетических потребностей миокарда при ишемии и препятствовать реализации АИЭ МП. В целом выявленные различия между группами в динамике концентрации глюкозы согласуются с предположением, что антиишемическое действие БАБ, и МП в частности, зависит от совокупности факторов, к которым относится не только гемодинамический, но и метаболический эффект препарата(ов), в том числе влияние на углеводный обмен.
Динамика показателей углеводного обмена на фоне приема МП и его комбинации с ТМЗ МВ в зависимости от АИЭ разовой дозы МП (Ме, 25–75%)
| Показатели | АИЭ+ (n=16) | АИЭ- (n=12) | ||||
| До лечения | МП 1-й месяц | МП+ТМЗ МВ 2-й месяц | До лечения | МП 1-й месяц | МП+ТМЗ МВ 2-й месяц | |
| Глюкоза натощак, мг/дл | 97,5 (90,0–110,5) | 96,0 (87,0–105,0) | 98,0 (91,5–101,5) | 100,0 (98,5–106,0) | 91,0* (89,0–107,5) | 98,0 (90,5–101,0) |
| Инсулин натощак, мкМЕд/мл | 9,7 (6,5–17,6) | 7,0 (5,4–11,5) | 11,0 (4,8–12,9) | 10,4 (8,4–12,3) | 11,5 (4,3–16,5) | 10,8 (4,8–13,2) |
| HOMA-IR | 1,30 (0,9–2,25) | 0,90 (0,70–1,50) | 1,45 (0,65–1,70) | 1,35 (1,15–1,65) | 1,50 (0,55–2,15) | 1,45 (0,65–1,70) |
| *р<0,05 – достоверность различий с соответствующим показателем до приема препарата по критерию Вилкоксона. | ||||||
Через 1 мес приема ТМЗ МВ у больных с отсутствием АИЭ МП отмечено восстановление исходных показателей концентрации глюкозы, а у больных с наличием эффекта концентрация глюкозы не изменилась. Уровень в крови инсулина и показатели HOMA2-IR в каждой группе больных также оставались без изменений (см. таблицу). Следовательно, прием ТМЗ МВ не оказывал неблагоприятного влияния на показатели углеводного обмена у больных, принимающих МП, что является существенным фактором безопасности комбинированной медикаментозной терапии.
В проведенном исследовании назначение ТМЗ МВ больным, принимающим МП, сопровождалось существенным усилением АИЭ и антиангинального эффекта терапии. При этом наиболее значимое улучшение показателей переносимости ФН и выраженности ангинозного синдрома на фоне повседневной активности (оцениваемого по частоте приступов стенокардии) наблюдалось у больных с отсутствием АИЭ МП. Это совпадает с полученными ранее данными об эффективности комбинированного применения ТМЗ МВ и пропранолола [6] и позволяет предположить, что указанная закономерность может иметь более общий характер и проявляться при сочетании ТМЗ МВ не только с пропранололом и МП, но и с другими БАБ.
Выявленная закономерность имеет важное практическое значение для больных с сочетанием ишемической болезни сердца и артериальной гипертонии, поскольку дозы БАБ, обеспечивающие достаточное снижение АД, далеко не всегда оказывают желаемый антиангинальный эффект, если ангинозный синдром присутствует. В этих условиях при необходимости назначения комбинации лекарственных средств для усиления антиангинального эффекта БАБ препаратом выбора может являться ТМЗ МВ, который не оказывает дополнительного влияния на системную гемодинамику, в том числе не вызывает избыточного снижения АД, но существенно ослабляет при этом выраженность ангинозного синдрома.
Причины выявленного феномена пока не изучены. Можно предположить, что у определенной части больных со стенокардией доступность свободных жирных кислот для обеспечения энергетических потребностей миокарда имеет особенно важное, критическое значение. Если у таких больных прием БАБ сопровождается не только снижением в крови концентрации свободных жирных кислот, но и глюкозы, возможность реализации АИЭ, несмотря на снижение потребности миокарда в кислороде, может быть существенно затруднена. Назначение таким больным ТМЗ МВ, механизм действия которого обусловлен ингибированием b-окисления свободных жирных кислот вследствие подавления активности фермента длинноцепочечной 3-кетоацил-КоА-тиолазы способствует переключению метаболизма миокарда на более интенсивное использование глюкозы [18], что в конечном итоге приводит к возрастанию продукции аденозинтрифосфорной кислоты и повышает устойчивость миокарда к развитию ишемии.
Улучшение чувствительности периферических тканей к инсулину на фоне ТМЗ МВ [14] позволяет предположить, что при более длительном приеме могут быть нивелированы неблагоприятные метаболические эффекты БАБ, связанные с развитием инсулинорезистентности тканей, что будет способствовать оптимизации эффекта препаратов этой группы. Подобный механизм действия ТМЗ МВ требует дополнительного изучения в специально спланированном исследовании с более длительным периодом комбинированной терапии и большей численностью больных.
ЛИТЕРАТУРА
1. Easteaugh JL, Calvert MJ, Freemantle N. Highlighting the need for better patient care in stable angina: results of the international Angina Treatment Patterns (ATP) Survey in 7074 patients. Family Practice 2005; 22: 43–50.
2. Daly CA, Clemens F, Sendon JLL, Tavazzi L et al. The initial management of stable angina in Europe from Euro Heart Survey. A description of pharmacological management and revascularization strategies initiated within the first month of presentation to a cardiologist in the Euro Heart Survey of Stable Angina. Eur Heat J 2005; 26: 1011–22.
3. Guidelines on the management of stable angina pectoris: executive summary. Task Force on the management of stable angina pectoris of the European Society of Cardiology. Eur Heart J 2006; 27: 1341–81.
4. Диагностика и лечение стабильной стенокардии. Российские рекомендации, 2-й пересмотр. Кардиоваск. терапия и профилактика. 2008; 7 (6): 3–40.
5. Метелица В.И., Бочкарева Е.В., Кокурина Е.В. и др. Индивидуальный выбор антиангинальных препаратов с помощью парных ВЭМ-тестов у больных стенокардией. Терапевт. арх. 1992; 9: 35–9.
6. Бутина Е.К., Кокурина Е.В., Дмитриева Н.А. и др. Сниженная чувствительность к антиишемическому эффекту пропрано-лола и возможность ее коррекции у больных стабильной стенокардией. Терапевт. арх. 2002; 34–9.
7. Sharma V, Dhillon P, Wambolt R et al. Metoprolol improves cardiac function and modulates cardiac metabolism in the streptozotocin-dia-betic rat. Am J Physiol Heart Circ Physiol 2008; 294: H1609–H1620.
8. Moro C, Polak J, Klimcakova E et al. Atrial natriuretic peptide stimulates lipid mobilization during repeated bouts of endurance exercise. Am J Physiol Endicrinol Metab 2006; 290 (5): E864–9.
9. Moro C, Pillard F, Glisezinski I et al. Exercise-induced lipid mobilization in subcutaneuos adipose tissue is mainly related to natriuretic peptides in overweight men. Am J Physiol Endocrinol Metab 2008; 295 (2): E505–13.
10. Sarafidis PA, Bakris GL. Antihypertensive treatment with beta-blockers and the spectrum of glycaemic control. Q J Med 2006; 99: 431–6.
11. Szwed H. Clinical benefits of trimetazidine in patients with recurrent angina. Coron Artery Dis 2004; 15 (1): 17–2.
12. Ribeiro LW, Ribeiro JP, Stein R et al. Trimetazidine added to combined hemodynamic anitianginal therapy in patients with type 2 diabetes: a randomized crossover trial. Am Heart J 2007; 154 (1): 78.e1–7.
13. Fragasso G, Piatti PM, Monti L et al. Short- and long-term beneficial effects of trimetazidine in patients with diabetes and ischemic car-diomyoparthy. Am Heart J 2003; 146 (5): Е18.
14. Cai JS, Peng ZJ. Effect of trimetazidine on insulin resistance in patients with coronary heart disease. Nan fang Yi Ke Da Xue Xue Bao 2006; 26 (2): 222–6.
15. Wallace NM, Levy JC, Matthews DR. Use and abuse of HOMA modeling. Diabetes Care 2004; 27: 1487–95.
16. Geloneze B, Vasques ACJ, Stabe CFC et al. HOMA1-IR and HOMA2-IR indexes in identifying insulin resistance and metabolic syndrome – Brazilian Metabolic Syndrome Study (BRAMS). Arq Bras Endocrinol Metab 2009; 53 (2): 281–7.
17. Vardeny O, Zebrack J, Gilbert EM. Effects of beta-blocker titration on glucose homeostasis in heart failure. J Pharm Technol 2009; 25 (2): 71–8.
18. Kantor PF, Lucien A, Kozak R, Lopaschuk GD. The antianginal drug trimetazidine shifts cardiac metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase. Circ Res 2000; 86: 580–8.
