О перспективах использования комбинаций фолиевой кислоты и активных фолатов для нутрициальной поддержки беременности
СтатьиОпубликовано в журнале:
Акушерство и гинекология № 4 /2019
Akusherstvo i ginekologiya/obstetrics and gynecology (Moscow) № 4 /2019
О.А. Громова1, И.Ю. Торшин1, Н.К. Тетруашвили2, А.Н. Галустян3, Н.А. Курицына3
1 ФИЦ ИУ РАН, Институт фармакоинформатики, Москва, Россия
2 ФГБУ «НМИЦ АГП им. Кулакова» МЗ РФ, Москва, Россия
3 ФГБОУ ВО «Санкт-Петербургский государственный педиатрической университет» Минздрава России
Фолиевая кислота наиболее часто используется для первичной профилактики пороков развития плода (ПРП). Профилактика ПРП и патологий беременности фолатами в синергидном сочетании с другими витаминами весьма эффективна вследствие повсеместного распространения полигиповитаминозов. Биоусвояемость фолиевой кислоты существенным образом зависит от используемой дозы и генетического профиля пациентки, поэтому перспективным трендом является использование активных форм фолатов (например, 5-метилтетрагидрофолата, 5-МТГФ). При этом 5-МТГФ может использоваться в комбинации с фолиевой кислотой, так как это дает очевидное фармакокинетическое преимущество – поддержание более стабильных уровней фолатов в крови. Если дозировка фолиевой кислоты в таких комбинациях не превышает 400 мкг/сут, то фолиевая кислота не будет приводить к нарушениям метаболизма эндогенных фолатов, в том числе 5-МТГФ.
Ключевые слова: фолиевая кислота, 5-метилтетрагидрофолат, беременность, Прегнотон Мама.
Вклад авторов. Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Галустян А.Н., Курицына Н.А.: разработка дизайна исследования, получение данных для анализа, обзор публикаций по теме статьи, анализ полученных данных, написание текста рукописи.
Конфликт интересов. Авторы заявляют об отсутствии возможных конфликтов интересов.
Финансирование. Исследование проведено без спонсорской поддержки.
Для цитирования: Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Галустян А.Н., Курицына Н.А. О перспективах использования комбинаций фолиевой кислоты и активных фолатов для нутрициальной поддержки беременности.
Акушерство и гинекология. 2019; 4: 87-94.
https://dx.doi.Org/10.18565/aig.2019.4.87-94
On prospects for using combinations of folic acid and active folates for the nutritional support of pregnancy
O.A. Gromova1, I.YU. Torshin1, N.K. Tetruashvili2, A.N. Galustyan3, N.A. Kuritsyna3
1 Institute of Pharmacoinformatics, Federal Research Center of Informatics and Management, Russian Academy of Sciences, Moscow, Russia
2 Academician V.I. Kulakov National Medical Research Center of Obstetrics, Gynecology, and Perinatology, Ministry of Health of the Russian Federation, Moscow, Russia
3 Saint Petersburg State Pedagogical Medical University, Ministry of Health of Russia
Folic acid is most often used for the primary prevention of fetal malformations (FMFs). The prevention of FMFs and pregnancy pathologies with folates in a synergistic combination with other vitamins is very effective due to the widespread distribution of polyhypovitaminoses. Folic acid bioavailability substantially depends on the dose used and the genetic profile of a patient, so the promising trend is to use active folate forms (for example, 5-methyltetrahydrofolate (5-MTHF)). In this case, 5-MTHP can be used in combination with folic acid, since this provides an obvious pharmacokinetic advantage of maintaining more stable blood folate levels. If the dosage of folic acid in such combinations does not exceed 400 pg/day, folic acid will not lead to impaired metabolism of endogenous folates, including 5-MTHF.
Keywords: folic acid, 5-methyltetrahydrofolate, pregnancy, Pregnoton Mama.
Authors’ contributions. Gromova O.A., Torshin I.Yu., Tetruashvili N.K., Galustyan A.N., Kuritsyna N.A.: developing of research design, obtaining data for analysis, reviewing publications on the topic of the article, analysis of the obtained data, article writing.
Conflict of interest. Authors declare lack of the possible conflicts of interests.
Financing. The study was performed without external funding.
For citation: Gromova O.A., Torshin I.Yu., Tetruashvili N.K., Galustyan A.N., Kuritsyna N.A. On prospects for using combinations of folic acid and active folates for the nutritional support of pregnancy.
Akusherstvo i Ginekologiya/Obstetrics and Gynecology. 2019; (4): 87-94. (in Russian)
https://dx.doi.org/10.18565/aig.2 019.4.87-94
Успешная профилактика пороков развития плода (ПРП) основана: на 1) санации очагов хронической инфекции, 2) исключении курения, алкоголя, вредных производственных факторов, 3) адекватном двигательном режиме, 4) поддержании положительного психоэмоционального фона и, конечно же, 5) обеспечении организма беременной всеми макро- и микронутриентами, необходимыми для оптимального развития плода. Использование специализированных витаминно-минеральных комплексов (ВМК) – наиболее рациональный способ нутрициальной поддержки беременности.
Для эффективной профилактики ПРП необходимо преодоление повсеместно распространенных полигиповитаминозов, т.е. сочетанных дефицитов многих витаминов. Дефициты цинка, железа, йода, селена, витаминов А, Е, D, С и практически любого из витаминов группы В, в том числе фолатов (В9), пиридоксина (В6) и цианокобаламина (В12), чрезвычайно опасны, так как способствуют возникновению патологий беременности и ПРП [1]. Поэтому ВМК для поддержки беременности должен включать максимально расширенную «линейку» витаминов и микроэлементов в адекватных дозах. Кроме того, используемые субстанции микронутриентов должны характеризоваться хорошими фармакокинетическими показателями, в том числе высокой биодоступностью [2].
Фолаты являются одним из важнейших витаминов для профилактики ПРП. Именно фолаты обеспечивают: 1) метилирование ДНК, 2) синтез пуриновых и пиримидиновых оснований, 3) синтез аминокислот (метионина, серина, гистидина) и белков, 4) синтез холина, 5) обезвреживание гомоцистеина. Участие фолатов в метилировании ДНК и синтезе нуклеотида тимина принципиально важно для митоза (процесса клеточного деления). Поэтому при добавлении фолатов к культуре клеток отмечается стимуляция роста и деления клеток, а в организме фолаты стимулируют пластические процессы во всех тканях, особенно в тканях с быстрым циклом обновления клеток (кровь, эпителий ЖКТ, паренхима печени и др.) [3].
Общеизвестно, что дефицит фолатов в плазме крови приводит к патологиям беременности и порокам развития. Особенно ярко эффекты дефицита фолатов проявляются при наличии факторов риска фолатного дефицита (пиелонефрит, тромбофилия, артериальная гипертония, ожирение, прием фолатвыводящих лекарств, потребление алкоголя, курение и др.). Дефицит фолатов нарушает биосинтез S-аденозилметионина, необходимого для метилирования ДНК растущих клеток. В результате дефицит фолатов приводит к нарушению процессов роста и развития клеток и формированию дефектов эмбриона (в частности, врожденных пороков сердца, дефектов нервной трубки (ДНТ), дефектов формирования неба, так называемой «волчьей пасти», «заячьей губы» и др.), а также расстройств аутистического спектра и синдрома дефицита внимания с гиперактивностью [4].
Компенсация дефицита фолатов может осуществляться посредством фолиевой кислоты, биологически активных форм фолатов (дигидрофолат (ДГФ), тетрагидрофолат (ТГФ), 5-метилтетрагидрофолат (5-МТГФ) и др.) и комбинаций фолиевой кислоты и активных фолатов. Как показано далее, повсеместная распространенность дефицитов фолатов в различных популяциях, существование определенных вариантов генов фолатного метаболизма, влияющих на усвоение фолиевой кислоты, воздействия на уровни гомоцистеина, различия в метаболизме фолиевой кислоты и 5-МГТФ, дозозависимые фармакокинетические и фармакодинамические особенности фолиевой кислоты и активных фолатов диктуют необходимость их сочетанного применения.
Результаты исследований обеспеченности фолатами различных популяций
Дефицит диетарного потребления фолатов широко распространен даже в западных странах. Исследование когорты женщин в Канаде (n=35107) показало, что только 18% женщин репродуктивного возраста потребляли 400 мкг/сут фолиевой кислоты [5]. По данным комитета EFSA Евросоюза [6], во многих европейских странах уровни потребления фолатов с пищей оставляют желать лучшего: суточное потребление фолатов составляет менее 75% от минимально допустимого для здоровых женщин (400 мкг/сут) и не более 40-50% от оптимального уровня потребления (600-800 мкг/сут).
Результаты анализа базы данных ИМБД (база данных Института микроэлементов) на предмет обеспеченности витаминами когорты женщин репродуктивного возраста из России и стран западной Европы (n=2141, 20-45 лет) показал, что в таком, казалось бы, «обеспеченном» регионе, как современная западная Европа, потребление определенных витаминов не всегда достигает даже минимально рекомендуемых норм суточного потребления. Например, витамина В6 потребляется в среднем 1,6 мг/сут (при норме 2 мг/сут), фолатов – 375 мкг/сут (с учетом витаминных препаратов с фолиевой кислотой) при норме 400 мкг/сут, а витамина Е – 6,2 мг/сут при норме 15 мг/сут. Также отмечено недостаточное потребление женщинами репродуктивного возраста магния, калия, кальция и железа не только в РФ, но и западной Европе (хотя и в меньшей степени). Более того, одновременно всеми рассмотренными эссенциальными микронутриентами было обеспечено менее 10% (!) участниц. Следует отметить, что диета обследованных характеризуется избыточным потреблением натрия (3,06 г/сут при норме 1,3 г/сут) и фосфора (1,19 г/сут при норме 0,8 г/сут) [7].
По данным исследования [7], обеспеченность россиянок фолатами существенно ниже, чем в западной Европе (только 15%, западная Европа – 35%). Тем не менее большинство женщин и в западной Европе были недостаточно обеспечены фолатами для профилактики ПРП: средние уровни фолатов в эритроцитах составили всего 628±284 нмоль/л, тогда как для эффективной профилактики необходимы уровни не менее 906 нмоль/л. При этом процент участниц из западной Европы, у которых уровни фолатов (в эритроцитах) превышали 906 нмоль/л, составил всего 13%. Таким образом, диета, даже в «обеспеченных» западных странах, заведомо не предоставляет количества фолатов, необходимого для эффективной профилактики ПРП.
Исследование [7] также показало, что нормализация уровней фолатов в эритроцитах при беременности и лактации достигалась именно за счет приема специальных ВМК для беременных, содержащих фолаты в дозировках не менее 400 мкг/сут. Вклад приема таких ВМК в уровни фолатов в эритроцитах составил + 193 нмоль/л (р=0,035). В то же время вклад только диеты в уровни фолатов в эритроцитах составил всего +42 нмоль/л, что не являлось даже статистически достоверным (р=0,21) [7]. Сопоставимые результаты были получены и в других крупномасштабных популяционных исследованиях [8, 9].
Полиморфизмы генов фолатного метаболизма, усвоение фолиевой кислоты и 5-МТГФ
Помимо недостаточного потребления и всасывания, к дефициту фолатов могут приводить определенные варианты нуклеотидных полиморфизмов генов фолатного обмена (MTHFR, DHFR, MTRR, TYMS, MTFHD1 и др.) [10], которые влияют на биотрансформации фолиевой кислоты. Поэтому компенсация фолатного дефицита только с использованием фолиевой кислоты не всегда успешна, так как фолиевая кислота должна преобразоваться в организме в активные формы фолатов (ДГФ, ТГФ, 5-МТГФ и др.).
Систематический анализ нуклеотидных полиморфизмов, влияющих на усвоение фолиевой кислоты, представляет собой отдельное направление исследований. Одним из наиболее подробно исследованных генетических полиморфизмов является полиморфизм 677CaT 5,10-метилентетрагидрофолатредуктазы (ген MTHFR). Замена нуклеотида «С» в 677-й позиции кодирующей ДНК на нуклеотид «Т» приводит к образованию «термолабильной» (низкостабильной) формы фермента и способствует снижению уровней активных фолатов. Более чем за 30 лет исследований было установлено, что этот полиморфизм был достоверно ассоциирован с широким кругом патологий (рис. 1) [10].
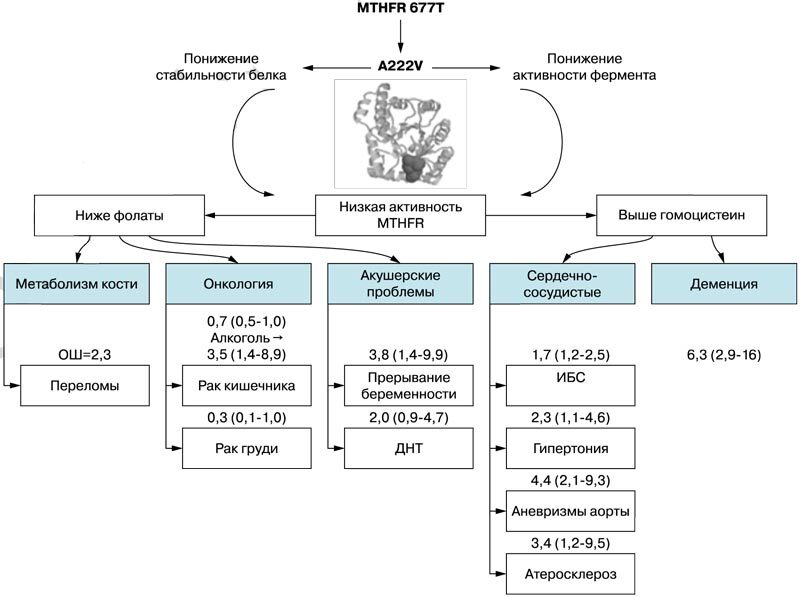
Рис. 1. Основные клинические проявления полиморфизма MTHFR 677 СД. Для каждого проявления указана величина эффекта, установленная по результатам исследований по доказательной медицине (отношение шансов и интервал достоверности) [10]
При приеме per os 5-МТГФ повышает уровни фолатов в плазме крови более эффективно, чем фолиевая кислота. При этом всасывание 5-МТГФ в малой степени зависит от генотипа полиморфизма MTHFR 677CaT. Здоровые женщины-добровольцы (генотип MTHFR TT, n=16; генотип MTHFR CC, n=8) принимали фолиевую кислоту (400 мкг, т.е. 906 нмоль) или 5-МТГФ (416 мкг, т.е. 906 нмоль) однократно per os. Площадь под кривой (AUC) и максимальная концентрация (Cmax) были значительно выше в случае приема 5-МТГФ. Время достижения пика концентрации (tmax) было значительно короче также для 5-МТГФ по сравнению с фолиевой кислотой (рис. 2) [11].
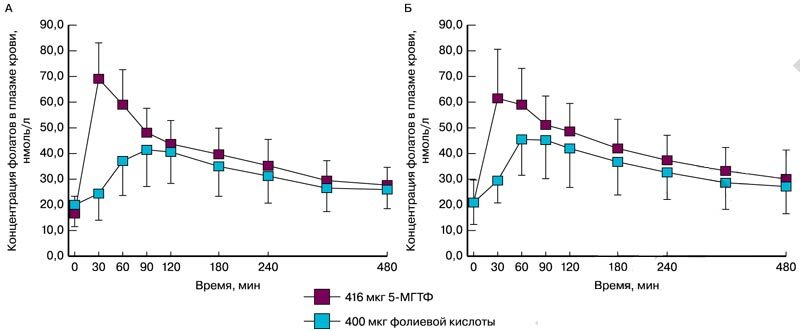
Рис. 2. Средние концентрации фолатов в плазме крови после однократного перорального приема фолиевой кислоты или 5-МТГФ женщинами с генотипом MTHFR ТТ (А) и с генотипом MTHFR СС (Б) [11]
Фолаты в терапии гипергомоцистеинемии
Как известно, гомоцистеин является побочным продуктом фолатного метаболизма, требующим дальнейшего обезвреживания. При дефиците фолатов или при наличии у пациентки тех или иных неблагоприятных вариантов генов метаболизма фолатов уровни гомоцистеина в плазме крови возрастают. Поэтому гипергомоцистеинемия – известный биомаркер дефицита фолатов, требующий неотложной компенсации фолатного дефицита.
Повышенные уровни гомоцистеина во время беременности стимулируют развитие спонтанных абортов, преэклампсии, венозной тромбоэмболии и других патологий. Гипергомоцистеинемия встречается у женщин с так называемым «необъяснимым» бесплодием (21±8 мкМ, n=20) и с «привычным» невынашиванием (19±6 мкМ, n=20); у здоровых пациенток: уровни гомоцистеина плазмы ниже (8±3 мкМ, р<0,05) [12]. Повышение концентраций гомоцистеина и метионина в крови и снижение отношения восстановленный:окисленный глутатион – информативные предикторы рождения ребенка с пороком сердца [13].
Клинические исследования указали на существование минимальной дозы фолиевой кислоты, необходимой для достоверного снижения концентраций гомоцистеина в крови. В рандомизированном исследовании дозозависимого эффекта фолиевой кислоты на уровни гомоцистеина в плазме крови (n=316) участники в течение 12 недель ежедневно получали фолиевую кислоту в дозировках 50, 100, 200, 400, 600 или 800 мкг/сут. В результате было установлено, что потребление фолиевой кислоты в дозировке 392 мкг/сут является минимальной дозой фолатов, при которой отмечается достоверное снижение уровней гомоцистеина в среднем на 22% [14].
Дозозависимые эффекты фолиевой кислоты на концентрацию гомоцистеина в крови были подтверждены в метаанализе 25 рандомизированных контролируемых исследований (n=2596). Потребление фолиевой кислоты в дозах 200, 400, 800, 2000 и 5000 мкг/сут было связано со снижением гомоцистеина на 13 (95% ДИ 10%-16%), 20 (17-22%), 23 (21-26%), 23 (20-26%) и 25% (22-28%) соответственно. Дополнение фолиевой кислоты витамином B приводило к дополнительному снижению гомоцистеина на 7% (95% ДИ 4-9%) [15]. Таким образом, доза фолатов порядка 400-800 мкг/сут является достаточно эффективным способом лечения гипергомоцистеинемии, а увеличение дозы 2000 мкг/ сут, 5000 мкг/сут достоверно не приводило к повышению эффективности (р=0,001).
Прием фолиевой кислоты в дозах 500 мкг/сут и более может нарушать внутриклеточный обмен эндогенных фолатов. Например, в двойном слепом исследовании группа добровольцев (n=50) была рандомизирована на получение фолиевой кислоты (500 мкг/сут, 8 недель) или плацебо. Фолиевая кислота значительно снижала уровень гомоцистеина в плазме (р=0,001), но не внутри мононуклеарных клеток периферической крови. Более того, без дотаций фолиевой кислоты концентрации гомоцистеина внутри клеток коррелировали с концентрациями S-аденозилметионина (SAM), а после курсового приема фолиевой кислоты корреляция между гомоцистеином и SAM в клетках не была установлена. Последнее наблюдение указывает на то, что фолиевая кислота в дозе 500 мкг/сут начинает вмешиваться в процесс регуляции фермента MTHFR регуляторным метаболитом SAM [16].
Различия в метаболизме фолиевой кислоты и 5-МТГФ
Фолиевая кислота, будучи фолатом растительного происхождения, не является эндогенным фолатом и должна пройти определенные биотрансформации в организме беременной. Эти биотрансформации фолиевой кислоты подразумевают взаимодействия с определенными белками протеома. Анализ протеома человека указал на существование не менее 20 белков, так или иначе взаимодействующих с фолатами [19]. К ним относятся прежде всего ферменты метаболизма фолатов (метилентетрагидрофолатредуктаза, метионин-синтаза-редуктаза, метилентетрагидрофолатциклогидролаза, дигидрофолатсинтаза и др.), фолат-транспортеры (гены FOLR1, FOLR2, FOLR3, SLC19A1, MFTC), обеспечивающие поступление фолатов внутрь клетки, тимидилат синтетаза и др. (рис. 3).
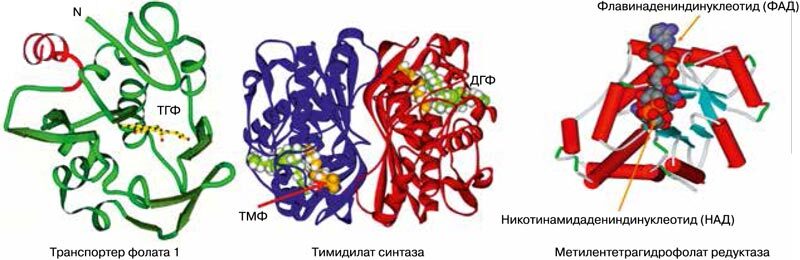
Рис. 3. Примеры структур белков, участвующих в метаболизме фолиевой кислоты. ТМФ, тимидилатмонофосфат; ДГФ, дигидрофолат; ФАД, флавинадениндинуклеотид; НАД, никотинамидинуклеотид [19]
Не являясь эндогенным метаболитом, фолиевая кислота перерабатывается в организме достаточно медленно. Поэтому передозировка фолиевой кислоты (возникающая зачастую в результате употребления так называемых «фортифицированных» продуктов или высокодозных препаратов синтетической фолиевой кислоты по 5000-1500 мкг/сут) перегружает и без того замедленные метаболические пути переработки фолатов. При этом происходит блокировка некоторых белков фолатного метаболизма, что вызывает физиологический дефицит эндогенных фолатов (так называемый «фолиевый парадокс»).
В частности, избыток фолиевой кислоты будет перегружать и блокировать фолат-транспортеры, осуществляющие приток активных фолатов внутрь клеток. ДГФ, накапливающийся при избыточном дозировании фолиевой кислоты, является ингибитором тимидилат синтетазы (TYMS), производящей тимидилатмонофосфат (ТМФ) для использования в синтезе ДНК и РНК и также ингибитором метилентетрагидрофолатредуктазы (MTHFR), опосредующей взаимопревращение 5-метил-ТГФ и 5,10-метилен-ТГФ. Ингибирование этого фермента при избытке фолиевой кислоты имеет эффект, биохимически схожий с эффектом обсуждаемого ранее полиморфизма 677 С/Т в гене MTHFR и соответствует ослаблению интенсивности биотрансформаций в цикле фолатов.
Избыток фолиевой кислоты может вызывать подавление синтеза молочно-фолатсвязывающего белка (FBP). В группе кормящих женщин (n=69) концентрации FBP были значительно ниже в результате обогащения пищи фолиевой кислотой. Неметаболизированная фолиевая кислота была обнаружена в 96% протестированных образцов молока [17]. Следует подчеркнуть, что так называемая «фортификация» продуктов питания синтетической фолиевой кислотой является сомнительной практикой, не имеющей четких положительных эффектов, но создающей риск неоправданно повышенного потребления фолиевой кислоты [18].
В отличие от фолиевой кислоты и ДГФ, избыток которых приводит к блокированию фолатного метаболизма, такой активный фолат, как 5-МТГФ не тормозит фолатный метаболизм. Поэтому 5-МТГФ, экзогенно поступающий в организм беременной в адекватных дозировках, не имеет побочных эффектов, характерных для избыточного потребления фолиевой кислоты (от 1000 мкг/сут и более). Кроме того, 5-МГТФ эффективно восполняет дефицит фолатов при любом генотипе ферментных систем биотрансформаций фолатов [19].
Курсовой прием 5-МТГФ позволяет достигать более высоких концентраций фолатов в крови, чем фолиевая кислота (в среднем на +200 нмоль/л). Беременные (n=72) принимали фолиевую кислоту (1000 мкг/сут) в течение всего срока гестации. После родов группа женщин была рандомизирована на прием 5-МТГФ (416 мкг/сут, 906 нмоль/сут), фолиевой кислоты (400 мкг/сут, 906 нмоль/сут) или плацебо. Через 16 недель лактации суммарная концентрация фолатов в эритроцитах у женщин в группе принимавших 5-МТГФ (2178 нмоль/л; 95% ДИ 1854-2559 нмоль/л) была выше, чем в группе принимавших фолиевую кислоту (1967 нмоль/л; 95% ДИ 1628-2377 нмоль/л; p<0,05) или значительно выше, чем в группе плацебо (1390 нмоль/л, 95% ДИ 1198-1613 нмоль/л; p<0,002) [20].
В исследовании [20] профили концентраций отдельных форм фолатов в крови различались между группами: в группе женщин, принимавших фолиевую кислоту, установлено достоверно более высокое количество 5-формил-ТГФ (p<0,03). Нарастание уровней 5-формил-ТГФ в ответ на прием фолиевой кислоты ассоциировано с недостаточностью витамина B12. При недостаточности витамина B12 резко снижена активность фермента метионинсинтазы, участвующего в биосинтезе S-аденозилметионина, необходимого для метилирования ДНК. Физиологически избыточная фолиевая кислота может производить ТГФ в обход метионинсинтазы, через ДГФ. При этом, однако, и будет происходить наблюдаемое накопление 5-формил-ТГФ. Таким образом, при восполнении недостаточности витамина В применение и фолиевой кислоты (в надлежащих дозах, не более 500 мкг/сут [16]), и 5-МТГФ будут приводить к близким профилям содержания различных фолатов в крови.
Дозозависимость эффектов приема фолиевой кислоты и 5-МГТФ
В сравнительно краткосрочных исследованиях (менее 40 недель приема) использование дозировок фолиевой кислоты не более 400 мкг/сут не позволяет достичь стабильных концентраций фолатов в эритроцитах. Например, было проведено сравнение приема фолиевой кислоты в дозах 140 мкг/сут (n=49) и 400 мкг/сут (n=48) женщинами детородного возраста в течение 40 нед. В качестве конечной точки использовали достижение уровней фолатов в эритроцитах более 906 нмоль/л. В конце исследования прием фолиевой кислоты в дозе 400 мкг/ сут приводил к меньшей частоте встречаемости пациенток с субоптимальными уровнями фолатов в эритроцитах (т.е. менее 906 нмоль/л: 400 мкг/сут – 18%, 140 мкг/сут – 35%). В группе плацебо субоптимальные уровни фолатов составили 58% как на начало, так и в конце исследования [21]. Тем не менее не только при приеме 140 мкг/сут, но и при приеме 400 мкг/сут фолиевой кислоты уровни фолатов в эритроцитах не достигли плато насыщения у всех пациенток даже к 40-й неделе приема.
Прием 5-МТГФ женщинами детородного возраста способствует более выраженному насыщению фолатами эритроцитов. Здоровые добровольцы в возрасте 19-33 лет (n=144) получали 400 мкг/сут фолиевой кислоты, эквимолярное количество 5-МТГФ (416 мкг/сут), половинное количество 5-МТГФ (208 мкг/сут) или плацебо в течение 24 недель. Уровни фолатов в эритроцитах были достоверно выше в группе получавших 5-МТГФ (р<0,001). При этом насыщение эритроцитов фолатами (участок плато на кривой, рис. 4) было достигнуто спустя 16 недель приема 5-МТГФ [22].
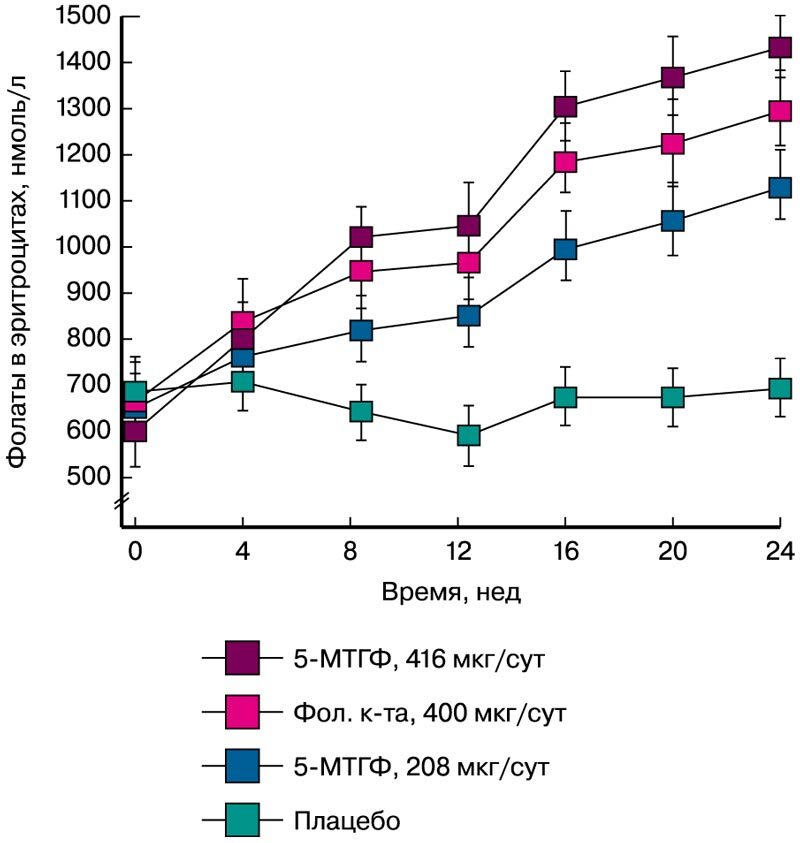
Рис. 4. Средние концентрации фолатов в эритроцитах в динамике после 24 недель приема, *Р<0,05 [22]
О взаимосвязи дозировки, фармакокинетики и фармакодинамики сочетаний фолиевой кислоты и 5-МГТФ
Фолиевая кислота – провитамин, из которого синтезируются активные формы фолатов. Биотрансформации фолиевой кислоты включают несколько этапов, прохождение которых требует определенного времени (2-5 ч) [23]. При поступлении в организм фолиевая кислота преобразуется в несколько этапов. Сначала происходит преобразование фолиевой кислоты в ДГФ посредством присоединения двух атомов водорода. Затем из ДГФ образуется наиболее типичная эндогенная форма фолатов – ТГФ. В дальнейшем преобразования ТГФ включают синтез 5-МТГФ (рис. 5) и синтез 5,10-метилен-ТГФ посредством фермента серинги-дроксиметилтрансферазы (ген SHMT1), коферментом которого является пиридоксаль фосфат – одна из активных форм витамина В6.
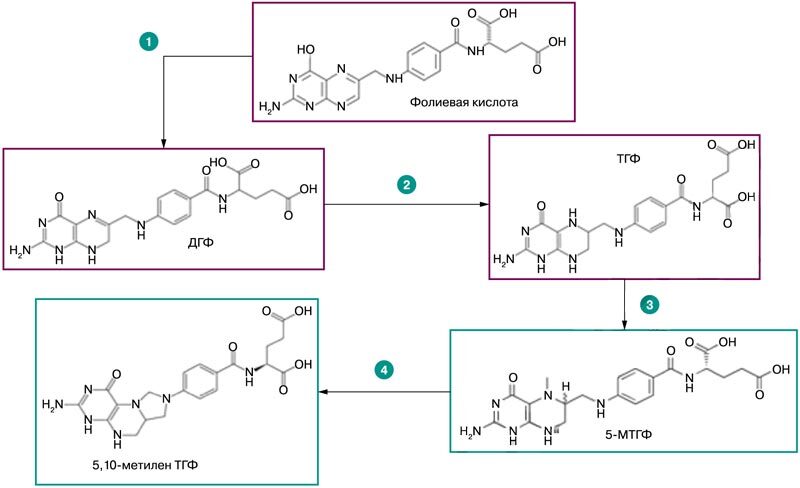
Рис. 5. Последовательность преобразований фолиевой кислоты в организме [23]
Таким образом, экзогенно поступающая фолиевая кислота постепенно преобразуется в организме, проходя стадии ДГФ, ТГФ, 5-МТГФ и др. В то же время экзогенно поступающий 5-МТГФ не требует прохождения по крайней мере трех стадий метаболизма фолатов, так что пик концентраций фолатов в плазме крови достигается быстрее именно при приеме 5-МГТФ.
Соответственно, основное преимущество сочетанного использования фолиевой кислоты и 5-МТГФ состоит в том, что такая смесь фолатов способствует поддержанию более стабильных концентраций фолатов в крови. Сначала формируется пик, вызванный 5-МГТФ, в то время как фолиевая кислота только начинает претерпевать описанные выше биотрансформации. Затем формируется пик, обусловленный нарастанием активных форм фолатов, синтезированных из фолиевой кислоты.
С фармакодинамической точки зрения, взаимодействие между фолиевой кислотой и активными фолатами в организме беременной существенно зависит от используемых доз. Как было показано в предыдущих разделах, избыток фолиевой кислоты может блокировать биотрансформации фолатов и вызывать «фолиевый парадокс» [1], тем самым нивелируя фармакокинетический синергизм фолиевой кислоты и 5-МТГФ [2]. Однако такого рода эффекты наблюдаются при дозировках фолиевой кислоты начиная с 500 мкг/сут (см. приведенный ранее пример с нарушением внутриклеточного обмена эндогенных фолатов [16]).
Заключение
Сочетание фолиевой кислоты и 5-МТГФ фармакокинетически выгодно. При соблюдении дозировок фолиевой кислоты не более 400 мкг/сут такое сочетание не порождает неблагоприятных фармакодинамических взаимодействий, связанных с ингибированием метаболизма эндогенных фолатов. Поэтому при использовании 200 мкг/сут фолиевой кислоты и 200 мкг/сут 5-МТГФ в составе Прегнотон Мама фолиевая кислота ни в коей мере не будет угнетать метаболизм эндогенных фолатов или 5-МТГФ, а наоборот, будет способствовать поддержанию более стабильных уровней фолатов в крови.
Литература/ References
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Лисицына Е.Ю. Системный анализ взаимосвязи дефицитов витаминов и врожденных пороков развития плода. Вопросы гинекологии, акушерства и перинатологии. 2012; 11(3): 54-64. [Gromova O.A., Torshin I.Yu., Tetruashvili N.K., Lisitsyna E.Yu. System analysis of the relationship of vitamin deficiencies and congenital malformations of the fetus. Issues of gynecology, obstetrics and perinatology. 2012; 1i(3): 54-64. (in Russian)].
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Лиманова О.А. О новых тенденциях в нутрициальной поддержке беременности. Акушерство и гинекология. 2018; 1: 21-8. [Gromova O.A., Torshin I.Yu., Tetruashvili N.K., Limanova O.A. On new trends in nutritional support of pregnancy. Obstetrics and gynecology/Akesherstvo i Ginekologiya. 2012; 11(3): 54-64. (in Russian)].
- Froese D.S., Fowler B, Baumgartner M.R. Vitamin B 12, folate, and the methionine remethylation cycle-biochemistry, pathways, and regulation. J. Inherit. Metab. Dis.January 2019. https://dx.doi.org/10.1002/jimd.12009.
- Lintas C. Linking genetics to epigenetics: The role of folate and folate-related pathways in neurodevelopmental disorders. Clin. Genet. 2019; 95(2): 241-52. https://dx.doi.org/10.1111/cge.13421.
- Shakur Y.A., Garriguet D., Corey P., O’Connor D.L. Folic acid fortification above mandated levels results in a low prevalence of folate inadequacy among Canadians. Am. J. Clin. Nutr. 2010; 92(4): 818-25. https://dx.doi.org/10.3945/ ajcn.2010.29696.
- EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA), 2009. Scientific Opinion on the substantiation of health claimf related to folate and blood formation (ID 79), homocyrteine metabolism (ID 80), energy-yielding metabolism (ID 90),function of the immune system (ID 91), function of blood vessels (ID 94, 175, 192), cell division (ID 193), and maternal tissue growth during pregnancy (ID 2882) pursuant to Article 13(1) of Regulation (EC) No 1924/2006 on request from the European Commission. EFSA Journal. 2009; 7(9): 1213. https://dx.doi.org/10.2903Zj.efsa.2009.1213.
- Лиманова О.А., Торшин И.Ю., Сардарян И.С., Калачева А.Г., Hababpashev A., Karpuchin D., Kudrin A., Юдина Н.В., Егорооа Е.Ю., Белинская А.Ю., Гришина R.P., Громов А.Н., Федотова Л.Э., Рудаков , Громова О.А. Обеспеченность микронутриентами и женское здоровье: интеллектуальный анализ клинико-эпидемиологических данных. Вопросы гинекологии, акушерства и перинатологии. 2014; 13(2): 5-15. [Limanova O.A., Torshin I.Yu., Sardaryan I.S., Kalacheva A.G., Hababpashev A., Karpuchin D., Kudrin A., Yudina N.V., Egorova E.Yu., Belinskaya A. .Yu., Grishina TR, Gromov AN, Fedotova L.E., Rudakov K.V., Gromova O.A. Micronutrient availability and women’s health: intellectual analysis of clinical and epidemiological data. Questions of gynecology, obstetrics and perinatology, 2014; 13(2): 5-15. (in Russian)].
- Colapinto C.K., O’Connor D.L., Dubois L., Tremblay M.S. Folic acid supplement use is the most significant predictor of folate concentrations in Canadian women of childbearing age. Appl. Physiol. Nutr. Metab. 2012; 37(2): 284-92. https:// dx.doi.org/10.1139/h11-161.
- Kondo A, Asada Y., Shibata K., Kihira M., Ninomiya K., Suzuki M. et al. Dietary folate intakes and effects of folic acid supplementation on folate concentrations among Japanese pregnant women. J. Obstet. Gynaecol. Res. 2011; 37(4): 331-6. https://dx.doi.org/10.1111/j.1447-0756.2010.01358.x.
- Torshin I.Yu. Bioinformatics in the post-genomic era: physiology and medicine. New York: Nova biomedical books; 2007.
- Prinz-Langenohl R, Bramswig S., Tobolski O., Smulders Y.M., Smith D.E., Finglas P.M., Pietrzik K. [6S]-5-methyltetrahydrofolate increases plasma folate more effectively than folic acid in women with the homozygous or wild-type 677C->T polymorphism of methylenetetrahydrofolate reductase. Br. J. Pharmacol. 2009; 158(8): 2014-21. https://dx.doi.org/10.1111/j.1476-5381.2009.00492.x.
- D’Uva M, Di Micco P., Strina I., Alviggi C., Iannuzzo M., Ranieri A. et al. Hyperhomocysteinemia in women with unexplained sterility or recurrent early pregnancy loss from Southern Italy: a preliminary report. Thromb. J. 2007; 5: 10.
- Rosenthal T.M., Leung S.T., Ahmad R., Young T., Lavie C.J., Moodie D.S., Shah S. Lifestyle modification for the prevention of morbidity and mortality in adult congenital heart disease. Congenit. Heart Dis. 2016; 11(2): 189-98. https:// dx.doi.org/10.1111/chd.12341.
- van OortF.V., Melse-Boonstra A., BrouwerI.A., Clarke R., West C.E., Katan M.B., Verhoef P. Folic acid and reduction of plasma homocysteine concentrations in older adults: a dose-response study. Am. J. Clin. Nutr. 2003; 77(5): 1318-23.
- Homocysteine Lowering Trialists’ Collaboration. Dose-dependent effects of folic acid on blood concentrations of homocysteine: a meta-analysis of the randomized trials. Am. J. Clin. Nutr. 2005; 82(4): 806-12.
- Smith D.E., Hornstra J.M., Kok R.M., Blom H.J., Smulders Y.M. Folic acid supplementation does not reduce intracellular homocysteine, and may disturb intracellular one-carbon metabolism. Clin. Chem. Lab. Med. 2013; 51(8): 164350. https://dx.doi.org/10.1515/cclm-2012-0694.
- Houghton L.A., Yang J., O’Connor D.L. Unmetabolized folic acid and total folate concentrations in breast milk are unaffected by low-dose folate supplements. Am. J. Clin. Nutr. 2009; 89(1): 216-20. https://dx.doi.org/10.3945/ ajcn.2008.26564.
- Pfeiffer C.M., Hughes J.P., Lacher D.A., Bailey R.L., Berry R.J., Zhang M. et al. Estimation of trends in serum and RBC folate in the U.S. population from pre- to postfortification using assay-adjusted data from the NHANES 1988-2010. J. Nutr. 2012; 142(5): 886-93 https://dx.doi.org/10.3945/jn.111.156919.
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Лиманова О.А. Активные формы фолатов в акушерстве. Акушерство и гинекология. 2013; 8: 97-102. [Gromova O.A., Torshin I.Yu., Tetruashvili N.K., Limanova O.A. Active folate forms in obstetrics. Obstetrics and gynecology/Akusherstvo i Ginekologiya. 2013; 8: 97-102. (in Russian)].
- Houghton L.A., Sherwood K.L., Pawlosky R., Ito S., O’Connor D.L. [6S]-5-Methyltetrahydrofolate is at least as effective as folic acid in preventing a decline in blood folate concentrations during lactation. Am. J. Clin. Nutr. 2006; 83(4): 842-50. https://dx.doi.org/10.1093/ajcn/83.4.842.
- Hursthouse N.A., Gray A.R., Miller J.C., Rose M.C., Houghton L.A. Folate status of reproductive age women and neural tube defect risk: the effect of long-term folic acid supplementation at doses of 140 microg and 400 microg per day. Nutrients. 2011; 3(1): 49-62. https://dx.doi.org/10.3390/nu3010049.
- Lamers Y., Prinz-Langenohl R., Bramswig S., Pietrzik K. Red blood cell folate concentrations increase more after supplementation with [6S]-5-methyltetrahydrofolate than with folic acid in women of childbearing age. Am. J. Clin. Nutr. 2006; 84(1): 156-61. https://dx.doi.org/10.1093/ ajcn/84.1.156.
- Henry O.R., Benghuzzi H., Taylor H.A. Jr., Tucci M., Butler K., Jones L. Suppression of homocysteine levels by vitamin B12 and folates: age and gender dependency in the Jackson Heart Study. Am. J. Med. Sci. 2012; 344(2):110-5. https://dx.doi.org/10.1097/MAJ.0b013e31823782a5.
Сведения об авторах:
Громова Ольга Алексеевна, д.м.н., профессор, в.н.с., научный руководитель Института фармакоинформатики, ФИЦ «Информатика и Управление» РАН. Адрес: 119333, Россия, Москва, ул. Вавилова, д. 42. РИНЦ SPIN-код: 6317-9833, Author ID: 94901, Scopus Author ID: 7003589812, ORCID iD: https://orcid.org/0000-0002-7663-710X, WOS ID: J-4946-2017
Торшин Иван Юрьевич, к.х.н., с.н.с. Института фармакоинформатики, ФИЦ «Информатика и Управление» РАН. Адрес: 119333, Россия, Москва, ул. Вавилова, д. 42. Scopus Author ID: 7003300274, РИНЦ SPIN-код: 1375-1114, Author ID: 54104, ORCID ID: 0000-0002-2659-7998, WOS ID: C-7683
Тетруашвили Нана Картлосовна, д.м.н., зав. 2-м отделением акушерским патологии беременности ФГБУ «НМИЦ АГП им. Кулакова» МЗ РФ. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Галустян Анна Николаевна, к.м.н., доцент, зав. кафедрой фармакологии с курсом клинической фармакологии и фармакоэкономики ФГБОУ ВО «Санкт-Петербургский государственный педиатрической университет» МЗ РФ. Адрес: 194100, Россия, Санкт-Петербург, ул. Литовская, д. 2.
Курицина Наталия Андреевна, к.м.н., доцент кафедры фармакологии с курсом клинической фармакологии и фармакоэкономики ФГБОУ ВО «Санкт-Петербургский государственный педиатрической университет» МЗ РФ, Адрес: 194100, Санкт-Петербург, ул. Литовская, д. 2. ORCID: 0000-0002-0200-5097, SPIN-код: 4361-7365
About the authors:
Gromova, Olga A., MD, professor, science head of the Institute of Pharmacoinformatics, leading researcher of the Department of Intellectual Systems, Institute of Pharmacoinformatics, Federal Research Center of Informatics and Management, Russian Academy of Sciences. 119333, Russia, Moscow, Vavilova str. 42. РИНЦ SPIN-код: 6317-9833, AuthorID: 94901, Scopus Author ID: 7003589812, ORCID iD https://orcid.org/0000-0002-7663-710X, WOS ID J-4946-2017
Torshin, Ivan Yu., PhD in Applied Mathematics, senior researcher, Institute of Pharmacoinformatics, Federal Research Center of Informatics and Management, Russian Academy of Sciences. 119333, Russia, Moscow, Vavilova str. 42. Scopus Author ID: 7003300274, РИНЦ SPIN-код: 1375-1114, AuthorID: 54104, ORCID iD: 0000-0002-2659-7998, WOS ID: C-7683-2018
Tetruashvili, Nana K., MD, head of the Department of Pregnancy Loss Prevention and Therapy, Academician V.I. Kulakov National Medical Research Center of Obstetrics, Gynecology, and Perinatology, Ministry of Health of the Russian Federation. 117997, Russia, Moscow, Ac. Oparina str. 4.
Galustiyan, Anna N., PhD, associate professor, head of the Department of Pharmacology with a course of clinical pharmacology and pharmacoeconomics, Saint Petersburg State Pedagogical Medical University, Ministry of Health of Russia. 194100, Russia, St. Petersburg, Litovskaya str. 2.
Kuritcyna, Natalia A., PhD, associate professor, Department of Pharmacology with a course of clinical pharmacology and pharmacoeconomics, Saint Petersburg State Pedagogical Medical University, Ministry of Health of Russia. 194100, Russia, St. Petersburg, Litovskaya str. 2. ORCID: 0000-0002-0200-5097, SPIN-код: 4361-7365
