Исследование эффективности парентерального препарата хондроитин сульфата (Инъектран) в терапии рецидивов хронической боли при остеоартрите коленных суставов с коморбидностью
СтатьиОпубликовано в журнале Лечащий врач № 7/2018; стр. 25-30
Сычёва А.С.1, Царегородцев С.В.1, Наумов А.В., Верткин А.Л.
1 – Кафедра терапии, клинической фармакологии и скорой медицинской помощи МГМСУ им. А.И. Евдокимова
Резюме В многопрофильном стационаре с октября 2017 по февраль 2018 гг был проведен проспективный анализ эффективности внутримышечного введения препарата Инъектран у пациентов с рецидивами хронической боли при остеоартрите коленных суставов с коморбидностью. В результате исследования выявлена эффективность инъектрана, о чем свидетельствовали динамика параметров шкалы ВАШ (уменьшение относительно начального визита – 16,1%), уменьшение скованности, улучшение функции пораженных суставов, суммарного индекса WOMAC (положительная динамика – 10,1 %) и снижение уровня CРБ (положительная динамика – 13,1%).
Ключевые слова: остеоартрит, дегенерация суставного хряща, симптом-модифицирующие препараты замедленного действия, хондроитина сульфат.
В соответствии с рекомендациями международного общества ревматологов (OARSI) остеоартрит (ОА) [1] – расстройство с вовлечением подвижных суставов, характеризующееся клеточным стрессом и деградацией внеклеточного матрикса, инициированных микро- и макротравматизацией, что активирует неадекватный репаративный ответ, включая провоспалительные механизмы врожденного иммунитета. Первоначально болезнь манифестирует как молекулярное расстройство (абнормальный метаболизм суставных тканей) с последующими анатомическими и / или физиологическими повреждениями (деградация хряща, ремоделирование костной ткани, формирование остеофитов, воспаление сустава и утрата нормальной функции сустава), которые в конечном итоге могут завершиться формированием заболевания.
По данным Федеральной службы государственной статистики (2016) болезни костно-мышечной системы, где большую долю составляют больные с ОА, являются 3-й по частоте причиной инвалидизации населения РФ, вслед за сердечно-сосудистыми заболеваниями (ССЗ) и онкологической патологией (табл. 1). Табл.1 Причины инвалидизации населения РФ (данные Федеральной службы государственной статистики, 2016 г.)
| Причины инвалидизации населения РФ (всего, тыс. человек) | 2006 | 2016 |
| Болезни системы кровообращения | 755 | 207 |
| Злокачественные новообразования | 191 | 212 |
| Болезни костно-мышечной системы и соединительной ткани | 118 | 42 |
| Последствия травм, отравлений и других воздействий внешних причин | 69 | 26 |
| Психические расстройства и расстройства поведения | 48 | 32 |
| Болезни нервной системы | 41 | 26 |
| Болезни глаза и его придаточного аппарата | 47 | 21 |
| Туберкулез | 35 | 17 |
| Болезни эндокринной системы, расстройства питания и нарушения обмена веществ | 50 | 12 |
| Болезни органов дыхания | 45 | 14 |
| Болезни органов пищеварения | 23 | 14 |
| Болезни уха и сосцевидного отростка | 14 | 13 |
| Последствия производственных травм | 7 | 2 |
| Профессиональные болезни | 3 | 1 |
ОА является самым распространенным хроническим заболеванием суставов, которое встречается примерно у 11–13% населения, в том числе 81 млн больных ОА зарегистрированы в Германии, Италии, Франции, Великобритании, Испании и 383 млн - в России, Бразилии, Индии и Китае.
Значительное увеличение частоты ОА обусловлено прежде всего быстрым старением популяций и пандемией ожирения. Прогнозируют, что к 2020 г. встречаемость ОА в популяциях может достичь 57%, причем существенно увеличиваются и затраты на лечение [2].
По данным официальной статистики Минздрава России, число первично зарегистрированных больных с этой патологией ежегодно увеличивается: если в 2011 г. этот показатель составлял 650,5 на 100 тыс. населения, то в 2012 г. он достиг 665,1 [3].
Особенности и трудности терапии пациентов с ОА, в первую очередь связаны с возрастом, наличием коморбидной патологии и вынужденной полипрагмазией. Эти же факторы способствуют прогрессированию ОА и определяют негативный прогноз заболевания.
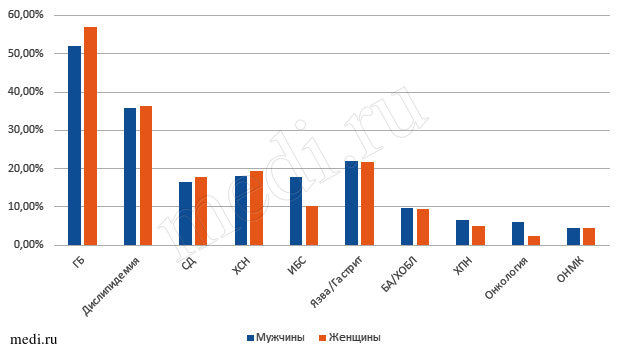
Наиболее часто ОА сочетается с гипертонической болезнью, атеросклерозом, ишемической болезнью сердца, ожирением, сахарным диабетом, хроническими обструктивными заболеваниями легких, заболеваниями желудочно-кишечного тракта. Распространенность выше перечисленных коморбидных состояний (рис.1) приблизительно в 2–3 раза выше при ОА, чем в общей популяции [5, 7]. Примерно у половины пациентов встречается сочетание ОА с хронической венозной недостаточностью периферических вен нижних конечностей [6].
Рис.1 Коморбидность при остеоартрозе (n=1021)
Основные цели лечения ОА:
- замедление прогрессирования заболевания уменьшение боли;
- улучшение функционального состояния суставов;
- отсутствие побочных эффектов фармакотерапии и обострения сопутствующих заболеваний;
- улучшение качества жизни, которые достигаются немедикаментозными, медикаментозными и хирургическими методами.


Симптом-модифицирующие препараты медленного действия, многие из которых обладают структурно-модифицирующими свойствами, в настоящее время уже завоевали устойчивые позиции в арсенале комплексных схем лечения ОА в мире. Доказано, что под воздействием альтернаций биохимических параметров фенотипически измененные фибробласты гиалинового хряща продуцируют провоспалительные цитокины, среди которых ИЛ-1 играет ключевую роль. Наряду с ИЛ-6 и ФНО-α этот цитокин ответственен за выброс синовитами металлопротеиназ - протеолитических ферментов, разрушающих суставной хрящ. Симптом-модифицирующие препараты медленного действия обладают хондропротективными свойствами, увеличивают анаболическую активность хондроцитов и одновременно супрессируют дегенеративные эффекты цитокинов на хрящ [9], что способствует замедлению темпов прогрессирования остеоартроза путем коррекции нарушенного метаболизма в гиалиновом хряще, нормализации или стабилизации в нем структурных изменений, профилактики изменений в непораженном суставе.
Табл. 2 10 финальных рекомендаций EULAR (2003), основанных как на доказательствах, так и на экспертном мнении
| 1 | Оптимальное лечение ОА коленного сустава требует сочетания немедикаментозных и медикаментозных методов |
| 2 | Лечение ОА коленного сустава следует подбирать с учетом: (а) Факторов риска заболевания коленного сустава (ожирение, неблагоприятные механические факторы, повышенные физические нагрузки) (б) Общих факторов риска (возраст, сопутствующие состояния, полипрагмазия) (с) Интенсивности боли и степени инвалидизации (д) Признаков воспаления — например выпот в полость сустава (е) Локализации и степени структурной патологии |
| 3 | Немедикаментозные подходы к лечению ОА коленного сустава должны включать: образование пациентов, физические нагрузки, специальные приспособления (трости, стельки для обуви, фиксирующие повязки на колено), а также снижение массы тела |
| 4 | Парацетамол является оральным анальгетиком первого выбора, и при достижении успеха в лечении данному анальгетику следует отдавать преимущества при необходимости долгосрочной терапии |
| 5 | Препараты для местного применения (НПВП, капсаицин) обладают клинической эффективностью и являются безопасными |
| 6 | Лечение НПВП показано пациентам, не реагирующим на парацетамол. Больным с повышенным риском осложнений со стороны ЖКТ следует назначать комбинацию неселективного НПВП и эффективного гастропротекторного препарата либо селективные ингибиторы ЦОГ-2 |
| 7 | Опиоидные анальгетики как в сочетании с парацетамолом, так и без него являются полезной альтернативой у пациентов, которым НПВП (включая селективные ингибиторы ЦОГ-2) противопоказаны, неэффективны и/или плохо переносятся |
| 8 | Препараты группы SYSADOA (глюкозамина сульфат, хондроитина сульфат, ASU, диацерейн и гиалуроновая кислота) оказывают симптоматический эффект и способны модифицировать структуру сустава |
| 9 | Внутрисуставные инъекции длительно действующего кортикостероида показаны при обострении боли в коленном суставе, особенно если она сопровождается выпотом в полость сустава |
| 10 | Целесообразность протезирования сустава следует рассматривать у пациентов с рентгенологическими признаками ОА коленного сустава, рефрактерной к лечению болью и выраженной инвалидизацией |
Традиционно назначаемые НПВП, относящиеся к ингибиторам ЦОГ-I и ЦОГ-II, имеют существенные ограничения как по дозам, так и длительности применения в связи с рядом нежелательных лекарственных реакций со стороны ССС, ЖКТ, печени и почек, которые нередко представляют угрозу для жизни пациента, в особенности полиморбидного, вынужденная полипрагмазия которого еще более повышает риски сердечно-сосудистых осложнений, и делает практически невозможной прогнозирование лекарственных взаимодействий терапии хронических сердечно-сосудистых заболеваний и НПВП. Результаты многих когортных исследований показали, что все НПВП, ингибиторы ЦОГ, повышают риски тромбоэмболических осложнений в общей популяции [10,11].
Эти риски увеличиваются практически по экспоненте у больных с высокими сердечно-сосудистыми рисками. Поэтому одним из основных постулатов врача, осуществляющего лечение пациента с ОА, является стремление как можно скорее снизить дозу, отменить НПВП, или лучше вообще отказаться от препаратов этой группы, в особенности в отношении больных с сопутствующими сердечно-сосудистыми заболеваниями. Такой подход отразился и в рекомендациях Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартроза (ESCEO), выпущенных в августе 2014 года, в которых наряду с немедикаментозным ведением пациентов с остеоартрозом первая линия фармакотерапии представлена препаратами SYSADOA, к которым относятся препараты хондроитин сульфата. По данным метаанализа H. Schneider и соавт., где оценивалось симптом-модифицирующее действие хондроитина сульфата при ОА коленного сустава (n=588), отмечен значимый эффект препарата хондроитина сульфата в отношении уменьшения боли при физической активности до 6 мм (p = 0,005) по ВАШ vs с плацебо после 3—6 мес. лечения, а также уменьшения индекса Лекена –0,73 (p = 0,01) [12]. M.C.Hochberg и соавт. провели метаанализ рандомизированных плацебо контролируемых 2-х летних исследований, в ходе которых определялись изменения суставной щели у пациентов (n=1179) с применением хондроитина сульфата.
Метаанализ показал достоверное замедление уменьшения минимальной ширины суставной щели на 0,13 мм (р=0,0002), у пациентов, принимавших хондроитин сульфат [13]. В том же исследовании было отмечено, что хондроитина сульфат достоверно более выраженно снижает потерю объема хрящевой ткани, чем плацебо уже через 6 месяцев лечения (p = 0,030). В латеральном отдела (p = 0,015), верхней поверхности большеберцовой кости (p = 0,002). Эффект сохраняет статистическую значимость и через 12 месяцев. По данным 4-летнего рандомизированного исследования приема хондроитина сульфата J-P. Raynauld и соавт. (n=57) отмечается тенденция к снижению частоты полной замены коленного сустава в группе хондроитина сульфата [14]. Исследователи B.Mazieres и соавт. в своем исследовании (n=132) пришли к выводам, что прием хондроитин сульфата уменьшает воспаление и боль на 33%, за счет этого уменьшается потребность в НПВП на 55% уже через 5 месяцев (p<0,001) [15].
Помимо вышеизложенного, реальная возможность применять в большинстве случаев короткие курсы НПВП находится в противоречии с самой природой хронической патологии, к которой относится ОА, требующий длительного, практически пожизненного лечения. Симптом-модифицирующие с доказанным в ряде РКИ структурно-модифицирующим действием хондропротекторы, применяемые для лечения ОА, характеризуются благоприятным профилем безопасности, оказывают комплексное воздействие на сустав и поэтому предназначены для длительного лечения повторными курсами с перерывами до 3-5 месяцев. Биологические эффекты хондроитина сульфата, к которым относится препарат Инъектран, чрезвычайно многообразны, и он является необходимым компонентом для нормального функционирования гиалинового хряща. Получены убедительные данные, что при приеме внутрь препараты хондроитина сульфата обладают противовоспалительным действием, которое реализуется торможением активности лизосомальных ферментов, супероксидных радикалов и экспрессии провоспалительных цитокинов. Кроме того, они стимулируют хондроциты и синтез протеогликанов с нормальной полимерной структурой, а его антикатаболическое действие идет за счет ингибиции металлопротеиназ – стромелизина, коллагеназы, фосфалипазы А2. Имеет также значение активация синтеза гиалуроновой кислоты, подавление преждевременной гибели (апоптоза) хондроцитов, нормализация структуры субхондральной кости. Доказан эффект препаратов хондроитин сульфата в интенсификации репарации гиалинового хряща.
Материалы и методы
На базе многопрофильного стационара с октября 2017 по февраль 2018 гг был проведен проспективный анализ эффективности внутримышечного введения препарата Инъектран у пациентов в возрасте 40-70 лет с остеоартрозом коленных суставов и коморбидными состояниями и выраженностью боли более 50 мм по ВАШ.
В исследование были включены 30 пациентов (7 мужчин и 23 женщины (табл. 3)) в возрасте от 45 до 80 лет. Препарат использовался в форме раствора для внутримышечных инъекций. В ампуле (2 мл) содержится 200 мг хондроитин сульфата, препарат применялся внутримышечно через день, 30 инъекций на курс лечения.
Критерии включения:
- Остеоартрит коленного (ых) сустава (ов) 2-3 рентгенологической стадии по Kellgren-Lowrence с коморбидностью
- Боль при ходьбе 50 мм по ВАШ
- Пациент прекратил прием хондропротекторов более, чем за 3 мес. от момента включения в данное исследование
- Пациенту не вводили внутрисуставно любые препараты в течение 6 недель до начала данного исследования
Исследование включило в себя 2 визита (в первый день и через два месяца после лечения), в ходе которых были оценены следующие показатели:
- Показатели функционального состояния печени и почек: АСТ, АЛТ, креатинин, мочевина
- WOMAC
- Интенсивность боли по ВАШ
- Показатели интенсивности воспаления (СРБ)
- Нежелательные явления (НЯ), серьезные нежелательные явления (СНЯ)
| Среднее | Все (N = 30) |
Мужчины (N = 7) |
Женщины (N= 23) |
| Возраст(лет) | 57,76 ± 8,9 | 56,85 ± 10,17 | 58,04 ± 8,83 |
| Рост(см) | 167,13 ± 8,69 | 176 ± 5.09 | 164,43 ± 7,74 |
| Вес(кг) | 76,16 ± 9,90 | 71 ± 4,65 | 77 ± 11,32 |
| ИМТ | 29,37 ± 4,42 | 22,67 ± 2,60 | 31,04 ± 2,85 |
| С-РБ в начале исследования(мг/л): | |||
| 8,62 ± 8,21 | 4,19 ± 2,20 | 9,97 ± 8,98 | |
| С-РБ через 2 месяца(мг/л): | |||
| 7,49 ± 6,44 | 3,86 ± 1,65 | 8,60 ± 6,95 | |
* ИМТ – индекс массы тела
* С-РБ – C- реактивный белок
Средний возраст пациентов 57,7 лет, средний ИМТ 29,37. Для оценки эффективности курса восстановительного лечения больных с остеоартрозом, нами был использована балльная оценка функционального состояния суставов по шкале WOMAC в абсолютных величинах, так как известно, что индекс является общепринятой анкетой, предназначенной для оценки симптомов ОА (функциональности) самим пациентом.
Результаты и обсуждение
Таблица 4. Шкалы WOMAC (баллов) и ВАШ (см) в 1-й день и через 2 месяца
| Все (N = 30) |
Мужчины (N = 7) |
Женщины (N= 23) |
|
| WOMAC и ВАШ в начале исследования: | |||
| WOMAC средний | 7,9 ± 5,9 | 6,9 ± 5,3 | 8,9 ± 6,4 |
| WOMAC - Боль | 3,2 ± 1,9 | 2,9 ± 1,8 | 3,5 ± 2,1 |
| WOMAC – ограниченная подвижность | 3,0 ± 2,3 | 2,8 ± 2,1 | 3,2 ± 2,6 |
| WOMAC – затруднения в выполнении повседневной деятельности | 3,3 ± 2.5 | 2,7 ± 2,2 | 3,9 ± 2,5 |
| ВАШ средний: | 6,2 ± 2,2 | 6,1 ± 2,1 | 6,4 ± 2,4 |
| WOMAC и ВАШ через 2 месяца: | |||
| WOMAC средний | 7,1 ± 6,2 | 6,6 ± 5,5 | 8,6 ± 6,9 |
| WOMAC - Боль | 2,8 ± 2,1 | 2,4 ± 2,2 | 3,3 ± 2,1 |
| WOMAC – ограниченная подвижность | 1,8 ± 2,3 | 1,5 ± 2,0 | 2,2 ± 2,7 |
| WOMAC – затруднения в выполнении повседневной деятельности | 2,9 ± 2,5 | 2,5 ± 2,3 | 3,3 ± 2,8 |
| ВАШ средний через 2 месяца: | 5,2 ± 2,6 | 5,4 ± 2,7 | 5,1 ± 2,6 |
В ходе исследования установлена хорошая переносимость препарата Инъектран. Нежелательных явлений отмечено не было, показатели функционального состояния печени и почек – в пределах нормы. Критериями эффективности препарата в лечении остеоартроза коленных суставов служили показатели интенсивности воспаления (СРБ), шкалы WOMAC и интенсивности боли по ВАШ.
Анализ проводился в течение 2 месяцев. Применение препарата привело к существенному улучшению – снижение СРБ, показателей WOMAC и ВАШ.
Индекс WOMAC исследовался в трех категориях: боль, ограничение подвижности и затруднения в выполнении повседневной деятельности. Болевой синдром по индексу WOMAC составлял в среднем 7,9, ограничение подвижности больные оценили в среднем в 3,0, а затруднения в повседневной деятельности в 3,3.
Суммарно степень выраженности болевого синдрома у всех наблюдавшихся пациентов по шкале ВАШ в начале исследования оценивалась в среднем в 62 мм, а уже через 2 месяца после начала исследования – в 52 мм (уменьшение относительно начального визита – 16,1%).
Динамика показателей индекса WOMAC: в начале исследования среднее – 7,9 баллов, через 2 месяца. – 7,1 балла (положительная динамика – 10,1 %).
Динамика СРБ как маркера интенсивности воспаления: 8,62 мг/л в начале лечения, 7,49 мг/л – через 2 месяца (положительная динамика – 13,1%).
На фоне проводимого лечения Инъектраном, отмечалась хорошая положительная динамика клинического течения остеоартроза. У больных достоверно уменьшился болевой синдром, как по ВАШ, так и по индексу WOMAC, значительно увеличилась подвижность активных движений в суставах, уменьшились затруднения в выполнении повседневных функций (Табл. 4).
Заключение
В результате исследования выявлена клиническая эффективность препарата Инъектран, обладающего симптом-модифицирующим действием у пациентов с ОА, о чем свидетельствовали уменьшение скованности, улучшение функции пораженных суставов, суммарного индекса WOMAC (положительная динамика – 10,1 %), шкалы ВАШ (уменьшение относительно начального визита – 16,1%), снижение уровня CРБ (положительная динамика – 13,1%). При изучении эффективности терапии подтверждены высокий показатель безопасности применения препарата и отсутствие побочных явлений.
Данное исследование позволяет рекомендовать Инъектран как достоверно эффективный в повседневной клинической практике препарат для лечения больных ОА в дневном стационаре и амбулаторно-поликлинических условиях.
ЛИТЕРАТУРА
- Osteoarthritis Cartilage. 2015 Apr 9. pii: S1063-4584(15)00899-7. doi: 10.1016/j.joca.2015.03.036.
- Мартынов А.И. Ведение больных остеоартритом с коморбидностью в общей врачебной практике: мнение экспертов, основанное на доказательной медицине /А. И. Мартынов, А. В. Наумов, А. Л. Вёрткин, Л. И. Алексеева, П. С. Дыдыкина//Лечащий врач. – 2015. - №4.
- Балабанова Р.М. Характер боли при остеоартрозе, подходы к лечению // Современная ревматология. 2014. № 2. С. 103–106.
- Mortality in osteoarthritis. M.C. Hochberg Clin. Exp. Rheumatol. 2008, 26(5 Suppl 51). P. 120-4.
- Галушко Е.А., Большакова Т.В., Виноградова И.Б. и др. Структура ревматических заболеваний среди взрослого населения России по данным эпидемиологического исследования (предварительные результаты) // Научно-практическая ревматология. 2009. № 1. С. 11–17.
- Салихов И.Г., Лапшина С.А., Мясоутова Л.И. и др. Остеоартроз и заболевания периферических вен нижних конечностей: особенности сочетанной патологии // Тер. архив. 2010. Т. 82. № 5. С. 58–60.
- Rosemann Th. Osteoarthritis: quality of life, comorbidities, medication and health service utilization assessed in a large sample of primary care patients / Thomas Rosemann, Gunter Laux, and Joachim Szecsenyi // J Orthop Surg. 2007; 2: 12.
- OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis and Cartilage 22 (2014) 363e388.
- Volpi N. Chondroitin sulphate for the treatment of osteoarthritis. Curr Med Chem 2005; 4(3): 221–234.
- Насонов Е.Л. Применение нестероидных противовоспалительных препаратов в медицине в начале 21 века. РМЖ, 2003; 11 (7), 375–378.
- FitzGerald GA, Patrono C. The Coxibs, selective inhibitors of cyclooxygenase–2. New Engl J Med 2001; 345: 433–442.
- H.Schneider. The Open Rheumatology Journal, 2012, 6, 183-189.
- M.C.Hochberg. Osteoarthritis and Cartilage 18 (2010) S28-S31.
- J-P. Raynauld et al. Cartilage 4 (3), 219 – 226, 2013.
- B.Mazieres, Rev.Rhum. Osteoartic., 1992, (59 (7-8), 466-472.
