Влияние Мексидола на выраженность системного воспалительного ответа у больных при операциях реваскуляризации миокарда в условиях искусственного кровообращения
СтатьиОпубликовано в журнале АНЕСТЕЗИОЛОГИЯ И КАРДИОРЕАНИМАЦИЯ, 2008; 1: 67—72
А.А. Еременко, Т.П. Зюляева, В.М. Егоров, Я.В. Сидоренко, М.В. Фоминых
Influence of Mexidol on systemic inflammation reaction at the patients undergoing myocardial revascularization surgery with artificial circulation
A.A. Eremenko, T.P. Zyulyaeva, V.M. Egorov, Ya.V. Sidorenko, M.V. Fominykh
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
У 40 больных ишемической болезнью сердца оценивали степень выраженности системного воспалительного ответа после операций реваскуляризации миокарда в условиях искусственного кровообращения. Больные основной группы (n=20) получали этилметилгидроксипиридина сукцинат (мексидол) в течение 5 сут до операции, интраоперационно и в течение 5 сут после операции. Больные контрольной группы (n=20) получали изотонический раствор натрия хлорида. Выраженность системного воспалительного ответа оценивали по концентрациям провоспалительных цитокинов — интерлейкина (IL)6, IL-8, фактора некроза опухолей (TNFα) и С-реактивного белка (СРБ). Для оценки степени повреждения внутренних органов исследовали динамику биохимических показателей — уровни ферментов (аланинаминотрансфераза, аспартатаминотрансфераза, γ-глутамилтранспептидаза, лактатдегидрогеназа, креатинфосфокиназа) и миоглобина в сыворотке крови. В послеоперационном периоде в обеих группах больных наблюдалось значительное увеличение концентраций IL-6, IL-8, TNFα, СРБ, однако в основной группе оно было статистически значимо ниже, чем в контрольной (p<0,05). В группе больных, получавших мексидол, увеличение уровня ферментов и миоглобина в сыворотке крови после операции было менее выраженным, чем в группе с плацебо (p<0,05). Таким образом, показано, что мексидол снижает выраженность синдрома системного воспалительного ответа после операций реваскуляризации миокарда в условиях искусственного кровообращения и оказывает органопротекторное действие. Systemic inflammation reaction was studied at 40 patients undergoing myocardial revascularization surgery with artificial circulation. Patients of the study group (n=20) were treated with Mexidol 5 days before, during and 5 days after surgery. Patients of control group (n=20) took 0,9 % NaCl. Systemic inflammation reaction was evaluated by IL-6, IL-8, TNFα and C-reactive protein concentrations. The severity of organs alteration was diagnosed by ALT, AST, GGT, LDG, KPK and myoglobin serum level. The patients of both groups in postoperative period demonstrate the increase of IL-6, IL-8, TNFα and CRP concentrations, but their level at study group was significantly lower that at control group (p<0.05). The levels of serum enzymes and myoglobin in Mexidol group were also lower compared with placebo group (p<0.05). It is concluded that Mexidol has organ-protection properties and reduce systemic inflammation reaction after myocardial revascularization procedures with artificial circulation.
Синдром системного воспалительного ответа (ССВО) возникает у большинства пациентов после кардиохирургических операций в условиях искусственного кровообращения (ИК) как механизм, защищающий организм от повреждающих факторов. Чрезмерная активация воспалительной реакции может быть причиной многих осложнений в послеоперационный период, наиболее тяжелым из которых является полиорганная недостаточность (ПОН) [6, 12].
В основе ССВО лежат нарушения регуляции про- и противовоспалительных механизмов [11]. Пусковыми моментами развития ССВО после кардиохирургических операций являются контакт клеток крови с компонентами аппарата ИК, хирургическая травма и феномен ишемии-реперфузии [8, 16]. Перечисленные механизмы приводят к активации кинин-калликреиновой системы, систем комплемента, коагуляции и фибринолиза. Образующиеся при этом провоспалительные медиаторы (брадикинин, активированные протеазы системы комплемента, активные факторы свертывания, фибрин и плазмин) запускают каскадную воспалительную реакцию, что приводит к активации тромбоцитов, лейкоцитов, клеток эндотелия, развитию воспалительной реакции в миокарде и легких и выбросу большого количества провоспалительных цитокинов — интерлейкинов (IL)-1, IL-6, IL-8, фактора некроза опухолей (TNFα) [15]. Повышение уровня провоспалительных цитокинов коррелирует с увеличением тяжести ССВО и частотой развития ПОН [14].
Активированные лейкоциты выделяют большое количество гидроксильных и супероксидных радикалов [17]. Кроме того, увеличению синтеза свободных радикалов кислорода, активации перекисного окисления липидов (ПОЛ) и нарушению антиоксидантной защиты организма способствуют гипоксия тканей, развивающаяся при ИК и кровопотере, реперфузия после длительной ишемии [1, 2, 7]. Свободные радикалы кислорода активируют ПОЛ, которое ведет к повреждениям клетки, а также участвуют в развитии воспалительного ответа — активируют лейкоциты, повышают продукцию цитокинов [9, 10, 13].
Генерализованный воспалительный ответ, сопровождающийся массивной активацией и выбросом провоспалительных цитокинов, свободных радикалов кислорода, продуктов ПОЛ и последующей эндогенной интоксикацией, ведет к поражению органов-мишеней: легких, сердца, головного мозга, печени, почек, что в итоге может стать причиной выраженной ПОН в послеоперационном периоде [4, 5].
Одним из перспективных лекарственных препаратов, влияющих на патогенез ССВО и ПОН, является этилметилгидроксипиридина сукцинат (мексидол) — производное янтарной кислоты и 3-окси-6-метил-2-этилпиридина, обладающий антиоксидантными и антигипоксическими свойствами.
Aнтиоксидантное действие мексидола обусловлено его способностью ингибировать образование свободных радикалов кислорода и ПОЛ, повышать активность ферментов антиоксидантной защиты организма (супероксиддисмутазы). Кроме того, мексидол взаимодействует с каталитически активными ионами двухвалентного железа, что приводит к уменьшению активности процессов свободнорадикального окисления. Как многие производные 3-оксипиридина, мексидол оказывает мембраностабилизирующее действие.
Препарат стимулирует прямое окисление глюкозы по пентозофосфатному пути, повышает концентрацию восстановленных нуклеотидов, тем самым усиливая антиоксидантную защиту клетки и стабилизируя уровень эндогенных антиоксидантов.
При воспалительной реакции мексидол более эффективно подавляет процессы свободнорадикального окисления по сравнению с широко применяемыми в клинике гидрофобными антиоксидантами. Это связано с тем, что для начальной стадии воспалительной реакции характерна гиперпродукция радикалов кислорода в водной фазе, тогда как гидрофобные ингибиторы свободнорадикального окисления взаимодействуют со свободными радикалами, локализованными в основном в гидрофобной зоне мембран и липопротеинов [3].
В присутствии мексидола активируется сукцинатоксигеназный путь окисления, что позволяет сохранить определенный уровень окислительного фосфорилирования в митохондриях и поддерживать синтез АТФ и креатинфосфата в условиях гипоксии. Активация сукцинатоксигеназного пути окисления способствует повышению резистентности клеток к гипоксии.
Исходя из того что мексидол влияет на некоторые звенья патогенеза системной воспалительной реакции, можно предположить, что этот препарат снижает выраженность ССВО и оказывает органопротективное действие у больных после операций коронарного шунтирования в условиях ИК.
Цель исследования — оценить эффективность фармакологической коррекции ССВО у пациентов после операций коронарного шунтирования с помощью мексидола.
Задачи исследования:
- Оценить влияние мексидола на развитие системного воспалительного ответа у пациентов после операций коронарного шунтирования с ИК по сравнению с плацебо.
- Оценить эффективность препарата в профилактике органных нарушений.
Материал и методы
Проведено рандомизированное плацебо-контролируемое исследование фазы II. В исследование включены 40 больных (35 мужчин и 5 женщин) с ИБС, которым в ГУ РНЦХ им. акад. Б.В. Петровского РАМН были выполнены операции реваскуляризации миокарда. Пациенты были рандомизированы (метод конвертов) на 2 группы, по 20 больных в каждой, получавшие мексидол или плацебо.
Критерии включения: подписанное информированное согласие, возраст 18—80 лет, ИБС, впервые обусловливающая необходимость операции аортокоронарного шунтирования, сердечная недостаточность I—IV класса по классификации NYHA, фракция изгнания больше или равна 35%, индекс массы тела не более 40 кг/м², масса тела >55 кг, хирургический доступ — срединная стернотомия.
Критерии исключения: острое нарушение мозгового кровообращения, тромбоз глубоких вен нижних конечностей, тромбоэмболия легочной артерии в течение 3 мес до операции; острый инфаркт миокарда за 7 дней и менее до операции; плохо контролируемый сахарный диабет; длительность ИК более 210 мин; нефропатия до операции с уровнем креатинина крови более 220 мкмоль/л; повышение уровня аспартатаминотрансферазы (АсАТ), аланинаминотрансферазы (АлАТ) в крови более 80 Ед/л и (или) билирубина крови более 40 мкмоль/л до операции; аллергия на мексидол или другие подобные лекарственные препараты; возвращение больного в операционную в связи с развитием осложнений: кардиогенного шока, обусловливающего необходимость внутриаортальной баллонной контрпульсации; послеоперационных кровотечений, при которых требуется рестернотомия; острый инфаркт миокарда, развившийся во время или после операции; острое нарушение мозгового кровообращения, тромбоэмболия легочной артерии во время или после операции.
Ограниченная сопутствующая терапия. Для пациентов, включенных в исследование, ограничивалась терапия следующими препаратами: ацетилцистеин, витамин Е, фосфокреатин (неотон), АТФ, цитохром С, реамберин и другие препараты янтарной кислоты, коэнзим Q, рибоксин.
Прием этих препаратов должен был быть прекращен за сутки до скринингового обследования пациентов (т.е. за 6—7 дней до хирургического вмешательства) и в течение недели после операции.
Введение исследуемого препарата. Пациентам основной группы ежедневно в течение 5 сут до операции вводили внутримышечно утром 2 мл 5% раствора (100 мг) этилметилгидроксипиридина сукцинат (мексидол, «Фармасофт»), днем 2 мл 5% раствора и вечером 4 мл 5% раствора. По окончании искусственного кровообращения пациенты получали 4 мл 5% раствора препарата. В течение 5 сут после операции больным вводили по 4 мл 5% раствора препарата внутримышечно 3 раза в день (утром, днем, вечером).
Пациентам контрольной группы (плацебо) вводили внутримышечно изотонический раствор натрия хлорида в те же сроки и в тех же объемах.
Уровень цитокинов (IL-6, IL-8, IL-10 и TNFα) определяли с помощью однофазного иммуноферментного анализа по ELISA с использованием наборов фирмы BioSource International. Биохимические показатели крови определяли на автоанализаторе KONE-ULTRA и KONELAB-30, оценивали уровень общего билирубина, АсАТ, АлАТ, ЛДГ, креатинфосфокиназы (КФК), ее фракции МБ (КФК-МБ), креатинина, глюкозы, общего белка, альбумина, γ-глутамилтранспептидаза (ГГТ), С-реактивного белка (СРБ), миоглобина, лактата.
Результаты
Пациенты основной и контрольной групп статистически значимо не различались по возрасту, степени стеноза левой коронарной артерии, фракции изгнания, функциональному классу сердечной недостаточности и стенокардии, частоте выявления артериальной гипертензии и перенесенного инфаркта миокарда до операции (табл. 1). Кроме того, в исследуемых группах не было выявлено статистически значимых различий между интраоперационными показателями, такими как тип операции (изолированное аортокоронарное шунтирование, аортокоронарное шунтирование + маммарокоронарное шунтирование, маммарокоронарное шунтирование + шунтирование лучевой артерией), длительность ишемии миокарда, длительность ИК, величина интраоперационной и послеоперационной кровопотери (табл. 2).
Таблица 1. Исходные демографические и клинические характеристики обследованных больных
| Показатель | Группы больных | |
| мексидол | плацебо | |
| Возраст, годы | 60,6±2,4 | 55,4±2,1 |
| Стеноз ствола левой коронарной артерии, число больных | 9 (37,5%) | 11 (42,3%) |
| Фракция изгнания, % | 56±2 | 55±1,3 |
| Стенокардия, число больных: | ||
| IV ФК | 9 (45%) | 10 (50%) |
| III ФК | 11 (55%) | 10 (50%) |
| Сердечная недостаточность, число больных: | ||
| ФК II | 1 (5%) | 1 (5%) |
| ФК III | 9 (45%) | 10 (50%) |
| ФК IV | 10 (50%) | 9 (45%) |
| Инфаркт миокарда до операции, число больных | 11 (55%) | 11 (55%) |
| Сопутствующая артериальная гипертензия, число больных | 18 (90%) | 17 (85%) |
Примечание. ФК — функциональный класс. Здесь и в табл. 2: различия показателей между группами статически незначимы (р>0,05).
Таблица 2. Основные интраоперационные показатели обследованных больных
| Показатель | Группы больных | |
| мексидол | плацебо | |
| Аортокоронарное шунтирование, число больных | – | 1 (5%) |
| Аортокоронарное + маммарокоронарное шунтирование, число больных | 19 (95%) | 19 (95%) |
| Маммарокоронарное шунтирование + шунтирование лучевой артерией, число больных | 1(5%) | – |
| Длительность ИК, мин | 92,6±6,1 | 94,7±7,0 |
| Длительность ишемии миокарда, мин | 61,7±4,9 | 61,8±6,3 |
| Интраоперационная кровопотеря, мл | 910±49 | 975±29 |
| Послеоперационная кровопотеря, мл | 299±22 | 273±15 |
Примечание. ИК — искусственное кровообращение.
Степень выраженности системного воспалительного ответа оценивали по уровню провоспалительных цитокинов IL-6, IL-8, TNFα, противовоспалительного цитокина IL-10 и СРБ (табл. 3).
Таблица 3. Динамика концентраций провоспалительных цитокинов
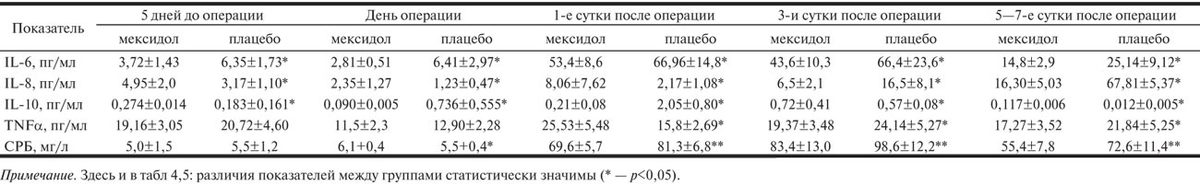
Концентрации IL-6, IL-8, TNFα, СРБ за 5 дней до операции и в день ее выполнения в обеих группах находились в пределах нормы. За 5 дней до операции концентрация провоспалительных цитокинов в исследуемых группах не различалась, уровень СРБ в группе плацебо был выше (p<0,05). В день операции концентрации TNFα и СРБ в двух группах не различались, уровень IL-6 был выше в группе плацебо, а IL-8 — незначительно выше в основной группе. Межгрупповые различия уровней провоспалительных цитокинов до операции незначительны и, вероятно, обусловлены индивидуальными различиями между больными.
В послеоперационном периоде наблюдалось значительное увеличение концентраций провоспалительных цитокинов TNFα, IL-6, IL-8, а также СРБ.
В 1-е сутки после операции концентрация IL-6 у больных обеих групп возросла по сравнению с исходной в 10-19 раз (р<0,01), причем в группе больных, получавших мексидол, уровень IL-6 был в 1,5 раза ниже, чем в контрольной группе (р<0,01). Такие же высокие концентрации IL-6 сохранялись на 3-и сутки послеоперационного периода, концентрация IL-6 в контрольной группе была выше (р<0,01). К 5—7-м суткам послеоперационного периода уровень IL-6 снизился в обеих группах. Однако в основной группе концентрация IL-6 оставалась в 1,7 раза ниже, чем в контрольной (р<0,01).
Уровень IL-8 в 1-е сутки после операции в контрольной группе был выше, чем в группе больных, получавших мексидол (2,35±1,27 и 1,23±0,47 пг/мл соответственно, p<0,01). Однако на 3-и и 5—7-е сутки послеоперационного периода концентрация IL-8 имела такую же динамику, как и концентрация IL-6. В группе больных, получавших мексидол, уровень IL-8 на 3-й и 5—7-й дни после операции был ниже, чем в контрольной в 2,5 и 4 раза соответственно (р<0,01).
Сходная динамика наблюдалась в отношении концентрации TNFα: после операции она возросла в обеих группах, однако прирост концентрации этого цитокина был менее выражен по сравнению с таковым концентрации IL-6 и IL-8. В 1-е сутки после операции уровень TNFα в группе больных, получавших мексидол, был выше, чем в контрольной (p<0,01), но к 3-м суткам послеоперационного периода концентрация TNFα в группе больных, получавших мексидол, была статистически значимо ниже, чем в контрольной (19,37±3,48 и 24,14±5,27 пг/мл соответственно, р<0,01). Такое же соотношение между группами сохранялось и на 5—7-й день послеоперационного периода (17,27±3,52 и 21,84±5,25 пг/мл, р<0,01).
Уровень СРБ в 1-е сутки после операции увеличился в обеих группах в 8—10 раз по сравнению с исходным и достиг максимальных значений к 3-м суткам после операции. В течение всего послеоперационного периода концентрация СРБ в группе больных, получавших мексидол, была достоверно ниже, чем в контрольной (р<0,01).
Таким образом, повышение концентрации провоспалительных цитокинов и СРБ в послеоперационном периоде свидетельствует о развитии системной воспалительной реакции после операций реваскуляризации миокарда в условиях ИК. Более низкие концентрации СРБ и провоспалительных цитокинов TNFα, IL-6, IL-8 у больных основной группы свидетельствуют о том, что мексидол снижает выраженность системной воспалительной реакции.
Динамика показателей клинического анализа крови у больных при операциях реваскуляризации миокарда. Развитие системного воспалительного ответа после операций реваскуляризации миокарда подтверждалось изменениями показателей клинического анализа крови (табл. 4).
Таблица 4. Динамика СОЭ и формулы белой крови
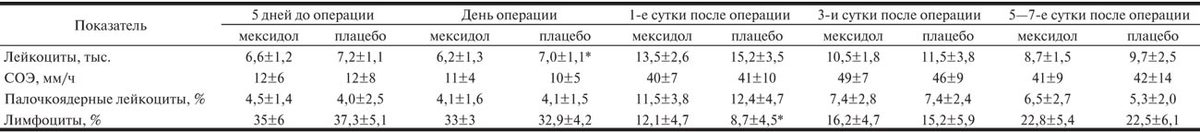
Такие показатели, как СОЭ, количество лейкоцитов, полиморфноядерных лейкоцитов и лимфоцитов до операции находились в пределах нормы и не различались между группами. В 1-е сутки после операции у больных обеих групп наблюдалось увеличение СОЭ (40±7 и 41±10 мм/ч в основной и контрольной группах соответственно), лейкоцитоз (13,5±2,6·109/л и 15,2±3,5·109/л), сдвиг лейкоцитарной формулы влево, уменьшение количества лимфоцитов. К 5—7-м суткам послеоперационного периода выраженность воспалительной реакции снижалась. Статистически значимых различий между показателями клинического анализа крови в исследуемых группах не было.
Динамика концентрации противовоспалительного цитокина IL-10 в плазме крови у больных при операциях реваскуляризации миокарда.
Концентрация IL-10 за 5 сут до операции не различалась между группами. После операции концентрация IL-10 увеличилась в обеих группах, при этом в 1-е сутки после операции концентрация IL-10 в контрольной группе была в 10 раз выше, чем в основной (p<0,01). К 3-м суткам послеоперационного периода концентрация IL-10 в группе больных, получавших мексидол, была статистически значимо выше, чем в контрольной.
Повышение концентрации IL-10 свидетельствует об активации противовоспалительных систем организма в ответ на развитие ССВО после операций с ИК. Меньшее увеличение концентрации IL-10 в группе, получавшей мексидол, может быть связано с тем, что степень воспалительного ответа после ИК в этой группе была ниже, и, следовательно, компенсаторная активация противовоспалительных цитокинов меньше.
Оценка органопротекторного действия мексидола после операций реваскуляризации миокарда в условиях ИК. Выраженность ССВО взаимосвязана с тяжестью состояния больных и частотой развития гемодинамической, дыхательной недостаточности, острого респираторного дистресс-синдрома, нарушений системы свертывания крови. Следовательно, можно предположить, что снижение уровня провоспалительных цитокинов уменьшает риск возникновения органной недостаточности в послеоперационном периоде.
Нарушение целостности клеточных мембран после операций в условиях ИК может приводить к значительному повышению активности ферментов в сыворотке крови и повышению концентрации миоглобина в послеоперационном периоде. Увеличение активности сывороточных ферментов отражает развитие повреждения тканей и органов при ССВО. Чтобы оценить степень повреждения внутренних органов после операций в условиях ИК, мы исследовали динамику биохимических показателей в послеоперационном периоде (табл. 5).
Таблица 5. Динамика биохимических показателей крови
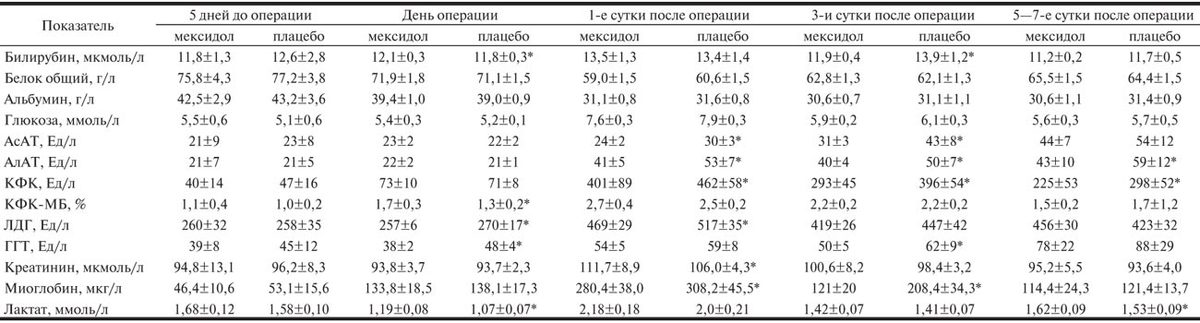
До операции измеряемые показатели биохимического анализа крови (активность сывороточных ферментов АсАТ, АлАТ, ЛДГ, КФК, КФК-МБ, ГГТ; концентрации общего белка, альбумина, общего билирубина, креатинина, глюкозы, СРБ, миоглобина, лактата) находились в пределах нормы в обеих группах. Статистически значимых межгрупповых различий не наблюдалось.
После операции возросли активность в сыворотке крови ферментов АсАТ, АлАТ, КФК, ЛДГ и содержание в крови миоглобина.
Активность АсАТ и АлАТ в сыворотке крови после операции увеличилась в 1,5—2 раза. Статистически значимые различия между группами больных наблюдались в течение 1—7-х суток послеоперационного периода. Активность этих ферментов в группе пациентов, получавших мексидол, была ниже (p<0,05).
Активность ГГТ после операции также увеличилась в обеих группах. В 1—3-и сутки послеоперационного периода и у больных основной группы была статистически значимо ниже, чем у пациентов контрольной группы.
Сходная динамика наблюдалась для ЛДГ. Активность ЛДГ после операции увеличилась в обеих группах в 1,5 раза, при этом в группе больных, получавших мексидол, активность ЛДГ в 1—3-и сутки послеоперационного периода была статистически значимо ниже, чем в контрольной.
Активность КФК в 1-е сутки после операции увеличилась в 6—7 раз. Максимальный уровень этого фермента наблюдался в 1-е сутки после операции. К 3—7-му дню послеоперационного периода активность КФК незначительно снизилась в обеих группах. В течение 7 сут послеоперационного периода активность КФК у больных основной группы была статистически значимо в 1,2—1,3 раза ниже, чем контрольной.
Таким образом, наблюдаемые межгрупповые различия активностей сывороточных ферментов в послеоперационном периоде свидетельствуют о защитной функции мексидола (защита от повреждения клеточных мембран и предотвращение поражения внутренних органов).
В 1-е сутки после операции наблюдалось повышение уровня миоглобина, более выраженное в контрольной группе (p<0,05). Затем уровень миоглобина снижался, однако межгрупповые различия сохранялись на 3-й день после операции. Концентрация миоглобина в группе больных, получавших мексидол, была статистически значимо выше, чем в контрольной (р<0,05). Однако на 5—7-е сутки после операции статистически значимых различий между двумя группами больных не было.
Более низкая активность ферментов сыворотки крови и миоглобина у пациентов основной группы свидетельствуют об органопротекторном действии мексидола. Полученные данные позволяют предположить, что мексидол способен снизить частоту развития осложнений после операций реваскуляризации миокарда в условиях ИК.
Выводы
- Операции реваскуляризации миокарда в условиях искусственного кровообращения (ИК) сопровождаются развитием выраженной системной воспалительной реакции, которая проявляется повышением концентрации СРБ, провоспалительных цитокинов TNFa, IL-6 и IL-8, лейкоцитозом, увеличением СОЭ, сдвигом лейкоцитарной формулы влево, а также поражением органов и тканей, проявляющимися увеличением уровня АлАТ, АсАТ, ГГТ, ЛДГ, КФК и миоглобина.
- Мексидол снижает выраженность системного воспалительного ответа после ИК, о чем свидетельствует более низкий уровень СРБ и TNFα, IL-6, IL-8 в группе больных, получавших мексидол, по сравнению с плацебо.
- Повышение уровня ферментов сыворотки крови отражает повреждение тканей и органов при синдроме системного воспалительного ответа после ИК. Более низкие концентрации АлАТ, АсАТ, ГГТ, ЛДГ, КФК и миоглобина в сыворотке крови больных, получавших мексидол, позволяют судить о защитном действии препарата при повреждении клеточных мембран и развитии органных нарушений.
- Органопротекторное действие мексидола и снижение выраженности синдрома системного воспалительного ответа (как одной из причин возникновения полиорганной недостаточности) позволяют предположить, что мексидол способен снизить частоту развития осложнений после операции реваскуляризации миокарда в условиях ИК.
Литература
- Андрианова М.Ю., Палюлина М.В., Кукаева Е.А., Мильчаков В.И. Перекисное окисление липидов и содержание средних молекул при операциях на сердце с искусственным кровообращением. Анест и реаниматол 2001; 2: 33—35.
- Зацепина Н.Е. Влияние искусственного кровообращения на перекисное окисление липидов: Автореф. дис. …канд. мед. наук. М 2001; 31.
- Клебанов Г.И., Любицкий О.Б., Васильева О.В. и др. Антиоксидантные свойства производных 3-оксипиридина: мексидола, эмоксипина и проксипина. Вопр мед химии 2001; 3: 25-27.
- Шевченко О.П., Хубутия М.Ш., Чернова А.В. и др. Молекулярные и клеточные механизмы развития осложнений после искусственного кровообращения. Трансплантол и искусств органы 1996; 3: 49—55.
- Bone R.C., Balk R. et al. Adult respiratory distress syndrom. Sequence and importance of development of multiple organ failure. Chest 1992; 101: 2: 320 — 326.
- Cameron D. Initiation of white cell activation during cardiopulmonary bypass: cytokines and receptors. J Cardiovasc Pharmacol 1996; 27 (suppl 1) :S1—S5.
- Frey B., Johnen W., Haupt R. et al. Bioactive oxidized lipids in the plasma of cardiac surgical intensive care patients. Shock 2002; 18: 1: 14—17.
- Hess M.L., Manson N.H. Molecular oxygen: friend and foe. The role of the oxygen free radical system in the calcium paradox, the oxygen paradox and ischemia/reperfusion injury. J Mol Cell Cardiol 1984; 16: 11: 969—985.
- Jennings G.R., Castresana M.R., Newman W.H. Regulation of tumor necrosis factor-alpha production in the isolated rat heart stimulated by bacterial lipopolysaccharide or reactive oxygen. Am Surg 2004; 70: 9:797—800.
- Kokura S., Yoshida N., Yoshikawa T. Anoxia/reoxygenation-induced leukocyte-endothelial cell interactions. Free Radic Biol Med 2002; 33: 427—432.
- Kristof A.S., Magder S. Low systemic vascular resistance state in patients undergoing cardiopulmonary bypass. Crit Care Med 1999; 27: 1121—1127.
- Laffey J.G., Boylan J.F., Cheng D.C. The systemic inflammatory response to cardiac surgery: implications for the anesthesiologist. Anesthesiology 2002; 97: 1: 215—252.
- Lum H., Roebuck K.A. Oxidant stress and endothelial cell dysfunction. Am J Physiol Cell Physiol 2001; 280: C719—C741.
- Mendonca-Filho H.T., Pereira K.C., Fontes M. et al. Circulating inflammatory mediators and organ dysfunction after cardiovascular surgery with cardiopulmonary bypass: a prospective observational study. Crit Care 2006; 10: 2: R46.
- Mojcik C.F., Levy J.H. Aprotinin and the systemic inflammatory response after cardiopulmonary bypass. Ann Thorac Surg 2001; 71: 2:745—754.
- Paparella D., Yau T.M., Young E. Cardiopulmonary bypass induced inflammation: pathophysiology and treatment. An update. Eur J Cardiothorac Surg 2002; 21: 2: 232—244.
- Prasad K., Kalra J., Bharadwaj B., Chaudhary A.K. Increased oxygen free radical activity in patients on cardiopulmonary bypass undergoing aortocoronary bypass surgery. Am Heart J 1992; 123: 1: 37—45.
