Клиническая эффективность применения метаболически активной инфузионной терапии у пациентов с жировой эмболией
СтатьиОпубликовано в:
Вестник интенсивной терапии имени А.И.Салтанова, 2018 г., № 2, стр. 50-55
А.Ю. Яковлев1, А.А. Певнев1, М.С. Белоус1, С.А. Тезяева3, Д.В. Рябиков2, С.И. Чистяков1, Т.А. Галанина1
1ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко», Нижний Новгород
2 ГБУЗ НО «Городская клиническая больница № 13», Нижний Новгород
3 ГБУЗ НО «Городская клиническая больница № 5», Нижний Новгород
Проведено исследование динамики органных нарушений у 22 пациентов с тяжелой сочетанной травмой, осложненной жировой эмболией, и эффективности применения метаболически активной инфузионной терапии. Выявлено, что в первые сутки с момента получения травмы характерно формирование полиорганной недостаточности, связанной с наличием травматического шока. Со вторых суток основой формирования полиорганной недостаточности у пациентов с тяжелой сочетанной травмой является манифестация жировой эмболии. Определена эффективность многокомпонентного антигипоксанта для предупреждения тяжести полиорганной недостаточности при развитии жировой эмболии в раннем посттравматическом периоде.
Ключевые слова: травма, жировая эмболия, SOFA, метионин, сукцинат
Для корреспонденции: Яковлев Алексей Юрьевич — д-р мед. наук, доцент, куратор ОРИТ ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко», Нижний Новгород.
Clinical efficacy of metabolically active fluid therapy in patients with fat embolism syndrome
A.Yu. Yakovlev1, A.A. Pevnev1, M.S. Belous1, S.A. Tezyaeva3, D.V. Ryabikov2, S.I. Chistyakov1, T.A. Galanina1
1 Nizhniy Novgorod regional clinical hospital named after N.A. Semashko, Nizhniy Novgorod
2 Nizhny Novgorod clinical hospital 13, Nizhniy Novgorod
3 Nizhny Novgorod clinical hospital 5, Nizhniy Novgorod
The research tested changes of organ disorders in 22 patients with fat embolism syndrome in the early posttraumatic period. It was found that early multiple organ failure is related to traumatic shock. At Day 1 and thereafter, in patients with the severe combined injury, multiple organ failure was associated with manifesting fat embolism. We confirmed the efficacy of multiple substrate antihypoxant fluid to prevent multiple organ failure related to fat embolism manifesting in the early post-traumatic period.
Keywords: trauma, fat embolism, SOFA, methionine, succinate
For correspondence: Aleksey Y. Yakovlev — Sc. D., Associate Prof., ICU curator of “Nizhniy Novgorod regional clinical hospital named after N.A. Semashko”, Nizhniy Novgorod.
Введение. Возрастающий дорожный травматизм является тяжелым бременем для экономики. Так, по данным ВОЗ, дорожно-транспортные происшествия являются одной из ведущих причин смерти в мире, а у людей в возрасте 15-29 лет — основной [1]. От осложнений травматической болезни, в том числе от жировой эмболии (ЖЭ), погибают около 15-20 % всех пострадавших с тяжелой сочетанной травмой (ТСТ) [2].
Жировая эмболия — это тяжелое, угрожающее жизни клиническое проявление жировой глобулемии, как правило характеризующееся следующей триадой: петехии, дыхательная недостаточность, церебральная недостаточность (снижение уровня сознания, психические нарушения) [3]. Согласно биохимической теории основой патогенеза ЖЭ является процесс гидролиза жира на свободные жирные кислоты. Показано, что продукты гидролиза жира, включая свободные жирные кислоты, вызывают острый респираторный дистресс-синдром (ОРДС) на моделях животных [4], при этом наиболее тяжелое повреждение легких и эндотелия вызывает олеиновая кислота [5, 6].
Учитывая особенности патогенеза, ЖЭ стоит рассматривать как один из основных факторов развития полиорганной недостаточности (ПОН) в первые пять суток после травмы. Ишемические нарушения системы микроциркуляции возникают вследствие обтурации сосудов жировыми эмболами, а также гидролиза триглицеридов до жирных кислот, оказывающих повреждающее действие на эндотелий сосудов [7]. Представляется перспективным использование антигипоксантов, потенциально восстанавливающих метаболизм неэтерифицированных жирных кислот (НЭЖК), в профилактике и лечении ЖЭ.
Цель исследования. Изучить динамику органных нарушений у пациентов с тяжелой сочетанной травмой, осложненной жировой эмболией, и эффективность применения многокомпонентного антигипоксанта «Ремаксол» в составе инфузионной терапии в сочетании со стандартной терапией.
Материалы и методы. Из 637 пациентов с ТСТ (тяжесть травмы по Injury Severity Score (ISS) ≥ 17 баллов), поступивших в региональные травматологические центры Нижнего Новгорода в 2012-2016 гг, были отобраны 22 (3,4 %) больных, у которых ранний посттравматический период осложнился развитием ЖЭ. Диагноз «жировая эмболия» выставлялся на основании суммарной оценки более 20 баллов по диагностической шкале «ВПХ-ЖЭ (Д)» [8]. Для оценки степени органного повреждения у пациентов с ЖЭ использовалась система оценки Sequential Organ Failure Assessment (SOFA) [9, 10]. Из исследования исключались больные в алкогольном опьянении, пациенты с черепно-мозговой травмой, с выявленной сопутствующей патологией (сахарный диабет, цирроз печени, острая и хроническая почечная недостаточность, хроническая патология легких). Дизайн исследования представлен на рис. 1.
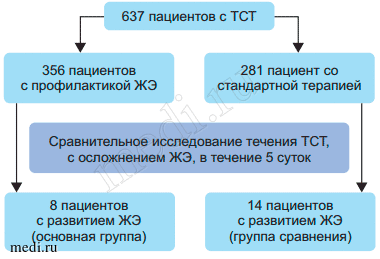 Рис 1. Дизайн исследования
Рис 1. Дизайн исследования
I группа (сравнения), включающая 14 пациентов, была выбрана из 281 больного, у которых профилактика и лечение ЖЭ включала инфузионную коррекцию гиповолемии препаратами, не содержащими субстратные антигипоксанты, раннюю оперативную стабилизацию переломов, обезболивание, гепарин. Частота ЖЭ при использовании стандартной ее профилактики составила 4,98 %.
Из 356 пациентов, получавших с момента поступления в стационар в течение 5 сут на фоне стандартной терапии (инфузионная коррекция гиповолемии, ранняя оперативная стабилизация переломов, обезболивание, гепарин) дополнительно инфузионный препарат «Ремаксол» (НТПФ «Полисан», Россия) в дозе 800 мл/сут, выбрали II (основную) группу из 8 пациентов, у которых травматическая болезнь также осложнилась ЖЭ. Объемы инфузии, в том числе и на догоспитальном этапе, у пациентов I и II групп не имели отличий. Частота развития ЖЭ при включении в комплекс лечения больных с тяжелой сочетанной травмой инфузионного антигипоксанта «Ремаксол» составила 2,25 %.
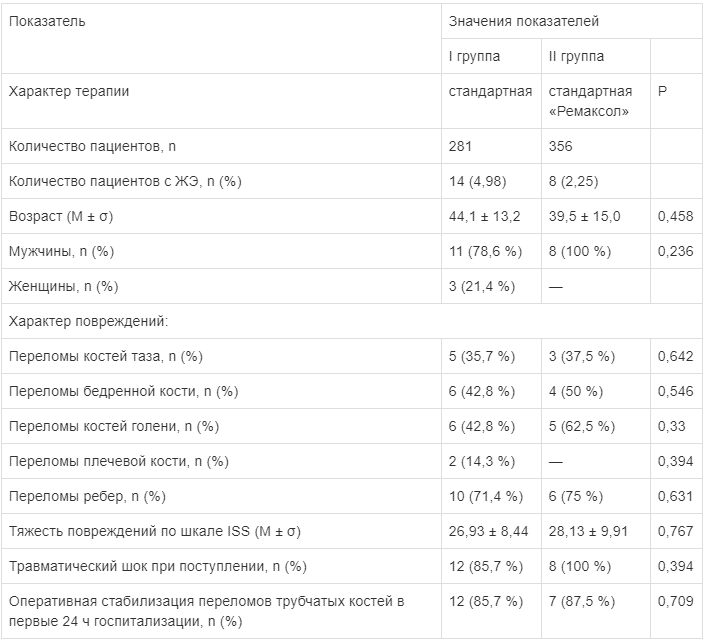
Общая характеристика групп пациентов представлена в табл. 1. Группы пациентов не имели отличий по полу, возрасту, тяжести полученной травмы, частоте развития травматического шока, срокам оперативной стабилизации переломов.
Таблица 1
Сравнительная характеристика групп больных
 Статистическая обработка результатов исследования осуществлялась с помощью пакета прикладных программ GNU PSPP 0.10.2. Полученные данные были проверены на нормальность распределения с помощью теста Шапиро—Уилка. Результаты исследований для количественных признаков с нормальным распределением представлены в виде среднего значения (М) и стандартного отклонения (а). При асимметричном распределении количественного признака данные представлены в виде медианы (Ме) и перцентилей (Р25; Р75). Для сравнения качественных данных в несвязанных выборках использовали точный тест Фишера. Для сравнения количественных признаков с нормальным распределением исп ользовали t-критерий Стьюдента, для анализа данных с асимметричным распределением: U-критерий Манна—Уитни для несвязанных выборок, Т-критерий Уилкоксона — для связанных. Разницу считали статистически значимой при p ≤ 0,05. Значения p < 0,1 считали статистической тенденцией.
Статистическая обработка результатов исследования осуществлялась с помощью пакета прикладных программ GNU PSPP 0.10.2. Полученные данные были проверены на нормальность распределения с помощью теста Шапиро—Уилка. Результаты исследований для количественных признаков с нормальным распределением представлены в виде среднего значения (М) и стандартного отклонения (а). При асимметричном распределении количественного признака данные представлены в виде медианы (Ме) и перцентилей (Р25; Р75). Для сравнения качественных данных в несвязанных выборках использовали точный тест Фишера. Для сравнения количественных признаков с нормальным распределением исп ользовали t-критерий Стьюдента, для анализа данных с асимметричным распределением: U-критерий Манна—Уитни для несвязанных выборок, Т-критерий Уилкоксона — для связанных. Разницу считали статистически значимой при p ≤ 0,05. Значения p < 0,1 считали статистической тенденцией.Результаты. При поступлении в стационар средние значения PaO2/FiO2 у пациентов групп I и II соответствовали норме. Все пациенты имели ясное сознание, а медиана величины уровня сознания по шкале комы Глазго (ШКГ) соответст вовала нормальным значениям [11]. Средние величины количества тромбоцитов в крови в исследуемых группах находились в диапазоне нормальных значений. Значения среднего артериального давления (СрАД) в группах I и II были ниже должных величин (в группе I — на 10 %, в группе II — на 5 %). Статистически значимых отличий при изучении данных показателей в исследуемых группах не выявлено (табл. 2).
Таблица 2
Динамика клинических показателей (M ± σ, Ме [Р25; Р75])
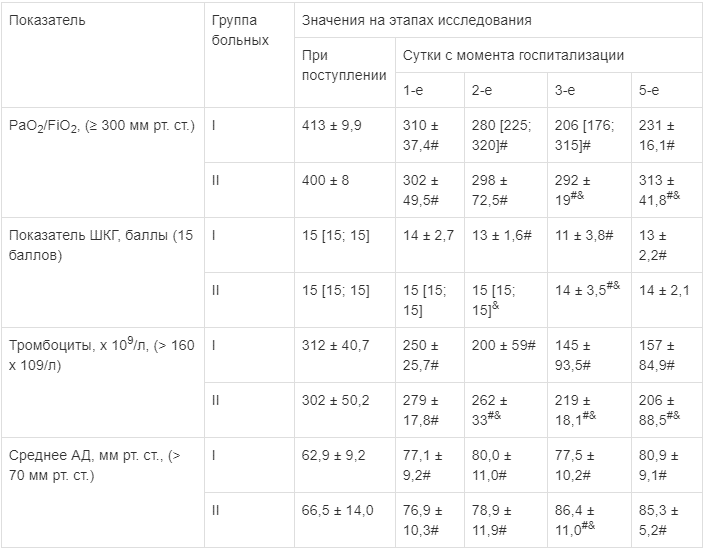 Статистически значимые различия: # — внутри группы по сравнению со значением при поступлении; & — относительно I группы на одинаковых этапах исследования.
Статистически значимые различия: # — внутри группы по сравнению со значением при поступлении; & — относительно I группы на одинаковых этапах исследования.При госпитализации тяжесть ПОН у пациентов с развившейся в последующем ЖЭ была обусловлена: 1) сохраняющимся травматическим шоком, требующим продолжения инфузионной коррекции гиповолемии и включения в состав интенсивной терапии а-, р-адреномиметиков; 2) дыхательной недостаточностью, проявляющейся снижением PaO2/FiO2 и, по-видимому, являющейся следствием травматического повреждения легочной паренхимы [12]. Статистически значимых различий в показателях оценки ПОН на данном этапе исследования не выявлено (табл. 3).
Таблица 3
Динамика показателей полиорганной недостаточности (M ± σ, Ме [Р25; Р75])
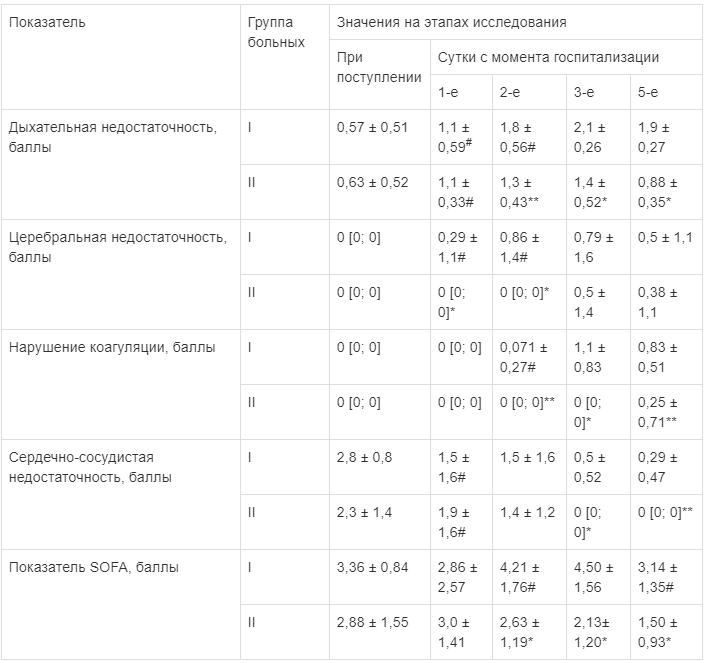 Статистически значимые различия: # — внутригрупповые по сравнению с предыдущими сутками; * — межгрупповые; ** — межгрупповые на уровне статистической тенденции.
Статистически значимые различия: # — внутригрупповые по сравнению с предыдущими сутками; * — межгрупповые; ** — межгрупповые на уровне статистической тенденции.На следующие сутки после поступления в стационар при изучении клинических показателей обращало на себя внимание их усугубление в связи с манифестацией ЖЭ.
Средние значения PaO2/FiO2 у пациентов групп I и II были значимо ниже показателей, зарегистрированных при поступлении в стационар (р < 0,001 для обеих подгрупп).
Пациенты группы II на данном этапе исследования имели ясное сознание, а медиана величины уровня сознания по ШКГ соответствовала нормальным значениям. У одного из пациентов группы I в этот период наблюдения произошла манифестация ЖЭ, которая сопровождалась гипоксемией, потребовавшей начала инвазивной ИВЛ, и снижением уровня сознания до комы. Таким образом, среднее значение величины уровня сознания по ШКГ в данной группе снизилось на 5 % от исходного, однако в связи с малым объемом выборки эти значения достоверно не отличались от значений при поступлении (р = 0,722) и от значений группы II (р = 0,780).
Количество тромбоцитов в крови в обеих исследуемых группах пациентов было значимо ниже показателя, зарегистрированного при поступлении в стационар (р = 0,018 и р = 0,031 соответственно), хотя и соответствовало нормальным значениям.
Среднее артериальное давление (СрАД) в исследуемых группах находилось в пределах должных величин и было значимо выше показателей, зарегистрированных при поступлении. Стоит отметить, что в исследуемых группах пациентов должный уровень АД поддерживался с помощью постоянной инфузии допамина.
В первые сутки с момента поступления в стационар тяжесть ПОН у пациентов с ЖЭ была обусловлена прогрессированием дыхательной недостаточности, проявлявшейся снижением PaO2/FiO2. На данном этапе это было связано с нарушением вентиляционно-перфузионных отношений, в том числе вследствие эмболизации сосудов малого круга кровообращения жировыми глобулами. Сохранялась сердечно-сосудистая недостаточность, менее выраженная по сравнению с данными , зарегистрированными при поступлении в стационар. Церебральная недостаточность, проявляющаяся снижением уровня сознания, усугубляла ПОН у пациентов группы I. Статистически значимых межгрупповых различий в показателях оценки ПОН на данном этапе исследования не выявлено.
На вторые сутки после травмы у пациентов обеих исследуемых групп отрицательная динамика тяжести ПОН была связана с появлением новых случаев ЖЭ и прогрессированием органных дисфункций у пациента группы I, у которого ЖЭ была диагностирована ранее. Средние значения PaO2/FiO2 у пациентов групп I и II умеренно снизились относительно предыдущего этапа исследования и по-прежнему были значимо ниже показателей, зарегистрированных при поступлении в стационар (р = 0,032 и р = 0,026 соответственно).
Пациенты группы II на данном этапе исследования имели ясное сознание, а средние величины уровня сознания по ШКГ соответствовали нормальным значениям. У пациентов группы I в этот период средние значения величины уровня сознания по ШКГ достоверно отличались от таковых при поступлении (р = 0,032) и пациентов группы II (р = 0,046). Среднее количество тромбоцитов умеренно снизилось, но по-прежнему находилось в пределах должных величин. Значения СрАД во всех исследуемых группах также находились в пределах должных величин.
Тяжесть ПОН на вторые сутки с момента поступления в стационар была обусловлена прогрессированием дыхательной, церебральной недостаточности и тромбоцитопенией, выраженными в большей степени у пациентов, не получавших «Ремаксол» (группа I). Сохранялась сердечно-сосудистая недостаточность, проявлявшаяся потребностью в постоянной инфузии допамина: у пациентов группы I — в 7 случаях (50 %), группы II — в 5 случаях (62,5 %). На этом этапе исследования зарегистрированы значимые межгрупповые различия в степени выраженности ПОН (р = 0,035). Следовательно, именно со вторых суток после травмы инфузии «Ремаксола» оказывали сдерживающее влияние на прогрессирование ПОН вследствие ЖЭ в раннем посттравматическом периоде.
На третьи сутки с момента госпитализации у пациентов обеих исследуемых групп продолжалось ухудшение изучаемых клинических показателей, что связано как с появлением новых случаев ЖЭ, так и с прогрессированием ПОН у больных с ранее возникшей ЖЭ.
Средние значения PaO2/FiO2 у пациентов групп I и II были значимо ниже показателей, зарегистрированных при поступлении в стационар (р = 0,012 и р = 0,016 соответственно). Однако интенсивность снижения PaO2/FiO2 у пациентов с ЖЭ, получавших «Ремаксол» (группа II), была менее выражена, что проявлялось статистически значимыми различиями (р = 0,047).
У пациентов обеих подгрупп в этот период значения уровня сознания по ШКГ достоверно отличались от средних величин при поступлении (р = 0,038 и р = 0,043 соответственно). Однако средние значения уровня сознания в группе II были значимо выше аналогичных показателей группы I (р = 0,047).
Несмотря на то что средние значения количества тромбоцитов в группе II находились в пределах должных величин, этот показатель прогрессивно уменьшался с момента поступления в стационар за счет манифестации ЖЭ. У пациентов группы I значения показателя были ниже таковых при поступлении в стационар, а также значений для группы II (р = 0,031 и р = 0,037 соответственно). Полученный результат связан с тем, что в группе I у 4 пациентов (28,6 %) было зарегистрировано снижение тромбоцитов ниже 150 х 109/л, у 6 (42,9 %) — ниже 100 * 109/л. В группе II у всех пациентов данный показатель соответствовал нормальным значениям. СрАД во всех исследуемых группах было в пределах должных величин. Достоверно меньшие значения СрАД зарегистрированы в группе I.
Тяжесть ПОН на третьи сутки с момента поступления в стационар была обусловлена дальнейшим прогрессированием дыхательной и церебральной недостаточности, а также тромбоцитопенией, которые были выражены в большей степени у пациентов, не получавших «Ремаксол». Сердечно-сосудистая недостаточность, проявлявшаяся снижением СрАД, менее 70 мм рт. ст. сохранялась лишь у 7 пациентов в группе I. Межгрупповые различия в степени выраженности ПОН зарегистрированы на уровне статистической значимости (р = 0,001).
К пятым суткам исследования балльная оценка тяжести ПОН в группе II была достоверно ниже по сравнению с таковой у пациентов группы I.
Средние значения PaO2/FiO2 у пациентов групп I и II были значимо ниже, чем при поступлении в стационар (р = 0,018 и р = 0,027 соответственно). Однако в группе пациентов, получавших «Ремаксол», PaO2/FiO2 был выше по сравнению с предыдущими сутками, а также был значимо выше значений в I группе (р = 0,043 и р = 0,038 соответственно).
У пациентов группы I в этот период оценка уровня сознания по ШКГ достоверно отличалась от значений при поступлении (р = 0,023). Уровень сознания в группе II не отличался от значений при поступлении.
Средние значения количества тромбоцитов в группе II были в пределах должных величин, однако прогрессивно уменьшались с момента поступления в стационар, что проявлялось статистически значимыми отличиями. У пациентов группы I количество тромбоцитов было значимо ниже, чем при поступлении в стационар, а также группы II (р = 0,027 и р = 0,042 соответственно).
Значения СрАД во всех исследуемых подгруппах находились в пределах должных величин, но при этом за счет снижения количества больных группы I, получающих инотропную поддержку системы кровообращения, достоверность отличий относительно группы II не определялась.
На пятые сутки наблюдения тяжесть ПОН у пациентов группы I была обусловлена сохраняющейся дыхательной и церебральной недостаточностью, а также тромбоцитопенией. В группе II в этот период наблюдалась тенденция к регрессу клинических проявлений ПОН. Межгрупповые различия в степени выраженности ПОН зарегистрированы на уровне статистической значимости (р = 0,006).
Обсуждение. У пациентов с ТСТ полиорганная недостаточность, связанная с манифестацией жировой эмболии, прогрессирует на 2-5-е сутки после получения травмы, что связано со сроками возникновения данного осложнения и требует внимания при проведении лечебно-профилактических мероприятий. Включение инфузионного антигипоксанта «Ремаксол» в комплекс лечения таких пациентов предупреждает прогрессирование ПОН, что может быть связано с действием его компонентов на развитие ЖЭ. Известно, что сукцинат наряду с предупреждением тканевой гипоксии может оказывать прямое вазодилатирующее действие [14], что уменьшает эмболическую опасность циркулирующих жировых глобул и последствия ишемических повреждений жизненно важных органов. Метионин, входящий в состав препарата, также может способствовать снижению выраженности ПОН за счет ускорения утилизации НЭЖК, оказывающих повреждающее действие на эндотелий [5]. В процессе метаболизма из метионина и аденозина синтезируется активная форма метионина — S-аденозилметионин, который является предшественником карнитина, участвующего в переносе длинноцепочечных НЭЖК, составляющих основу жировых эмболов, через мембрану митохондрий. Стоит отметить, что карнитин синтезируется в основном из экзогенно поступающих незаменимых аминокислот лизина и метионина [15], что представляется затруднительным у пациентов в критических состояниях на фоне развития энтеральной недостаточности [16], вследствие чего развивается дефицит карнитина [17-20]. Снижение концентрации НЭЖК при инфузии метионинсодержащего антигипоксанта «Ремаксол» приводит к сокращению сроков циркуляции крупных жировых глобул размером более 6 мкм, способных блокировать микроциркуляторное русло [21], что также может вносить свой вклад в профилактику органных дисфункций. Восстановление метаболизма свободных жирных кислот со снижением их концентрации в крови может также препятствовать слиянию мелких глобул в крупные, тем самым влиять на ишемические механизмы формирования ПОН.
Выводы. Включение в комплекс лечения у больных с тяжелой сочетанной травмой многокомпонентного антигипоксанта «Ремаксол» в дозе 800 мл/сут в течение первых пяти суток посттравматического периода способствует уменьшению частоты развития жировой эмболии (с 4,98 до 2,25 %) и более благоприятному течению синдрома полиорганной недостаточности.
Полученные результаты требуют продолжения клинических исследований, направленных на изучение взаимосвязи нарушений метаболизма свободных жирных кислот и циркуляции жировых глобул, с более детальным изучением роли антиоксидантов и прооксидантов в формировании полиорганной недостаточности у больных с тяжелой сочетанной травмой.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Яковлев А.Ю. — дизайн исследования, редактирование статьи; Певнев А.А. — подготовка литературного обзора, сбор научного материала, статистическая обработка; Белоус М.С., Тезяева С.А., Галанина Т.А. — сбор научного материала; Рябиков Д.В. — сбор научного материала, статистическая обработка; Чистяков С.И. — редактирование статьи.
ORCID авторов
Яковлев А.Ю. — 0000-0002-4616-5711
Певнев А.А. — 0000-0002-2293-634X
Белоус М.С. — 0000-0002-1869-6144
Тезяева С.А. — 0000-0002-1870-6145
Рябиков Д.В. — 0000-0002-4032-622X
Чистяков С.И. — 0000-0003-1320-1402
Галанина Т.А. — 0000-0002-4836-621Х
Литература/ References
1. Доклад о безопасности дорожного движения в мире 2015 г. Резюме. Октябрь 2015 г. WHO, ed. (2015). «Global Status Report on Road Safety 2015» (PDF) (official report). Geneva, Switzerland: World Health Organisation (WHO). pp. vii, 1-14, 75ff (countries), 264-271 (table A2), 316-332 (table A10).
2. Дерябин И.И., Насонкин О.С. Травматическая болезнь. Л.: Медицина, 1987. [Deryabin I.I., Nasonkin O.S. Travmaticheskaya bolezn'. Leningrad: Meditsina, 1987. (In Russ)]
3. Saigal R., Mittal M., Kansal A., et al. Fat embolism syndrome. J. Assoc. Phys. India. 2008; 56: 245-249.
4. Szabo G., Magyar Z., Reffy A. The role of free fatty acids in pulmonary fat embolism. Injury. 1977; 8(4): 278-283.
5. Crocker G., Jones J. Effects of oleic acid-induced lung injury on oxygen transport and aerobic capacity. Respiratory physiology and neurobiology. 2014; 196(1): 43-49.
6. Shi S., Gao Y., et al. Elevated free fatty acid level is a risk factor for early postoperative hypoxemia after on-pump coronary artery bypass grafting: association with endothelial activation. J. Cardiothorac. Surg. 2015; 10: 122.
7. Kwiatt M.E., Seamon M.J. Fat embolism syndrome. Int. J. Crit. Illn. Inj. Sci. 2013; 3: 64-68.
8. Борисов М.Б., Гаврилин С.В. Синдром жировой эмболии при тяжелых сочетанных травмах. Вестник хирургии имени И.И. Грекова. 2006; 165(5): 68-71. [Borisov M.B., Gavrilin S.V. The fat embolism syndrome in severe combined traumas. Vestnik khirurgii imeni I.I. Grekova. 2006; 165(5): 68-71. (In Russ)]
9. Vincent J.L., Moreno R., Takala J., et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dys-function/failure. On behalf of the working group on sepsis-related problems of the European society of intensive care medicine. Intensive Care Med. 1996; 22: 707-710.
10. Antonelli M., Moreno R., Vincent J.L., et al. Application of SOFA score to trauma patients. Sequential Organ Failure Assessment. Intensive Care Med. 1999; 25: 389-394.
11. Teasdale G., Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet. 1974; 2(7872): 81-84.
12. Герасимов Л.В., Карпун Н.А., Пирожкова О.С. Избранные вопросы патогенеза и интенсивного лечения тяжелой сочетанной травмы. Общая реаниматология. 2012; 8(4): 111-117. [Gerasimov L.V., Karpun N.A., Pirozhkova O.S. Selected issues of the pathogenesis and intensive treatment of severe concomitant injury. Obshchaya reanimatologiya. 2012; 8(4): 111-117. (In Russ)].
13. Ehinger J.R., Piel S., Ford R., et al. Cell-permeable succinate prodrugs bypass mitochondrial complex I deficiency. Nat. Commun. 2016; 7: 12317.
14. Leite L.N., Gonzaga N.A., Simplicio J.A., et al. Pharmacological characterization of the mechanisms underlying the vascular effects of succinate. Eur. J. Pharmacol. 2016; 789: 334-343.
15. Adeva-Andany M.M., Calvo-Castro I., Fernandez-Fernandez C., et al. Significance of L-carnitine for human health. IUBMB Life. 2017; 69: 578-594.
16. Weimann A., Felbinger T.W. Gastrointestinal dysmotility in the critically ill: A role for nutrition. Curr. Opin. Clin. Nutr. Metab. Care. 2016.
17. Endo K., Tsuji A., Kondo S., et al. Carnitine is associated with fatigue following chemoradiotherapy for head and neck cancer. Acta Oto-Laryngol. 2015; 135: 846-852.
18. Famularo G., De Simone C., Trinchieri V., Mosca L. Carnitines and its congeners: a metabolic pathway to the regulation of immune response and inflammation. Ann. N. Y. Acad. Sci. 2004; 1033: 132-138.
19. Flanagan J.L. et al. Role of carnitine in disease. Nutrition & Metabolism. 2010; 7: 30.
20. Jeevanandam M., Young D.H., Ramias L., Schiller W.R. Effect of major trauma on plasma free amino acid concentrations in geriatric patients. Am. J. Clin. Nutr. 1990; 51: 1040-1045.
21. Яковлев А.Ю., Певнев А.А., Никольский В.О. и др. Метаболическая профилактика жировой эмболии. Анестезиология и реаниматология. 2016; 61(4): 280-283. [Yakovlev A. Yu., Pevnev А.А., Nikol’skiy V.O., et al. Metabolic prevention of fat embolism. Anesteziologiya i reanimatologiya. 2016; 61(4): 280-283. (In Russ)]
Комментарии
ПРАКТИКА ПЕДИАТРА
