Хемореактомный анализ молекул тиамина дисульфида, тиамина гидрохлорида и бенфотиамина
СтатьиОпубликовано в журнале:
« Неврология, нейропсихиатрия, психосоматика. » 2017; 9(2):50-57.
Громова О.А.1,2, Торшин И.Ю.2,3, Стаховская Л.В.4, Федотова Л.Э.1,2
1ФГБОУВО «Ивановская государственная медицинская академия» Минздрава России, Иваново, Россия;
2Российский сотрудничающий центр Института микроэлементов ЮНЕСКО при ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия;
3ФГАОУВО «Московский физико-технический институт (государственный университет)», Долгопрудный, Россия;
4ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
1153000, Иваново, Шереметевский пр., 8; 2,4117997, Москва, ул. Островитянова, 1; 3141700, Московская область,Долгопрудный, Институтский пер., 9
Цель исследования - анализ взаимодействий, которые могли бы указать на потенциальные фармакологические свойства молекул тиамина, тиамина дисульфида и др.
Материал и методы. Проведено моделирование свойств тиамина дисульфида (бистиамин) в сравнении с контрольными молекулами - тиамина гидрохлоридом и бенфотиамином. Исследование выполнено с использованием хемореактомного моделирования - новейшего направления постгеномной фармакологии.
Результаты и обсуждение. Хемореактомный анализ показал, что тиамина дисульфид может ингибировать молекулярные рецепторы, вовлеченные в регуляцию артериального давления: адренорецепторы, рецепторы вазопрессина, ангиотензина. Тиамина дисульфид в большей степени, чем бенфотиамин, может ингибировать обратный захват серотонина, повышать уровень серотонина, ингибировать рецептор бензодиазепина и обратный захват дофамина, усиливать высвобождение ацетилхолина в нейронах. Эти молекулярные эффекты соответствуют седативному и противосудорожному профилю действия тиамина дисульфида. Моделирование указало на существование у тиамина дисульфида нейропротекторного, противовоспалительного, нормолипидемического и противоопухолевого действия.
Заключение. Результаты моделирования подтверждаются имеющимися данными клинических и экспериментальных исследований и указывают на практически не исследованные молекулярные механизмы действия тиамина дисульфида, бенфотиамина и тиамина гидрохлорида.
Ключевые слова: тиамина дисульфид; тиамина гидрохлорид; бенфотиамин; хемоинформатика; биоинформатика; системная фармакология.
Для ссылки: Громова ОА, Торшин ИЮ, Стаховская ЛВ, Федотова ЛЭ. Хемореактомный анализ молекул тиамина дисульфида, тиамина гидрохлорида и бенфотиамина. Неврология, нейропсихиатрия, психосоматика. 2017;9(2):50-57.
Chemoreactomic analysis of thiamine disulfide, thiamine hydrochloride, and benfotiamine molecules
Gromova O.A.1,2, Torshin I.Yu.1,3, Stakhovskaya L.V.4, Fedotova L.E.1,2
1Ivanovo State Medical Academy, Ministry of Health of Russia, Ivanovo, Russia;
2Russian Satellite Center of Trace Element Institute for UNESCO, N.I. Pirogov Russian National Medical Research University, Ministry of Health of Russia, Moscow, Russia;
3Moscow Institute of Physics and Technology (State University), Dolgoprudnyi, Moscow Region, Russia;
4N.I. Pirogov Russian National Medical Research University, Ministry of Health of Russia, Moscow, Russia
18, Sheremetevsky Passage., Ivanovo 153000; 2,41, Ostrovityanov St., Moscow 117997; 39, Institutskiy Lane, Dolgoprudnyi, Moscow Region 141700
Objective: to analyze the interactions that could indicate the potential pharmacological properties of the molecules of thiamin, thiamine disulfide, and others.
Material and methods. The investigators simulated the properties of thiamine disulfide (bistiamin) versus those of the reference molecules of thiamin hydrochloride and benfotiamine. The study was performed using chemoreactomic simulation that is the newest area in post-genome pharmacology.
Results and discussion. Chemoreactomic analysis has shown that thiamine disulfide can inhibit the molecular receptors involved in blood pressure regulation: adrenoceptors, vasopressin receptor, and angiotensin receptor. Thiamine disulfide can inhibit the reuptake of serotonin, increase its levels, inhibit benzodiazepine receptor and dopamine reuptake, and enhance neuronal acetylcholine release to a large extent than benfotiamine. These molecular effects are consistent with the sedative and anticonvulsant action profile of thiamine disulfide. Simulation has indicated that thiamine disulfide has neuroprotective, anti-inflammatory, normolipidemic, and antitumor activities.
Conclusion. The simulation results are confirmed by the available clinical and experimental findings and indicate the virtually unstudied molecular mechanisms of action of thiamine disulfide, benfotiamine, and thiamin hydrochloride.
Keywords: thiamine disulfide; thiamine hydrochloride; benfotiamine; chemoinformatics, bioinformatics, systems pharmacology.
For reference: Gromova OA, Torshin IYu, Stakhovskaya LV, Fedotova LE. Chemoreactomic analysis of thiamine disulfide, thiamine hydrochloride, and benfotiamine molecules. Nevrologiya, neiropsikhiatriya, psikhosomatika = Neurology, neuropsychiatry, psychosomatics. 2017;9(2):50-57.
DOI: dx.doi.org/10.14412/2074-2711-2017-2-50-57
Витамин B1 (тиамин и его производные) широко используется в неврологии. Первый опыт клинического применения витамина B1 - терапия тяжелых авитаминозов Bi (синдром Корсакова, болезнь бери-бери и др.), сопровождающихся потерей памяти и периферической полиневропатией. Было установлено, что длительная недостаточная обеспеченность витамином B1 приводит не только к снижению памяти на ближайшие события, но и к бессоннице, офтальмоплегии, беспокойству, судорогам, головной боли. Стало известно, что специфическая неврологическая симптоматика у пациентов с алкоголизмом во многом обусловлена именно дефицитом витамина B1 [1].
В пище витамин B1 представлен преимущественно в виде тиамина и его фосфорилированных форм - тиамина трифосфата и тиамина пирофосфата. Последний является важным кофактором многих белков. Основным механизмом биологического действия витамина B1 является участие тиамина пирофосфата как кофактора в ферментах, ответственных за метаболизм аминокислот и синтез АТФ.
Проведенный нами ранее анализ показал, что взаимодействие тиамина (в виде кофактора тиамина пирофосфата) со специфическими белками человека характеризуется четырьмя основными направлениями: энергетический метаболизм клетки и синтез АТФ (митохондрия, митохондриальная α-кетоглутарат дегидрогеназа, цикл Кребса, пируватдегидрогеназа, оксоглутарат дегидрогеназа, связывание иона магния); метаболизм углеводов (глюкозы, транскетолазы, гликолиз), жиров (α-окисление жирных кислот), аминокислот (катаболизм аминокислот с разветвленной цепью); кроветворение (транспортер фолатов, дифференцировка клеток при гемопоэзе); нейробиологические роли (активация синтеза миелиновой оболочки, активация сигнального пути рецептора аденозина, метаболизм аденозина, развитие пирамидальных нейронов, таламуса, гиппокампа, стриатума, коры мозжечка) [2].
Для восполнения потребности в витамине B1 используются собственно тиамин и такие его синтезированные производные, как тиамина гидрохлорид, пиритиамин, ацетилтиамин, ацефуртиамин, беклотиамин, фурсултиамин, сульбутиамин, бенфотиамин, винтиамол, тиамина дисульфид и др. Данные формы витамина Bi отличаются как по биодоступности и устойчивости, так и по накоплению в различных тканях, жидкостях организма, проникновению через гематоэнцефалический барьер, скорости преобразования в коферментную форму. Такие формы тиамина, как тиамина гидрохлорид, тиамина дисульфид, пиритиамин, при пероральном применении интенсивнее накапливаются в тканях мозга в отличие от бенфотиамина [3]. Бенфотиамин, наоборот, более интенсивно накапливается в крови и печени [4].
B какой бы форме витамин B1 не поступал в организм, биологическое действие осуществляется, в конечном счете, именно молекулой тиамина и его фосфат-производных (прежде всего тиамина пирофосфата). Однако следует отметить, что взаимодействие тиамина пирофосфата в качестве кофактора с белками является далеко не единственным способом реализации нейробиологических эффектов тиамина и его производных. Молекулы тиамина дисульфида, тиамина гидрохлорида и бенфотиамина также могут взаимодействовать с другими белками человека, которые не нуждаются в тиамин-пирофосфатном кофакторе.
Цель исследования - анализ взаимодействий, которые могли бы указать на потенциальные фармакологические свойства молекул тиамина, тиамина дисульфида и др.
Материал и методы. Представлены результаты моделирования свойств тиамина дисульфида (бистиамин) в сравнении с контрольными молекулами - тиамина гидрохлоридом и бенфотиамином. Исследование проводилось с использованием новейшего направления постгеномной фармакологии - хемореактомного моделирования. B рамках постгеномной парадигмы молекула любого лекарственного средства «мимикрирует» под определенные метаболиты (вследствие наличия того или иного сходства химической структуры) и, связываясь с теми или иными белками протеома, оказывает соответствующее данному препарату действие (как позитивное, так и негативное) [5]. Совокупность имеющихся данных о взаимодействии с белками протеома позволяет сделать обоснованные выводы о потенциальных эффектах молекул тиамина дисульфида, тиамина гидрохлорида и бенфотиамина.
Анализ фармакологических «возможностей» тиамина дисульфида и молекул сравнения проведен на основе хемоинформационного подхода [6-9], т. е. сравнения химической структуры молекул со структурами миллионов других молекул, свойства которых известны [10].
Результаты и обсуждение. С помощью хемоинформационного анализа были проведены сравнения химической структуры тиамина дисульфида с молекулами в базе данных метаболома человека (Human Metabolome Database, HMDB) и с молекулами в базах данных лекарственных средств. B качестве модели метаболома человека использовались более 40 000 соединений, приведенных в HMDB [11].
Анализ схожих с тиамина дисульфидом молекул показал, что за исключением тиамина и простых производных тиамина (тиамина фосфат, тиамина пирофосфат, тиамина нитрат и др.) все остальные известные молекулы метаболома человека находились на весьма значительном «химическом расстоянии» (dχ) от молекулы тиамина дисульфида (>0,5) и от молекулы бенфотиамина (>0,6). Таким образом, с точки зрения структуры молекул в метаболоме человека тиамина дисульфид, тиамина гидрохлорид и бенфотиамин являются «уникальными» молекулами.
Результаты хемореактомного моделирования свойств молекулы тиамина дисульфида и бенфотиамина
Хемореактомное моделирование показало, что тиамина дисульфид может взаимодействовать с рядом молекулярных рецепторов, вовлеченных в регуляцию артериального давления (АД): адренорецепторами, рецепторами вазопрессина, ангиотензина (табл. 1). Константа ингибирования (Ki), например, рецепторов вазопрессина Vu человека составила 96 нМ для тиамина дисульфида и 885 нМ для бенфотиамина, что соответствует более высокому (в 9 раз, или 885:96) сродству тиамина дисульфида к данной разновидности рецепторов по сравнению с бенфотиамином. Результаты моделирования связывания тиамина дисульфида указанными рецепторами подтверждаются результатами моделирования его экспериментальных эффектов: ингибирование накопления норадреналина в срезах мозга мышей, снижение АД у крыс (на 1,9 мм рт. ст.) и кошек (на 13 мм рт. ст.).
Данные клинических и экспериментальных исследований показывают, что дефицит тиамина стимулирует развитие гипертензии легочной артерии [12]. В частности, исследование 12 пациентов с глюкозотолерантностью показало, что прием гипердоз тиамина (300 мг/сут, 6 нед) сопровождался достоверным снижением диастолического АД (с 71,4±7,4 до 67,9±5,8 мм рт. ст.; p=0,005) и тенденцией к снижению систолического АД (с 120,7±15,3 до 116,5±11,0; p=0,06) [13].
Таблица 1. Эффекты тиамина дисульфида в отношении различных типов рецепторов нейротрансмиттеров (по данным хемореактомного моделирования)
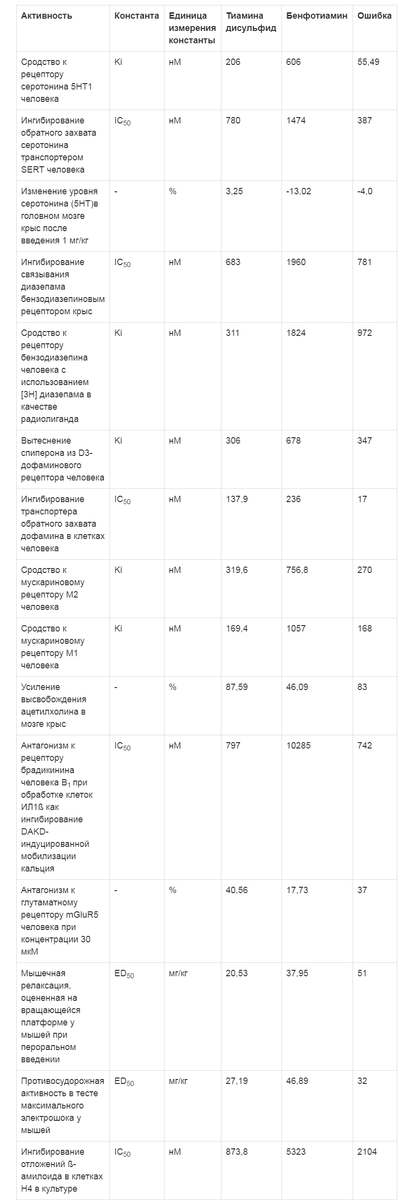
Хемореактомное моделирование эффектов взаимодействия тиамина дисульфида с различными рецепторами нейротрансмиттеров показало, что по сравнению с бенфотиамином он в 2 раза активнее может ингибировать обратный захват серотонина, на 3,25% интенсивнее повышать уровень серотонина, в 6 раз более выраженно подавлять выработку рецептора бензодиазепина (Ki - 311 нМ для тиамина и 1824 нМ для бенфотиамина), ингибировать обратный захват дофамина, синтез рецепторов брадикинина и глутамата, усиливать высвобождение ацетилхолина (см. табл. 1). Все эти эффекты соответствуют седативному и противосудорожному профилю действия тиамина дисульфида и подтверждены в экспериментах (тест на вращающейся платформе, противосудорожная активность в тесте с электрошоком).Примечание. ИЛ - интерлейкин; IC50 - концентрация полумаксимального ингибирования (показатель эффективности лиганда при ингибирующем биохимическом или биологическом взаимодействии); ED50 - концентрация, вызывающая полумаксимальный эффект.
По данным экспериментальных исследований, дефицит тиамина в организме ассоциирован с повышением судорожной готовности ЦНС [14]. Данный эффект связан, в частности, с поражением тканей мозга, возникающим при экспериментальном воспроизведении дефицита тиамина [15], что приводит не только к повышению судорожной готовности ЦНС, но и к тяжелым нарушениям обучения [16], в частности у детей [17].
Представленные в табл. 1 результаты хемореактомного моделирования позволяют предположить, что противо-судорожный эффект тиамина дисульфида связан, в частности, с его нейропротекторным действием (ингибированием отложения ß-амилоида в клетках; IC50 - 874 нМ для тиамина дисульфида и 5323 нМ для бенфотиамина, т. е. тиамина дисульфид в 6,1 раза активнее, или в соотношении 5323/874, ингибирует отложение амилоида). Нейропротекторное действие тиамина дисульфида обусловлено, во-первых, усилением высвобождения ацетилхолина в мозге (на 87,6%) и, во-вторых, антагонизмом к глутаматному рецептору mGluR5 (подавление на 40,6%).
Известно, что избыточная экспрессия и, следовательно, активность глутаматного рецептора mGluR5 ассоциирована с усилением отложения ß-амилоида в экспериментальной модели болезни Альцгеймера (БА) [18]. При дефиците тиамина происходит повышение уровня внеклеточного глутамата [19, 20], что усиливает повреждение нервной ткани у пациентов. При дефиците тиамина также снижается выработка ацетилхолина в мозге [21], что ускоряет нейродегенеративные изменения при деменциях.
Результаты хемореактомного моделирования указали на возможный противовоспалительный эффект и тиамина дисульфида, и бенфотиамина. Противовоспалительная активность тиамина дисульфида связана, по-видимому, со снижением синтеза/секреции белка острой фазы фактора некроза опухоли р (ФНОα) и, соответственно, со снижением экспрессии провоспалительного фактора транскрипции NF-kappaB, опосредующего эффекты ФНОα. При моделировании экспериментальных эффектов тиамин дисульфид ингибировал стимулированную липополисахаридом экспрессию ФНОα на 10,9%, в то время как бенфотиамин - не более чем на 1,3%. IC50 для ингибирования продукции ФНОα в Th1-лимфоцитах человека была почти в 3 раза меньше для тиамина дисульфида (1305 нМ), чем для бенфотиамина (3676 нМ), что определяет более выраженный (в 2,8 раза) провоспалительный эффект тиамина дисульфида по сравнению с бенфотиамином.
Данные экспериментальных исследований подтверждают провоспалительное влияние дефицита витамина В1 и, наоборот, существование противовоспалительных эффектов тиамина. В модели сепсиса, воспроизведенного посредством повреждения слепой кишки, уровни ФНОα и белка-аттрактанта моноцитов (MCP-1) в перитонеальной жидкости были достоверно выше при дефиците тиамина [22]. Исследования на моделях отека и гранулемы позволили установить дозозависимый противовоспалительный и обезболивающий эффект тиамина в дозах 50, 100 и 125 мг/кг [23].
Таблица 2. Эффекты тиамина дисульфида в отношении показателей липидного профиля крови (по данным хемореактомного моделирования)
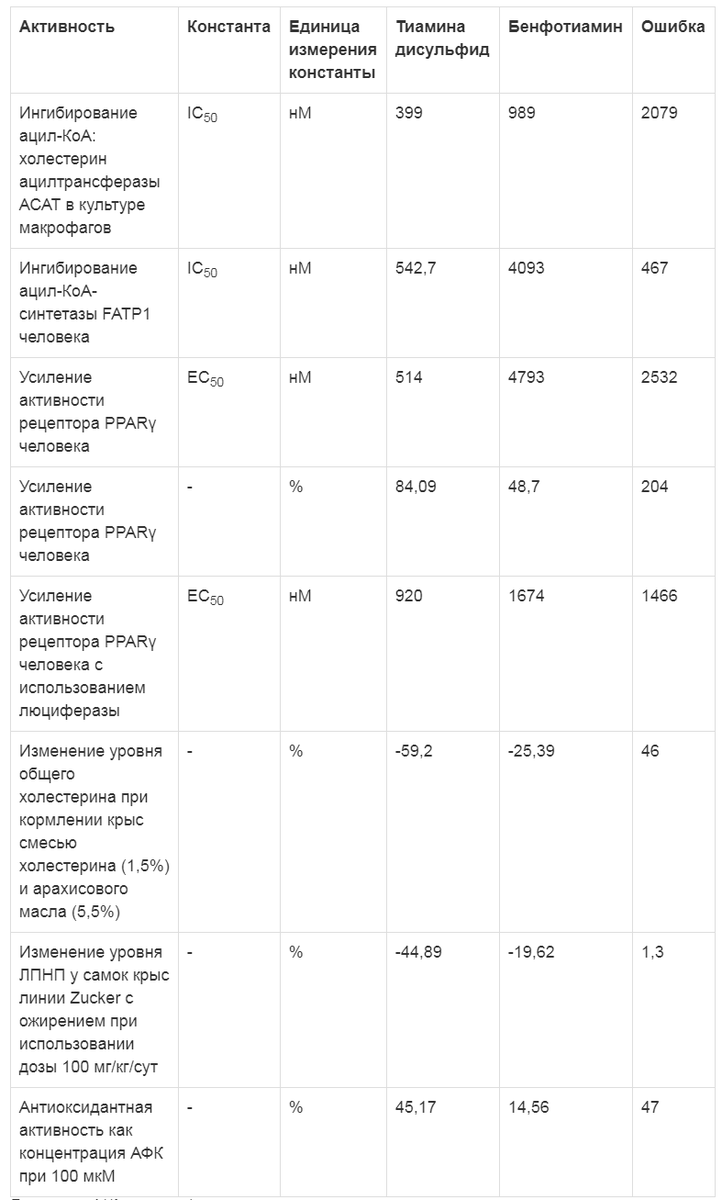
Результаты хемореактомного моделирования указывают на положительное влияние тиамина дисульфида на показатели липидного профиля крови (табл. 2), что связано, во-первых, с ингибированием тиамина дисульфидом ферментов липидного метаболизма (ацил-КоА: холестерин ацилтрансфераза АСАТ, ацил-КоА-синтетаза FATP1) и, во-вторых, с активацией тиамина дисульфидом рецептора PPARy, играющего важную роль в метаболизме глюкозы и липидов. Показано также, что тиамина дисульфид может снижать уровень общего холестерина и липопротеинов низкой плотности (ЛПНП).Примечание. АФК - активные формы кислорода.
Экспериментальные данные показывают, что высокие дозы тиамина противодействуют дислипидемии, возникающей в стрептозотоциновой модели сахарного диабета (СД) [24]. Дотация тиамина в экспериментах на модели СД способствует достоверному снижению уровня триглицеридов, холестерина и холестерина липопротеинов высокой плотности [25]. Клиническое исследование с участием пациентов с СД 2-го типа (n=60) показало, что прием тиамина в дозе 100 мг/сут в течение 6 мес приводил к достоверному снижению уровня общего холестерина (p=0,03) [26].
Результаты хемореактомного моделирования выявили противоопухолевые эффекты тиамина дисульфида (табл. 3). Установлено, что тиамина дисульфид может намного эффективнее, чем бенфотиамин, ингибировать рост клеток PC3 рака простаты (на 13,92% против 5,39%), клеток KG1 острого миелолейкоза человека (на 21,37% против 7,56%), аденокарциномы поджелудочной железы 03Т/С (на 21,75% против 9,33%).
Результаты экспериментальных исследований позволяют предположить, что тиамина дисульфид, тиамина гидрохлорид и бенфотиамин могут характеризоваться противоопухолевыми эффектами. Пероральный прием тиамина в эксперименте тормозил развитие гепатоцеллюлярной карциномы [27]. Показана противоопухолевая активность бенфотиамина на клетках лейкемии [28]. Однако имеющиеся экспериментальные данные весьма фрагментарны и разрозненны, что не позволяет сделать обоснованные выводы о сравнительной противоопухолевой эффективности тиамина гидрохлорида, тиамина дисульфида и бенфотиамина. Тиамин может активировать цитохром Р450 3А7 и 7А1, что важно для метаболизма холестерина, стероидов и лекарств. Активация тиамина дисульфидом глутамиламинопептидазы способствует ускоренной деградирации вазоконстрикторного ангиотензина II. Активация мускаринового рецептора ацетилхолина М1 соответствует ноотропному эффекту тиамина дисульфида. Ингибирование тиамина дисульфидом белка SOCS3 будет улучшать внутриклеточную передачу сигнала от рецепторов эритропоэтина, инсулина, лептина. Ингибирование бенфотиамином лейкотриенового рецептора LTB4R может проявляться противовоспалительным эффектом.
Таблица 3. Противоопухолевые эффекты тиамина дисульфида (по данным хемореактомного моделирования)
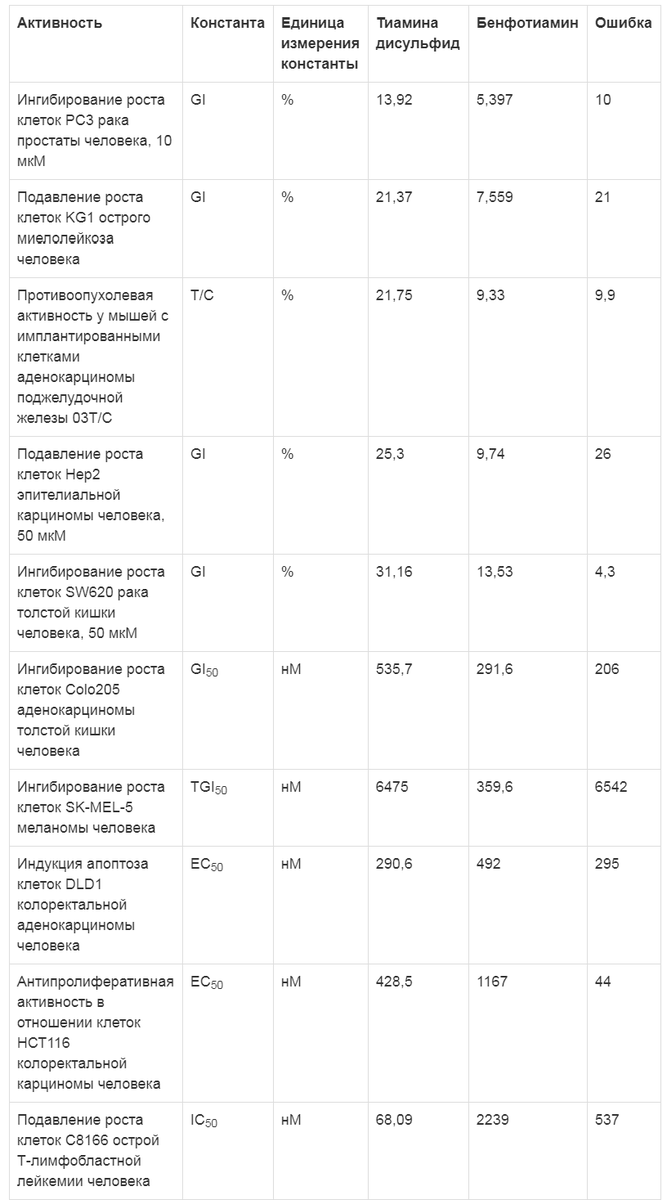
Было проведено сравнение эффектов тиамина дисульфида и тиамина гидрохлорида. Вследствие большей структурной схожести этих двух молекул отличий в прогнозируемых свойствах оказалось гораздо меньше, чем при сравнении тиамина дисульфида и бенфотиамина. Тем не менее установлен ряд отличий в нейробиологических эффектах, противовоспалительном, антиагрегантном действии и фармакокинетических параметрах тиамина дисульфида и тиамина гидрохлорида (табл. 4).Примечание. GI - ингибирование роста опухолевых клеток (в %); GI50 - концентрация 50% ингибирования роста опухолевых клеток.
Таблица 4. Сравнение эффектов тиамина дисульфида и тиамина гидрохлорида (по результатам хемореактомного моделирования)
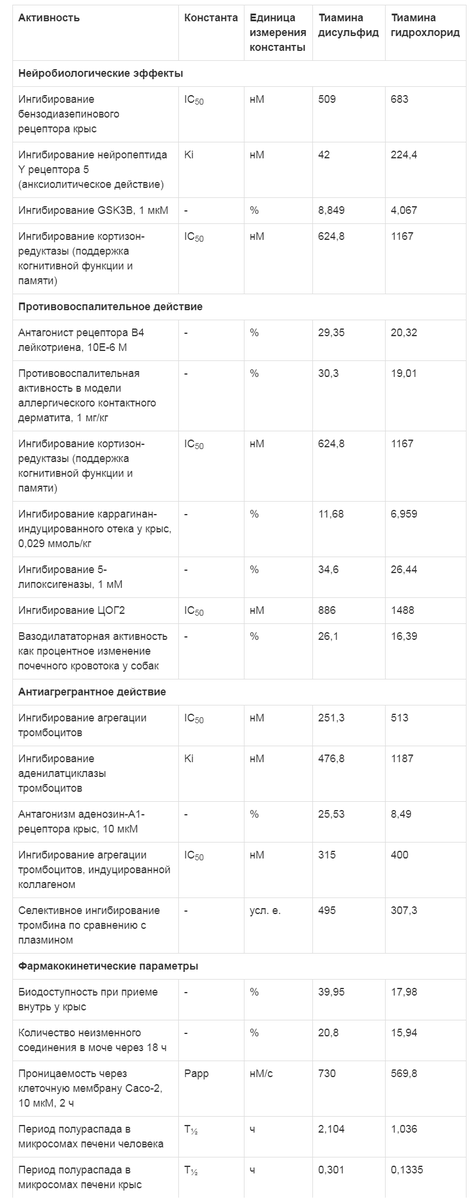
Моделирование нейробиологических эффектов показало, что по сравнению с тиамина гидрохлоридом тиамина дисульфид может более выраженно ингибировать бензодиазепиновые рецепторы (IC50 - 509 нМ против 683 нМ) и рецептор-5 нейропептида Y (Ki - 42 нМ против 224,4 нМ), что будет проявляться как более выраженное анксиолитическое действие тиамина дисульфида.Примечание. ЦОГ2 - циклооксигеназа 2.
Противовоспалительное действие было спрогнозировано и для тиамина дисульфида, и для тиамина гидрохлорида. Обе молекулы могут ингибировать ЦОГ2 (IC50 для тиамина дисульфида - 886 нМ, для тиамина гидрохлорида - 1488 нМ) и 5-липоксигеназу, а также являться антагонистами рецептора В4 лейкотриена.
Антиагрегрантное действие было несколько более выраженным (в 1,9 раза) у тиамина дисульфида (IC50 - 251 нМ) по сравнению с тиамина гидрохлоридом (513 нМ) за счет более активного подавления аденилатциклазы тромбоцитов и антагонизма к аденозиновому рецептору (25,5% против 8,49%).
Сравнительное моделирование фармакокинетических параметров указало на несколько более высокую биодоступность тиамина дисульфида по сравнению с тиамина гидрохлоридом у крыс (39,95% против 17,98%), более высокую проницаемость через мембраны (730 нМ/с против 569,8 нМ/с) и более медленный распад в микросомах печени (T½ - 2,1 ч против 1,04 ч).
Заключение. Для фармакотерапии неврологических заболеваний используются разные химические производные тиамина. Например, бенфотиамин («жирорастворимая» форма витамина В1) не поступает в ЦНС и действует преимущественно на периферическом уровне. Поэтому препараты на основе бенфотиамина используются для лечения полиневропатии (преимущественно диабетического генеза). Тиамина дисульфид и тиамина гидрохлорид, напротив, проходят через гематоэнцефалический барьер, концентрируются в ЦНС и вследствие этого эффективны не только при полиневропатии, но и при восстановлении функции памяти, в том числе при синдроме Корсакова.
Результаты хеморектомного анализа тиамина дисульфида, тиамина гидрохлорида и бенфотиамина во многом дополнили представления об этих действующих веществах. Тиамина дисульфид (входит в состав препарата Нейробион®) может ингибировать молекулярные рецепторы, вовлеченные в регуляцию АД: адренорецепторы, рецепторы вазопрессина, ангиотензина. На уровне ЦНС тиамина дисульфид может ингибировать обратный захват серотонина, повышать уровень серотонина и ингибировать рецептор бензодиазепина (антидепрессивный эффект), а также обратный захват дофамина (что важно для терапии алкогольной зависимости) и усиливать высвобождение ацетилхолина (поддержка памяти и нейропротекция). В сравнении с тиамина гидрохлоридом у тиамина дисульфида ярче проявляются антиагрегрантное действие, что важно для пациентов с тромбофилией.
Установленные в результате хемореактомного анализа различия между бенфотиамином, тиамина гидрохлоридом и тиамина дисульфидом позволяют определить перспективные направления клинического использования этих соединений в неврологии.
СПИСОК ЛИТЕРАТУРЫ
- Ребров ВГ, Громова ОА. Витамины, макро- и микроэлементы. Москва: Геотар-Медиа; 2008. 986 с. [Rebrov VG, Gromova OA. Vitaminy, makro- i mikroelementy [Vitamins, macro- and micronutrients]. Moscow: Geotar-Media; 2008. 986 p.]
- Громова ОА, Торшин ИЮ, Гусев ЕИ. Синергидные нейропротекторные эффекты тиамина, пиридоксина и цианкобаламина в рамках протеома человека. Фармакокинетика и фармакодинамика. 2016;(4):37-49. [Gromova OA, Torshin IYu, Gusev EI. Synergistic neuroprotective effects of thiamine, pyridoxine and cyanocobalamin in the framework of the human proteome. Farmakokinetika i farmakodinamika. 2016;(4):37-49. (In Russ.)].
- Greenwood J, Pratt OE. Comparison of the effects of some thiamine analogues upon thiamine transport across the blood-brain barrier of the rat. J Physiol. 1985 Dec;369:79-91.
- Volvert ML, Seyen S, Piette M, et al. Benfotiamine, a synthetic S-acyl thiamine derivative, has different mechanisms of action and a different pharmacological profile than lipid-soluble thiamine disulfide derivatives. BMC Pharmacol. 2008 Jun 12;8:10. doi: 10.1186/1471-2210-8-10.
- Torshin IYu. Bioinformatics in the post-genomic era: physiology and medicine. NovaBiomedicalBooks: New-York; 2007.
- Журавгев ЮИ, Рудаков КВ, Торшин ИЮ. Алгебраические критерии локальной разрешимости и регулярности как инструмент исследования морфологии аминокислотных последовательностей. Труды МФТИ. 2011;3(4):67-76. [Zhuravlev YuI, Rudakov KV, Torshin IYu. Algebraic criteria for local solvability and regularity as a tool to investigate the morphology of amino acid sequences. Trudy MFTI. 2011;3(4):67-76. (In Russ.)].
- Рудаков КВ, Торшин ИЮ. Об отборе информативных значений признаков на базе критериев разрешимости в задаче распознавания вторичной структуры белка. ДАН. 2011;441(1):1-5. [Rudakov KV, Torshin IYu. About the selection of informative characteristic values on the basis of criteria of solvability in the problem of protein secondary structure recognition. DAN. 2011;441(1):1-5. (In Russ.)].
- Журавлев ЮИ. Об алгебраическом подходе к решению задач распознавания или классификации. Проблемы кибернетики. 1978;(33):5-68. [Zhuravlev YuI. About algebraic approach to solving the problems of recognition or classification. Problemy kibernetiki. 1978; (33):5-68. (In Russ.)].
- Торшин ИЮ, Громова ОА. Экспертный анализ данных в молекулярной фармакологии. Москва: Издательство МЦНМО; 2012. 768 с. [Torshin IYu, Gromova OA. Ekspertnyi analiz dannykh v molekulyarnoi farmakologii [Expert data analysis in molecular pharmacology]. Moscow: Izdatel'stvo MTsNMO; 2012. 768 p.]
- Bolton E, Wang Y, Thiessen PA, Bryant SH. PubChem: Integrated Platform of Small Molecules and Biological Activities. In: Annual Reports in Computational Chemistry, Volume 4. Washington: American Chemical Society; 2008.
- Wishart DS, Tzur D, Knox C, et al. HMDB: the Human Metabolome Database. Nucleic Acids Res. 2007 Jan;35(Database issue):D521-6.
- Park JH, Lee JH, Jeong JO, et al. Thiamine deficiency as a rare cause of reversible severe pulmonary hypertension. Int J Cardiol. 2007; 121(1):e1-3 Epub 2007 Mar.
- Alaei-Shahmiri F, Soares MJ, Zhao Y, Sherriff J. The impact of thiamine supplementation on blood pressure, serum lipids and C-reactive protein in individuals with hyper-glycemia: a randomised, double-blind crossover trial. Diabetes Metab Syndr. 2015 Oct-Dec; 9(4):213-7. doi: 10.1016/j.dsx.2015.04.014. Epub 2015 Apr 29.
- Cheong JH, Seo DO, Ryu JR, et al. Lead induced thiamine deficiency in the brain decreased the threshold of electroshock seizure in rat. Toxicology. 1999 Apr 15;133(2-3):105-13.
- Vortmeyer AO, Colmant HJ. Differentiation between brain lesions in experimental thiamine deficiency. Virchows Arch A Pathol Anat Histopathol. 1988;414(1):61-7.
- Irle E, Markowitsch HJ. Thiamine deficiency in the cat leads to severe learning deficits and to widespread neuroanatomical damage. Exp Brain Res. 1982;48(2):199-208.
- Fattal-Valevski A, Bloch-Mimouni A, Kivity S, et al. Epilepsy in children with infantile thiamine deficiency. Neurology. 2009 Sep 15;73(11): 828-33. doi: 10.1212/WNL.0b013e3181b121f5. Epub 2009 Jul 1.
- Shrivastava AN, Kowalewski JM, Renner M, et al. Beta-amyloid and ATP-induced diffusional trapping of astrocyte and neuronal metabotropic glutamate type-5 receptors. Glia. 2013 Oct;61(10):1673-86. doi: 10.1002/glia. 22548. Epub 2013 Aug 6.
- Langlais PJ, Zhang SX. Extracellular glutamate is increased in thalamus during thiamine deficiency-induced lesions and is blocked by MK-801. J Neurochem. 1993 Dec;61(6):2175-82.
- Hamilton A, Zamponi GW, Ferguson SS. Glutamate receptors function as scaffolds for the regulation of beta-amyloid and cellular prion protein signaling complexes. Mol Brain. 2015 Mar 24;8:18. doi: 10.1186/s13041-015-0107-0.
- Cheney DL, Gubler CJ, Jaussi AW. Production of acetylcholine in rat brain following thiamine deprivation and treatment with thiamine antagonists. J Neurochem. 1969 Sep; 16(9):1283-91.
- de Andrade JA, Gayer CR, Nogueira NP, et al. The effect of thiamine deficiency on inflammation, oxidative stress and cellular migration in an experimental model of sepsis. J Inflamm (Lond). 2014 Apr 24;11:11. doi: 10.1186/1476-9255-11-11. eCollection 2014.
- Moallem SA, Hosseinzadeh H, Farahi S. A study of acute and chronic anti-nociceptive and anti-inflammatory effects of thiamine in mice. Iran Biomed J. 2008 Jul;12(3):173-8.
- Babaei-Jadidi R, Karachalias N, Kupich C, et al. High-dose thiamine therapy counters dyslipidaemia in streptozotocin-induced diabetic rats. Diabetologia. 2004 Dec;47(12):2235-46. Epub 2004 Dec 11.
- Naveed AK, Qamar T, Ahmad I, et al. Effect of thiamine on lipid profile in diabetic rats. J Coll Physicians Surg Pak. 2009 Mar;19(3): 165-8. doi: 03.2009/JCPSP.165168.
- Al-Attas O, Al-Daghri N, Alokail M, et al. Metabolic Benefits of Six-month Thiamine Supplementation in Patients With and Without Diabetes Mellitus Type 2. Clin Med Insights Endocrinol Diabetes. 2014 Jan 23;7:1-6. doi: 10.4137/CMED.S13573. eCollection 2014.
- Sheline CT. Thiamine supplementation attenuated hepatocellular carcinoma in the Atp7b mouse model of Wilson's disease. Anticancer Res. 2011 Oct;31(10):3395-9.
- Sugimori N, Espinoza JL, Trung LQ, et al. Paraptosis cell death induction by the thiamine analog benfotiamine in leukemia cells. PLoS One. 2015 Apr 7;10(4):e0120709. doi: 10.1371/ journal.pone.0120709. eCollection 2015.
Декларация о финансовых и других взаимоотношениях
Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать. Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи была одобрена всеми авторами.
