Острые респираторные инфекции со стенозируюшим ларинготрахеитом у детей: современные возможности этиотропной и противовоспалительной терапии
СтатьиФ. С. Харламова, о. В. Кладова, Т. П. Легкова, Л. И. Фельдфикс, В. Ф. Учайкин
ГОУ ВПО РГМУ РОСЗДРАВА, Морозовская детская клиническая больница, Москва
Целью настоящего исследования явилось изучение терапевтической эффективности и безопасности Биопарокса и Эреспала у 105 больных в возрасте от 2,5 мес. до 5 лет со среднетяжелыми формами ОРВИ с проявлениями стенозирующего ларинготрахеобронхита. Из них у 55 больных ОРВИ осложнилась бактериальной инфекцией: у 30 детей — фаринготонзиллитом, у 20 — острым средним отитом и у 5 — эпиглоттитом. 35 больных в качестве этиотропной терапии получали Биопарокс (основная группа) и 20 больных — системный антибиотик Ампициллин (группа сравнения). Все больные поступили в стационар в первые 1—2 дня от начала заболевания и получали общепринятую базисную терапию. Биопарокс назначался по 4 ингаляции через рот и по 4 ингаляции в каждый носовой ход 4 раза в день. Ампициллин назначали из расчета 100 мг/кг массы тела в 3 приема. Курс лечения продолжался, в среднем, 5 дней. Эреспал сироп получали 30 детей с ОРВИ и обструктивным ларинготрахеитом, со стенозом гортани 1—2 степени без признаков бактериального осложнения. Эреспал сироп назначался в сочетании со щелочными ингаляциями, в суточной дозе 4—6 мг/кг массы тела, разделенной на три приема. Средняя продолжительность лечения составила 7 дней. В группу контроля вошли 20 детей с аналогичным диагнозом, которые получали симптоматическую терапию. Биопарокс и Эреспал являются безопасными стартовыми противовоспалительными препаратами в селективной терапии стенозирующего ларинготрахеита на фоне ОРЗ смешанной вирусно-бактериальной этиологии. Важным является то, что применение этих препаратов позволяет значительно сократить количество симптоматических препаратов базисной терапии ОРВИ и стеноза гортани.
Ключевые слова: ОРЗ, стенозирующий ларинготрахеит, Биопарокс, Эреспал сироп, Ампициллин
При острых респираторных заболеваниях (ОРЗ), ассоциированных с вирусами гриппа, парагриппа, аденовирусами, PC-вирусами, корона-, рино-, реовирусами и др. возникает поражение респираторного тракта на всех уровнях с формированием симптомокомплексов ринита, фарингита, ларингита, трахеита, бронхита разной степени выраженности и пневмонии. Особенностью острых респираторных вирусных инфекций (ОРВИ) в детском возрасте является высокая степень вероятности присоединения к 3—5 дням болезни бактериальной инфекции с развитием гнойных осложнений. Особой проблемой для педиатрии являются часто и длительно болеющие дети, составляющие до 25% детского населения, более всего склонные к бактериальным осложнениям, среди которых гнойный ларинготрахеит, бронхит, острый средний отит, тонзиллофарингит, синусит обусловлены в основном пневмотропными бактериями, вегетирующими в дыхательных путях. У детей первого года жизни частота подобных осложнений ОРВИ достигает 80% [1]. Наиболее частыми бактериальными патогенами респираторного тракта являются Streptococcus pneumoniae, pyogenes; Haemophilus influezae; Moraxella catarrhalis; Staphylococcus aureus, haemolyticus идр.
К группам риска по развитию острых обструктивных заболеваний респираторного тракта — стенозирующего ларинготрахеита или ларинготрахеобронхита, относят детей с аллергическими заболеваниями: атопической аномалией конституции, пищевой и поствакцинальной аллергией, часто и длительно болеющих, сенсибилизированных предшествующими инфекциями и лекарственной терапией [1—4].
Известно, что подавляющее большинство ОРЗ, первично являясь по этиологии вирусными, не требуют назначения системной антибактериальной терапии, которая имеет строго определенный спектр показаний при собственно бактериальных инфекциях. В то же время высокая частота вероятных бактериальных осложнений ОРВИ у детей раннего возраста и у часто болеющих детей с транзиторной или вторичной иммунной недостаточностью требует от врача с целью их профилактики использовать в терапии антибиотики. В этом смысле широкое использование антибактериальных препаратов с целью профилактики присоединения микробной инфекции вполне понятно, тем более, что ранние признаки активации сапрофитирующей микробной флоры часто не имеют манифестного клинического проявления, и врачу хочется «подстраховаться», особенно у детей раннего возраста. С другой стороны, такая терапия нередко приводит к нежелательным последствиям — дисбиотическим нарушениям, аллергизации организма и прочим, а также влечет за собой проблему развития антибиотикорезистентности. Следовательно, с практической точки зрения решить вопрос «назначать или не назначать антибактериальный препарат?» при ОРВИ, в каждом конкретном случае весьма сложно, и этот вопрос может быть одним из самых трудных в проблеме респираторной патологии детского возраста. По нашему мнению, решить вопрос о назначении антибактериального средства при ОРЗ на основании совершенствования критериев диагностики бактериальных осложнений или введения временных ограничений для включения антибиотиков в программу лечения (например, после 3-го дня от начала ОРВИ), не представляется возможным. Поэтому на первый план выдвигается задача минимизации нежелательных последствий применения системных антибактериальных средств. Тактикой и стратегией антибактериальной терапии ОРЗ является выбор антибиотика с наибольшим терапевтическим и наименьшим токсическим потенциалом, а также уменьшение риска селекции и распространения резистентных штаммов бактерий [5, 6]. В этой связи особый интерес привлекают антибиотики для местного применения. При таком способе введения больше оснований рассчитывать на высокую эффективность, поскольку создается нужная концентрация антибактериальных средств непосредственно в зоне поражения и одновременно удается избежать системного их действия. На основании имеющихся по этому вопросу данных литературы, наиболее полно этим требованиям отвечает аэрозольный препарат Биопарокс, представляющий собой антибиотик фузафунжин для местного применения [7—9]. Доказано, что после ингаляционного применения Биопарокса, он не определяется в плазме крови, а остается на поверхности слизистой оболочки дыхательных путей. Биопарокс не вызывает прямой или перекрестной резистентности даже при многократном применении. Он сохраняет конкурентное равновесие между организмами орофарингеальной и кишечной флоры, и не вызывает резистентности у симбиотических бактерий [7].
Учитывая особенности патогенеза, в комплексную терапию обструктивного ларингита и/или бронхита входят муколитические, отхаркивающие, антигистаминные, седативные, бронхолитические и нередко гормональные препараты. Таким образом, лечение сводится, в основном, к симптоматической и синдромальной терапии, которая не всегда обеспечивает противовоспалительный и дренажный эффекты в респираторном тракте и часто не обеспечивает предотвращение бактериальных осложнений. Нередко в симптоматической терапии избыточное назначение вазоконстрикторов может приводить к развитию ятрогенных ринитов, а применение внутрь деконгексантов имеет много побочных эффектов. Назначение гормональных препаратов сопровождается побочными эффектами, которые приводят к снижению фагоцитарной и антибактериальной активности эффекторных клеток, ингибированию ответа Т-лимфоцитов на ИЛ-1 и формирование в них т-РНК для ИЛ-2 и γ-INF.
В 1998 году в России появилось новое противовоспалительное средство Эреспал (фенспирид), представленный французской Фармацевтической Группой Сервье. Этот препарат выпускается в виде 2-х лекарственных форм: сироп — 150 мл (в 5 мл содержится 10 мг фенспирида) и таблетки, содержащие 80 мг фенспирида. Эреспал (фенспирид) не являясь ни стероидным, ни нестероидным противовоспалительным средством, действует на все звенья воспалительного процесса [10, 11]. В последнее время появились данные об успешных клинических испытаниях этого препарата в педиатрии при острых и хронических заболеваниях верхних дыхательных путей [10, 11].
Целью настоящего исследования явилось изучение терапевтической эффективности и безопасности Биопарокса и Эреспала при ОРВИ со стенозирующим ларинготрахеитом, протекающих с бактериальными осложнениями.
Материалы и методы исследования
Под наблюдением находилось 105 больных со среднетяжелыми формами ОРВИ с клиническими проявлениями по типу стенозирующего ларинготрахеита или ларинготрахеобронхита, из них у 55 больных в возрасте от 2,5 мес до 5 лет ОРВИ осложнилась бактериальной инфекцией в виде фаринготонзиллита (у 30 детей), острого среднего отита (у 20) и эпиглоттита (у 5 детей). О развитии бактериальной инфекции свидетельствовало наличие серозно-гнойного отделяемого из носа с неприятным запахом, возникновение отита, явлений гранулезного фарингита с наложениями слизисто-гнойного секрета на задней стенке глотки и эпиглоттита с отечным и воспаленным надгортанником.
35 больных в качестве единственного средства этиотропной терапии получали Биопарокс (основная группа) и 20 больных — системный антибиотик Ампициллин (группа сравнения).
Все больные поступили в стационар в первые 1—2 дня от начала заболевания и получали общепринятую базисную терапию: щелочные ингаляции, муколитические, десенсибилизирующие препараты, сосудосуживающие капли в нос. Биопарокс назначался по 4 ингаляции через рот и по 4 ингаляции в каждый носовой ход 4 раза в день. Ампициллин назначали из расчета 100 мг/кг массы тела в 3 приема. Курс лечения продолжался до уменьшения или полного купирования катаральных симптомов и симптомов интоксикации — в среднем 5 дней.
С целью противовоспалительной терапии Эреспал сироп получали 30 детей с ОРВИ и обструктивным ларинготрахеитом, со стенозом гортани I—2 степени без признаков бактериального осложнения. Эреспал сироп назначался в сочетании со щелочными ингаляциями, в суточной дозе 4—6 мг/кг массы тела, разделенной на три приема. Средняя продолжительность лечения составила 7 дней.
В группу контроля, подобранную по случайному признаку, вошли 20 детей с аналогичным диагнозом, которые получали общепринятую терапию, включавшую щелочные ингаляции, антигистаминные препараты, микстуру от кашля и др.
Эффективность лечения оценивали на 3, 5 и 7 дни приема Эреспала, учитывая при этом характер изменения симптомов (кашля, насморка, стеноза гортани, гиперемии и отека слизистой оболочки ротоглотки, температурной реакции тела).
Для выявления возбудителя в развитии осложнения ОРВИ был исследован биоценоз ротоглотки. Определялся качественный состав и количественное содержание отдельных микроорганизмов на слизистой оболочке ротоглотки с учетом существующих норм, рассчитанных в КОЕ/тампон. В соответствии с методическими рекомендациями были приняты следующие нормативы: Staphylococcus aureus — 101—102; Streptococcus haemolyticus — 103—104; Enterococcus — 101—102; Escherichia coli — 101—102; Candida albicans — 101— 102; Bacillus — 102; Klebsiella — 101—102; Streptococcus — 103—104; Staphylococcus saprophyticus — 101; Candida spp. — 101.
Результаты и их обсуждение
В группе больных с бактериальными осложнениями ОРВИ наиболее часто обнаруживались стафилококки (42,6%) и стрептококки (16,7%), реже — другие патогены. По совокупности клинико-лабораторных данных можно было считать, что у 42,6% больных осложнение ОРЗ было обусловлено стафилококком, у 16,7% — стрептококком, у 7,4% — грибами, у 5,5% — клебсиеллой, у 32% — смешанной флорой.
После окончания лечения Биопароксом существенно уменьшилось общее количество выделяемых микроорганизмов (рис. 1). Как видно из рисунка, общее количество микроорганизмов после лечения Биопароксом снизилось в 1,6 раза, а при лечении Ампициллином — наоборот, увеличилось в 1,2 раза.
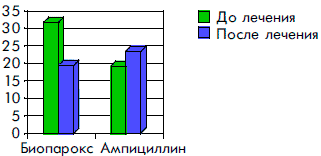
Рисунок 1. Общее количество микроорганизмов до и через 5 дней после лечения Биопароксом и Ампициллином
Позитивные изменения в биоценозе ротоглотки у больных, получавших Биопарокс, произошли за счет уменьшения частоты обнаружения стафилококков, стрептококков, кроме того, у них не обнаруживались М. catarrhalis, E. coli, не происходило роста грибковой флоры, тогда как у детей, получавших Ампициллин, положительные сдвиги в биоценозе ротоглотки были не столь существенными, и кроме того, у них значимо увеличилась частота обнаружения грибковой флоры и стрептококков (табл. 1). Как видно из представленных данных, у 36,4% больных, получавших Биопарокс, наблюдалась полная эрадикация выделенных микроорганизмов. В группе контроля эрадикации не произошло в эти же сроки наблюдения.
Таблица 1
Динамика показателей микрофлоры ротоглотки у больных ОРВИ с бактериальными осложнениями на фоне терапии Биопароксом и в группе контроля (число больных)
|
Микроорганизм |
Биопарокс |
Ампициллин | ||
| До лечения | Через 5 дней после лечения | До лечения | Через 5 дней после лечения | |
| Staph, aureus, sapr. | 14 | 9 | 9 | 5 |
| Enterococcus | 2 | 1 | 0 | 0 |
| E. coli | 3 | 3 | 5 | 7 |
| Candida albicans | 3 | 3 | 0 | 7 |
| Pseudomonus aeruginosa | 0 | 2 | 0 | 0 |
| Bacillus | 1 | 0 | 0 | 0 |
| Klebsiella | 0 | 1 | 3 | 4 |
| Streptococcus | 4 | 1 | 0 | 1 |
| Str. haemolyticus | 3 | 1 | 2 | 1 |
| Moraxella catarrhalis | 1 | 0 | 1 | 0 |
| Cand/daspp. | 1 | 0 | 0 | 0 |
| L(-) E. coli сла-боферментирующая | 1 | 0 | 1 | 0 |
| Всего | 33 | 21 | 21 | 25 |
| Показатель эрадикации | 36,4% | Эрадикации не произошло | ||
Таким образом, при лечении Биопароксом больных ОРВИ с проявлениями бактериальных осложнений, в отличие от применения системного антибиотика, в динамике заболевания дисбиотические изменения микрофлоры ротоглотки имели тенденцию к нормализации качественного и количественного состава, что значительно повлияло на продолжительность основных клинических симптомов заболевания и длительность пребывания больных в стационаре (табл. 2). Как видно из представленных данных, у больных основной группы продолжительность лихорадки сократилась в 1,8 раза, проявления интоксикационного синдрома (недомогание, снижение аппетита, слабость, снижение физической активности) — в 1,5 раза, явления ларингита — в 1,3 раза, ринита — в 2,3 раза, на фоне лечения Биопароксом продуктивный кашель с эффектом разжижения мокроты появлялся с 3 дня, а в группе контроля — после 4. Максимальный клинический эффект отмечен у 52% детей уже на 2 сутки приема препарата. В эти же сроки у 48% детей отмечалось разжижение мокроты, в то время как в группе сравнения эти изменения регистрировались только у 36% детей. Исчезновение грубого сухого кашля на 2—3 день терапии Биопароксом регистрировалось у 75% детей, независимо от степени стеноза, а в группе контроля — только у 41%.
Таблица 2
Динамика симптомов ОРВИ с обструктивным ларинготрахеитом с бактериальными осложнениями у детей, леченных Биопароксом и Ампициллином
| Продолжительность симптомов (М ± m) | Биопарокс, n = 35 | Ампициллин, n = 20 |
| Температура тела | 1,5 ± 0,2* | 2,7 ± 0,3 |
| Интоксикационный синдром | 1,7 ± 0,4** | 2,7 ± 0,3 |
| Серозно-гнойное отделяемое из носа | 1,4 ± 0,1* | 3,7 ± 0,2 |
| Явления тонзиллофарингита | 4,5 ± 0,2 | 6,3 ± 0,3 |
| Осиплость голоса | 1,8 ± 0,3* | 2,4 ± 0,2 |
| Сухой кашель | 1,8 ± 0,2* | 2,6 ± 0,4 |
| Стеноз гортани | 1,1 ± 0,3** | 2,3 ± 0,2 |
Таким образом, лечение Биопароксом при среднетяжелых формах ОРВИ с бактериальными осложнениями было эффективным у 100%, в то время как лечение Ампициллином — у 86,7% больных. Эффективным мы считали лечение в тех случаях, когда клиническое выздоровление или выраженное улучшение с нормализацией температуры, купированием явлений стеноза гортани и исчезновением симптомов интоксикации наступали до 5 дня от начала терапии. Клинический эффект оценивался как «отличный» в тех случаях, когда уже на 2 день лечения наступало существенное изменение в состоянии больного. Обращает на себя внимание то, что у 2 (13,3%) больных, получавших Ампициллин, в первые 2 дня лечения положительная динамика клинических симптомов практически отсутствовала, что послужило основанием для усиления терапии этим больным препаратами иммунокорригирующего действия. Лечение Ампициллином продолжалось до нормализации температуры и купирования явлений стеноза гортани. Динамика купирования основных клинических симптомов заболевания отражалась на сроках пребывания больных в стационаре. Так, среднее количество койко-дней в основной группе больных достоверно меньше, чем в группе контроля: 4,3 ± 0,6 против 6,9 ± 0,6 дней (p < 0,01).
Побочных эффектов при применении Биопарокса мы не выявили, тогда как в группе сравнения у 5 детей отмечалась аллергическая сыпь, у 6 — явления диспепсии и, что немаловажно, факт развития стрессовых ситуаций во время проведения инъекций.
Полученные результаты позволяют высказаться о преимуществе топического применения антибиотика перед традиционной терапией системным антибактериальным препаратом. Ингаляция Биопарокса непосредственно в зону поражения способствует созданию высокой терапевтической концентрации антибиотика в очаге инфекции в максимально короткие сроки, в самом начале развития инфекции, что, во-первых, способствует сокращению продолжительности симптомов болезни и сроков пребывания в стационаре, а во-вторых — более эффективной эрадикации возбудителей в очаге воспаления.
Сравнительный анализ клинических симптомов в динамике заболевания показал высокую эффективность сиропа Эреспал. Так, у детей, получавших этот препарат, достоверно быстрее нормализовалась температура тела, уменьшались явления ринита, отек и гиперемия слизистой ротоглотки, исчезал сухой кашель, чем у детей, получавших традиционную терапию. Отмечалась и тенденция к более быстрому купированию симптомов стеноза гортани (рис. 2, 3, 4, 5, 6).
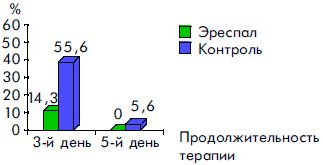
Рисунок 2. Динамика температурной реакции при ОРВИ у детей на фоне терапии Эреспалом и в группе контроля
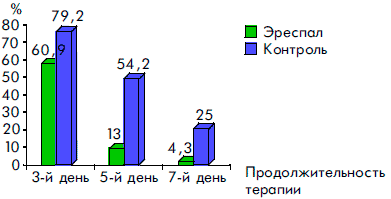
Рисунок 3. Динамика симптомов ринита при ОРВИ у детей, получавших Эреспал, и в группе контроля
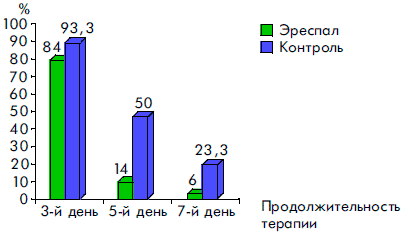
Рисунок 4. Динамика воспалительных явлений в ротоглотке у детей, получавших Эреспал, и в группе контроля при ОРВИ с обструктивным ларинготрахеитом
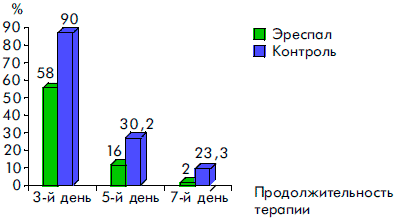
Рисунок 5. Динамика исчезновения сухого кашля у детей, получавших Эреспал, и в группе контроля при ОРВИ с обструктивным ларинготрахеитом

Рисунок 6. Динамика симптомов стеноза гортани при ОРВИ у детей, получавших Эреспал, и в группе контроля
К пятому дню терапии более чем у 80% пациентов прекращались кашель и насморк, значительно уменьшались гиперемия и отек слизистой ротоглотки. У всех детей к этому времени отсутствовали симптомы обструкции дыхательных путей и температура тела была нормальной. Через семь дней приема Эреспал сиропа гиперемия и отек слизистой ротоглотки сохранялись только у 3 (6%) детей, насморк — у 2 (4,3%) детей и кашель — у 1 ребенка.
Важно отметить, что в группе детей, получавших Эреспал сироп, бактериальных осложнений не было ни в одном случае, тогда как в группе сравнения у 5 детей были зарегистрированы бактериальные осложнения (у двух присоединился бронхит и у трех — отит).
Заключение
ОРЗ, независимо от этиологии, является воспалительным процессом в дыхательных путях, развивающимся в результате того, что вирусные, бактериальные патогены или их токсические субстанции, при несовершенстве факторов местной мукоцилиарной (неиммунной) и иммунной защиты, адгезируются на слизистой оболочке с первичной альтерацией респираторного эпителия. Это индуцирует развитие воспалительной реакции, в которой чужеродные антигены активизируют макрофаги, нейтрофилы, эндотелиоциты и др. к выбросу монокинов и лимфокинов (ИЛ-1,6,8,12,18; фнО-α и ИНф-γ). Последние активизируют межклеточные реакции иммунного взаимодействия, при котором высвобождаются медиаторы воспаления (гистамин, серотонин, кинины, лейкотриены, простагландины, фАТ, тромбоксаны А2 и В2, компоненты комплемента), что в совокупности инициирует развитие ранней (сосудистой) фазы воспаления с выраженной экссудацией и отеком, вслед за которой хемотаксические факторы опосредуют позднюю (клеточную) внесосудистую фазу воспалительной реакции. В процессе этой фазы фагоцитирующие макрофаги, нейтрофилы, лимфоциты, мигрирующие из микроциркуляторного русла в очаг воспаления, выбрасывают БАВ (протеолитические ферменты, пероксидазы, свободные кислородные радикалы), вторично повреждающие респираторный эпителий с его десквамацией и нарушением мукоцилиарного транспорта. Наступает 3 фаза воспаления в виде гиперплазии эпителия в ответ на клеточную пролиферацию, активированную продуктами тканевой альтерации — тканевыми стимуляторами роста.
Гиперреактивность дыхательных путей развивается в ответ на воспалительные изменения, сопровождающиеся высвобождением медиаторов и стимуляцию непосредственно инфекционными триггерами Н1-гистаминовых, αl-адренергических и М-холиновых рецепторов, а также к избыточной секреции таких нейропептидов, как субстанция Р, нейрокинов А и В и вазоактивного интестинального пептида [12]. В норме после перенесенной ОРВИ сохраняется гиперреактивность дыхательных путей до 2—6 недель. В тех же случаях, когда имеется аллергический фон нередко частые респираторные инфекции являются причиной формирования хронического воспалительного процесса с исходом в поствоспалительный фиброз дыхательных путей со стабильной гиперчувствительностью респираторного тракта [13]. Поэтому при ОРВИ первоочередной задачей терапии является раннее назначение этиотропной и патогенетической противовоспалительной терапии [6].
Важным эффектом Биопарокса, помимо антибактериального действия, является его противовоспалительное действие. Он способен подавлять секрецию молекул межклеточной адгезии 1 типа (ICAM-1) макрофагами, тем самым уменьшать продукцию и выброс медиаторов воспаления, ранних интерлейкинов воспаления и подавлять синтез свободных радикалов кислорода [14].
Полученные результаты позволяют высказаться о преимуществе топического применения Биопарокса перед традиционной терапией системным антибактериальным препаратом. Ингаляция Биопарокса непосредственно в зону поражения способствует созданию высокой терапевтической концентрации антибиотика в очаге инфекции в максимально короткие сроки, в самом начале развития инфекции, что, во-первых, способствует сокращению продолжительности общих и местных симптомов воспалительного процесса при ОРЗ с бактериальными осложнениями и сроков пребывания в стационаре, а во-вторых — более эффективной эрадикации возбудителей в очаге воспаления.
Эреспал сироп (фенспирид) оказывает уникальное многоплановое воздействие на все звенья воспалительного процесса слизистой оболочки дыхательных путей. Под влиянием фенспирида на Н1-рецепторы гистамина уменьшается объем секреции, снижается выработка слизи, что приводит к уменьшению воспаления в верхних дыхательных путях. фенспирид, подавляя синтез метаболитов арахидоновой кислоты, нормализует микроциркуляцию и, как следствие, уменьшает воспаление в очаге инфекции. Также данный препарат оказывает блокирующее действие на альфа1-адренорецепторы, за счет чего уменьшается образование секрета в просвете верхних дыхательных путей. Еще одним достоинством фенспирида является его способность тормозить секрецию цитокинов, прежде всего фактора некроза опухоли-a. Известно, что последний является мощным провоспалительным цитокином, стимулирующим секрецию муцина эпителиальными клетками верхних дыхательных путей [11]. Уменьшение образования медиаторов воспаления приводит к подавлению миграции эффекторных воспалительных клеток (макрофагов, полиморфно-ядерных лейкоцитов in vitro, in vivo) [15].
Таким образом, фенспирид патогенетически показан при заболеваниях верхних дыхательных путей, что подтверждает и наше исследование у детей при ОРВИ с обструктивным ларинготрахеитом. Особо следует отметить то, что в группе, получавших Эреспал сироп, ни у одного ребенка не было отмечено бактериальных осложнений. Этот факт можно объяснить тем, что фенспирид, воздействуя на все медиаторы воспаления, нормализует скорость мукоцилиарного транспорта, и как следствие восстанавливает защитные функции слизистой верхних дыхательных путей, что в свою очередь ускоряет их санацию и предотвращает бактериальные осложнения.
Выводы
1. Биопарокс высокоэффективен и безопасен в качестве стартового антибиотика, действующего непосредственно в очаге поражения, что позволяет повысить эффективность эрадикации патогенов в очаге воспаления и сократить длительность пребывания больного ребенка в стационаре.
2. Терапия Биопароксом ОРВИ со стенозирующим ларинготрахеитом предотвращает развитие бактериальных осложнений, а при их развитии сокращает сроки антибиотикотерапии.
3. У детей при ОРВИ со стенозирующим ларинготрахеитом раннее назначение терапии Эреспалом в сиропе способствует сокращению продолжительности основных симптомов ОРВИ и стеноза гортани.
4. Биопарокс и Эреспал являются безопасными стартовыми противовоспалительными препаратами в селективной терапии стенозирующего ларинготрахеита на фоне ОРЗ смешанной вирусно-бактериальной этиологии. Важным является то, что применение этих препаратов позволяет значительно сократить количество симптоматических препаратов базисной терапии ОРВИ и стеноза гортани.
ЛИТЕРАТУРА: 1. Часто и длительно болеющие дети: современные возможности иммунореабилитации (руководство для врачей) / Н. А. Коровина и др. — М., 2001.
2. Запруднов А. М. Клинико-патогенетические аспекты заболеваний органов дыхания у часто болеющих детей. — М., 1996.
3. Тузанкина И. А. Клининико-иммунологические подходы к формированию групп ЧБД и эффективность иммуномодулирующей терапии в комплексе группоспецифических реабилитационных мероприятий: Автореф. дисс. ... к.м.н. — Екатеринбург, 1992.
4. Сафронова А. Н. Современные подходы к терапии бронхитов у детей / А. Н. Сафронова, Н. А. Геппе // Мед. помощь. — 2000. — № 6. — С. 1—2.
5. Яковлев С. В. Рациональное применение антибиотиков при респираторных инфекциях в амбулаторной практике. Профилактика развития резистентности // Мат. симп. «Болезни органов дыхания у детей: сложные вопросы и пути решения». VIII Конгресс педиатров России. — М., 2003. (Приложение). — С. 1—6.
6. Острые респираторные заболевания у детей: лечение и профилактика (пособие для врачей). — М., 2002. — 70 с.
7. Rouveix В. et al. // Antimicrobial. Agents. — 2004. — V. 24(S2). — S. 153—432/81 p.
8. German-Fattal М. Fusafungine: an antimicrobial agent for the local treatment of respiratory tract infections // Clin. Drug Invest. — 1996. — V. 12. — P. 308—317.
9. Балясинская Г. Л. Диагностика и лечение гнойных осложнений заболеваний ЛОР-органов при ОРВИ у детей // Мат. симп. «Болезни органов дыхания у детей: сложные вопросы и пути решения». VIII Конгресс педиатров России. — М., 2003. (Приложение). — С. 7—9.
10. Брэмс X. М. Клиническая эффективность Эреспал сиропа при респираторных заболеваниях у грудных детей и детей младшего возраста / X. М. Брэмс, Ж. Р. Томас // Arch. MEDICI. — 1982. — V. 37. — 1. — P. 67—72.
11. Cuenant G. Efficacy of Pneumorel 80 mg (fenspiride) in the treatment of chronic sinusitis. Double-blind, placebo-controlled stady // Rhinology. — 1988. — Suppl. 4. — P. 21—29.
12. Черняк А. В. Бронхиальная гиперреактивность: Механизмы развития и ее измерение / А. В. Черняк, Т. Л. Пашкова // Бронхиальная астма. Под ред. ф. Г. Чучалина. — 1997. — Т. 1. — С. 343—356.
13. Клинико-патогенетическое обоснование применения ИРС 19 у детей с бронхолегочными заболеваниями / О. В. Кладова и др. // Вопр. совр. педиатрии. — 2002. — № 3. — С. 36—39.
14. Инфекция и антимикробная терапия / Ю. М. Овчинников и др. — М., 2000. — Т. 2. — № 6. — С. 3—5.
15. Shelhamer J. Н. Immunologic and neuropharmacologic stimulation of mucus glycoprotein release from human airways in vitro / J. Н. Shelhamer, Z. Marom, M. Kaliner // J. Clin. Invest. — 1980. —V. 66. — P. 1440—1448.
