Исследование ингаляционной токсичности газообразного диоксида хлора в низкой концентрации при воздействии на крыс в течение шести месяцев с двухнедельным восстановительным периодом
СтатьиОпубликовано в журнале:
Журнал промышленной гигиены и токсикологии 2012, 7:2
Акинори Акаматсу1,2, Чеолсунг Ли1, Хирофуми Морино1, Таканори Миура1, Норио Огата1 и Такаши Шибата1
1 Компания Taiko Pharmaceutical Co., Ltd, Сиута-ши, Осака, Япония.
Полный список сведений об авторах приводится в конце статьи.
Резюме
Общие сведения: Газообразный диоксид хлора (ДХ) обладает мощным антимикробным действием в очень низкой концентрации и может использоваться как средство дезинфекции в промышленных и общественных помещениях. При этом остается неизвестным, является ли безопасным хроническое воздействие газообразного ДХ в концентрациях, эффективных для борьбы с микроорганизмами. В этой связи было выполнено исследование ингаляционной токсичности ДХ в низкой концентрации при долговременном воздействии на крыс в рамках шестимесячного эксперимента с общим воздействием на организм и с последующим двухнедельным восстановительным периодом. Целью эксперимента было доказательство того, что воздействие газообразного ДХ в концентрации до 0,1 ppm (объемное отношение) может считаться безопасным по результатам серии токсикологических исследований.
Методика: Крысы подвергались воздействию газообразного ДХ в концентрации 0,05 ppm или 0,1 ppm 24 часа в сутки, 7 дней в неделю в течение 6 месяцев при свободном содержании животных и неограниченном доступе к корму и еде в камере, имитирующей обычный образ жизни человека. Контрольные животные контактировали только с воздухом. В течение периода исследования регистрировался вес тела животных, а также потребление ими корма и воды. После шестимесячного контакта и двухнедельного восстановительного периода животных умертвили и выполнили серию токсикологических исследований, включая биохимический и общий анализ крови, аутопсию, взвешивание органов и гистопатологические исследования.
Результаты: Газообразный ДХ в точных объемах подавался в камеру в течение всего периода исследования. В указанный период не было выявлено каких-либо признаков токсичного воздействия газообразного ДХ. Мы не наблюдали каких-либо существенных расхождений в показателях прибавления в весе, потребления корма и воды, а также относительного веса органов тела животных. В ходе биохимического и общего анализа крови не было выявлено каких-либо изменений, связанных с токсичным воздействием газообразного ДХ. При вскрытии и гистопатологическом исследований не наблюдалось каких-либо признаков токсичного воздействия газообразного ДХ даже на органы дыхательной системы, которые, как предполагалось, должны были оказаться наиболее уязвимыми.
Выводы: Газообразный ДХ в концентрации до 0,1 ppm, превышающей уровень концентрации, эффективной для борьбы с микроорганизмами, при общем непрерывном воздействии на организм крыс в течение шести месяцев оказался нетоксичным в условиях, имитирующих обычный образ жизни человека.
Ключевые слова: Диоксид хлора, газ, ингаляция, долгосрочное воздействие, токсичность, общее воздействие на организм
Общие сведения
Диоксид хлора (ДХ), который при комнатной температуре представляет собой растворимый в воде газ желтого цвета, существует в виде относительно стабильного свободного радикала и является очень сильным окислителем [1–3]. В этой связи при растворении в воде ДХ обладает мощным антимикробным действием на бактерии и вирусы in vitro [4–7].
Кроме того, в ходе последних исследований было установлено, что газообразный ДХ также обладает мощным антимикробным действием [8–10]. В частности, было описано, что газообразный ДХ в низкой концентрации, соответствующей 0,03 ppm, может использоваться в качестве профилактики инфицирования мышей вирусом гриппа типа A [11]. Кроме того, по свидетельству Огаты (Ogata) и Шибаты (Shibata), емкости, выделяющие газообразный ДХ в малых количествах, установленные в классной комнате, позволили повысить посещаемость школы учащимися в зимний период, предположительно, в связи с профилактикой эпидемических простудных и гриппозных заболеваний [12]. Кроме того, в рамках клинического исследования заболеваемости группы людей было установлено, что газообразный ДХ в крайне низкой концентрации, такой как 0,01 ppm или 0,02 ppm, является средством профилактики гриппоподобного заболевания [13]. Другие исследования также позволили выявить способность газообразного ДХ в низкой концентрации инактивировать кошачий калицивирус (FCV), суррогат норовируса, который был нанесен на стеклянную поверхность во влажном или сухом состоянии [14,15]. Концентрации газообразного ДХ в рамках указанных исследований не превышали восьмичасовой средневзвешенной во времени концентрации (TWA), которая была установлена Управлением США по охране труда и промышленной гигиене (OSHA) на уровне 0,1 ppm [16]. Результаты этих исследований свидетельствуют о том, что газообразный ДХ в низких концентрациях может использоваться в качестве эффективного средства дезинфекции жилых и присутственных помещений, таких как жилые здания, офисы, здания аэропортов, больницы, при условии, что применяемые концентрации газообразного ДХ не являются токсичными.
Однако токсичное воздействие газообразного ДХ в низкой концентрации, в частности, его долгосрочное токсичное воздействие на организм, до сих пор не было достаточно изучено. В немногочисленных исследованиях ингаляционной токсичности газообразного ДХ авторы Поле и Дебрусс [17–19] применяли высокие концентрации газообразного ДХ, такие как 2,5 ppm и выше. Кроме того, период воздействия газообразного ДХ на организм не превышал у них 45 дней. Более долгосрочное исследование было выполнено Дальхамном [20]. Оно показало, что уровень ненаблюдаемого вредного воздействия (NOAEL) на крыс, которые контактировали с газообразным ДХ 5 часов в день в течение 10 недель, составляет 0,1 ppm. Однако в связи с тем, что концентрация газообразного ДХ в период проведения эксперимента значительно колебалась в пределах от 0,05 ppm до 0,3 ppm, ценность этого исследования весьма ограничена. В этой связи в настоящее время представляется крайне желательным изучить вопрос о наличии или отсутствии признаков токсичного воздействия газообразного ДХ в концентрации в 0,1 ppm или ниже при воздействии на животных в течение более длительного периода времени, по сравнению с исследованием Дальхамна. Кроме того, результаты исследования, в рамках которого животные контактировали бы с газообразным ДХ постоянно в течение 24 часов, могут оказаться полезными для воспроизведения реальных условий жизни человека. Если в этих условиях будет доказана безопасность газообразного ДХ в низких концентрациях, последний может постоянно использоваться для борьбы с инфекцией в помещениях, занимаемых людьми.
Таким образом, цель настоящего исследования заключается в том, чтобы изучить вопрос о наличии или отсутствии признаков токсичного воздействия газообразного ДХ в низкой концентрации, не превышающей 0,1 ppm, уровень которой должен точно регулироваться при его постоянном воздействии на крыс в течение более длительного периода, по сравнению с предыдущими исследованиями, в условиях свободного доступа к корму и воде, имитирующих обычный образ жизни человека. В целом, обоснование уровня воздействия, выбранного в рамках настоящего исследования, построено на базе более ранних работ (включая наши собственные), где было продемонстрировано, что антимикробное действие газообразного ДХ проявляется при концентрации от 0,01 ppm [13] до 0,03 ppm [11]. Как следствие, мы выбрали уровни газообразного ДХ в пределах от 0,05 ppm до 0,1 ppm, то есть в диапазоне, охватывающем концентрации, обладающие антимикробным эффектом, но при этом не превышающем значения 0,1 ppm, которое является восьмичасовым TWA допустимого уровня долгосрочного воздействия, согласно Управлению OSHA США.
Методика
Лабораторные животные и условиях их содержания
Самки и самцы крыс породы Спраг Доули Crl:CD (SD) в возрасте около 5 недель были получены из лаборатории Charles River Laboratories Japan (Йокогама, Япония). Однополые животные, попарно помещенные в клетки, содержались в виварии при температуре 24±3 °C и относительной влажности воздуха 50±10 %, с двенадцатичасовым циклом чередования светлого и темного времени суток. Животные получали в неограниченном количестве корм CRF-1 (производства компании Oriental Yeast, Токио, Япония) и водопроводную воду. До начала эксперимента они прошли недельную акклиматизацию и карантин. Все эксперименты над животными проводились в строгом соответствии с требованиями Руководства Национального института здравоохранения по обращению с лабораторными животными и были утверждены Внутренним комитетом по обращению с животными компании Hamri Corporation, по заказу которое выполнялось настоящее исследование.
Генерация газообразного ДХ и экспериментальная ингаляционная камера
Источником газообразного ДХ служила электрохимическая система [21]. Вкратце, газообразный ДХ мы получали путем растворения продукта электролиза хлорида калия в растворе хлорита натрия. Экспериментальная установка для воздействия на крыс газообразным ДХ изображена на рисунке 1. Герметичные экспериментальные ингаляционные камеры, каждая размером 700 Ш × 1350 Г × 1600 В мм, были изготовлены из нержавеющей стали и панелей из прозрачного пластика на основе винилхлорида. Кратность воздухообмена в камере составляла 30 раз в час. Для поддержания равномерного потока газообразного ДХ и равномерной концентрации газообразного ДХ внутри камеры использовались пять компактных (25 мм × 25 мм × 10 мм) электрических вентилятора постоянного тока со скоростью потока воздуха 0,048 м³/мин (модель F2510CT-12UCV производства компании Shicoh Engineering, г. Канагава, Япония), которые были установлены в каждой камере. Крысы одного пола были помещены попарно в клетки из нержавеющей стали в камере, где концентрация газообразного ДХ задавалась посредством регулирования электрического тока, применяемого для электролиза, и постоянно отслеживалась при помощи газоанализатора ДХ (модель CS-7 с датчиком CDS-7 производства компании New Cosmos Electric, г. Осака, Япония). Устройство для контроля уровня газообразного ДХ проходило калибровку один раз в сутки с использованием стеклянной индикаторной трубки с газообразным ДХ (No. 23 M производства компании Gastec, г. Канагава, Япония).
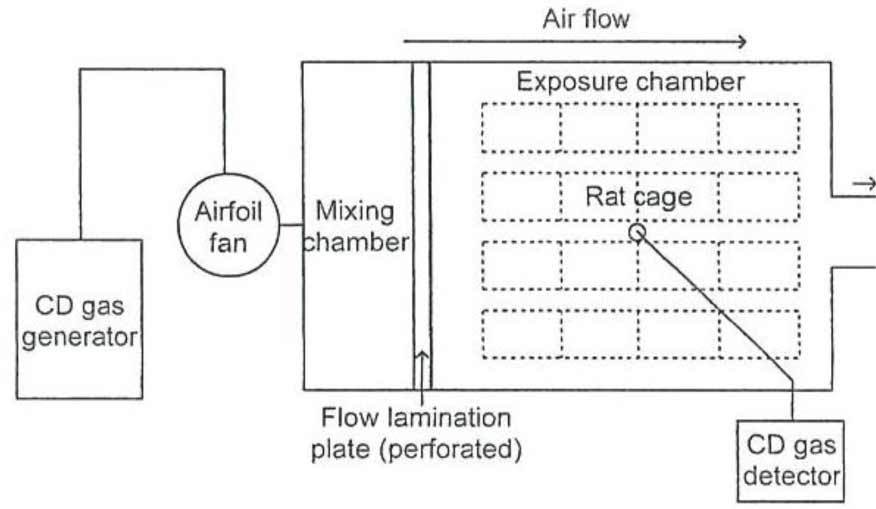
| Air flow | Поток воздуха |
| Exposure chamber | Экспериментальная камера |
| CD gas generator | Генератор газообразного ДХ |
| Airfoil fan | Вентилятор с профилированными лопатками |
| Mixing chamber | Смесительная камера |
| Rat cage | Клетка с крысами |
| Flow lamination plate (perforated) | Пластина – ламинатор потока (перфорированная) |
| CD gas detector | Датчик газообразного ДХ |
Рисунок 1. Схема устройства экспериментальной камеры с газообразным ДХ. Газообразный ДХ, подаваемый из генератора газообразного ДХ (который показан в левой части), смешивается с воздухом при помощи вентилятора с профилированными лопатками; затем он поступает в смесительную камеру и затем распределяется через панель с отверстиями (ламинизатор потока) в виде равномерного потока газообразного ДХ в точно заданной концентрации, обтекая клетки с животными в экспериментальной камере. Пробоотборник датчика газообразного ДХ установлен в середине камеры для постоянного отслеживания концентрации газообразного ДХ. Кратность обмена воздуха в камере – 30 раз в час. Чтобы обеспечить равномерное воздействие газообразного ДХ на крыс клетки менялись местами один раз в неделю. В ходе предварительного эксперимента мы убедились в том, что образ жизни животных, корм, вода и экскременты не оказывают влияния на концентрацию ДХ, проходящего через камеру (данные не показаны). Мы также получили подтверждение того, что концентрация газообразного ДХ является одинаковой на впускном и выпуском отверстиях, а также в центре камеры (данные не показаны).
Схема эксперимента
Три группы, каждая из которых состояла из 16 самцов и 16 самок крыс, были сформированы при помощи метода стратифицированного случайного отбора. Различия средней массы тела в каждой группе не превышали ± 20%. Указанные группы контактировали либо с газообразным ДХ в концентрации 0,05 ppm (низкой) и 0,1 ppm (высокой) или только с воздухом (контроль). Животные подвергались воздействию газообразного ДХ 24 часа в сутки, 7 день в неделю в течение 6 месяцев, за исключением времени, необходимого для ухода за лабораторными животными (измерение массы тела, добавление корма и воды один раз в неделю и удаление экскрементов дважды в неделю). Каждая процедура занимала 30 минут. Чтобы исключить различия в уровне газообразного ДХ, связанные с положением клеток в рамках экспериментального пространства, клетки с крысами менялись местами внутри камеры каждую неделю. По окончании экспериментального периода 10 самцов и 10 самок из каждой группы были умерщвлены. Оставшиеся 6 самцов и 6 самок из каждой группы содержались в течение дополнительного двухнедельного восстановительного периода. В это время они контактировали только с воздухом.
Наблюдения
В течение экспериментального и восстановительного периодов за животными велось наблюдение на предмет возможной смертности и признаков отравления. Каждую неделю фиксировалась масса тела животных, а также потребление ими корма и воды.
Биохимический и общий анализы крови
Перед аутопсией животным не давали корма приблизительно 16 часов чтобы избежать помутнения плазмы крови. Затем животные были подвергнуты эвтаназии при помощи эфира, а их кровь была откачана через брюшную аорту. Полученная кровь была исследована на аспартат-аминотрансферазу (AST), аланин-аминотрансферазу (ALT), гамма-глутамилтранспептидазу (γ-GTP), общий белок (TP), альбумин (ALB), отношение альбумина к глобулину (A/G), глюкозу в крови (BG), общий холестерин (TC), триглицерид (TG), азот мочевины крови (BUN), интерлейкин (IL-6), фактор некроза опухолей-альфа (TNF-α), креатинин (CRE), C-реактивный белок (CRP), фосфор (P), кальций (Ca), натрий (Na), калий (K), хлор (Cl), время свертывания крови (PT), активированное частичное тромбопластиновое время (APTT), количество красных кровяных телец (RBC), количество белых кровяных телец (WBC), концентрацию гемоглобина (Hb), гематокрит (HTC), количество тромбоцитов (PLT), среднюю концентрацию гемоглобина в эритроците (MCH), процентное содержание нейтрофилов (NE%), процентное содержание эозинофилов (EO%), процентное содержание базофилов (BA%), процентное содержание моноцитов (MO%) и процентное содержание лимфоцитов (LY%). Были получены бронхоальвеолярные смывы (BALF) из левой альвеолы с использованием 1,0 мл физиологического раствора в фосфатном буфере для определения количества блуждающих клеток (BC) и процентного содержания белых кровяных телец (WBC%).
Аутопсия, взвешивание органов и гистопатологическое исследование
После отбора крови и получения BALF у животных были извлечены головной мозг, гипофиз, глаз, щитовидная железа, вилочковая железа, сердце, аорта, правое легкое, трахея, глотка, печень, селезенка, поджелудочная железа, надпочечная железа, желудок, почка, тонкий кишечник, толстый кишечник, яичники, семенники, мочевой пузырь, бедренная кость и носовая полость, которые затем были исследованы макроскопически на предмет наличия признаков отравления. Затем было выполнено взвешивание головного мозга, печени, селезенки, надпочечной железы, яичников и семенников, после чего все органы были зафиксированы в 10-процентном растворе формалина с нейтральным фосфатно-буферным физиологическим раствором. Затем правое легкое, трахея, глотка и носовая полость были помещены в парафин, окрашены гематоксилином и эозином и исследованы при помощи оптического микроскопа.
Статистический анализ
Все результаты были выражены в форме средних значений ± стандартное отклонение. С разницей в двое суток с применением метода дисперсионного анализа были выполнены измерения, результаты которых были использованы для сравнения массы тела и усвоения пищи и воды в группе животных, которые контактировали с газообразным ДХ, в сравнении с контрольной группой. Прочие параметры анализировались с применением критерия Даннетта. Уровень значимости был установлен как p < 0,05 или p < 0,01.
Результаты
Концентрация газообразного ДХ
Значения концентрации газообразного ДХ в экспериментальной камере в течение всего периода воздействия представлены на рисунке 2. В камере с низкой концентрацией газа незначительные временные изменения среднего уровня газообразного ДХ за каждую неделю оставались в пределах от 0,047 ppm до 0,060 ppm, при этом изменения значений в камере с высокой концентрацией составили от 0,075 ppm до 0,120 ppm. Среднее значение ± стандартное отклонение концентрации газообразного ДХ в течение периода экспериментального воздействия для камеры с низкой концентрацией составило 0,054 ± 0,007 ppm, а аналогичное значение для камеры с высокой концентрацией составило 0,103 ± 0,011 ppm.
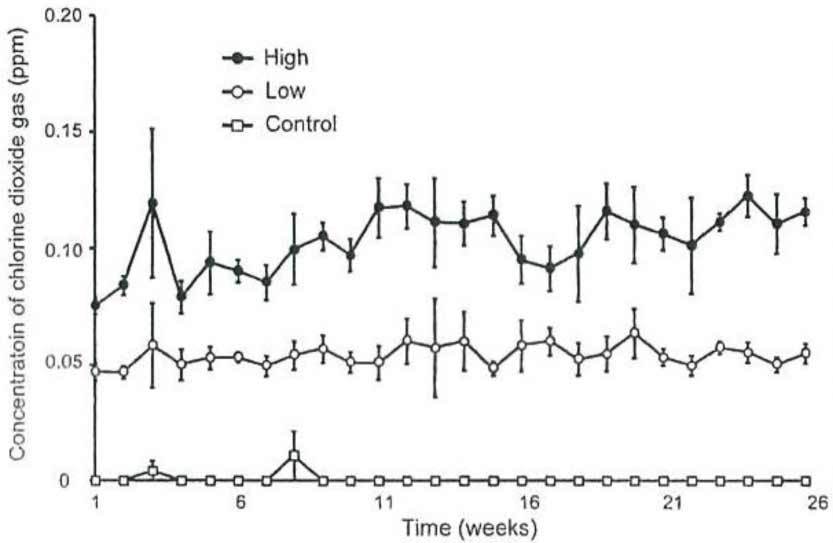
| Concentration of chloride dioxide gas (ppm) | Концентрация газообразного диоксида хлора (ppm) |
| High | Высокая концентрация |
| Low | Низкая концентрация |
| Control | Контроль |
| Time (week) | Время (неделя) |
Рисунок 2. Динамика временных изменений концентрации газообразного ДХ в каждой из камер. Концентрация газообразного ДХ в каждой из камер изменялась постоянно в течение всего шестимесячного периода. Не желая перегружать рисунок, мы использовали символы для обозначения средних значений концентрации газообразного ДХ каждую неделю (незакрашенные квадраты: контроль (воздух); незакрашенные кружки: 0,05 ppm; закрашенные кружки: 0,1 ppm), а поперечные линии – для обозначения стандартных отклонений. В течение всего шестимесячного периода воздействия не было отмечено тенденции к увеличению или уменьшению концентрации газообразного ДХ, а колебания уровня газообразного ДХ оставались в пределах ± 25% независимо от дозировки ДХ. Среднее значение ± стандартное отклонение концентрации газообразного ДХ в течение периода воздействия для камеры с низкой концентрацией составляет 0,054 ± 0,007 ppm, а для камеры с высокой концентрацией – 0,103 ± 0,011 ppm.
Макроскопические наблюдения, потребление корма и воды, масса тела и относительная масса органов
В течение всего периода исследования в ходе ежедневных наблюдений не было зафиксировано ни одного случая гибели животных, равно как и признаков отравления, связанных с газообразным ДХ. Не было отмечено статистически значимых изменений массы тела в течение экспериментального периода между экспериментальной и контрольной группами (p = 0,348 у самцов, p = 0,466 у самок; рисунок 3). Кроме того, не было отмечено каких-либо статистически значимых различий в потреблении корма и воды между экспериментальными и контрольными крысами (потребление корма: p = 0,101 у самцов, p = 0,613 у самок; потребление воды: p = 0,848 у самцов, p = 0,812 у самок; рисунок 4). Что касается относительной массы органов, не было обнаружено статистически значимых изменений как у самцов, так и у самок крыс в стечение периода воздействия (таблица 1). Кроме того, в течение восстановительного периода не наблюдалось существенных изменений относительной массы органов как у самцов, так и у самок крыс (данные не показаны).
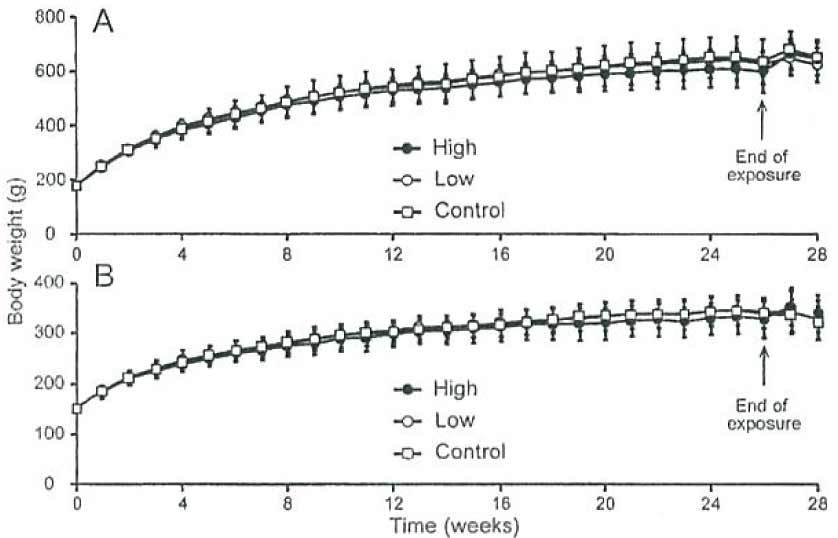
| Body weight (g) | Масса тела (г) |
| High | Высокая концентрация |
| Low | Низкая концентрация |
| Control | Контроль |
| End of exposure | Конец периода воздействия |
| Time (week) | Время (неделя) |
Рисунок 3. Изменения массы тела крыс, которые контактировали с газообразным ДХ. Стрелки обозначают конец периода воздействия и начало восстановительного периода. (A): самцы и (B): самки. Символы (незакрашенные квадраты: контроль; незакрашенные кружки: 0,05 ppm и закрашенные кружки: 0,1 ppm) обозначают среднюю массу тела, а поперечные линии – стандартное отклонение. Масса тела животных измерялась один раз в неделю. Количество крыс, которые использовались для расчета среднего значения ± стандартное отклонение, составило 16 особей в течение периода воздействия и 6 особей в течение восстановительного периода. Не было отмечено статистически значимых различий между группой, которая контактировала с газообразным ДХ, и контрольной группой в течение всего периода исследования.
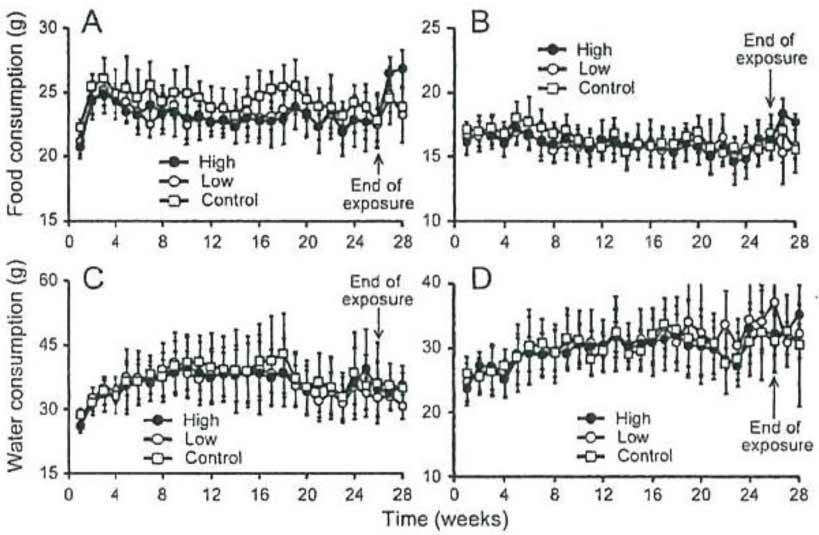
| Food consumption (g) | Потребление корма (г) |
| High | Высокая концентрация |
| Low | Низкая концентрация |
| Control | Контроль |
| End of exposure | Конец периода воздействия |
| Time (weeks) | Время (недели) |
Рисунок 4. Потребление корма и воды крысами, которые контактировали с газообразным ДХ. Стрелки обозначают конец периода воздействия и начало восстановительного периода. (A): потребление корма самцами, (B): потребление корма самками, (C): потребление воды самцами и (D): потребление воды самками. Символы (незакрашенные квадраты: контроль; незакрашенные кружки: 0,05 ppm и закрашенные кружки: 0,1 ppm) обозначают средние значения потребления корма и воды, а поперечные линии обозначают стандартные отклонения. Измерения выполнялись один раз в неделю. Количество крыс, которые использовались для расчета среднего значения ± стандартное отклонение, составило 16 особей в течение периода воздействия и 6 особей в течение восстановительного периода. Не было отмечено статистически значимых различий между группой, контактировавшей с газообразным ДХ, и контрольной группой в течение всего периода исследования, независимо от концентрации газообразного ДХ.
Таблица 1. Относительная масса органов (%) тела крыс, которые подвергались воздействию газообразного ДХ в течение 6 месяцев
| Группа | Контроль | Низкая концентрация | Высокая концентрация | |||
|---|---|---|---|---|---|---|
| Орган | Самцы | Самки | Самцы | Самки | Самцы | Самки |
| Головной мозг | 0,36 ± 0,05 | 0,60±0,06 | 0,34 ± 0,02 | 0,59 ± 0,04 | 0,38 ± 0,06 | 0,64 ± 0,07 |
| Печень | 2,50 ± 0,20 | 2,46 ± 0,19 | 2,43 ± 0,28 | 2,47 ± 0,15 | 2,47 ± 0,15 | 2,43 ± 0,26 |
| Селезенка | 0,13 ± 0,01 | 0,17 ± 0,02 | 0,13 ± 0,01 | 0,16 ± 0,01 | 0,13 ± 0,01 | 0,16 ± 0,03 |
| Надпочечная железа (правая) | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 |
| Надпочечная железа (левая) | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 | 0,01 ± 0,00 |
| Семенник (правый) | 0,29 ± 0,04 | 0,28 ± 0,05 | 0,32 ± 0,04 | |||
| Семенник (левый) | 0,30 ± 0,04 | 0,30 ± 0,02 | 0,32 ± 0,05 | |||
| Яичник (правый) | 0,02 ± 0,01 | 0,01 ± 0,01 | 0,02 ± 0,01 | |||
| Яичник (левый) | 0,02 ± 0,00 | 0,01 ± 0,01 | 0,02 ± 0,01 | |||
Каждый показатель соответствует среднему значению ± стандартное отклонение для 10 крыс.
Результаты биохимического и общего анализов крови
Некоторые параметры биохимического и общего анализов крови в течение периода воздействия указывают на наличие статистически значимых различий между крысами, которые контактировали с газообразным ДХ, и крысами контрольной группы (таблицы 2 и 3). К числу этих параметров относятся изменения значений Ca и MO% у крыс-самцов и BC у крыс-самок, которые не зависели от дозы вещества, поскольку группа, контактировавшая с более высокой дозой вещества, не обнаруживает статистически значимых отличий. Хотя параметры EO%, полученные у крыс-самцов как из группы, контактировавшей с высокой дозой вещества, так и из группы, контактировавшей с низкой дозой вещества, оказались значительно ниже значений, полученных в контрольной группе крыс, это отличие также не зависело от размера дозы. В течение восстановительного периода ни один из наблюдаемых параметров не был связан с изменениями, обусловленными воздействием газообразного ДХ (данные не показаны). Имело место статистически значимое изменение значения BUN у крыс-самок, контактировавших с веществом в высокой концентрации.
Таблица 2. Результаты биохимического анализа крови крыс, которые контактировали с газообразным ДХ в течение 6 месяцев
| Группа | Контроль | Низкая концентрация | Высокая концентрация | |||
|---|---|---|---|---|---|---|
| Исследуемое вещество | Самцы | Самки | Самцы | Самки | Самцы | Самки |
| AST (ед./л) | 115,3 ± 34,7 | 140,6 ± 64,3 | 99,6 ± 20,0 | 115,5 ± 21,8 | 99,7 ± 22,1 | 179,6 ± 178,5 |
| ALT (ед./л) | 37,5 ± 10,5 | 55,7 ± 39,6 | 33,4 ± 7,5 | 38,1 ± 11,1 | 38,8 ± 15,7 | 82,8 ± 116,4 |
| γ-GTP (ед./л) | 1,0 ± 0,0 | 1,1 ± 0,3 | 1,0 ± 0,0 | 1,0 ± 0,0 | 1,0 ± 0,0 | 1,0 ± 0,0 |
| TP (г/дл) | 6,2 ± 0,2 | 7,3 ± 0,6 | 6,0 ± 0,4 | 7,3 ± 0,4 | 6,2 ± 0,2 | 7,2 ± 0,6 |
| ALB (г/дл) | 2,3 ± 0,1 | 3,0 ± 0,3 | 2,2 ± 0,1 | 3,1 ± 0,2 | 2,3 ± 0,1 | 3,1 ± 0,3 |
| A/G | 0,58 ± 0,03 | 0,72 ± 0,07 | 0,58 ± 0,04 | 0,74 ± 0,04 | 0,60 ± 0,04 | 0,76 ± 0,06 |
| BG (мг/дл) | 137,4 ± 11,3 | 137,1 ± 24,6 | 135,3 ± 27,6 | 131,2 ± 14,7 | 132,7 ± 13,0 | 129,2 ± 16,3 |
| TC (мг/дл) | 75,2 ± 14,2 | 87,5 ± 26,2 | 67,3 ± 18,2 | 101,6 ± 23,0 | 76,2 ± 16,0 | 88,5 ± 29,3 |
| TG (мг/дл) | 71,0 ± 19,4 | 84,4 ± 50,1 | 61,1 ± 21,9 | 118,6 ± 65,7 | 64,9 ± 32,9 | 69,1 ± 36,0 |
| BUN (мг/дл) | 14,1 ± 2,1 | 13,1 ± 1,6 | 14,0 ± 1,9 | 13,6 ± 2,3 | 15,4 ± 2,1 | 15,2 ± 0,9* |
| CRE (мг/дл) | 0,33 ± 0,03 | 0,38 ± 0,05 | 0,33 ± 0,05 | 0,35 ± 0,02 | 0,36 ± 0,03 | 0,36 ± 0,02 |
| CRP (мг/дл) | 0,03 ± 0,00 | 0,03 ± 0,00 | 0,03 ± 0,00 | 0,03 ± 0,00 | 0,03 ± 0,00 | 0,03 ± 0,00 |
| P (мг/л) | 6,3 ± 0,4 | 5,8 ± 0,4 | 6,2 ± 0,5 | 5,3 ± 0,7 | 6,2 ± 0,4 | 6,1 ± 0,8 |
| Ca (мг/л) | 10,3 ± 0,31 | 1,2 ± 0,6 | 9,9 ± 0,2* | 11,0 ± 0,2 | 10,3 ± 0,3 | 11,2 ± 0,6 |
| Na (мэкв/л) | 143,6 ± 1,0 | 141,6 ± 1,5 | 143,5 ± 1,5 | 141,5 ± 1,5 | 143,7 ± 0,9 | 142,0 ± 1,2 |
| K (мэкв/л) | 4,6 ± 0,2 | 4,8 ± 0,6 | 4,7 ± 0,2 | 4,4 ± 0,3 | 4,6 ± 0,2 | 4,6 ± 0,6 |
| Cl (мэкв/л) | 104,6 ± 1,4 | 102,6 ± 2,4 | 105,1 ± 0,7 | 102,2 ± 1,2 | 103,9 ± 1,7 | 102,1 ± 2,0 |
| PT (сек) | 15,9 ± 2,0 | 10,6 ± 0,6 | 15,0 ± 1,6 | 10,7 ± 0,7 | 15,6 ± 1,7 | 11,6 ± 3,2 |
| APTT (сек) | 22,7 ± 3,1 | 24,9 ± 6,0 | 20,6 ± 2,1 | 22,5 ± 3,1 | 21,1 ± 2,3 | 24,0 ± 12,5 |
| IL-6 (пг/мл) | Н/о | Н/о | Н/о | Н/о | 63,8 ± 24,1 | Н/о |
| TNF-α (пг/мл) | Н/о | Н/о | Н/о | Н/о | Н/о | Н/о |
Каждый показатель соответствует среднему значению ± стандартное отклонение для 10 крыс.
* Статистически значимое отличие от контрольной группы, p < 0,05.
Н/о: Не обнаружено (ниже нижней границы количественного определения: TNF-α: < 12,5 пг/мл IL-6: < 62,5 пг/мл).
Таблица 3. Результаты общего анализа крови и исследования BALF, взятых у крыс, которые контактировали с газообразным ДХ в течение 6 месяцев
| Группа | Контроль | Низкая концентрация | Высокая концентрация | |||
|---|---|---|---|---|---|---|
| Исследуемое вещество | Самцы | Самки | Самцы | Самки | Самцы | Самки |
| Количество клеток крови | ||||||
| RBC (102/мкл) | 1108 ± 85 | 942 ± 124 | 1030 ± 111 | 834 ± 72 | 1019 ± 117 | 881 ± 130 |
| WBC (104/ мкл) | 89 ± 20 | 62 + 15 | 94 ± 29 | 56 ± 18 | 92 ± 21 | 63 ± 22 |
| Hb (м/дл) | 18,1 ± 1,4 | 16,8 ± 1,8 | 17,5 ± 2,2 | 15,2 ± 1,3 | 17,1 ± 2,0 | 16,8 ± 2,6 |
| HTC (%) | 54,4 ± 3,8 | 49,5 ± 5,9 | 52,1 ± 6,6 | 44,6 ± 4,0 | 51,7 ± 6,4 | 47,3 ± 7,5 |
| PLT (104/мкл) | 78,4 ± 18,0 | 92,4 ± 18,7 | 85,5 ± 20,9 | 90,9 ± 18,7 | 93,2 ± 31,2 | 81,2 ± 19,5 |
| MCH (пг) | 16,3 ± 0,4 | 17,9 ± 0,6 | 16,8 ± 0,6 | 18,3 ± 0,8 | 16,8 ± 0,7 | 18,3 ± 0,9 |
| NE% (%) | 14,9 ± 5,8 | 12,5 ± 6,5 | 10,4 ± 3,1 | 13,7 ± 3,5 | 17,1 ± 4,8 | 17,5 ± 6,3 |
| EO% (%) | 0,9 ± 0,6 | 1,2 ± 0,9 | 0,2 ± 0,4* | 0,7 ± 0,6 | 0,3 ± 0,3* | 1,1 ± 0,6 |
| BA% (%) | 0,5 ± 0,6 | 0,5 ± 0,5 | 0,5 ± 0,4 | 0,8 ± 0,3 | 0,5 ± 0, | 30,2 ± 0,3 |
| MO% (%) | 12,2 ± 4,2 | 12,5 ± 3,5 | 8,8 ± 2,4* | 13,7 ± 3,0 | 11,5 ± 4,8 | 13,1 ± 6,3 |
| LY% (%) | 69,3 ± 7,9 | 71,9 ± 6,6 | 75,4 ± 5,3 | 67,9 ± 6,3 | 68,5 ± 4,8 | 66,2 ± 8,9 |
| Количество клеток в BALF | ||||||
| BC (104/мл) | 39,4 ± 45,1 | 12,5 ± 10,0 | 27,1 ± 37,6 | 39,9 ± 18,1* | 21,8 ± 13,1 | 28,4 ± 23,5 |
| WBC% (%) | 0,0 ± 0,0 | 0,0 ± 0,0 | 0,0 ± 0,0 | 0,0 ± 0,0 | 0,0 ± 0,0 | 0,0 ± 0,0 |
Каждый показатель соответствует среднему значению ± стандартное отклонение для 10 крыс.
* Статистически значимое отличие от контрольной группы, p < 0,05
Аутопсия и гистопатологическое исследование
Макроскопическое наблюдение при вскрытии животных не выявило каких-либо признаков отравления. При гистопатологическом исследований органов, которые представлялись наиболее уязвимыми, таким как носовые каналы, носовая полость, глотка, трахея и бронхи, не было обнаружено каких-либо отклонений, связанных с воспалительными процессами, такими как истончение слизистой оболочки, инфильтрация и увеличения числа блуждающих клеток, а также увеличение числа лимфатических фолликулов (данные не показаны). Мы отметили высокий уровень гемосидерина в кровеносных сосудах после окончания периода воздействия, причем он осаждался на подслизистом слое легочных капилляров. Но поскольку аналогичные результат наблюдался как в экспериментальной, так и в контрольной группе, его нельзя отнести на счет воздействия газообразного ДХ. Кроме того, в течение восстановительного периода не было отмечено каких-либо различий между экспериментальной и контрольной группами (данные не показаны). Отмечался рост числа макрофагоцитов (хотя умеренный) у некоторых крыс как в течение периода воздействия, так и в течение восстановительного периода. Но поскольку подобное увеличение числа макрофагоцитов также наблюдалось у нескольких самок в контрольной группе в течение восстановительного периода, это наблюдение не следует рассматривать в качестве общего явления. Увеличение числа количества блуждающих клеток наблюдалось у нескольких крыс как в экспериментальной, так и в контрольной группе; следовательно, этот результат не следует рассматривать как связанный с воздействием газообразного ДХ.
Обсуждение
Результаты нашего исследования свидетельствуют об отсутствии существенных признаков отравления при контакте с газообразным ДХ в низкой концентрации, не превышающей 0,1 ppm, 24 часа в сутки, 7 дней в неделю в течение шестимесячного периода общего воздействия газа на организм крыс. Этот период воздействия оказался длиннее, по сравнению с предыдущими исследованиями [17–20]. Кроме того, нам удалось поддерживать концентрацию газообразного ДХ в пределах ±25% относительно целевой концентрации в течение всего периода воздействия, в отличие от исследования Дальхамна, в ходе которого фактические уровни газообразного ДХ колебались в широких пределах от 0,05 ppm до 0,3 ppm относительно целевой концентрации, составляющей 0,1 ppm [20]. Согласно Управлению OSHA США, уровень TWA продолжительного (восьмичасового) допустимого воздействия газообразного ДХ в воздухе окружающей среды на рабочем месте составляет 0,1 ppm. Полученные нами результаты подтверждают, что этот уровень не является токсичным для крыс даже в случае непрерывного круглосуточного воздействия. Кроме того, в ходе предварительного эксперимента мы подтвердили, что условия содержания животных, корм, вода и экскременты не влияли на условия нашего эксперимента, предположительно, в связи с высокой кратностью вентиляции воздуха – 30 раз в час (данные не показаны). Мы также убедились до начала исследования в том, что уровень газообразного ДХ является одинаковым в камере и в клетке, независимо о того, в какой точки камеры выполняется замер.
Поскольку речь идет об ингаляционном воздействии окислителя, ожидалось, что основными органами, на которые будет направлено его воздействие, окажутся органы дыхательной системы. Однако мы не отметили существенных изменений показателя WBC в крови и в BALF. Кроме того, количество цитокинов (TNF-α и IL-6), которое увеличивается при наличии воспалительного процесса [22, 23], было практически неопределимым (таблица 2), ниже предела количественного обнаружения (TNF-α: < 12,5 пг/мл; IL-6: < 62,5 пг/мл). В группе крыс-самцов, которые контактировали с веществом в высокой концентрации, показатель IL-6 был обнаружим (63.8 пг/мл), однако его значение оказалось на уровне или ниже уровня порога количественного обнаружения. Кроме того, в ходе гистопатологического исследования не было выявлено каких-либо признаков токсичного воздействия на носовые каналы, носовую полость, глотку, трахею и бронхи. На этом основании мы заключили, то воздействие на весь организм газообразного ДХ в концентрации, не превышающей 0,1 ppm, 24 часа в сутки, 7 дней в неделю в течение 6 месяцев не вызывает воспалительных процессов в органах дыхания у крыс.
В ходе биохимического и общего анализов крови мы наблюдали некоторые параметры со статистически значимыми изменениями. Однако почти все изменения указанных параметров не зависели от дозы вещества. Показатель EO%, который, как известно, повышается при аллергической реакции, такой как астма или заражение паразитическим членистоногими [24–27], имел статистически значимые различия в значениях для экспериментальной и контрольной групп. Но это изменение не зависело от дозы вещества и оказалось ниже в экспериментальной группе, по сравнению с контрольной. По нашему мнению, поскольку предположительный механизм действия ДХ – это окисление, то есть физико-химическая реакция, то токсичность, при условии ее наличия, должна была проявиться в зависимости от дозы вещества.
Таким образом, мы пришли к выводу о том, что статистически значимое изменение показателя EO% не является признаком токсичного воздействия газообразного ДХ. Наблюдалось статистически значимое изменение в значении BUN при воздействии высокой концентрации вещества на крыс-самок. При этом, по данным лаборатории Charles River по крысам породы Спраг Доули (SD) [28], стандартное значение ± стандартное отклонение значения BUN у крыс SD в возрасте 30 недель составляет 16,9 ± 1,9 мг/дл. Кроме того, средние значения в контрольной группе и в группе, которая контактировала с веществом в низкой концентрации, оказались ниже эталонного диапазона значений. Таким образом, мы пришли к выводу о том, что значение BUN у крыс-самок, которые подверглись воздействию вещества в высокой концентрации, находятся в пределах нормы без каких-либо признаков токсичного воздействия на организм.
В результате предыдущих исследований были установлены уровень LOAEL, равный 2,5 ppm при 30-дневном воздействии [17], уровень LOAEL, равный 1 ppm при воздействии в течение двух месяцев [18], уровень NOAEL, равный 5 ppm, и уровень LOAEL, равный ppm, при воздействии в течение 4 недель [19], а также уровень NOAEL 0,1 ppm при воздействии в течение 10 недель и уровень LOAEL, равный 10 ppm, при воздействии в течение 2 недель [20]. Все исследования проводились на крысах. Однако основной целью нашего исследования было доказательство того, что газообразный ДХ в концентрации до 0,1 ppm (которая превышает уровень эффективного воздействия на микроорганизмы) является безопасным, даже при длительном периоде контакта с веществом. В этой связи, даже несмотря на то, что мы не смогли определить обычные уровни NOAEL и/или LOAEL, наше исследование имеет определенную ценность, поскольку оно подтверждает, что концентрация газообразного ДХ, позволяющая эффективно бороться с микробами, не является токсичной.
Ранее было установлено, что газообразный ДХ в низкой концентрации служит профилактикой респираторного инфекционного заболевания in vivo, способен инактивировать кошачий калицивирус, вирус гриппа типа A, золотистый стафилококк и кишечную палочку in vitro [11–15]. Согласно упомянутым исследованиям, эффективность газообразного ДХ проявляется также и при концентрациях ниже 0,1 ppm. Таким образом, результаты нашего исследования указывают на то, что уровень газообразного ДХ, при котором он эффективен против болезнетворных организмов, может не являться токсичным для крыс, в связи с чем постоянное воздействие газообразного ДХ в низкой концентрации, не превышающей 0,1 ppm, может использоваться в качестве эффективного метода дезинфекции жилых или присутственных помещений, таких как жилые здания, офисы, здания аэропортов и больницы, несмотря на наличие некоторых факторов неопределенности, связанных, например, с межвидовыми различиями и индивидуальными особенностями, которые также необходимо принимать во внимание. Как следствие, более высокая доза или дозы могут применяться с целью выявления уровней LOAEL и NOAEL. Кроме того, могут потребоваться дополнительные токсикологические исследования, такие как исследования неблагоприятного воздействия на внутриутробное развитие или на репродуктивную функцию, которые позволят гарантировать безопасность постоянного применения газообразного ДХ в низкой концентрации в общественных помещениях в целях борьбы с различными болезнетворными организмами, передаваемыми воздушно-капельным путем или живущими на различных поверхностях.
Сокращения
ДХ: диоксид хлора; AST: аспартат-аминотрансфераза; ALT: аланин-аминотрансфераза; γ-GTP: гамма-глутамилтранспептидаза; TP: общий белок; ALB: альбумин; A/G: отношение альбумина к глобулину; BG: глюкоза в крови cose; TC: общий холестерин; TG: триглицерид; BUN: азот мочевины крови; IL-6: интерлейкин-6; TNF-α: фактор некроза опухолей-альфа; CRE: креатинин; CRP: C-реактивный белок; P: фосфор; CA: кальций; Na: натрий; K: калий; Cl: хлор; PT: время свертывания крови; APTT: активированное частичное тромбопластиновое время; RBC: количество красных кровяных телец; WBC: количество белых кровяных телец; Hb: концентрация гемоглобина: HTC: гематокрит; PLT: количество тромбоцитов; MCH: средняя концентрация гемоглобина в эритроците; NE%: процентное содержание нейтрофилов; EO%: процентное содержание эозинофилов; BA%: процентное содержание базофилов; MO%: процентное содержание моноцитов; LY%: процентное содержание лимфоцитов; BALF: бронхоальвеолярный смыв; BC: количество блуждающих клеток в BALF; WBC%: процентного содержания белых кровяных телец в BALF; LOAEL: уровень наименьшего наблюдаемого вредного воздействия; NOAEL: уровень ненаблюдаемого вредного воздействия.
Благодарности
Мы выражаем свою признательность Азусе Секи, Хирофуми Комаксубара (Hirofumi Komatsubara), Тошиюки Такашиме и Акихито Ватанабе за их советы и помощь, оказанную в проведении настоящего эксперимента. Мы также благодарим Фумихиро Озаву, Дайсуке Като, Казухико Тагучи и Шигео Асаду за технические консультации относительно системы генерации газообразного ДХ.
Подробные сведения об авторах
1 Taiko Pharmaceutical Co., Ltd., Суита-ши, Осака, Япония.
2 Отдел научных исследований, Taiko Pharmaceutical Co., Ltd., 3-34-14 Учихонмачи, Суита-ши, Осака 564-0032, ЯПОНИЯ.
Вклад авторов в написание статьи
AA выполнил перевод, редактуру и окончательную доработку рукописи; CL осуществлял общее руководство исследованием; HM участвовал в составлении плана исследования; TM занимался разработкой схемы и планированием исследования; NO участвовал в критическом анализе схемы исследования и рукописи; TS содействовал окончательному утверждению рукописи. Все авторы прочли и утвердили окончательную версию рукописи.
Конкурирующие интересы
Авторы заявляют об отсутствии у них конкурирующих интересов.
References
- Fukayama MY, Tan H, Wheeler WB, Wei CI: Reactions of aqueous chlorine and chlorine dioxide with model food compounds. Environ Health Perspect 1986, 69:267-274.
- Moran T, Pace J, McDermott EE: Interaction of chlorine dioxide with flour: certain aspects. Nature 1953, 171:103-106.
- Ogata N: Denaturation of protein by chlorine dioxide: oxidative modification of tryptophan and tyrosine residues. Biochemistry 2007, 46:4898-4911.
- Eleraky NZ, Potgieter LN, Kennedy MA: Virucidal efficacy of four new disinfectants. JAAHA 2002, 38:231-234.
- Foschino R, Nervegna I, Motta A, Galli A: Bactericidal activity of chlorine dioxide against Escherichia coli in water and on hard surfaces. J Food Protect 1998, 61:668-672.
- Li JW, Xin ZT, Wang XW, Zheng JL, Chao FH: Mechanisms of inactivation of hepatitis a virus in water by chlorine dioxide. Water Res 2004, 38:1514-1519.
- Sanekata T, Fukuda T, Miura T, Morino H, Lee C, Maeda K, Araki K, Otake T, Kawahata T, Shibata T: Evaluation of the antiviral activity of chlorine dioxide and sodium hypochlorite against feline calicivirus, human influenza virus, measles virus, canine distemper virus, human herpesvirus, human adenovirus, canine adenovirus and canine parvovirus. Biocontrol Sci 2010, 15:45-49.
- Kuroyama I, Osato S, Nakajima S, Kumota R, Ogawa T: Environmental monitoring and bactericidal efficacy of chlorine dioxide gas in a dental office. Biocontrol Sci 2010, 15:103-109.
- Rastogi VK, Ryan SP, Wallace L, Smith LS, Shah SS, Martin GB: Systematic evaluation of the efficacy of chlorine dioxide in decontamination of building interior surfaces contaminated with anthrax spores. Appl Environ Microbiol 2010, 76:3345-3351.
- Trinetta V, Morgan MT, Linton RH: Use of high-concentration-short-time chlorine dioxide gas treatments for the inactivation of Salmonella enteric spp. inoculated onto Roma tomatoes. Food Microbiol 2010, 27:1009-1015.
- Ogata N, Shibata T: Protective effect of low-concentration chlorine dioxide gas against influenza A virus infection. J Gen Virol 2008, 89:60-67.
- Ogata N, Shibata T: Effect of chlorine dioxide gas of extremely low concentration on absenteeism of schoolchildren. IJMMS 2009, 1:288-289.
- Mimura S, Fujioka T, Mitsumaru A: Preventive effect against influenza-like illness by low-concentration chlorine dioxide gas. Jpn J Environ Infect 2010, 25:277-280.
- Morino H, Fukuda T, Miura T, Lee C, Shibata T, Sanekata T: Inactivation of feline calicivirus, a norovirus surrogate, by chlorine dioxide gas. Biocontrol Sci 2009, 14:147-153.
- Morino H, Fukuda T, Miura T, Shibata T: Effect of low-concentration chlorine dioxide gas against surface bacteria and viruses on a glass surface in wet environment. Lett Appl Microbiol 2011, 53:628-634.
- US Department of Labor’s Occupational Safety and Health Administration: Occupational safety and health guideline for chlorine dioxide. 2006.
- Paulet G, Desbrousses S: On the action of ClO2 at low concentrations on laboratory animals. Arch Mal Prof 1970, 31:97-106.
- Paulet G, Desbrousses S: On the toxicology of chlorine dioxide. Arch Mal Prof 1972, 33:59-61.
- Paulet G, Desbrousses S: Actions of discontinuous exposure to chlorine dioxide (ClO2) on the rat. Arch Mal Prof 1974, 35:797-804.
- Dalhamn T: Chlorine dioxide toxicity in animal experiments and industrial risks. A M A Arch Ind Health 1957, 15:101-107.
- Gates D: The chlorine dioxide handbook. In Water Disinfection Series. Edited by: Cobban B, Murray P. Livingston A: American Water Works Association, Denver; 1998:.
- Shacter E, Arzadon GK, Williams J: Elevation of interleukin-6 in response to a chronic inflammatory stimulus in mice: inhibition by indomethacin. Blood 1992, 80:194-202.
- Walsh LJ, Trinchieri G, Waldorf HA, Whitaker D, Murphy GF: Human dermal mast cells contain and release tumor necrosis factor alpha, which induces endothelial leukocyte adhesion molecule 1. PNAS 1991, 88:4220-4224.
- Jatakanon A, Lim S, Barnes PJ: Changes in sputum eosinophils predict loss of asthma control. Am J Respir Crit Care Med 2000, 161:64-72.
- Pizzichini MM, Pizzichini E, Clelland L, Efthimiadis A, Pavord I, Dolovich J, Hargreave FE: Prednisone-dependent asthma: inflammatory indices in induced sputum. Eur Respir J 1999, 13:15-21.
- Plager DA, Stuart S, Gleich GJ: Human eosinophil granule major basic protein and its novel homolog. Allergy 1998, 53:33-40.
- Ushio H, Watanabe N, Kiso Y, Higuchi S, Matsuda H: Protective immunity and mast cell and eosinophil responses in mice infested with larval Haemaphysalis longicorni ticks. Parasite Immunol 1993, 15:209-214.
- Charles River Laboratories Japan Inc: Monitoring data within longtime feeding for Crl:CD (SD) rats. 2009 [http://www.crj.co.jp/pdf/info_common/62/2197210/survival_data_SD_mar_2009.pdf].
