Влияние малобелковой диеты, сбалансированной незаменимыми кето/аминокислотами и высокоэнергетической питательной смесью, на прогрессирование почечной недостаточности при додиализной хронической болезни почек, обусловленной системными заболеваниями
СтатьиОпубликовано в журнале, клиническая нефрология 1 - 2009 Ю.С. Милованов, Л.В. Лысенко, Л.Ю. Милованова, И.А. Добросмыслов
Клиника нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева ММА ИМ. И.М. Сеченова, Москва
Цель исследования. Оценка влияния малобелковой диеты (МЕЛ), сбалансированной незаменимыми кето/аминокислотами и высокоэнергетической питательной смесью на замедление почечной недостаточности у больных системными заболеваниями с додиализными стадиями хронической болезни почек (ХЕП).
Материалы и методы. 46 больных с III-IV стадиями ХЕП, обусловленной системными заболеваниями (33 системной красной волчанкой и 13 разными формами системных васкулитов), рандомизировали в 3 группы: 1 -я - 18 больных (10 с III и 8 с IV стадией) - за время наблюдения (24-48 месяцев) получали мел (0,6 г белка на кг/сут) с назначением оптимального комплекса всех незаменимых кето/аминокислот; 2-я - 18 больных (10 с III и 8 с IV стадиями) - получали также МЕЛ, но с увеличением содержания растительного белка до 0,3 г/кг/сут за счет высокоочищенного белка сои в составе высокоэнергетической питательной смеси; 3-я - 10 больных (7 с III и 3 с IV стадиями; группа сравнения) находились на свободной диете. оба варианта МЕЛ назначались всем больным 1-й и 2-й групп независимо от исходного нутритивного статуса. нутритивный статус пациентов оценивали на основании антропометрических данных и других, принятых для его оценки параметров. потребление белка и калорийность пищи рассчитывали по 3-дневным дневникам питания.
Результаты. Среди 46 больных системными заболеваниями с III—IV стадиями ХЕП нарушения нутритивного статуса выявлены почти у половины (45,7 %) больных. Оба варианта МЕЛ хорошо переносились, в результате их применения достигнута коррекция нутритивных нарушений у больных, у которых они были исходно, и достигнута профилактика нутритивных нарушений у остальных больных 1-й и 2-й групп. В то же время среди пациентов 3-й группы (контроль) по мере прогрессирования почечной недостаточности частота нарушений нутритивного статуса увеличилась в 1,5 раза (с 40 до 60 %). У больных, принимавших МЕЛ не менее года, нами отмечено замедление падения скорости КФ, более значимо - с добавлением высокоэнергетической смеси.
Предупреждение или максимальное отдаление терминальной стадии хронической болезни почек (ХБП) остается одной из важнейших проблем клинической нефрологии. Скорость прогрессирования почечной недостаточности у больных с ХБП зависит от ряда факторов, среди которых важное прогностическое значение имеют нарушения нутритивного статуса, оказывающие значительное влияние на выживаемость и уровень реабилитации этих больных [1—4]. Так, по данным Zakar G. [5], летальность в течение первого года диализной терапии составила 15 % среди больных, у которых концентрация сывороточного альбумина при поступлении на лечение гемодиализом была выше 3,5 г/дл, и 39 % среди больных с концентрацией сывороточного альбумина менее 3,0 г/дл.
В последние годы отмечено усиление интереса к диетическому лечению больных на додиализных стадиях ХБП. В небольших по численности исследованиях показано, что ограничение суточной квоты белка в еде до 0,6 г/кг/сут с назначением эссенциальных аминокислот (ЭАК) и их кетоаналогов (КА) предупреждает накопление токсических продуктов, уменьшает или отдаляет развитие терминальной уремии [5—7]. Вместе с тем результаты нескольких многоцентровых исследований, включавших большее число пациентов, в том числе широко известного исследования MDRD (Modification of Diet in Renal Disease), не дают твердых оснований для столь однозначного вывода [8—10]. Различие результатов объясняют сложностями в организации МБД (0,6 г/кг/сут), особенно массовой, и одновременно в обеспечении достаточной калорийности пищи (не менее 35 ккал/кг/сут). При дефиците энергии нарушается не только всасывание в желудочно-кишечном тракте ЭАК и КА, но и трансформация КА в организме в ЭАК [11].
В клинической практике последних лет для профилактики нарушений нутритивного статуса у больных ХБП при снижении суточной квоты белка в еде до 0,6 г/кг/сут в пищевой рацион вводят высокоэнергетические питательные смеси, сбалансированные по содержанию незаменимых аминокислот [12].
Диетотерапия больных ХБП нуждается в дальнейшей оптимизации; в частности, мало изученными остаются причины большой частоты нарушений нутритивного статуса у больных системными заболеваниями (системные васкулиты, СКВ) с ХБП на додиализном этапе. Целью нашего исследования была оценка способности МБД, сбалансированной незаменимыми кето/аминокислотами и высокоэнергетической питательной смесью, замедлять развитие почечной недостаточности у больных системными заболеваниями на додиализных стадиях ХБП.
Материал и методы
В исследование включены 46 больных системными заболеваниями с III—IV стадиями ХБП - 33 системной красной волчанкой (СКВ) и 13 различными системными васкулитами.
В зависимости от количества потребляемого белка в рационе и соотношения в нем животного и растительного белка пациенты были разделены на 3 группы. 1-ю группу составили 18 больных (10 с III и 8 с IV стадиями), у которых применили вариант № 1 диеты с содержанием белка 0,6 г/кг/сут -0,4 г/кг белка животного происхождения и 0,2 г/кг/сут пищевого растительного белка. Во 2-ю группу включены 18 больных (9 с III и 9 с IV стадиями), у них использовали вариант № 2 диеты с тем же общим содержанием белка, но с увеличением количества растительного белка до 0,3 г/кг за счет добавления в пищу высокоочищенного соевого белка (изолята). Больным и первой и второй групп обязательно назначали оптимальный комплекс всех ЭАК и КА из расчета 0,1 г/кг/сут. В 3-ю группу (группа сравнения) включены 10 больных (7 с III и 3 c IV стадиями). Больные из группы сравнения за время наблюдения (24-48 мес.) по личной мотивации находились на обычной диете (содержание белка - 1,1-1,3 г/кг/сут). Калорийность пищевого рациона в диете № 1 в среднем составила 33 ккал/кг/сут, в диетах № 2 и 3 - 34 ккал/кг/сут. Группы были равноценны по выраженности АД и протеинурии. Атигипертензивная терапия включала фозиноприл в дозе 5-10 мг/сут и петлевые диуретики (табл. 1).
Таблица 1. Распределение больных в зависимости от стадии ХБП
| Группы больных | ХБП III стадии (СКФ 30-59 мл/мин/1,73 м2) * | ХБП IV стадии (СКФ 15-29 мл/мин/1,73 м2) |
| подгруппы/число больных | ||
| 1-я группа (n = 18). Диета № 1 | 10 | 8 |
| 2-я группа (n = 18). Диета № 2 | 9 | 9 |
| 3-я группа (группа сравнения) (n = 10). Обычное питание | 6 | 4 |
| Всего | 25 | 21 |
| Итого | 46 | |
* СКФ — скорость клубочковой фильтрации.
У обследованных больных наблюдалось рецидивирующее течение нефрита, у части больных (10 - СКВ, 1 - криоглобулинемическим васкулитом, 2 - микроскопическим полиартериитом, 2 - гранулематозом Вегенера) в анамнезе были обострения, клинически протекающие по типу быстропрогрессирующего нефрита, но в период проведения исследования тяжелого обострения заболевания у них не наблюдалось.
Для изучения нутритивного статуса использованы антропометрические данные - ИМТ (индекс массы тела), толщину КЖСТ (кожно-жировой складки над трицепсом), ОМП (окружность мышц плеча), абсолютное число лимфоцитов, уровень альбумина и трансферрина крови. Оценку потребления белка и калорийность пищи рассчитывали по 3-дневным дневникам питания, где сам больной подробно записывает свой дневной рацион с указанием количества белка и калорий.
При расчете почечной выживаемости за конечную точку принимали снижение СКФ < 15 мл/мин/1,73 м2 или начало заместительной почечной терапии.
Результаты и обсуждение
Среди 46 больных системными заболеваниями с III-IV стадиями ХБП нарушения нутритивного статуса выявлены почти у половины (21/45,7 %) больных (табл. 2).
Таблица 2. Частота выявления нарушения нутритивного статуса в зависимости от степени почечной недостаточности (стадии ХБП)
| Группы больных | СКФ (30-59 мл/мин/1,73 м2) | СКФ (15-29 мл/мин/1,73 м2) |
| число больных (абс.,%) | ||
| 1-я группа, % (n = 18) | 40 (4/10) | 62,5 (5/8) |
| 2-я группа, % (n = 18) | 55,5 (5/9) | 33,3 (3/9) |
| 3-я группа (группа сравнения), % (n = 10) | 33,3 (2/6) | 50,0 (2/4) |
| Всего, % (n = 46) | 57,1 (12/21) | 36,0 (9/25) |
В отличие от больных хроническим гломерулонефритом, у которых нутритивные нарушения выявлялись только на IV стадии ХБП [12], во всех группах больных системными заболеваниями нарушения нутритивного статуса начинали выявляться уже на III стадии и нарастали по мере прогрессирования почечной недостаточности к IV стадии ХБП.
Ранее нами было продемонстрировано влияние на уменьшение ИМТ как интегрального показателя нутритивных нарушений у больных ХБП, низкой калорийности питания, тяжести почечной недостаточности, а при системных заболеваниях также высокой протеинурии и продолжительности кортикостероидной терапии [12].
В настоящем исследовании в 1-й и 2-й группах всем больным, включая тех, у которых были выявлены нарушения нутритивного статуса, без предшествующей коррекции нутритивных нарушений были назначены диеты № 1 и 2 соответственно. Мы попытались ответить на основной вопрос исследования: способна ли МБД с назначением препарата незаменимых ЭАК и КА, исправить существующие нутритивные нарушения и обеспечить профилактику нарушений нутритивного статуса у больных системными заболеваниями, при этом затормозить прогрессирование ХБП, а также возможно ли усиление благоприятных эффектов МБД с помощью частичной замены в диете больных животного белка соевым изолятом?
Диеты № 1 и 2 вполне удовлетворительно переносились больными, что документально подтверждалось их записями в дневниках питания. Этим объясняется приверженность больных к лечению: большинство из них могли принимать диеты № 1 и 2 длительно - до 1,5 лет. При этом у больных с анорексией (обычно при СКФ менее 25 мл/мин,1,73 м2) применение диет № 1 и 2 привело к существенному уменьшению анорексии, прежде всего у больных, в рационе которых животный белок был частично заменен на высокоочищенный белок сои. В результате через 3 месяца от начала применения этих диет в группе больных с исходно выявленными нутритивными нарушениями достигнута нормализация основных показателей нутритивного статуса как у женщин, так и мужчин, у которых нарушения были более выражены. У пациентов, принимавших диету № 2, нормализация массы тела и других показателей нутритивного статуса происходила более быстро, при этом изменение нутритивных показателей к концу 3 месяцев было более значимым, чем при использовании диеты № 1 (табл. 3).
Таблица 3. Динамика основных показателей нутритивного статуса у больных с iii-iv стадиями ХБП с исходными нарушениями нутритивного статуса при использовании МБД № 1 и 2 (N = 17)
| Показатель | Диета № 1 (n = 9) | Диета № 2 (n = 8) | ||
| в начале исследования | через 3 месяца | в начале исследования | через 3 месяца | |
| ИМТ, кг/м2 | 17,9 ± 0,2 (18,2-17,5) | 20,6 ± 0,62 ** Δ 2,7 (21,9-18,8) | 17,2 ± 0,4 (18,1-16,5) | 20,7 ± 0,82 ** Δ 3,5 (22,0-19,0) |
| КЖСТ, мм | М 9,0 ± 0,1 (9,1-8,9) Ж 12,1 ± 0,2 (12,6-11,8 ) | М 9,9 ± 0,2 ** Δ 0,9 (9,6-10,3) Ж 13,5 ± 0,12 * Δ 1,4 (13,2-13,9) | М 8,5 ± 0,1 (8,9-8,1) Ж 11,5 ± 0,4 (12,3-10,9 ) | М 9,9 ± 0,2 ** Δ 1,4 (9,5-10,4) Ж 13,1 ± 0,3 * Δ 1,6 (13,4-12,0) |
| ОМП, см | М 21,4 ± 0,3 (21,9-20,8) Ж 20,9 ± 0,27 (21,0-20,4) | М 23,1 ± 0,21 ** Δ 1,7 (23,4-22,9) Ж 22,1 ± 0,15 ** Δ 1,2 (22,4-21,9) | М 20,2 ± 0,6 (21,5-19,1) Ж 18,5 ± 0,67 (19,7-17,4) | М 23,1 ± 0,2 ** Δ 2,9 (23,4-21,2) Ж 21,2 ± 0,2 ** Δ 2,7 (21,4-20,9) |
| Сывороточный альбумин, г/л) | 3,2 ± 0,12 (3,5-3,0) | 3,8 ± 0,09 * Δ 0,6 (4,1-3,5) | 2,9 ± 0,11 (3,2-2,8) | 3,7 ± 0,08 * Δ 0,8 (3,8-3,5) |
| Сывороточный трансферрин, мг/дл | 169,7 ± 2,03 (175-164) | 190,3 ± 2,3 * Δ 20,6 (195-186) | 163,5 ± 2,95 (169-158) | ,4 ± 3,38 * Δ 32,9 (200-190) |
| Абсолютное число лимфоцитов крови | 1689,3 ± 21,33 (1750-1618) | 1895,3 ± 26,29 ** Δ 206 (1956-1830) | 1433,5 ± 115,99 (1655-1218) | 1931,3 ± 38,4 **Δ 497,8 (2000-1830) |
Различия с исходным уровнем (Δ) статистически значимы. *p < 0,05; **p < 0,01.
За тот же период среди 10 больных группы сравнения у 4 с диагностированными в период скрининга нарушениями нутритивного статуса начальной степени, несмотря на свободную диету без ограничения белка, произошло нарастание нутритивньгх нарушений и ухудшение самочувствия. По мере прогрессирования почечной недостаточности к IV стадии ХБП частота нарушений нутритивного статуса увеличилась в 1,5 раза (с 40 до 60 %).
Для оценки влияния МБД на прогрессирование хронической почечной недостаточности мы сопоставили кривую падения СКФ в группе больных, получавших малобелковые диеты № 1 и 2 и в контрольной группе больных, принимавших обычную диету (табл. 4, рисунок).
Таблица 4. Влияние разных вариантов МБД на скорость прогрессирования почечной недостаточности у больных ХБП на додиализном этапе
| Варианты диет/число больных | СКФ мл/мин/1,73 м2 (M ± m) | ||||||||||
| период наблюдения, годы | скрининг | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | |||||
| Диета № 1 (n = 20) | 30,1 ± 0,42 | 28,4 ± 0,62 (1,7) | 26,7 ± 0,28 (3,4) | 25,0 ± 0,38 (5,1) | 23,3 ± 0,32 (6,8) | 22,1 ± 0,43 (8,0) | |||||
| Диета № 2 (n = 20) | 29,9 ± 0,7 | 28,3 ± 0,37 (1,6) | 26,7 ± 0,39 (3,2) | 25,1 ± 0,44 (4,8) | 23,5 ± 0,42 (6,4) | 22,1 ± 0,34 (7,8) | |||||
| Обычное питание (n = 10) | 30,0 ± 0,29 | 27,9 ± 0,34 (2,1) | 26,0 ± 0,47 (4,0) | 23,5 ± 0,39 (6,5) | 22,0 ± 0,37 (8,0) | 19,8 ± 0,22 (10,2) | |||||
В скобках — скорость падения клубочковой фильтрации — Л СКФ.
Рис. Влияние диет № 1 и 2 и обычного питания на скорость прогрессирования почечной недостаточности у больных ХБП III—IV стадий
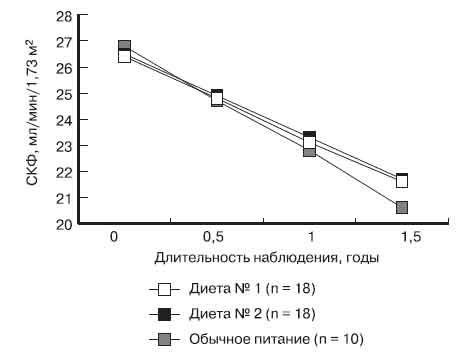
У 10 больных группы контроля к концу года кривая падения СКФ была близкой к расчетной - 4 мл/мин/год. Именно двое из троих больных группы контроля поступили к концу 1,5 лет наблюдения на лечение ГД. У больных, принимавших малобелковые диеты не менее года, нами отмечено замедление падения скорости КФ по сравнению с расчетной - в среднем на 0,75 мл/мин/год при применении диеты № 1 и на 0,8 мл/мин/год - при применении диеты № 2.
Исходя из этих расчетов можно полагать, что применение диет № 1 и 2 у больных ХБП IV стадии при исходной скорости СКВ 26 мл/мин приведет в течение 4 лет к увеличению додиализного периода соответственно на 11 и 12 месяцев.
У всех 36 больных, в пищевой рацион которым назначались кетоаналоги незаменимых аминокислот, являющиеся кальциевыми солями (не содержащими фосфор) и способствующими связыванию фосфатов в кишечнике и их выведению из организма, отмечено существенное снижение гиперфосфатемии. Уменьшение выраженности гиперфосфатемии у больных с III—IV стадиями ХБП имеет важное значение. Как свидетельствуют данные литературы [1, 13, 14], гиперфосфатемия вызывает увеличение секреции паратиреоидного гормона с гиперкальциемией и развитием вторичного гиперпаратиреоза. Снижение гиперфосфатемии более значимым было среди больных 2-й группы, чем 1-й, то есть замена в МБД части животного белка на высокоочищенный белок сои с низким содержанием фосфатов позволяет более эффективно контролировать гиперфосфатемию, предупреждать развитие вторичного гиперпаратиреоза. В то же время у всех 10 больных группы контроля, которые не ограничивали белок в еде и не принимали препаратов незаменимых кето/аминокислот, гиперфосфатемия нарастала. Наши данные (табл. 5) согласуются с результатами исследования Mitch W., Clark A. [15] о возможности при соблюдении МБД и приеме КА достичь реутилизации азота мочевины для синтеза незаменимых аминокислот из их кетоаналогов со снижением азотемии.
Таблица 5. Влияние мбд № 1 и 2 на гиперфосфатемию и гиперазотемию у обследованных больных (N = 36)
| Показатель | Норма | МБД № 1 (n=18) | МБД № 2 (n=18) | ||
| в начале исследования | через 12 месяцев | в начале исследования | через 12 месяцев | ||
| Фосфор сыворотки крови, мг/дл | 2,5—5,5 | 6,80 ± 0,55 (5,8—7,8) | 5,00 ± 0,29 (4,5—5,8) ** | 6,90 ± 0,42 (5,7—7,9) | 4,70 ± 0,23 (4,0—5,2) ** |
| Азот сыворотки крови, мг/дл | 10—20 | 67,40 ± 5,11 (55—75) | 53,80 ± 4,04 (45—60) * | 69,70 ± 3,12 (65—74) | 48,20 ± 2,03 (40—54) ** |
**p < 0,01.
В нашем наблюдении МБД с добавлением в пищу смеси высокоочищенного белка сои (№ 2) и назначением незаменимых кето/ аминокислот (№ 1 и № 2) и при длительном использовании (не менее 12 месяцев) способствовали у 36 больных (18 больных 1-й группы и 18 — 2-й) с дислипидемией снижению плазменного уровня общего холестерина и холестерина ЛНП, триглицеридов и, при этом — повышению содержание холестерина ЛВП (табл. 6).
Таблица 6. Влияние МБД № 1 и 2 на показатели обмена липидов у больных с дислипидемией на додиализном этапе ХБП (N = 36)
| Показатель | Норма | МБД № 1 (n = 18) | МБД № 2 (n = 18) | ||
| в начале исследования | через 12 месяцев | в начале исследования | через 12 месяцев | ||
| Холестерин общ. сыворотки крови (мг/дл) | 150—250 | 280,00 ± 8,57 260,0—300,0 | 197,30 ± 10,45 * 180,0—230,0 | 276,00 ± 6,48 265,0—290,0 | 201,70 ± 9,34 * 185,0—235,0 |
| Холестерин ЛНП сыворотки крови (мг/дл) | 100—160 | 170,90 ± 4,94 162,0—180,0 | 143,20 ± 6,18 * 133,0—154,0 | 174,90 ± 5,26 161,0—150,0 | 140,50 ± 5,95 * 129,0—150,0 |
| Холестерин ЛВП сыворотки крови (мг/дл) | 35—75 | 28,70 ± 1,34 26,4—33,0 | 66,80 ± 1,35 * 63,1—68,8 | 27,90 ± 0,68 27,0—30,5 | 68,2 ± 4,0 * 58,0—75,0 |
| Триглицериды сыворотки крови (мг/дл) | 50—150 | 169,60 ± 9,78 156,0—178,0 | 101,30 ± 8,05 * 86,5—115,0 | 172,90 ± 4,21 160,0—180,0 | 97,40 ± 12,28 * 85,0—119,0 |
*p < 0,01.
По некоторым данным [1, 7], МБД с добавлением высокоочищенного белка сои и назначением незаменимых кето/ аминокислот оказывает и другие метаболические эффекты, которые не изучались в нашей работе — уменьшение экскреции альбумина, падение в плазме концентрации щавелевой кислоты, пролактина, свободных радикалов и повышение тестостерона, витамина D3. Все эти эффекты замедляют прогрессирование атеросклероза, уменьшают проявления ренальной остеодистрофии по данным трепанобиопсий кости [1, 14].
Таким образом, нарушения нутритивного статуса являются одним из частых осложнений ХБП у больных системными заболеваниями, достигая 36 % на III и 57 % на IV стадии, среди больных хроническим гломерулонефритом нутритивные нарушения выявлялись только на IV стадии ХБП и у меньшего числа (28,3 %) больных [12]. Высокий риск развития нутритивных нарушений среди больных системными заболеваниями кроме общих для ХБП факторов риска обусловлен факторами активности болезни (повышение уровня воспалительных цитокинов) и продолжительностью кортикостероидной терапии.
Первичная профилактика белково-энергетической недостаточности у больных с ХБП III—IV стадий традиционно включает ограничение потребления белка с обязательным приемом комплекса незаменимых аминокислот и их кетоаналогов. МБД, сбалансированная амино- и кетокислотами, предупреждает накопление токсических продуктов, уменьшает или отдаляет появление уремической диспепсии, в то время как питание без ограничения белка, усугубляя диспепсию, способно индуцировать нутритивные нарушения [1, 7, 13].
Следует, однако, иметь в виду, что прием амино- и кетокислот требует адекватных энергетических затрат. Энергия необходима не только для всасывания в желудочно-кишечном тракте амино- и кетокислот, но и для конверсии кетокислот в полноценные незаменимые аминокислоты [11]. Обеспечение достаточной калорийности пищи часто затруднительно для больных, поскольку предусматривает тесный контакт с нефрологом-диетологом, приобретение дополнительных знаний больным и по диетологии, увеличение затрат времени на выбор продуктов питания и приготовление блюд. Включение в рацион питания высокоэнергетической смеси, приготовленной на основе очищенного соевого белка (изолята), значительно упрощает составление и точно обеспечивает необходимое количество высококалорийного питания больных. Небелковая калорийность смеси достигается за счет медленновсасывающихся углеводов (мальтодекстрин), которые не вызывают повышения уровня сахара в крови, и растительных жиров (соевых и пальмовых), которые не только не повышают уровень холестерина, но и представляют собой доступный источник калорий у истощенных больных с нарушением абсорбции жира. Общая калорийность 100 г смеси составляет 405 ккал (1693 кДж).
Соотношение в пищевом рационе больного животного и высокоочищенного соевого белка зависит от пищевых вкусов и привычек пациента. По нашим данным у пациентов, приверженных к использованию преимущественно растительного белка, а также у больных с анорексией (обычно при СКФ менее 25 мл/мин,1,73 м2) целесообразно увеличение содержания высокоочищенного соевого белка до 0,3 г/кг/сут. Белок сои в меньшей степени, чем белок животного происхождения (мясо, рыба, молоко и др.), способен повышать гиперперфузию и гиперфильтрацию в ремнантных нефронах [12]. Как свидетельствуют наши данные, МБД (0,6 г белка/кг массы тела/сут) с частичной заменой животного белка на высокоочищенный белок сои в составе высококалорийной смеси и с назначением комплекса незаменимых кето/аминокислот позволяет добиться замедления снижения СКФ на 0,8 ± 0,03 мл/мин/1,73 м2, обеспечивает профилактику развития белково-энергетической недостаточности у больных системными заболеваниями с ХБП. Такой вариант МБД показан прежде всего больным с IV стадией ХБП, имеющим расстройства пищеварения, обусловленные уремией, а также больным системными заболеваниями, начиная уже с III стадии ХБП, если у них сохраняется активность болезни.
Литература
1. K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification, and Stratification. Am J Kidney Dis 2002;39(Suppl. 1).
2. Klahr S, Levey AS, Beck GJ, et al. for the Modification of Diet on Renal Disease Study Group: The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. N Engl J Med 1994;330:877-84.
3. Kasiske BL, Lacatua JDA, Ma JZ, et al. A meta-analysis of the effects of dietary protein restriction on the rate of decline in renal function. Am J Kidney Dis 1998;31:954-61.
4. Милованов Ю.С. Хроническая почечная недостаточность. В кн.: Рациональная фармакотерапия / Под ред. Н.А. Мухина, Л.В. Козловской, Е.М. Шилова. М., 2006;13:586-601.
5. Zakar G. The effect of ketoacid supplement on the course of chronic renal failure and nutritional parameters in predialysis patients and patients on regular dialysis theraphy: the Hungarian ketosteril cohort study. Wien Klin Wschr 2001;113:S686-S694.
6. Walser M, Hill SB, Ward L, et al. A crossover comparison of progression of chronic renal failure: Ketoacids versus amino acids. Kidney Int 1993; 43:933-39.
7. Ермоленко В.М., Козлова Т.А., Михайлова Н.А. Значение малобелковой диеты в замедлении прогрессирования хронической почечной недостаточности // Нефрология и диализ. 2006. № 4. С. 310—320.
8. Modification of Diet in Renal Disease (MDRD) Study Group (prepared by Levey A.S., Adler S., Caggiula A.W., England B.K., Grerne T., Hunsicker L.G., Kusek J.W., Rogers N.L., Teschan P.E.): Effects of dietary protein restriction on moderate renal disease in the Modification of Diet on Renal Disease Study. J Am Soc Nephrol 1996;7:2616-26.
9. Modification of Diet on Renal Disease Study Group (prepared by Teschan P.E., Beck G.J., Dwyer J.T., Greene Т., Klahr S., Levey A.S., Mitch W.E., Snetselaar L.G., Steinman T., Walser M.): Effect of ketoacid-amino acid-supplemented very low protein diet on the progression of advanced renal disease: A reanalysis of the MDRD feasibility study. Clin Nephrol 1998;501:273-83.
10. Fouque D, Wang P, Laville M, et al. Low-protein diet delay end stage renal disease in non diabetic adults with chronic renal failure. NDT 2000; 15:1986-92.
11. Laouari D, kloinknecht C, Broyer M. Utilisation drs krtoanalodues d,acides amines dans l,insuffisance renale chronique. Nephrologie 1986;7:133-37.
12. Милованов Ю.С., КозловскаяЛ.В., МиловановаЛ.Ю. Нефропротективное значение ранней коррекции нарушений нутритивного статуса у больных с хронической болезнью почек на додиализном этапе // Терапевтический архив. 2008. № 6. С. 56-60.
13. Мухин Н.А., Тареева И.Е., Шилов Е.М. Диагностика и лечение болезней почек. М., 2002. 381 c.
14. Bergesio F, Monzani G, Guasparini A, et al. Cardiovascular risk factors in severe chronic renal failure: the role of dietary treatment. Clin Nephrol 2005;64:103-12.
15. Mich W, Clark A. Specifity of the effect of leucin and its metabolites on protein degradation in skeletal muscle. Biochem J 1984;222:579-86.
16. Duenbas M, Draibe S, Avesani C, et al. Influence of renal function on spontaneous dietary intake and on nutritional status of chronic renal insufficiency patients. Europ. J Clin Nutr 2003;57:1473-78.
Комментарии
ПРАКТИКА ПЕДИАТРА
