Вопросы безопасности терапии рофлумиластом у пациентов с ХОБЛ
СтатьиОпубликовано в журнале:
АтмосферА. Пульмонология и аллергология 1, 2013
С.Н. Авдеев Сергей Николаевич Авдеев – профессор, зам. директора НИИ пульмонологии ФМБА России, Москва. Рофлумиласт является первым и пока единственным ингибитором фосфодиэстеразы-4, зарегистрированным в качестве препарата дополнительной терапии у больных тяжелой хронической обструктивной болезнью легких (ХОБЛ) с симптомами кашля и продукцией мокроты, частыми обострениями, уже получающих терапию длительнодействующими бронходилататорами. Рофлумиласт является перспективным препаратом для лечения больных ХОБЛ с сопутствующим метаболическим синдромом, что связано с двумя его благоприятными эффектами: снижением избыточной массы тела у пациентов с ожирением и улучшением гликемического профиля у больных сахарным диабетом 2-го типа. Терапия рофлумиластом у больных ХОБЛ приводит к снижению на 35% риска развития сердечно-сосудистых событий (сердечно-сосудистой летальности, нефатального инфаркта миокарда и нефатального инсульта).
Ключевые слова: хроническая обструктивная болезнь легких, рофлумиласт, метаболический синдром, сердечнососудистые события.
Относительно недавно в небольшой список лекарственных препаратов, применяемых для длительной поддерживающей терапии хронической обструктивной болезни легких (ХОБЛ), был включен новый препарат рофлумиласт (РМ) – Даксас [1]. Рофлумиласт и его активный метаболит N-оксид РМ являются селективными ингибиторами фермента фосфодиэстеразы-4 (ФДЭ-4), механизм действия которых проявляется в снижении активации воспалительных клеток [2]. Препарат зарегистрирован для применения в Европейском союзе в 2010 г., а в России – в 2011 г. для больных ХОБЛ стадии 3 и 4 по классификации GOLD 2007 г. (объем форсированного выдоха за 1-ю секунду (ОФВ1) <50% после ингаляции бронходилататора) с частыми обострениями, несмотря на корректное использование длительнодействующих бронходилататоров. В США в настоящее время РМ зарегистрирован как “препарат для снижения риска обострений у пациентов с ХОБЛ тяжелого течения с хроническим бронхитом и частыми обострениями в анамнезе” [3]. В соответствии с современными рекомендациями GOLD (2013) РМ рассматривается как дополнение к комбинации ингаляционного глюкокортикостероида (ИГКС) и длительнодействующего β2-агониста (ДДБА) или к длительнодействующему антихолинергическому препарату (ДДАХП) у пациентов с тяжелой или очень тяжелой бронхиальной обструкцией и высоким риском обострений (группы С и D по новой классификации GOLD) [1].
Данные о клинической эффективности РМ
Основной механизм действия РМ при ХОБЛ связан с угнетением воспалительной реакции дыхательных путей. В исследованиях in vitro продемонстрирована способность препарата и его активного метаболита N-оксида РМ подавлять функцию многих типов клеток, в том числе нейтрофилов, моноцитов, макрофагов, CD4+- и CD8+ T-лимфоцитов, клеток эндотелия, эпителия, гладкомышечных клеток и фибробластов [4]. D.C. Grootendorst et al. в клиническом исследовании выявили, что терапия РМ у больных ХОБЛ в течение 4 нед приводит к улучшению функциональных показателей и к снижению в мокроте количества воспалительных клеток, таких как нейтрофилы, лимфоциты и эозинофилы [5]. Кроме того, на фоне терапии РМ отмечено уменьшение концентрации воспалительных маркеров – нейтрофильной эластазы, интерлейкина-8 (ИЛ-8), эозинофильного катионного белка и α2-макроглобулина [5].
Препарат не обладает прямыми бронхорасширяющими свойствами, однако благодаря своим противовоспалительным эффектам способен улучшать функциональные показатели при ХОБЛ [6]. У больных ХОБЛ с продуктивным кашлем терапия РМ приводила к улучшению качества жизни, связанного со здоровьем, уменьшению одышки и снижению потребности в препаратах для купирования симптомов [7].
Практически во всех проведенных плацебоконтролируемых исследованиях частота среднетяжелых и тяжелых обострений ХОБЛ на фоне терапии РМ была достоверно ниже (на 14–17%), чем на фоне использования плацебо [8, 9]. Эффект РМ был более выражен у больных с бронхитическим фенотипом ХОБЛ (снижение частоты обострений на 26% по сравнению с показателем группы плацебо), с частыми обострениями ХОБЛ (снижение частоты обострений на 22% по сравнению с показателем группы плацебо) и у больных, получавших одновременно ИГКС (снижение частоты обострений на 19%) [8]. J.A. Wedzicha et al. продемонстрировали, что среди больных с частыми обострениями через 1 год терапии обострения оставались частыми в 32,0% случаев при лечении РМ по сравнению с 40,8% в группе плацебо (отношение риска (ОР) 0,799, p = 0,0148) (рис. 1) [10].
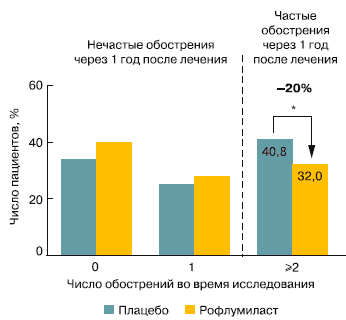
Рис. 1. Значительное снижение частоты обострений ХОБЛ при терапии РМ в течение 1 года (по [10]). * ОР 0,799, p = 0,0148.
Таким образом, впервые было показано, что противовоспалительная терапия РМ позволяет изменить фенотип заболевания: перевести пациента из фенотипа с частыми обострениями в более стабильный фенотип с нечастыми обострениями.
Препарат хорошо сочетается с другими известными лекарственными средствами, используемыми для длительной поддерживающей терапии ХОБЛ, и при этом можно говорить о его синергическом эффекте с ДДБА, ДДАХП и ИГКС [7, 11, 12].
Данные о безопасности РМ
Судить о безопасности терапии РМ сегодня можно на основании результатов рандомизированных контролируемых исследований (РКИ), включавших довольно большую выборку больных ХОБЛ. Из наиболее частых нежелательных явлений (НЯ) терапии этим препаратом можно отметить диарею, тошноту, снижение аппетита, снижение массы тела и головную боль [13, 14].
Управление по контролю качества пищевых продуктов, лекарственных препаратов и косметических средств США (FDA) опубликовало данные совокупного анализа, основанного на результатах 14 плацебоконтролируемых исследований II и III фаз, которые составили так называемый “пул безопасности ХОБЛ” [15]. Этот пул включал приблизительно 12 тыс. больных ХОБЛ, из которых более половины получали РМ в дозе 500 мкг 1 раз в сутки (5766 пациентов (88%)) или 250 мкг 1 раз в сутки (797 пациентов (12%)). Среди больных, получавших 500 мкг/сут РМ, 1232 пациента принимали препарат как минимум 1 год, 1081 пациент – от 6 до 12 мес, 2081 пациент – от 3 до 6 мес и 1370 пациентов – менее 3 мес [14]. Наиболее частым НЯ РМ была диарея – 10,1% по сравнению с 2,6% в группе плацебо (табл. 1).
Таблица 1. Частота развития НЯ (абс. (%)): анализ объединенных данных (по [14, 15])
| Побочные эффекты | Плацебо (n = 5491) | РМ 500 мкг (n = 5766) |
| Все НЯ | 3447 (62,8) | 3873 (67,2) |
| Серьезные НЯ | 782 (14,2) | 781 (13,5) |
| Смерть | 86 (1,6) | 84 (1,5) |
| НЯ, которые, по мнению исследователя, связаны с приемом препарата | 294 (5,4) | 1003 (17,4) |
| Прекращение приема препарата из-за НЯ | 503 (9,2) | 824 (14,3) |
| Инфекции назофарингит бронхит инфекции верхних дыхательных путей пневмония грипп | 1508 (27,5) 346 (6,3) 192 (3,5) 234 (4,3) 110 (2,0) 132 (2,4) | 1492 (25,9) 364 (6,3) 177 (3,1) 219 (3,8) 104 (1,8) 145 (2,5) |
| Желудочно-кишечные расстройства диарея тошнота | 143 (2,6) 79 (1,4) | 585 (10,1) 297 (5,2) |
| Снижение массы тела | 101 (1,8) | 394 (6,8) |
| Респираторные расстройства ХОБЛ одышка | 1271 (23,1) 120 (2,2) | 1142 (19,8) 84 (1,5) |
| Мышечно-скелетные расстройства боли в спине | 117 (2,1) | 176 (3,1) |
| Неврологические проблемы головная боль головокружение | 110 (2,0) 65 (1,2) | 266 (4,6) 139 (2,4) |
| Нарушения метаболизма и питания снижение аппетита | 22 (0,4) | 125 (2,2) |
| Психические расстройства бессонница | 50 (0,9) | 148 (2,6) |
| Сосудистые расстройства гипертензия | 136 (2,5) | 95 (1,6) |
Большинство НЯ носили легкий и умеренный характер, возникали чаще всего в первые недели приема препарата и разрешались в ходе его дальнейшего приема [16]. Считается, что причиной желудочно-кишечных НЯ является угнетение изоформы фермента ФДЭ-4D в головном мозге. Например, другой ингибитор ФДЭ-4 – циломиласт, разработка которого уже прекращена из-за развития выраженных диспептических явлений, проявлял в 10 раз большую избирательность к ФДЭ-4D, чем к другим изоформам фермента. Более хорошая переносимость РМ объясняется отсутствием у него селективности по отношению к ФДЭ-4D.
У больных ХОБЛ, получавших терапию РМ, чаще, чем в группе плацебо, отмечалось снижение массы тела. После отмены препарата масса тела у большинства пациентов восстановилась в течение 3 мес. Таким образом, у лиц с пониженным нутритивным статусом необходимо контролировать массу тела во время каждого визита.
Перспективы использования РМ при метаболическом синдроме
По данным недавно проведенного отечественного исследования, распространенность метаболического синдрома (МС) у больных ХОБЛ составляет примерно 24% [17]. Сочетание МС и ХОБЛ обусловливает более тяжелое течение ХОБЛ, увеличение частоты сердечно-сосудистых событий (ССС) в более раннем возрасте (в среднем на 30%), повышение летальности (приблизительно в 2 раза), преимущественно от сердечно-сосудистых причин [17]. В основе прогрессирования ХОБЛ на фоне МС и формирования ССС лежат инсулинорезистентность и дислипидемия, что приводит к эндотелиальной дисфункции, реологическим нарушениям, которые, в свою очередь, способствуют быстрому развитию ишемической болезни сердца (ИБС) и хронической ишемической болезни мозга [17–19].
Перспективы применения РМ при МС связаны с двумя благоприятными эффектами препарата – снижением избыточной массы тела у пациентов с ожирением и улучшением гликемического профиля у больных сахарным диабетом (СД) 2-го типа.
В годичных РКИ у больных ХОБЛ, принимавших РМ, наблюдалось снижение массы тела в среднем на 2,09 кг (в группе плацебо отмечалась прибавка массы тела в среднем на 0,08 кг; p 30 кг/м2) (рис. 2) [9, 20].
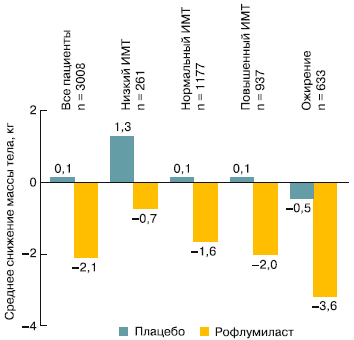
Рис. 2. Наибольшее снижение массы тела у более полных пациентов при терапии РМ (по [9]).
Биоимпедансным методом были выявлены минимальные изменения индекса безжировой массы тела, т.е. снижение массы тела на фоне терапии РМ обусловлено преимущественным уменьшением жировой массы и не связано со снижением мышечной массы тела.
Одной из неожиданных находок в проведенных клинических исследованиях стало благоприятное влияние РМ на гликемический профиль у больных ХОБЛ с сопутствующим СД 2-го типа: препарат приводил к отчетливому снижению уровня глюкозы крови натощак (рис. 3) и гликолизированного гемоглобина (HbA1c) [21].
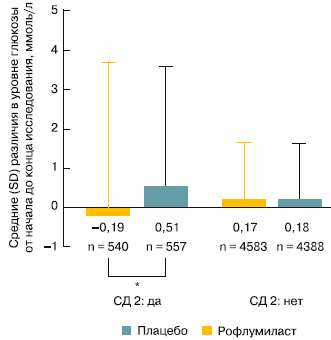
Рис. 3. Снижение уровня глюкозы крови при терапии РМ у больных ХОБЛ с СД 2-го типа (по [21]). * p = 0,0135.
Предположительно, гипогликемические эффекты РМ также опосредуются через влияние на внутриклеточные уровни циклического аденозинмонофосфата, так как небольшие изменения в массе тела у пациентов вряд ли могли бы оказать такое влияние на метаболизм глюкозы. Уровни глюкозы крови натощак не изменялись у больных ХОБЛ без СД (см. рис. 3). Эти данные указывают на возможность улучшения гликемического профиля при сочетании ХОБЛ и СД [21]. В другом исследовании РМ снижал уровень фруктозамина, маркера длительного контроля СД, и концентрацию HbA1c у больных с впервые выявленным СД 2-го типа без сопутствующей ХОБЛ (табл. 2) [22].
Таблица 2. Изменения гликемического профиля (динамика показателей) при терапии РМ у пациентов с впервые выявленным СД (по [22])
| Показатель | РМ | Плацебо | Различие между группами | р |
| Глюкоза натощак, ммоль/л | -1,18 | -0,14 | 1,04 (-1,63; -0,45) | 0,0006 |
| HbA1c, % | -0,79 | -0,33 | -0,45 (-0,66; -0,24) | <0,0001 |
| Фруктозамин, мкмоль/л | -21,7 | 0,70 | -22,4 (-35,5; -9,2) | 0,0010 |
| Инсулин, мкЕД/мл | -0,01 | -0,60 | 0,59 | 0,5206 |
Необходимо проведение дальнейших исследований для определения роли РМ в достижении контроля СД и возможности предотвращения его осложнений.
Влияние терапии РМ на ССС
В крупных эпидемиологических исследованиях было продемонстрировано, что ведущей причиной летальности больных ХОБЛ легкого и среднетяжелого течения является не дыхательная недостаточность, как традиционно принято считать, а сердечно-сосудистые заболевания (ССЗ) – ИБС и сердечная недостаточность [23–25]. Согласно данным популяционных исследований, у больных ХОБЛ риск сердечно-сосудистой смерти повышен в 2–3 раза и составляет приблизительно 50% от общего количества смертельных случаев [26–28]. Причинами частого сочетания ХОБЛ и ССЗ могут быть общий фактор риска – курение, а также персистирующее системное воспаление, окислительный стресс, хронические инфекции, прием некоторых лекарственных средств и др. [29, 30]. Накапливается всё больше данных о том, что хроническое персистирующее воспаление вносит весомый вклад в патогенез атеросклероза и ССЗ у больных ХОБЛ [30, 31].
В настоящее время данных о благоприятном влиянии лекарственной терапии ХОБЛ на ССС относительно немного. В исследовании UPLIFT было отмечено достоверное уменьшение риска развития серьезных ССС во время терапии тиотропием – ОР 0,84 (95% доверительный интервал (ДИ) 0,73–0,98), а ОР летального исхода к концу 4-го года терапии (1440-й день) снизилось на 13% (p W.B. White et al. проанализировали все ССС, которые отмечались в РКИ, посвященных изучению эффективности терапии РМ у больных ХОБЛ [35]. В совокупный анализ было включено 14 РКИ длительностью от 12 до 52 нед (всего 12054 пациента, из них 6563 принимали РМ в суточной дозе 250–500 мкг и 5491 – плацебо). Все летальные исходы и серьезные нефатальные ССС были рассмотрены независимым арбитражным комитетом, не имеющим информации о связи событий с видом терапии. В качестве основной конечной точки были выбраны так называемые “важные нежелательные ССС” (ВНССС), включавшие в себя сердечно-сосудистые летальные исходы, нефатальный острый инфаркт миокарда и нефатальный инсульт. Исходно между группами больных, принимавших РМ или плацебо, не было выявлено никаких различий по возрасту, тяжести ХОБЛ, сопутствующим ССЗ и приему других лекарственных препаратов. Количество сердечно-сосудистых факторов риска (артериальная гипертензия, СД, гиперлипидемия и ИБС) в группах сравнения также было сопоставимым.
В общей сложности в этом анализе было зарегистрировано 78 сердечно-сосудистых летальных исходов и 51 нефатальное ВНССС. Всего в анализе было подтверждено 128 ВНССС, при этом 52 события были отмечены у пациентов, принимавших РМ, и 76 событий – у пациентов, принимавших плацебо. Таким образом, в группе РМ риск развития ВНССС был на 35% ниже, чем в группе плацебо (ОР 0,65; 95% ДИ 0,45–0,93; p = 0,019). Для отдельно взятых ССС, таких как сердечно-сосудистая смерть, нефатальный острый инфаркт миокарда и нефатальный инсульт, ОР был также <1, но ни по одному ССЗ между группами РМ и плацебо не было достоверных различий. С поправкой на длительность терапии частота ССЗ на фоне лечения РМ составила 14,3 на 1000 пациентов-лет, а на фоне использования плацебо – 22,3 на 1000 пациентов-лет. Кривые Каплана–Мейера, описывающие вероятность развития ВНССС, представлены на рис. 4 (общая длительность наблюдений ограничена 372 днями).
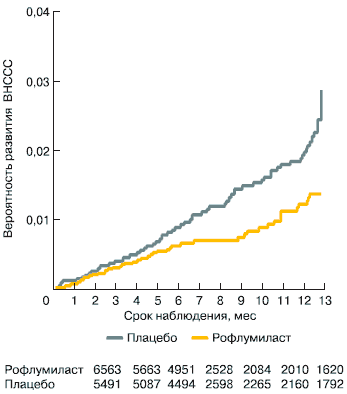
Рис. 4. Влияние терапии РМ на ВНССС (по [35]). ОР 0,65, p = 0,019.
Различия по нежелательным событиям между группами появлялись приблизительно в сроки от 90 до 150 дней от начала исследований.
Сердечно-сосудистые события чаще всего развивались у пациентов с исходными сердечно-сосудистыми факторами риска. Однако даже в этих случаях терапия РМ была ассоциирована со снижением общего числа ВНССС по сравнению с таковым при испоьзовании плацебо. Другие характеристики больных, такие как возраст, пол, стаж курения, прием ИГКС или ДДБА, также не оказали существенного влияния на различия между группами РМ и плацебо по числу ССС.
При субанализе годичных исследований было выявлено, что терапия РМ приводит к достоверному снижению числа обострений ХОБЛ по сравнению с таковым при приеме плацебо. При сопоставлении количества пациентов с обострениями и без обострений пропорция больных с ВНССС оказалась сходной (1,7 и 1,6% соответственно).В то же время при сравнении количества пациентов с ВНССС и без ВНССС пропорция больных, перенесших обострения ХОБЛ, также была сходной (43,2 и 42,1% соответственно).
В недавних исследованиях было установлено, что у пациентов со среднетяжелым и тяжелым течением ХОБЛ имеет место выраженная системная воспалительная реакция, которая характеризуется повышением концентрации фактора некроза опухоли α, ИЛ-6 и С-реактивного белка сыворотки крови по сравнению с показателями здоровых добровольцев [31, 36–38]. D.D. Sin, S.F. Man выявили тесную взаимосвязь между выраженностью системного воспаления и поражением миокарда у больных ХОБЛ [31]. Хорошо известно, что терапия ингибиторами ФДЭ-4 ассоциирована со значимыми противовоспалительными эффектами, доказанными как in vitro, так и in vivo [39, 40]. Терапия РМ приводит к уменьшению выраженности воспалительной реакции в дыхательных путях у больных ХОБЛ, и, возможно, этот противовоспалительный эффект вносит наибольший вклад в снижение числа обострений заболевания [5, 9]. Предположительно, достигнутое снижение количества ВНССС при терапии РМ также может быть связано с уменьшением сосудистого воспаления на фоне приема ингибитора ФДЭ-4.
Таким образом, в исследовании, посвященном анализу сердечно-сосудистой безопасности терапии РМ у больных ХОБЛ, было продемонстрировано снижение риска ССС на 35% за счет уменьшения риска всех трех компонентов ВНССС (сердечно-сосудистой летальности, нефатального инфаркта миокарда и нефатального инсульта).
Заключение
Новый препарат РМ является первым и пока единственным ингибитором ФДЭ-4, зарегистрированным в качестве дополнительной терапии больных тяжелой ХОБЛ с симптомами кашля и продукцией мокроты, частыми обострениями, уже получающих лечение длительнодействующими бронходилататорами. Рофлумиласт характеризуется хорошим уровнем безопасности. Из наиболее частых НЯ терапии этим препаратом можно отметить диарею, тошноту, снижение аппетита, снижение массы тела и головную боль. Большинство НЯ носят легкий и умеренно выраженный характер и обычно разрешаются самостоятельно.
Рофлумиласт является перспективным препаратом для лечения больных ХОБЛ с сопутствующим МС, что связано с двумя его благоприятными эффектами – снижением избыточной массы тела у пациентов с ожирением и улучшением гликемического профиля у больных СД 2-го типа. Терапия РМ у больных ХОБЛ приводит к снижению на 35% риска развития ССС (сердечно-сосудистой летальности, нефатального инфаркта миокарда и нефатального инсульта). С учетом современных данных об эффективности и безопасности терапии РМ профиль больного ХОБЛ, наиболее подходящего для назначения данного препарата, можно представить, как показано на рис. 5.
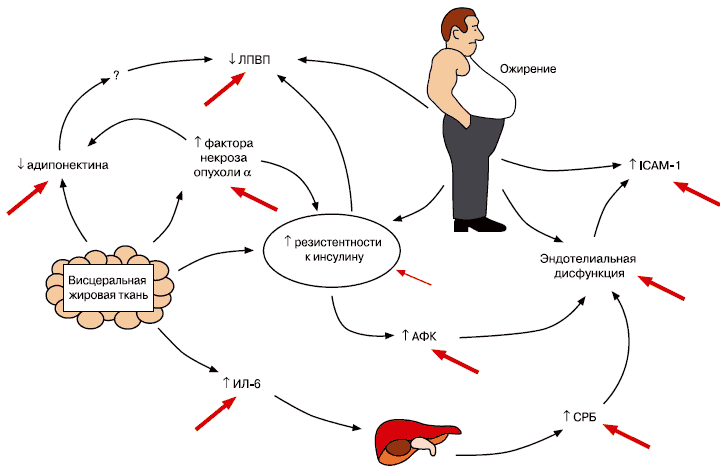
Рис. 5. Подходящий больной ХОБЛ для терапии РМ (ХОБЛ стадии 3–4 (C–D) (ОФВ1 <50%); частые обострения (≥2 в год); бронхитический вариант (кашель/мокрота); МС (ожирение/СД 2-го типа); ССЗ). АФК – активная форма кислорода, ЛПВП – липопротеиды высокой плотности, СРБ – С-реактивный белок, ICAM-1 – молекула межклеточной адгезии-1.
Список литературы
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. NHLBI/WHO workshop report. Last updated 2013 // goldcopd.org
- Hatzelmann A. et al. // Pulm. Pharmacol. Ther. 2010. V. 23. P. 235.
- Daliresp®. Full Prescribing Information, Revised September 2011. Forest Pharmaceuticals. St. Louis, 2011.
- Weidenbach A. et al. // Am. J. Respir. Crit. Care Med. 2008. V. 177. P. A652.
- Grootendorst D.C. et al. // Thorax. 2007. V. 62. P. 1081.
- Rabe K.F. et al. // Lancet. 2005. V. 366. P. 563.
- Fabbri L.M. et al. // Lancet. 2009. V. 374. P. 695.
- Calverley P.M. et al. // Am. J. Respir. Crit. Care Med. 2007. V. 176. P. 154.
- Calverley P.M. et al. // Lancet. 2009. V. 374. P. 685.
- Wedzicha J.A. et al. // Chest. 2013. V. 143: online firs. journal.publications.chestnet.org
- Rennard S.I. et al. // Respir. Res. 2011. V. 12. P. 18.
- Bateman E.D. et al. // Eur. Respir. J. 2011. V. 38. P. 553.
- Oba Y., Lone N.A. // Ther. Adv. Respir. Dis. 2013. V. 7. P. 13.
- Rabe K.F. // Br. J. Pharmacol. 2011. V. 163. P. 53.
- Centre for Drug Evaluation and Research. Application number 022522Orig1s000. Medical Review(s) // http://www.accessdata. fda.gov/drugsatfda-docs/nda/2011/022522Orig1s000MedR.pdf
- Tenor H. et al. // Phosphodiesterases as Drug Targets. Handbook of Experimental Pharmacology 204 / Ed. by S.H. Francis et al. Berlin; Heidelberg, 2011.
- Карпечкина Ю.Л. Распространенность, особенности клинического течения и лечения ХОБЛ на фоне метаболического синдрома: клинико-патогенетическое исследование: Дис. … канд. мед. наук. М., 2010.
- Visser M. et al. // JAMA. 1999. V. 282. P. 2131.
- Rexrode K.M. et al. // Ann. Epidemiol. 2003. V. 13. P. 674.
- Martinez F. et al. // Am. J. Respir. Crit. Care Med. 2010. V. 181. P. A4441.
- Wouters E.F.M. et al. // Am. J. Respir. Crit. Care Med. 2010. V. 181. P. A4471.
- Wouters E.F. et al. // J. Clin. Endocrinol. Metab. 2012. V. 97. P. E1720.
- Hansell A.L. et al. // Eur. Respir. J. 2003. V. 22. P. 809.
- Janssens J.P. et al. // J. Am. Geriatr. Soc. 2001. V. 49. P. 571.
- Rutten F.H. et al. // Br. Med. J. 2005. V. 331. P. 1379.
- Engstrom G. et al. // Circulation. 2001. V. 103. P. 3086.
- Huiart L. et al. // Chest. 2005. V. 128. P. 2640.
- Rosengren A., Wilhelmsen L. // Int. J. Epidemiol. 1998. V. 27. P. 962.
- Anthonisen N.R. et al. // Ann. Intern. Med. 2005. V. 142. P. 233.
- Wieshammer S. et al. // Respiration. 2010. V. 79. P. 355.
- Sin D.D., Man S.F. // Circulation. 2003. V. 107. P. 1514.
- Tashkin D.P. et al.; UPLIFT Study Investigators // N. Engl. J. Med. 2008. V. 359. P. 1543.
- Calverley P.M. et al.; TORCH Investigators // Thorax. 2010. V. 65. P. 719.
- Calverley P.M. et al.; TORCH Investigators // N. Engl. J. Med. 2007. V. 356. P. 775.
- White W.B. et al. // Chest. 2013. V. 143: online first. journal.publications.chestnet.org
- Takabatake N. et al. // Am. J. Respir. Crit. Care Med. 2000. V. 161. P. 1179.
- Eid A.A. et al. // Am. J. Respir. Crit. Care Med. 2001. V. 164. P. 1414.
- Schols A.M. et al. // Thorax. 1996. V. 51. P. 819.
- Hatzelmann A., Schudt C. // J. Pharmacol. Exp. Ther. 2001. V. 297. P. 267.
- Bundschuh D.S. et al. // J. Pharmacol. Exp. Ther. 2001. V. 297. P. 280.
