Значение показателей терапевтической эквивалентности при замене оригинального препарата на воспроизведенный на примере фозиноприла
Статьи Опубликовано в журнале:«Рациональная фармакотерапия в кардиологии»; 2011; 7(4); стр. 431-436.
Н.П. Кутишенко1, С.Ю. Марцевич1,2; Ж.Д. Кобалава3, Е.К. Шаварова3
2 Первый Московский государственный медицинский университет им. И.М. Сеченова, 119991, Москва, Трубецкая ул., 8-2
3 Российский Университет Дружбы Народов. 117198, Москва, Миклухо-Маклая ул., 6
Цель. Изучение терапевтической эквивалентности оригинального и воспроизведенного препаратов фозиноприла у больных артериальной гипертонией (АГ) 1 -2 степени и оценка экономической эффективности замены оригинального препарата генериком.
Материал и методы. В открытое перекрестное рандомизированное исследование включены 36 пациентов с АГ 1 -2 ст. в возрасте 41 -82 года и длительностью заболевания от 3 до 22 лет. Все пациенты получали два курса лечения: воспроизведенным препаратом (Фозикард) и оригинальным препаратом (Моноприл); последовательность курсов определялась путем рандомизации. Каждому курсу предшествовал отмывочный период продолжительностью 10-14 дней. Длительность лечения составляла 6 нед; препараты назначали 1 раз/день; начальная доза 10 мг/сут. Определение артериального давления (АД) и частоты сердечных сокращений (ЧСС) проводили в конце контрольного периода, а также через 2, 4 и 6 нед терапии, при АД>140/90 мм рт.ст. добавляли гидрохлортиазид 12,5 мг, далее увеличивали дозу фозиноприла до 20 мг/сут.
Результаты. Больные в группах были сопоставимы по основным клиническим показателям. Оба препарата фозиноприла оказывали сопоставимый антигипертензивный эффект, при этом различия между препаратами по влиянию на систолическое и диастолическое АД и ЧСС на всех этапах лечения были недостоверны. Индивидуальный анализ выявил тенденцию к более выраженному эффекту Моноприла по сравнению с Фозикардом, однако различия были недостоверны. Средняя доза фозиноприла составила для Моноприла 11,8 мг/сут±3,9 мг, для Фозикарда - 13,2±4,7 мг/сут (р=0,13); частота монотерапии препаратами фозиноприла в дозе 10 мг/сут была одинаковой (у 41% и 44% пациентов, соответственно); частота различной по составу комбинированной терапии отличалась незначимо. В конце исследования снижение АД<140/90 мм рт.ст. было зарегистрировано у 29 (85,3%) пациентов, получавших Моноприл и у 27 (79,4%) - Фозикард (p=0,52). Оба препарата показали хороший профиль безопасности.
Заключение. Фозикард или его комбинация с гидрохлортиазидом терапевтически эквивалентны оригинальному препарату Моноприлу или его комбинации с гидрохлортиазидом.
Ключевые слова: фозиноприл, терапевтическая эквивалентность, экономическая эффективность.
РФК 2011;7(4):431-436
Value of therapeutic equivalence in substitution of original drug with generic by example of fosinipril
N.P. Kutishenko1, S.Yu. Martsevich 1,2, Zh.D. Kobalava3, Е.К. Shavarova3
2 I.M. Setchenov First Moscow State Medical University. Trubetskaya ul. 8-2, Moscow, 1 19991 Russia
3 Peoples' Friendship University of Russia. Miklukho-Maklaya ul. 6, Moscow, 117198 Russia
Aim. To study the therapeutic equivalence of original and generic fosinopril in patients with arterial hypertension (HT) of 1 -2 degrees, and to evaluate the cost effectiveness of original drug substitution with generic.
Material and methods. Patients (n=36) with HT of 1 -2 degree aged 41 -82 years and disease duration up 3 to 22 years included in an open, crossover, randomized trial. All patients had two courses of treatment: with generic (Fosicard) and the original drug (Monopril); sequence of courses was determined by randomization. Wash-out period (10-14 days) preceded each course. Treatment duration was 6 weeks; drugs were administered QD; initial dose - 10 mg/day. Blood pressure (BP) and heart rate (HR) were evaluated at the end of the wash-out period, and in 2, 4 and 6 weeks of therapy. In case of ineffective BP control (>140/90 mm Hg) hydrochlorothiazide 12.5 mg was added initially and dose fosinopril was increased up to 20 mg/day next.
Results. Patients in groups were comparable by basic clinical parameters. Both fosinopril based drugs have comparable antihypertensive effect. Differences between their effect on systolic and diastolic BP as well as HR at all steps of treatment were not significant. The individual analysis revealed a tendency to more pronounced Monopril antihypertensive effect compared with Fosicard, but the differences were not significant. An average dose of Monopril was 11,8±3,9 mg/day, and Fosicard - 13.2±4.7 mg/day (p=0.13); the rate of monotherapy with both drugs of fosinopril at dose of 10 mg/day was similar (in 41 % and 44% of patients, respectively); the rate of combined therapies with various composition differed insignificantly. Reduction in BP <140/90 mmHg was recorded at the end of the study in 29 (85.3%) patients treated with Monorpil and in 27 (79.4%) - Fosicard (p=0.52). Both drugs showed a good safety profile.
Conclusion. Fosicard or its combination with hydrochlorothiazide is therapeutically equivalent to original drug (Monopril) or its combination with hydrochlorothiazide.
Key words: fosinopril, therapeutic equivalence, cost-effectiveness.
Rational Pharmacother. Card. 2011;7(4):431-436
Артериальная гипертония (АГ) - один из самых распространенных модифицируемых факторов риска сердечно-сосудистых заболеваний. В странах Европы распространенность АГ в настоящее время составляет около 44% [1]. Учитывая рост данного показателя, а также все возрастающую стоимость лечения АГ, все большую актуальность приобретают исследования по изучению факторов или причин, влияющих на выбор того или иного метода лечения, а также возможности перевода пациента на более дешевые и экономически выгодные варианты терапии: замена препарата внутри одного класса или между классами, замена оригинального препарата на воспроизведенный и т.д. Крупных клинических исследований по изучению влияния на прогноз взаимозаменяемости антигипертензивных препаратов по вполне понятным причинам не проводилось и вряд ли такие исследования когда-либо будут проведены, поэтому информация о терапевтической эквивалентности и экономической эффективности таких замен достаточно ограниченна. Сомнения в том, что применение воспроизведенных препаратов не всегда приносит ожидаемую экономическую выгоду, появились достаточно давно, фактически с того момента, когда эти препараты стали широко использоваться в клинической практике. Так, Duh M.S. et al. попытались рассчитать экономическую выгоду от перевода пациентов с оригинального противоэпилептического препарата на воспроизведенный, осуществленного в США в рамках государственного проекта. В результате данный проект позволил сохранить гораздо меньше материальных ресурсов, чем предполагалось заранее [2]. Проанализировав все обстоятельства, авторы пришли к выводу, что «провал» данной программы был связан с необходимостью повышения у ряда пациентов дозы препарата, а также дополнительным назначением других противоэпилептических препаратов для контроля стабильного состояния пациента. В Швеции перевод пациентов на ряд воспроизведенных препаратов вызвал заметный рост сообщений о нежелательных явлениях [3].
Большинство российских специалистов, признавая изложенные выше факты, делают вывод о необходимости проведения прямых сравнительных исследований по изучению терапевтической эквивалентности с теми воспроизведенными препаратами (дженериками), которые уже зарегистрированы и чаще всего назначаются в клинике. Отделом профилактической фармакологии ФГУ ГНИЦ ПМ предпринята попытка создания реестра клинических контролируемых рандомизированных исследований, выполненных с дженериками в России [4]. Одним из исследований этого регистра было исследование, посвященное изучению взаимозаменяемости оригинального и воспроизведенного фозиноприла.
Цель исследования - изучение терапевтической эквивалентности оригинального и воспроизведенного препаратов фозиноприла у больных АГ 1 -2 степени.
Материал и методы
Открытое перекрестное рандомизированное исследование по сравнительному изучению эффективности и переносимости двух препаратов фозиноприла: оригинального препарата Моноприл (фозиноприл производства компании Bristol-Myers Squibb) и воспроизведенного препарата Фозикард (фозиноприл производства компании Actavis). Ранее проведенное исследование биоэквивалентности Фозикарда продемонстрировало полное соответствие оригинальному препарату по всем фармакокинетическим параметрам (рис. 1). Исследование терапевтической эквивалентности проводилось в двух центрах: ФГУ ГНИЦ ПМ и Российском Университете Дружбы Народов в 2007 году. Для исследования были отобраны 36 пациентов с АГ 1-2 ст. в возрасте 41-82 года и длительностью заболевания от 3 до 22 лет. Каждый больной должен был пройти два курса лечения фозиноприлом: препаратом Фозикард и препаратом Моноприл, последовательность назначения курсов определялась путем рандомизации. Каждому курсу предшествовал контрольный период продолжительностью 10-14 дней, в течение которого больные не принимали никаких антигипертензивных препаратов. Длительность лечения каждым препаратом составляла 6 нед, препараты назначались 1 раз/день (утром). Начальная доза фозиноприла составляла 10 мг/сут, измерение АД и ЧСС проводили в конце контрольного периода, а также через 2, 4 и 6 нед терапии. При недостаточном антигипертензивном эффекте пациента переводили на комбинированную терапию - добавление гидрохлортиазида (Гипотиазид) 12,5 мг/сут. Если на очередном визите желаемый антигипертензивный эффект не достигался, то дозу фозиноприла в составе комбинированной терапии увеличивали до 20 мг/сут. Учет и регистрацию нежелательных побочных эффектов и явлений осуществляли во время каждого визита. Полностью курс лечения Моноприлом и Фозикардом завершили 34 человека, 2 пациента выбыли по причине личных обстоятельств. Проведение исследования было одобрено этическим комитетом ФГУ ГНИЦ ПМ, каждый пациент подписывал форму информированного согласия на участие в исследовании.
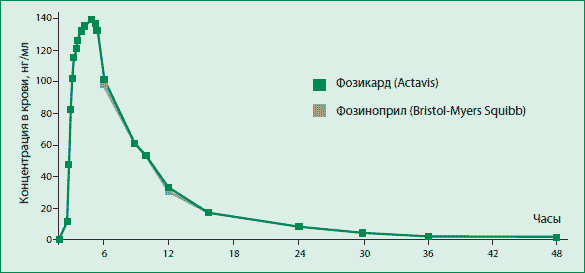
Рис. 1. Сравнение биоэквивалентности оригинального фозиноприла (Моноприл) и воспроизведенного (Фозикарда)
Антигипертензивный эффект препаратов оценивали по результатам измерения АД (изменение от базового уровня при окончании 6-недельного курса терапии). Препарат считали эффективным, если регистрировалось снижение АД ниже уровня 140/90 мм рт.ст. Отдельно оценивался эффект препарата по снижению диастолического АД (ДАД) на 10 мм рт.ст. и более и/или систолического АД (САД) на 20 мм рт.ст. и более.
Для сравнения показателей эффективности были разработаны и приняты следующие критерии: неполное соответствие - при наличии статистически достоверных различий между лекарственными препаратами по любому из выбранных критериев эффективности (достижение целевых значений изучаемого показателя эффективности, необходимость титрования дозы препарата и/или перевода на комбинированную терапию и т.д.); почти полное соответствие - достоверных различий нет, но имеются различия (≥10%) по частоте титрования дозы и/или перевода на комбинированную терапию; полное соответствие - существенных отличий между препаратами нет, различия в частоте титрования дозы и/или перевода на комбинированную терапию не превышают 10%.
Для сравнительной оценки показателей безопасности были разработаны следующие градации: неполное соответствие - статистически достоверные различия в частоте возникновения нежелательных явлений или регистрация даже 1 серьезного нежелательного явления, имеющего доказанную связь с приемом препарата; почти полное соответствие - достоверных различий нет, но имеются различия (≥10%) в частоте регистрации нежелательных явлений или случаи прекращения приема изучаемого лекарственного препарата в связи с развитием нежелательного явления; полное соответствие - отличия между препаратами по частоте регистрации нежелательных явлений не превышают 10%.
Оценку и анализ данных проводили с помощью пакета прикладных программ STATISTICA 6.0. Использовали как стандартные методы описательной статистики (вычисление средних, стандартных отклонений, стандартных ошибок, ранговых статистик и т.д.), так и известные критерии значимости для параметрического и непараметрического распределения признаков (t-критерий Стьюдента, Вилкоксона, Манна-Уитни и т.д.).
Результаты исследования
В исследование были включены 9 мужчин (25%) и 27 женщин (75%) в возрасте от 41 до 82 лет, медиана и интерквартильный размах - 55,5 лет (от 51,5 до 66,0). Длительность заболевания АГ колебалась от 1 года до 49 лет, медиана и интерквартильный размах составили 6,0 лет (от 3 до 22 лет). До включения в исследование большинство пациентов (n=23 - 63%) антигипертензивную терапию не получали, 5 пациентов (14%) лечились нерегулярно, 2 пациента (6%) получали терапию в неадекватных дозах, регулярную адекватную антигипертензивную терапию получали всего 6 пациентов (17%) как в виде монотерапии, так и в виде комбинированной терапии.
Группы больных, случайным образом распределенных в соответствии с определенной последовательностью назначения препаратов, были сопоставимы по основным клиническим показателям (табл. 1).
Таблица 1.
Результаты рандомизации: сравнительная характеристика больных, начавших исследование с Моноприла и Фозикарда (медиана и интерквартильный размах)
| Моноприл (n=17) | Фозикард (n=19) | P | |
| Пол (м/ж), % | 2/15 (12/88) | 7/1 2 (37/63) | |
| Возраст, лет | 56,0 (53,0 - 66,0) | 54,0 (50,0 - 63,0) | 1,0 |
| Рост, см | 162,0 (159,0 - 168,0) | 165,0 (160,0 - 170,0) | 0,32 |
| Вес, кг | 80,2 (76,0 - 87,0) | 83,6 (75,0 - 90,0) | 1,0 |
| ИМТ, кг/м2 | 30,1 (26,6 - 33,3) | 27,8 (26,9 - 33,5) | 0,32 |
| Давность АГ, лет | 14,0 (5,0 - 25,0) | 5,0 (3,0 - 7,0) | 0,32 |
| САД, мм рт.ст. | 146,0 (141,3 - 150,7) | 151,0 (146,0 - 156,3) | 0,1 |
| ДАД, мм рт.ст. | 91,3 (84,7 - 94,7) | 92,0 (87,3 - 96,0) | 1,0 |
| ЧСС, мин-1 | 70,0 (64,0 - 75,0) | 70,0 (64,0 - 80,0) | 0,54 |
Через 2 нед терапии в обеих группах отмечалось статистически значимое по сравнению с исходными данными снижение как САД (p<0,0001), так и ДАД (p<0,0001). Через 4 и 6 нед в обеих группах отмечалось дальнейшее усиление антигипертензивного эффекта терапии, имеющее статистически значимый характер для показателей САД при приеме Фозикарда через 4 нед (р=0,04), а при приеме Моноприла - через 6 нед (р=0,01). Основные данные по динамике АД и ЧСС на фоне лечения обоими препаратами представлены в табл. 2.
Таблица 2.
Показатели АД и ЧСС на фоне терапии Моноприлом и Фозикардом (M±s)
| Этапы терапии | АД | Моноприл (n=34) | Фозикард (n=34) | P |
| Исходно | САД | 147,4 ± 8,0 | 149,9 ± 8,1 | 0,3 |
| ДАД | 92,1 ± 5,0 | 92,6 ± 4,6 | 0,4 | |
| ЧСС | 71,4 ± 8,1 | 73,6 ± 9,48 | 0,2 | |
| 2 недели | САД | 135,7 ± 8,6*** | 135,8 ± 10,3*** | 0,7 |
| ДАД | 85,8 ± 7,3*** | 86,3 ± 6,9*** | 0,5 | |
| ЧСС | 71,3 ± 7,5 | 70,8 ± 8,8 † | 0,8 | |
| 4 недели | САД | 132,1 ± 11,7*** | 132,7 ± 9,2*** † | 0,7 |
| ДАД | 83,2 ± 8,3*** | 84,4 ± 7,5*** | 0,4 | |
| ЧСС | 71,1 ± 8,6 | 71,7 ± 8,8 | 0,4 | |
| 6 недель | САД | 128,4 ± 7,7*** † | 131,1 ± 8,4*** | 0,1 |
| ДАД | 81,3 ± 7,3*** | 83,6 ± 6,7*** | 0,07 | |
| ЧСС | 70,1 ± 7,6 | 71,0 ± 8,1 | 0,9 |
Оригинальный и воспроизведенный препараты фозиноприла оказывали сопоставимый антигипертензивный эффект, при этом различия между препаратами по их влиянию на показатели САД, ДАД и ЧСС на всех этапах лечения не носили статистически значимого характера. Кроме того, на фоне приема обоих препаратов снижение АД не сопровождалось клинически значимыми изменениями со стороны ЧСС.
На рис. 2 представлена в графическом виде динамика показателей САД и ДАД по отношению к исходным данным на различных этапах лечения каждым из препаратов.
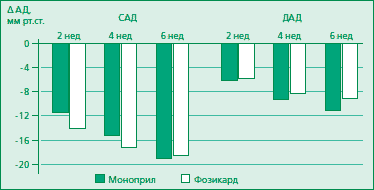
Рис. 2. Изменение САД, ДАД в различные сроки наблюдения
Средние дозы фозиноприла для оригинального и воспроизведенного препаратов оказались почти одинаковыми и составили для Моноприла 11,8±3,9 мг/сут, а для Фозикарда — 13,2±4,7 мг/сут, значимых различий между назначаемыми дозами препаратов не было (р=0,13).
По данным индивидуального анализа отмечалась тенденция к более выраженному эффекту Моноприла по сравнению с Фозикардом, однако различия между препаратами не носили статистически значимого характера. Монотерапия Фозикардом и Моноприлом в дозе 10 мг/сут в данном исследовании была примерно одинаково эффективной (у 44% и 41% пациентов, соответственно), однако состав комбинированной терапии отличался: при лечении Моноприлом чаще использовалось сочетание 10 мг фозиноприла и 12,5 мг гидрохлортиазида (41 %), а при проведении курса терапии Фозикардом чаще приходилось увеличивать дозу фозиноприла до 20 мг (32%), р=0,35.
В конце исследования достижение «целевого» уровня АД (АД<140/90 мм рт.ст.) было зарегистрировано у 29 (85,3%) пациентов, получавших Моноприл, и у 27 (79,4%) пациентов, получавших Фозикард, различия между препаратами не были статистически значимыми (p=0,52). При анализе антигипертензивного эффекта препаратов по их влиянию на снижение САД на 20 мм рт.ст. и более оказалось, что Моноприл и Фозикард по своей эффективности не отличались друг от друга и данный эффект был отмечен у 47,1% пациентов в каждой группе (р=1,0). Эффект Моноприла на снижение ДАД на 10 мм рт.ст. и более оказался более выраженным, чем у Фозикарда (55,9% и 47,1% пациентов, соответственно), однако различия между препаратами при данном анализе также не были статистически значимыми (р=0,46).
Во время исследования оба препарата показали хороший профиль безопасности: только у 4 пациентов были зарегистрированы нежелательные явления (см. табл. 3). Возможная связь нежелательного явления с приемом препарата была обнаружена только в 2 случаях, маловероятная - также в 2 случаях, во всех случаях нежелательные явления не были серьезными, не требовали коррекции или отмены терапии.
Таблица 3.
Частота нежелательных явлений
| Побочный эффект | Моноприл | Фозикард |
| Слабость | - | 1 |
| Кашель | 1 | - |
| Боль в спине (радикулит) | 1 | - |
| ОРЗ | - | 1 |
| Всего: | 2 | 2 |
Обсуждение результатов
Вопросы взаимозаменяемости лекарственных препаратов, в том числе и воспроизведенных, остаются довольно сложными и далеко не решенными, хотя ясно одно - нельзя механически переносить данные исследований по эффективности и безопасности, полученные разработчиком оригинального препарата, на воспроизведенный препарат. В противном случае кажущиеся выгодные ценовые показатели могут обернуться дополнительными расходами как для государства, так и для пациента (например, недостаточно эффективное лечение, побочные эффекты, требующие дополнительных финансовых затрат и т.д.). В существующих в РФ условиях регистрации воспроизведенных препаратов, позволяющих проникать на рынок препаратам, не полностью соответствующим оригинальному как по эффективности, так и по безопасности, проведение сравнительных пострегистрационных клинических исследований представляется крайне желательным. Кроме того, результаты таких исследований смогут ответить на вопрос экономической эффективности такого вмешательства. Нарастание объема клинических исследований у нас в стране свидетельствует о насущной потребности отобрать для использования в медицинской практике по-настоящему полноценную замену оригинальному лекарственному средству [5]. Тем не менее, в настоящее время отсутствуют документы, определяющие порядок проведения и критерии оценки результатов таких исследований.
Анализ результатов проведенного исследования показал, что данные в отношении оригинального препарата Моноприла полностью соответствуют многочисленным литературным данным об эффективности фозиноприла, назначаемого как в виде монотерапии, так и в комбинации с гидрохлортиазидом у больных с АГ, которая оценивалась методом стандартного измерения АД [6-8]. Все это позволяет считать данные, полученные в отношении Фозикарда и комбинации Фозикарда с гидрохлортиазидом, крайне убедительными. Современные концепции лечения АГ однозначно свидетельствуют, что наиболее перспективным путем повышения эффективности контроля АД являются комбинации двух и более антигипертензивных препаратов, при этом рациональность комбинации ингибитора ангиотензин-превращающего фермента (АПФ) и тиазидного диуретика сомнению не подвергается и является общепризнанной [9,10]. В исследовании были также получены достаточно высокие показатели достижения «целевого» АД, при этом «целевой» уровень не был достигнут при лечении обоими изучаемыми препаратами практически у одних и тех же пациентов. Возможно, эти пациенты имели или более выраженную степень, или более тяжелое течение АГ, скорее всего, они нуждались в более мощном лечении и назначении трех- и даже четырехкомпонентной схемы терапии. Следует отметить хорошую переносимость лечения, о чем свидетельствовала низкая частота всех нежелательных явлений, зарегистрированных при приеме оригинального и воспроизведенного препаратов. Известно, что хорошая переносимость фозиноприла была отмечена и в других ранее выполненных исследованиях [11,12].
Данное исследование было проведено в строгом соответствии с протоколом с использованием перекрестного метода, позволяющего оценить эффективность и переносимость оригинального и воспроизведенного препарата на одной и той же группе пациентов, когда ответ пациентов на вмешательство (терапию) может сильно варьировать из-за их индивидуальных особенностей.
Известно, что при проведении клинических исследований с целью подтверждения эквивалентности различных терапевтических схем установить истинную равноценность тех или иных видов лечения бывает весьма сложно, поскольку для доказательства этого предполагается взять очень большую выборку пациентов. Минимум, что можно сделать, - показать сходство терапевтических режимов в рамках заранее установленных границ. Для этого заранее были определены критерии эффективности, а также допустимый уровень различия стандартной и тестируемой схем лечения, который был вполне приемлемым с практической точки зрения и позволял считать оба вида терапии взаимозаменяемыми. В соответствии с принятыми критериями результаты исследования свидетельствуют о практически полном соответствии Моноприла и Фозикарда по эффективности и полном соответствии по безопасности, что позволяет сделать вывод о терапевтической эквивалентности Фозикарда оригинальному препарату.
Очень важно, что оценку терапевтической эквивалентности своим препаратам стремятся дать, в первую очередь, фармацевтические компании, репутация которых в России и так достаточно высока. Препараты компании Актавис (комбинированные препараты фозиноприл 10 мг/гидрохлортиазид 1 2,5 мг и фозиноприл 20 мг/гидрохлортиазид 1 2,5 мг) уже прошли самую серьезную проверку качества и одобрены FDA для применения на территории США [13].
С другой стороны, привлечение внимания к экономическим аспектам оценки замены оригинальных препаратов на воспроизведенные помогает в поиске более адекватных способов снижения затрат в здравоохранении. К сожалению, в настоящее время четкие рекомендации, позволяющие оценить экономическую целесообразность приема того или иного препарата на основании проведения с ним небольших по своему объему сравнительных клинических исследований, до конца не разработаны [14]. Полученные данные о терапевтической эквивалентности вполне позволяют в дальнейшем для оценки экономической эффективности использования Фозикарда вместо оригинального препарата применить подход «минимизации затрат» путем вычисления абсолютной разницы затрат на изучаемые препараты.
Заключение
Таким образом, на сегодняшний день есть все основания утверждать, что Фозикард продемонстрировал практически полное соответствие по эффективности и полное соответствие по безопасности оригинальному препарату Моноприлу.
Сведения об авторах:
Кутишенко Наталья Петровна — д.м.н., руководитель лаборатории отдела профилактической фармакотерапии ГНИЦ ПМ
Марцевич Сергей Юрьевич — д.м.н., профессор, руководитель отдела профилактической фармакотерапии ГНИЦ ПМ; профессор кафедры доказательной медицины Первого МГМУ им. И.М. Сеченова
Кобалава Жанна Давидовна — д.м.н., профессор кафедры пропедевтики внутренних болезней РУДН.
Шаварова Елена Курбановна - к.м.н, доцент той же кафедры
Литература
1. Wolf-Maier K., Cooper R.S., Benegas J.R. at al Hypertension and blood pressure levels in 6 European countries, Canada, and the USA. JAMA 2003; 289: 2363-2369.
2. Duh M.S., Andermann F, Paradis RE. et al. The economic consequences of generic substitution for antiepileptic drugs in 1 public payer setting: the case of lamotrigine. Dis Manag 2007; 1 0: 21 6-225.
3. Hellstrom J., Rudholm N. Side effects of generic competition? Eur J Health Econ 2004; 5: 203-208.
4. Registry of clinical controlled randomized study performed with generics in Russia. Russian (Реестр клинических контролируемых рандомизированных исследований, выполненных с дженериками в России.
5. Federal Law of 12.04.2010 № 61-FZ "On circulation of drugs". Russian (ФЗ РФ от 12.04.2010г. №61-ФЗ «Об обращении лекарственных средств»).
6. Fernandez M., Madero R., Gonzalez D. et al. Combined versus single effect of fosinopril and hydrochlorothiazide in hypertensive patients. Hypertension. 1 994; 23(1 Suppl): 1207-121 0.
7. Rool J.L., Cushman W.C., Saini R.K. et al. Use of factorial design and quadratic response surface models to evaluate the fosinopril and hydrochlorothiazide combination therapy in hypertension. Am J Hypertens 1997; 10(1): 117-123.
8. Guthrie R., Reggi D.R., Rlesher M.M. at al. Efficacy and safety of fisinopril/hydrochlorithiazide combination on ambulatory blood pressure profiles in hypertension. Fosinopril/Hydrochlorothizide Investigators. Am J Hypertens 1996; 9(4): 306-311.
9. Zanchetti A., Hansson L. The role of combination therapy in mordern antihypertensive therapy. J Cardiovasc pharmacol 2000; 35: 1 -3.
10. Mancia G., De Backer G., Dominiczak A. et al. 2007 ESH-ESC Practice guidelines for the management of arterial hypertension: ESH-ESC Task Force on the Management of Arterial Hypertension. J Hypertens 2007; 25(9): 1751-1762.
11. Wagstaff A.J., Davies R., McTavish D. Fosinopril. A reappraisal of its pharmacology and therapeutic efficacy in essential hypertension. Drugs 1996;51(5):777-91
12. Karpov Yu.A. Fosinopril in the treatment of hypertension (FLAG): The Russian program isassessing the attainability of the target levels of blood pressure. Russkiy meditsinskiy zhurnal 2001; 10:406-410. Russian (Карпов Ю.А. Фозиноприл при лечении артериальной гипертонии (ФЛАГ): российская программа оценки практической достижимости целевых уровней артериального давления. РМЖ 2001; 10:406-410).
13. Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations.
14. Yagudina R.I., Kulikov A.Yu. Rharmacoeconomics: general information, research methods. Novaya apteka 2007; 9: 73-78. Russian (Ягудина Р.И., Куликов А.Ю. Фармакоэкономика: общие сведения, методы исследования. Новая аптека 2007; 9: 73-78).
