Зависит ли эффективность эрадикации Helicobacter pylori от супрессии кислотообразования в желудке?
Статьи Опубликовано в журнале:
« Клинические перспективы гастроэнтерологии, гепатологии » 6, 2012г. В.Д. Пасечников, Д.В. Пасечников, И.Л. Литвиненко
Ставропольская государственная медицинская академия
Цель исследования. Определить связь между уровнем эрадикации Helicobacter pylori (H. рylori) и супрессией кислотообразующей функции желудка при проведении эмпирической терапии 1-й линии с включением в ее состав генериков омепразола в комбинации с амоксициллином и кларитромицином.
Материал и методы. Сравнивалась эффективность эрадикации H. pylori при использовании двух схем терапии, включающих амоксициллин (А), кларитромицин (К) и генерики омепразола (омез, омепразол – ОМЕ) в двух параллельных группах (по 30 человек каждая) в зависимости от уровня кислотной супрессии. Уровень кислотной супрессии оценивали посредством измерения среднего уровня внутрижелудочного рН, используя 24-часовую рН-метрию, проводившуюся до начала терапии и после 10 дней приема препаратов.
Результаты. Более высокий уровень эрадикации H. pylori получен у больных, лечившихся по схеме ОМЕЗ-АК, по сравнению с пациентами, получавшими лечение по схеме ОМЕ-АК (86,2% и 59,3% соответственно, р=0,049. У пациентов с достигнутой эрадикацией бактерии средний уровень внутрижелудочного рН оказался достоверно выше, чем у больных с неудачной эрадикацией H. pylori. У пациентов, получавших комбинацию ОМЕЗ-АК, средний уровень внутрижелудочного рН был достоверно выше, чем в группе больных, получавших ОМЕ-АК.
Заключение. Уровень эрадикации H. pylori зависит от кислотосупрессивного эффекта ингибитора протонной помпы, включенного в схему терапии. Генерик омепразола ОМЕЗ оказывает более выраженное кислотосупрессивное действие, чем генерик ОМЕ, что предопределяет более высокий уровень эрадикации H. pylori при 10-девном назначении комбинации препаратов ОМЕЗ-АК, по сравнению с ОМЕ-АК.
Ключевые слова: эрадикация, H. pylori, генерики омепразола, кларитромицин, амоксициллин.
Kомбинация омепразола с амоксициллином и клари-тромицином (ОАК), назначаемая в течение 10–14 дней, является эмпирической терапией 1-й линии в схемах эрадикации Helicobacter pylori (H. pylori), рекомендованных Маастрихт-4 в регионах с низкой резистентностью к кларитромицину [1]. Однако не только высокий уровень резистентности H. pylori к антимикробным средствам, но и недостаточная супрессия кислотообразования во время проведения терапии снижают эффективность эрадикации [2]. Известно, что снижение эффективности антимикробных средств по отношению к H. pylori обусловлено их нестабильностью и деградацией в кислой среде желудка [3]. В этой связи адекватная супрессия кислотообразования в желудке может рассматриваться как один из факторов успешной эрадика-ции H. pylori. Опубликовано всего одно исследование, показавшее зависимость эффективности эрадикации H. pylori от степени ингибирования внутригастральной секреции во время проведения терапии [2], и это обстоятельство диктует необходимость проведения новых исследований в этой области.
Цель исследования – определить связь между уровнем эрадикации H. pylori и супрессией кислотообразующей функции желудка при проведении эмпирической терапии 1-й линии с включением в ее состав генериков омепразола в комбинации с амоксициллином и кларитромицином.
Критерии включения/ невключения пациентов в исследование
В исследование были включены пациенты обоего пола в возрасте от 18 до 60 лет, инфицированные H. pylori (позитивные по результатам быстрого уреазного теста и гистологического исследования).
Критерии невключения в исследование:
- осложнения (кровотечение, перфорация, стеноз) язвенной болезни двенадцатиперстной кишки,
- развившиеся во время текущего обострения или в недавнем прошлом (в течение предыдущего месяца);
- сопутствующие эзофагит и язвенная болезнь желудка, подтвержденные результатами эндоскопических исследований;
- проводившаяся в течение предыдущего месяца до начала текущего исследования эрадикационная терапия, включающая ингибиторы протонной помпы (ИПП) и два антибиотика;
- наличие в анамнезе хирургических вмешательств на пищеводе, желудке и двенадцатиперстной кишке;
- аллергические реакции к препаратам, включенным в эрадикационную терапию;
- прием аспирина или нестероидных противовоспалительных средств;
- беременность или лактация.
Дизайн исследования
Эндоскопия.
Всем пациентам до начала терапии проводилось эндоскопическое исследование с биопсией из тела желудка и антрального отдела. Повторное эндоскопическое исследование выполняли спустя 4 нед после окончания лечения. Цель эндоскопических исследований – определение H. pylori-инфицирования (1-е исследование) и контроль эрадикации бактерии (2-е исследование).
Определение внутригастральной кислотности (24-часовое мониторирование рН в желудке).
Исходное 24-часовое мониторирование рН выполняли за 7 дней до начала исследования – с 8 часов утра до приема пищи до 8 часов следующего дня. Повторное исследование проводилось на 10-й день эрадикационной терапии после утреннего приема лекарств.
Определение 24-часового профиля рН в желудке проводилось с использованием монокристаллического сурьмяного катетера и референсного электрода. Данные из регистратора (MicroDigitrapper; Synectics Medical, Sweden) переносили в компьютер и анализировали с помощью программ с вычислением стандартных показателей. Референсный электрод фиксировали на коже передней грудной стенки.
В течение 24 ч пациенты вели дневник, в котором отмечали время приема пищи, принятия горизонтального положения, сна, приема лекарственных средств, время принятия вертикального положения, появление изжоги, боли и других симптомов.
Эрадикация H. pylori.
Пациенты, включенные в исследование, получали 10-дневную эрадикационную терапию (ОАК), включавшую генерики омепразола: (ОМЕЗ) или (ОМЕ) по 20 мг 2 раза в сутки за 30 мин до еды, амоксициллин (А) по 1000 мг 2 раза в сутки, кларитромицин (К) по 500 мг 2 раза в сутки.
Определение приверженности к лечению (комплаенс) и проверка соблюдения предписанного режима приема лекарственных средств. Комплаенс определялся на основе расчета отношения, выраженного в процентах: количество употребленного препарата/должное количество назначенного препарата. Подсчет употребленных лекарственных средств проводился на основе учета возвращенных упаковок. Предписанный режим приема лекарственных средств и продолжительность эрадикации проверяли по дневнику пациента.
Определение H. pylori-статуса.
Наличие H. pylori в биопсийном материале определяли двумя методами: морфологическим с окраской гистологических срезов по Гимзе и с использованием быстрого уреазного теста. Эрадикация H. pylori считалась успешной на основе совпадения негативных результатов обоих методов через 4 нед после окончания терапии.
Определение чувствительности штаммов к кларитромицину.
Для получения культуры H. pylori и последующего определения антибиотикорезистентности H. pylori к кларитромицину проводили гомогенизацию биопта-та слизистой оболочки желудка. Инокуляция гомогенатов проводилась в среду Mueller Hinton II Agar (Becton Dickinson, Franklin Lakes, NJ, USA) с 7% лошадиной кровью. Инкубация проводилась в микро-аэрофильных условиях (5% O2, 10% CO2, и 85% N2) при 37 °С до 4 дней. Бактерии H. pylori идентифицировали по характерной морфологии колоний, окрашивания по Граму, позитивных реакций на оксидазу, каталазу и уреазу [4].
Выраженность антибиотикорезистентности к кларитромицину оценивали с помощью метода серийных разведений в концентрациях от 0,015 до 8 мг/мл с определением минимальной поглощающей концентрации [5].
Статистическая обработка и анализ полученных результатов.
Математическую обработку результатов выполняли с использованием статистической программы SPSS 17.0. Сравнение показателей в исследуемых группах проводили на основе расчета 95% доверительного интервала для различий между уровнями эра-дикации. Анализ проводился с использованием двух методов: с учетом пациентов, завершивших протокол исследования (per protocol, PP), и среди всех пациентов, включенных в исследование (intention-to-treat, ITT).
Результаты исследования
В исследование вошли 60 пациентов (ITT), полностью соответствующих критериям включения (40% мужчин и 60% женщин). 1-ю группу составили пациенты, получившие ОМЕЗ в комбинации с амоксициллином и кларитромицином (30 человек), во 2-ю группу вошли больные, получавшие ОМЕ в комбинации с амоксициллином и кларитромицином (30 человек).
В 1-й группе эрадикация H. pylori наступила у 25 (83,3%) из 30 пациентов, включенных в исследование (ITT), и у 25 (86,2%) из 29, завершивших протокол (PP). Во 2-й группе эрадикация наступила у 16 (53,3%) пациентов из 30, включенных в исследование (ITT), и у 16 (59,3%) из 27, завершивших протокол (PP).
При сравнении эффективности терапии (ITT) отмечен достоверно более высокий уровень эрадикации H. pylori в 1-й группе по сравнению с результатами, полученными во 2-й группе (83,3% и 53,3% соответственно, р=0,026; Z=2,22, 95% доверительный интервал 0,0645 – 0, 5355). Среди завершивших протокол (PP) более высокий уровень эрадикации H. pylori также получен у больных, принимавших лечение по схеме ОМЕЗ-АК (86,2% и 59,3% соответственно, р=0,049; Z=1,97; 95% интервал доверительности 0,0369–0,5011).
Определение чувствительности штаммов H. pylori к кларитромицину проводилось ретроспективно у всех лиц, результаты которых показали неэффективную эради-кацию (n=15). В группе больных, получавших ОМЕЗ-АК с неэффективной эрадикацией H. pylori (n=4), резистентность к кларитромицину была обнаружена у 1 (25%) пациента, в группе больных, получавших ОМЕ-АК, – у 2 (18,2%) из 11. При сравнении долей больных с резистентностью к кларитромици-ну в обеих группах достоверных различий не обнаружено (р=0,67; Z= –0,431, 95% доверительный интервал (–0,3866 – 0, 5266).
У пациентов обеих групп отмечалась высокая приверженность к проводимой терапии (эрадикации), составившая 100%, ни в одном случае не был нарушен режим приема лекарственных средств.
До начала терапии средний уровень внутрижелудочного рН оказался одинаковым и составил в 1-й группе 3,53±0,32 с колебаниями от 2,7 до 4,27, во 2-й группе – 3,45±0,041 с колебаниями от 2,2 до 4,32. Достоверных различий в уровне внутрижелудочного рН до начала терапии в сравниваемых группах больных не выявлено (р=0,129).
Профиль внутрижелудочной кислотности по уровням рН в течение 24 часов после последнего приема препаратов у больных, получавших оба варианта терапии и завершивших протокол (PP) при различном исходе эрадикации H. pylori, показан на рис. 1А. У пациентов с достигнутой эради-кацией бактерии средний уровень внутрижелудочного рН (рис. 1Б) оказался 5,92 ± 0,04 (колебания рН 5,22 – 6,07), в то время как у больных с неудачной эрадикацией H. pylori он оказался достоверно ниже – 5,11±0,147 (колебания 3,5–5,21; p=0,0001).
Профиль 24-часового мониторинга рН у больных с успешной эрадикацией H. pylori, завершивших протокол (PP), показан на рис. 2А. У пациентов, получавших комбинацию ОМЕЗ-АК (рис. 2Б), средний уровень внутрижелудочного рН был достоверно выше (6,11±0,022; колебания рН 5,1–6,22), чем в группе больных, получавших ОМЕ-АК (5,65±0,04; колебания рН 4,86–5,88, p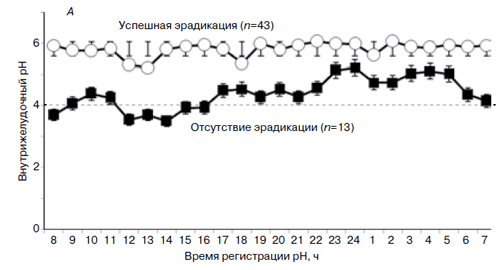
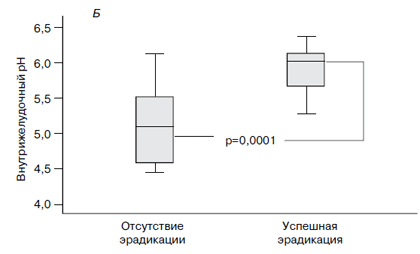
Рис. 1. 24-часовый профиль рН (А) и средний уровень рН в течение 24 часов мониторирования (Б)
при различном исходе эрадикации H. pylori у больных, получавших оба варианта терапии
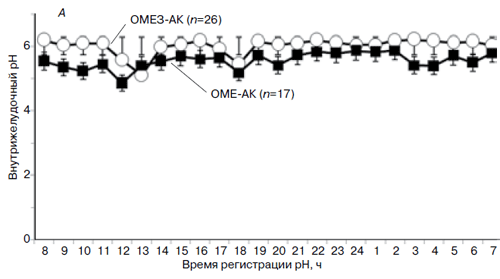
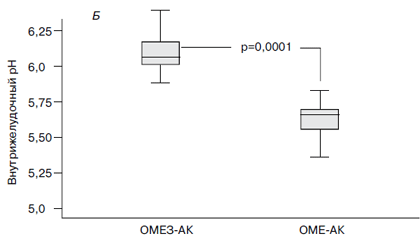
Рис. 2. 24-часовый профиль рН (А) и средний уровень рН в течение 24 часов мониторирования (Б)
у больных, получавших различные варианты терапии
Обсуждение результатов исследования
Итак, мы получили два достоверно отличающихся уровня эрадикации H. pylori, используя две схемы терапии, в состав которых входили два генерика омепразола и два антибиотика, произведенных одной и той же фармацевтической компанией.
Какой из предполагаемых факторов ответствен за неудачную попытку эрадикации при использовании трехкомпонентных схем в нашем исследовании?
Существует несколько причин, обусловливающих снижение эффективности эрадикации H. pylori тремя препаратами:
– снижение приверженности к терапии (комплаенс);
– неадекватная супрессия кислотообразования;
– высокий уровень бактериального обсеменения;
– тип штамма бактерии;
– увеличение резистентности H. pylori к антибактериальным препаратам.
В обеих группах нашего исследования приверженность к терапии была высокой и составила 100%, что контролировалось двумя способами.
Несомненно, снижение комплаенса могло оказать негативное влияние на уровень эрадикации. Так, S.S. Kao и соавт. [6] провели многофакторный анализ, установивший, что приверженность к терапии является единственным независимым клиническим фактором, влияющим на эффективность эрадикации H. pylori. Уровни эрадикации H. pylori в группах больных с удовлетворительной и неудовлетворительной приверженностью к терапии составили 96,4 и 60% соответственно.
Нами не проводилось генотипирование штаммов H. pylori и не определялась плотность бактериальной обсемененности. Существует определенная вероятность, что эти факторы могут влиять на эффективность эрадикации H. pylori, снижая ее уровень. L.J. van Doorn и соавт. [7] установили, что cagA-негативные штаммы s2/m2 были резистентными к терапии в сравнении c сagA-позитивными s1am1 или s1am2 штаммами. Неэффективная эрадикация была ассоциирована с преобладанием штаммов с vacA s1, у которых в 47% случае отсутствовал ген cagA [8]. Увеличение бактериальной плотности H. pylori ассоциируется со значительным снижением уровня эрадикации, что было показано в исследовании Y.C. Lai и соавт. [9] и других авторов.
У больных с неудачной попыткой эрадикации H. pylori при использовании схем ОМЕЗ-АК и ОМЕ-АК мы не обнаружили достоверных различий в частоте штаммов, резистентных к кларитромицину. Безусловно, главной причиной неэффективной эрадикации бактерии H. pylori является рост резистентности штаммов к кларитромицину и устойчивая резистентность к метронидазолу. Так, в Европе в целом резистентность к кларитромицину увеличилась с 9% в 1998 г. [10] до 17,5% в 2008 г. [11]. Более того, отмечается высокий уровень резистентности к левофлоксацину (14,1%) и метронидазолу (34,9%). В странах Западной, Центральной и Южной Европы резистентность для кларитромицина и левофлоксаци-на составляет более чем 20%, а в северной части Европы – менее 10% [11]. Мы показали, что независимо от схемы применяемых препаратов у больных с отрицательным результатом терапии, средний уровень внутрижелудочного рН был ниже при сравнении с успешно проведенной эрадикацией бактерии H. pylori, т. е. генерики не обеспечили адекватного снижения кислотности в желудке. Наши данные близки к результатам исследования M. Sugimoto и соавт. [2], показавших, что у пациентов с успешной эрадикацией H. pylori средний уровень 24-часового рН оказался равен 6,4 (от 5,0 до 7,6). Этот уровень рН был достоверно выше, чем у пациентов с неудачными результатами при проведении эрадикации, – 5,2 (2,2–6,2), p=0,01.
Таким образом, уровень внутрижелудочного рН при эрадика-ционной терапии может быть предиктором ее исхода. Как зависит уровень эрадикации H. pylori от степени супрессии кислотной продукции желудка? ИПП используются в схемах эрадикации H. pylori в силу их выраженного эффекта, связанного с доставкой антибиотиков в места обитания бактерий. Известно, что кислота, вырабатываемая желудком, вызывает деградацию антибиотиков в его просвете. Антибиотики, используемые в схемах эрадикации H. pylori, различаются по их чувствительности к кислоте желудочного сока. Так, метронидазол является соединением с высокой стабильностью в желудочном соке при рН от 2 до 7 с периодом полураспада около 800 ч. Амоксициллин является нестабильным соединением при низком уровне рН, но его период полураспада равняется 15 ч при рН=2. В противоположность амок-сициллину кларитромицин является значительно менее устойчивым соединением в кислой среде, и его период полураспада менее чем 1 ч при рН=2 [12, 13].
Поскольку кларитромицин и амоксициллин являются кислото-чувствительными антибиотиками, желудочная секреция кислоты должна быть потенциально ингиби-рована ИПП в целях предупреждения их деградации при низком уровне рН во время эрадикаци-онной терапии [2]. Адекватная супрессия кислотопродуцирующей функции желудка обусловливает стабильность кислоточувствитель-ных антибиотиков и биодоступность в желудочной среде, увели- чивая концентрацию антибиотиков в слизистой оболочке желудка [3, 14, 15]. Известно, что высокий уровень внутрижелудочного рН может снизить уровни минимальной инги-бирующей концентрации (MIC) для кислоточувствительных антибиотиков; при подъеме внутрижелудочного рН с 3,5 до 5,5 эффективность амоксициллина увеличивается более чем в 10 раз [3]. Более того, ингибирование кислотной продукции вызывает активацию фазы размножения бактерии H. pylori, во время которой они становятся более чувствительными к антибиотикам [15]. Антибиотики проникают в просвет желудка посредством диффузии липидов, в которых они растворены.
Таким образом, растворенные в липидах, они пассивно переносятся через липидные компоненты мембран клеток эндотелия, выстилающего артериальные капилляры желудка, по градиенту концентрации [12].
Определеную роль в механизме доставки атибиотиков играет процесс их ионизации. Неионизованные лекарства легче переносятся через мембрану вследствие менее выраженного полярного строения молекул, чем ионизованные формы. Метронидазол присутствует в плазме крови в преимущественно неионизованной форме, поэтому легко покидает просвет сосудов и накапливается в желудочном соке в просвете желудка. Омепразол уменьшает концентрацию метронидазола посредством снижения уровня кислотной секреции, при этом за счет снижения объема желудочной продукции повышается концентрация амоксициллина [14].
Кроме омепразола, возможно, и другие ИПП также снижают вязкость желудочной слизи, тем самым увеличивая доставку к клеткам всех антибиотиков. В некоторых сообщениях авторы отмечают, что ингибирование кислотообра-зования омепразолом обусловливает повышение концентрации кларитромицина в ткани желудка, результаты других исследований свидетельствуют об отсутствии этого эффекта [16, 17]. Считается, что ИПП имеют непосредственный супрессивный эффект на жизнедеятельность H. pylori, но потенциально значимого влияния на эрадикацию это не оказывает при монотерапии этими средствами [18].
Таким образом, мы допускаем, что уровень внутрижелудочного рН может быть предиктором исхода эрадикационной терапии; потенциальное ингибирование кислотной продукции является необходимым условием ее успеха при использовании в схемах терапии кислоточувствительных антибиотиков.
Влияют ли различия в фармакокинетике ИПП на уровень эра-дикации H. pylori?
Мы установили, что уровень эрадикации в схеме с двумя кислоточувствительными антибиотиками (кларитромицином и амоксициллином) и омезом (ОМЕЗ-АК) был достоверно выше (86,2%), чем при использовании тех же антибактериальных средств и иного генерика омепразола – 59,3% (схема ОМЕ-АК). Считаем, что различия в уровне эрадикации в свете приведенных выше фактов определяются разным уровнем ингибирования кислотной продукции. При использовании схемы ОМЕЗ-АК мы добились достоверного повышения (р=0,0001) среднего уровня внутрижелудочного рН с 3,53±0,032 до 6,11±0,022 у 26 пациентов с успешной эрадикацией бактерии. При использовании схемы ОМЕ-АК достоверное повышение (р=0,0001) среднего -уровня внутрижелудочного рН с 3,45±0,041 до 5,65±0,04 произошло у 17 пациентов с успешной эрадикацией H. pylori.
Поскольку до проведения эрадикации средний уровень внутрижелудочного рН в сравниваемых группах был одинаковым, а после 10 дней терапии имел достоверные различия (см. рис. 2), то можно предположить, что большая частота эрадикации H. pylori в группе больных, получавших ОМЕЗ-АК (1-я группа), в сравнении с больными, получавшими ОМЕ-АК (2-я группа), обусловлена различием в супрессии кислотообразования и, следовательно, повышением эффективности кислотозависимых антибиотиков.
Таким образом, мы считаем, что различия в кислотосупрессив-ном эффекте ИПП могут быть значимым фактором, определяющим исход эрадикации H. pylori, вероятно, за счет различий в фармако-кинетике генериков или оригинальных препаратов.
P. Hsu и соавт. [19] сравнили две схемы препаратов для эрадикации H. pylori, в которых были использованы одинаковые антибиотики (амоксициллин и кларитромицин) и различные ИПП (пантопразол по 40 мг 2 раза в сутки и эзомепразол по 40 мг 2 раза в сутки). Были получены результаты, свидетельствующие об увеличении эффекта эрадикации бактерии на 12% у больных, получавших эзомепразол, по сравнению с пациентами, получавшими пантопразол. Авторами другого исследования было показано, что уровень внутрижелудочного рН был значительно выше у больных, в схеме терапии которых использовался эзомепразол, чем у пациентов, получавших пантопразол [20].
Исход эрадикации H. pylori зависит от дозы ИПП. При проведении мета-анализа эффективности однократной и двойных доз ИПП, M. VallveLи соавт. [21] показали, что уровень эрадикации H. pylori был значимо выше при использовании в схемах терапии двойной дозы ИПП. Несмотря на различия в фармакокинетике отдельных ИПП, приведенные выше результаты сравнения пантопразола и эзомепразола [19] и последующее проведение метаанализа не выявило значимых преимуществ каких-либо ИПП в плане исходов эрадикационной терапии [22].
Выводы
1. Ингибирование кислотной продукции желудка является важным элементом терапии, включающей кислоточувствительные антибиотики. Согласно рекомендациям Маастрихт-4, для улучшения ответа на эрадикацию целесообразно увеличить дозу ИПП в схемах ИПП - кларитромицин -амоксициллин/метронидазол [1].
2. Существующие различия между генериками должны учитываться при выборе препарата для проведения эрадикационной терапии. Список литературы 1. Malfertheiner P., Megraud F., O’Morain C.A. et al.; European Helicobacter Study Group. Management of Helicobacter pylori infection—the Maastricht IV/ Florence Consensus Report. Gut. 2012 May; 61(5):646– 64.
2. Sugimoto M, Furuta T, Shirai N, et al. Evidence that the degree and duration of acid suppression are related to Helicobacter pylori eradication by triple therapy. Helicobacter. 2007 Aug; 12(4):317–23.
3. Grayson ML, Eliopoulos GM, Ferraro MJ, Moellering RC Jr. Effect of varying pH on the susceptibility of Campylobacter pylori to antimicrobial agents. Eur J Clin Microbiol Infect Dis 1989; 8:888–9.
4. Dent JC, McNulty CA. Evaluation of a new selective medium for Campylobacter pylori. Eur J Clin Microbiol Infect Dis 1988; 7:555–8.
5. Кудрявцева Л.В. Региональные генотипы и уровни резистентности к антибактериальным препаратам Helicobacter pylori: автореферат дис. доктора медицинских наук : 03.00.07 / Моск. мед. акад. им. И.М. Сеченова Москва, 2004. –41 с.
6. Kao SS, Chen WC, Hsu PI, et al. 7-Day Nonbismuth-Containing Concomitant Therapy Achieves a High Eradication Rate for Helicobacter pylori in Taiwan. Gastroenterol Res Pract. 2012; 2012:463985.
7. van Doorn LJ, Schneeberger PM, Nouhan N, et al. Importance of Helicobacter pylori cagA and vacA status for the efficacy of antibiotic treatment. Gut. 2000 Mar; 46(3):321–6.
8. Yakoob J, Jafri W, Abbas Z, et al. Risk factors associated with Helicobacter pylori infection treatment failure in a high prevalence area. Epidemiol Infect. 2011 Apr; 139 (4):581–90.
9. Lai YC, Wang TH, Huang SH, et al. Density of Helicobacter pylori may affect the efficacy of eradication therapy and ulcer healing in patients with active duodenal ulcer
10. Glupczynski Y, Megraud F, Lopez-Brea M, et al. European multicentre survey of in vitro antimicrobial resistance in Helicobacter pylori. Eur J Clin Microbiol Infect Dis 2001; 20:820e3.
11. Megraud F, Coenen S, Versporten A, et al. on behalf of the Study Group participants. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption. Gut. 2012 May 12.
12. Goddard A. Review article: Factors influencing antibiotic transfer across the gastric mucosa. Aliment Pharmacol Ther 1998; 12:1175–84.
13. Erah P, Goddard A, Barrett D, et al. The stability of amoxicillin,clarithromycin and metronidazole in gastric juice: Relevance to the treatment of Helicobacter pylori infection. J Antimicrob Chemother 1997; 39:5–12.
14. Goddard AF, Jessa MJ, Barrett DA, et al. Effect of omeprazole on the distribution of metronidazole, amoxicillin, and clarithromy-cin in human gastric juice. Gastroenterology 1996; 111:358–67.
15. Scott D, Weeks D, Melchers K, Sachs G. The life and death of Helicobacter pylori. Gut 1998; 43 (Suppl. 1):S56–60.
16. Gustavson L, Kaiser J, Edmonds Am Locke C, et al. Effect of omeprazole on gastric concentrations of clarithromycin in plasma and gastric tissue at steady state. Antimicrob Agents Chemother 1992; 36:1147–50.
17. Pedrazzoli J, Calafatti S, Ortiz R, et al. Transfer of clarithromycin to gastric juice is enhanced by omeprazole in Helicobacter pylori-infected individuals. Scand J Gastro- enterol 2001; 36:1248–53.
18. Vakil N. Helicobacter pylori: factors affecting eradication and recurrence. Am J Gastroenterol. 2005 Nov; 100(11):2393–4.
19. Hsu P, Lai K, Lin C, et al. A pro spective randomized trial of esomeprazole versus pantoprazole-based triple therapy for Helicobacter pylori eradication. Am J Gastroenterol 2005; 100(11):2387–92
20. Miehlke S, Madisch A, Kirsch C, et al. Intragastric acidity during treatment with esomeprazole 40 mg twice daily or pantoprazole 40 mg twice daily-A randomized, two-way crossover study. Aliment Pharmacol Ther 2005; 21:963–7.
21. Vallve M, Vergara M, Gisbert J, et al. Single vs. double dose of a proton pump inhibitor in triple therapy for Helicobacter pylori eradication: A meta-analysis. Aliment Pharmacol Ther 2002; 16:1149–56.
22. Vergara M, Vallve M, Gisbert J, et al. Meta-analysis: Comparative efficacy of different proton pump inhibitors on triple therapy for Helicobacter pylori eradication. Aliment Pharmacol Ther 2001; 18:647–54.
