Продление додиализного периода при раннем назначении комплексного нефропротективного лечения
СтатьиОпубликовано в журнале, Врач, 6, 2008 В клиническом разборе принимают участие:
академик РАМН, профессор Н. Мухин,
доктор медицинских наук, профессор Л. Козловская,
доктор медицинских наук Ю. Милованов,
кандидат медицинских наук В. Фомин,
кандидат медицинских наук С. Милованова
Клинический разбор в Клинике нефрологии, внутренних и профессиональных болезней им. Е. М. Тареева ММА им. И. М. Сеченова
Проф. Н. Мухин. Одной из важнейших проблем нефрологии является предупреждение или максимальное отдаление терминальной стадии хронической болезни почек (ХБП) с весьма ограниченными возможностями влияния на течение (проявления) болезни. На этой стадии жизнь больных полностью зависит от методов заместительной почечной терапии — перитонеального и гемодиализа, трансплантации почки. Несмотря на то что в настоящее время достигнуты значительные успехи в этой области, остается много нерешенных вопросов как медицинского плана, так и социально-экономических, связанных с обеспечением донорскими органами при максимальном сохранении качества жизни больных, что относится к одной из первостепенных задач здравоохранения. Исходя из теоретических предпосылок и накопленного практического опыта, можно полагать, что своевременное начало наблюдения пациентов с ХБП при условии соблюдения ими соответствующей малобелковой диеты, надлежащем контроле уровня АД и анемии может способствовать замедлению темпов снижения скорости клубочковой фильтрации (СКФ), улучшению качества жизни и профилактике сердечно-сосудистых осложнений. Эффективность этих мер у больных ХБП на додиализном этапе демонстрируют 2 наших наблюдения, касающихся мужчин молодого возраста с исходно одинаковыми показателями почечных функций, но при диаметрально противоположном отношении к рекомендуемому лечению.
Клиническое наблюдение №1
С. Милованова. Больной О., 1970 года рождения, менеджер (рис. 1).
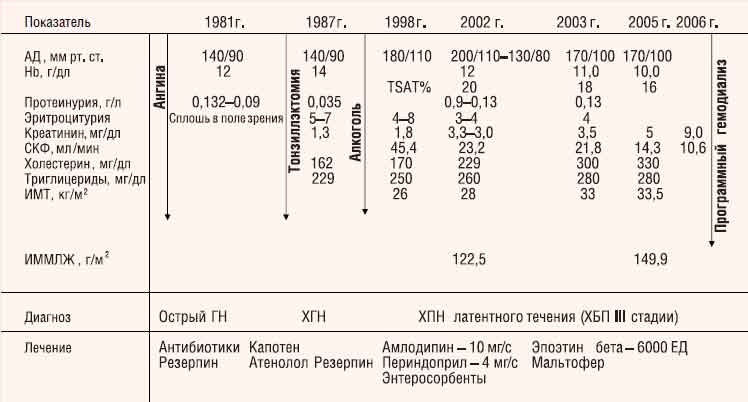
Рис. 1. Клиническая характеристика больного О., 1970 года рождения (менеджер)
В 11-летнем возрасте после ангины развился острый нефрит (гематурия, олигурия, отеки, повышение АД). В последующие годы сохранялись умеренная протеинурия и эритроцитурия (5—7 эритроцитов в поле зрения), подъемы АД максимально до 140/90 мм рт. ст., по поводу чего больной периодически принимал резерпин.
При обследовании в 1987 г. выявлены умеренная артериальная гипертензия (АГ) (АД 140/80 мм рт. ст.), следовая протеинурия (0,035 г/л), эритроцитурия (до 5 эритроцитов в поле зрения). Диагностирован хронический гломерулонефрит (ХГН). Проведена плановая тонзиллэктомия; лечение антигипертензивными препаратами нерегулярное.
Во время повторного обследования в 1991 г. вновь выявлены следовая протеинурия (0,09 г/л), умеренная эритроцитурия (4—7 эритроцитов в поле зрения) при сохранной функции почек. Отмечены повышение индекса массы тела (ИМТ) до 26 кг/м2, гипертриглицеридемия — до 250 мг/дл. АД — в пределах 140/80 мм рт. ст., рекомендована диета. Назначены каптоприл (75 мг/сут), атенолол (50 мг/сут), которые больной принимал несистематически.
С 1991 по 1998 г. злоупотреблял алкоголем, нарушал диетический режим. С 1998 г. появились и стали медленно нарастать признаки хронической почечной недостаточности (ХПН): содержание креатинина сыворотки крови увеличилось до 1,8 мг/дл, СКФ, рассчитанная по формуле MDRD, составила 45,4 мл/мин/1,73 м2; усилилась АГ с периодическими подъемами АД до 180/110 мм рт. ст.; больной по-прежнему нерегулярно принимал антигипертензивные препараты.
При первом (в ноябре 2002 г.) обследовании в Клинике им. Е. М. Тареева обращали на себя внимание избыточная масса тела (ИМТ>27 кг/м2), уровень АД — 200/110 мм рт. ст., креатинина — 3,3 мг/дл (СКФ — 23,2 мл/мин/1,73 м2), триглицеридов — 229 мг/дл, Hb — 14,3 г/дл, отмечался умеренный мочевой синдром (белок в моче — 0,33 г/л, эритроциты — до 8 в поле зрения). Данные УЗИ: почки уменьшены в размерах (толщина паренхимы 14 мм). При эхокардиографическом (ЭхоКГ) исследовании выявлены признаки концентрического ремоделирования левого желудочка: относительная толщина стенок (ОТС) — 0,76 (норма <0,45), индекс массы миокарда левого желудочка (ИММЛЖ) — 122,5 г/м2 (норма у мужчин ≤134 г/м\2). Клинический диагноз: ХГН латентного течения (ХБП III стадии). На фоне ограничения потребления соли, регулярного приема антигипертензивных препаратов (амлодипин — 20—10 мг/сут, периндоприл — 4 мг/сут) АД стабилизировалось на уровне 140/90—130/80 мм рт. ст. Назначены энтеросорбенты и диета с ограничением суточной квоты белка (0,8 г/кг); достигнуто снижение азотемии (уровень креатинина сыворотки понизился с 3,3 до 3,0 мг/дл), отмечено снижение массы тела на 2 кг. Однако после выписки из клиники больной не соблюдал диету, злоупотреблял алкоголем, нерегулярно принимал антигипертензивные препараты, отменил прием периндоприла.
В июне 2003 г. — стойкое повышение АД (170/100—160/100 мм рт. ст.), дальнейшее прогрессирование ХПН, несмотря на отсутствие явных признаков активности нефрита (белок в моче — 0,13 г/л, эритроциты — 4 в поле зрения), уровень сывороточного креатинина — 3,5 мг/дл, СКФ — 21,8 мл/мин/1,73 м2. Стал отмечать головокружение, быструю утомляемость при умеренной физической нагрузке. Впервые выявлены анемия (Hb — 11,0 мл/дл), гипоферремия (коэффициент насыщения трансферрина железом — TSAT 18%). По данным ЭхоКГ, дальнейшее нарастание выраженности гипертрофии левого желудочка — ГЛЖ (ИМ-МЛЖ — 149,9 г/м2; ОТС — 1,76) со снижением диастолической функции (Е/А — 0,54/0,70). Рекомендованы диета с большим, чем ранее, ограничением белка (0,6 г/кг в сутки), сбалансированная незаменимыми амино- и кетокислотами, коррекция анемии препаратами эпоэтина бета подкожно (по 2000 МЕ 3 раза в неделю) в сочетании с приемом железа (полимальтозный комплекс гидроокиси железа — Fe3+ для приема внутрь — 200 мг/сут), однако рекомендации врача по малобелковой диете и лечению анемии пациент по-прежнему не выполнял, антигипертензивные препараты принимал нерегулярно.
К маю 2005 г. АД определяется на уровне 170/100 мм рт. ст., сохраняются избыточная масса тела (ИМТ — 33,5 кг/м2), значительно повышенный уровень холестерина и триглицеридов в сыворотке крови, отмечены нарушение толерантности к углеводам, гиперурикемия, содержание креатинина сыворотки крови повысилось до 5 мг/дл (СКФ — 14,3 мл/мин/1,73 м2), наросла тяжесть анемии (Hb — 10 г/л), усилилась гипоферремия (TSAT — 16%).
В августе 2006 г. в связи с прогрессирующим ухудшением состояния пациента — нарастанием тяжелой ХПН (сывороточный уровень креатинина 10,6 мг/дл, СКФ — 9,0 мл/мин/1,73 м2, уровень калия — 6,5 ммоль/л) — начато лечение программным гемодиализом в возрасте больного 36 лет.
Проф. Н. Мухин. Прошу сделать короткое заключение по этому больному.
Ю. Милованов. Представленное наблюдение демонстрирует роль гемодинамических и метаболических механизмов прогрессирования ГН: отсутствие надлежащего контроля уровня АД, избыточная масса тела и гиперлипидемия способствовали прогрессированию латентного нефрита и раннему (для данного варианта нефрита) присоединению ХПН. Несоблюдение больным назначенного врачом режима приема антигипертензивных препаратов привело к развитию концентрической ГЛЖ и формированию диастолической дисфункции. При ХБП с почечной недостаточностью (III—IV стадия) прогноз во многом зависит от выполнения пациентом предписанных рекомендаций. Психологическая дезадаптация больного к лечению (синдром compliance) с несоблюдением малобелковой диеты, отказом от коррекции анемии, нерегулярным приемом антиги пертензивных средств, возможно, обусловили необычно быстрое прогрессирование ХПН, формирование ГЛЖ и диастолической дисфункции, а в последующем, во время лечения гемодиализом, — развитие серьезных сердечно-сосудистых осложнений: интрадиализной гипотонии, нарушений сердечного ритма, острого коронарного синдрома, хронической сердечной недостаточности.
Злоупотребление алкоголем, несомненно, также способствовало усугублению у больного метаболических нарушений (ожирения и дислипидемии), которые являются факторами риска и, в соответствии с современными представлениями, одним из механизмов прогрессирования ХБП. Кроме того, пристрастие к алкоголю привело к снижению критики и формированию психологической дезадаптации к лечению.
Клиническое наблюдение №2
С. Милованова. Больной С., 1962 года рождения, электромонтажник (рис. 2).
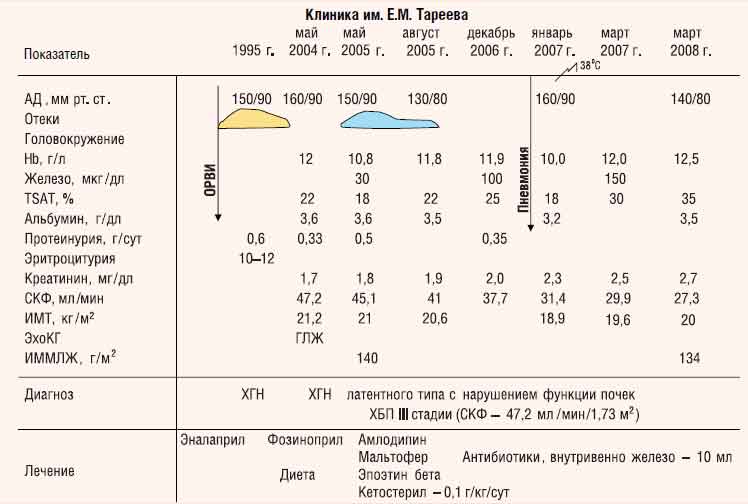
Рис. 2. Клиническая характеристика больного С., 1962 года рождения (элекромонтажник)
Заболел в 1995 г., когда после перенесенной острой респираторной вирусной инфекцией (ОРВИ) появились отеки лица и ног, затем присоединились боли в пояснице. Обнаружены протеинурия (белок — 0,6 г/сут), умеренная эритроцитурия (10—12 в поле зрения), повышение АД (до 150/90 мм рт. ст.). Диагностирован ХГН. В последующие годы сохранялись следовая протеинурия, эритроцитурия. Повышение уровня АД до 150/90 мм рт. ст., антигипертензивные препараты принимал нерегулярно, работал. В мае 2004 г. впервые обследован в Клинике им. Е. М. Тареева: отмечены АГ (АД 160/90 мм рт. ст.), умеренная нормохромная анемия (Hb — 12,0 г/дл при TSAT — 22%), впервые зафиксировано повышение уровня креатинина сыворотки до 1,7 г/дл, при этом протеинурия составляла 0,33 г/сут. На ЭКГ — признаки ГЛЖ. ИМТ в пределах нормальных значений — 21,2 кг/м2 (масса тела 65 кг, рост 175 см).
Клинический диагноз: ХГН латентного течения с нарушением функции почек — ХБП III стадии (СКФ, рассчитанная по формуле MDRD, — 49,6 мл/мин/1,73 м2). Назначены с нефропротективной целью ингибиторы ангиотензинпревращающего фермента — АПФ (фозиноприл — 10 мг/сут), диета с ограничением белка до 0,8 г/кг в сутки.
В марте 2005 г. стал отмечать головокружение, быструю утомляемость при умеренной физической нагрузке, с трудом работал по специальности.
В мае 2005 г. при контрольном обследовании: АГ (АД 150/90 мм рт. ст.), нарастание анемии (Hb — 10,8 г/дл), появление гипоферремии (TSAT — 18%), нарастание почечной недостаточности (уровень креатинина сыворотки крови — 1,8 мг/дл, СКФ — 45,1 мл/мин/1,73 м2, протеинурия — 0,5 г/сут). При допплерЭхоКГ-исследовании — признаки ГЛЖ эксцентрического типа (ИММЛЖ — 140 г/м2, относительная толщина стенок — ОТС — 0,44).
Назначены препараты железа (полимальтозный комплекс гидроокиси железа — Fe3+ для приема внутрь) в дозе 200 мг/сут, через 2 нед, после коррекции гипоферремии (TSAT увеличился до 22%), начато введение эпоэтина бета подкожно: 6 тыс. ЕД в неделю. Антигипертензивная терапия была усилена присоединением блокатора кальциевых каналов амлодипина (5 мг/сут). Рекомендованы диета с ограничением белка до 0,6 г/кг в сутки, прием эссенциальных аминокислот (ЭАК) и их кетоаналогов — КА (Кетостерил — 0,1 г/кг в сутки).
Через 3 мес (август 2005 г.) достигнут уровень Hb — 11,8 г/дл при TSAT — 22%; доза эпоэтина бета уменьшена до 4 тыс. ЕД в неделю при продолжении приема железа внутрь в дозе 200 мг/сут. АД стойко сохраняется на уровне 130—140/80—90 мм рт. ст., уровень креатинина сыворотки крови — в пределах 1,9 мг/дл (41,5 мл/ мин/1,73 м2). Самочувствие больного улучшилось: уменьшилась слабость, исчезли головокружения, что позволило ему возобновить профессиональную деятельность. Пациенту рекомендовано продолжить лечение эпоэтином бета в дозе 4 тыс. ЕД в неделю в сочетании с препаратами железа внутрь, малобелковая диета (ограничение белка в еде до 0,6 г/кг в сутки) с продолжением приема препарата «Кетостерил» по 0,1 г/кг в сутки, что неукоснительно выполнялось пациентом.
При контрольном обследовании в декабре 2006 г. состояние оставалось стабильным: Hb — 11,9 г/дл, сывороточное железо — 100 мкг/дл, TSAT — 25%, креатинин — 2,0 мг/дл (СКФ — 37,7 мл/мин/1,73 м2). АД 140/90 мм рт. ст. (на фоне приема фозиноприла в дозе 10 мг/сут и амлодипина — 5 мг/сут), протеинурия — 0,35 г/сут, показатели нутритивного статуса — в пределах нормальных значений. Самочувствие пациента было вполне удовлетворительным, он продолжал работать.
В январе 2007 г. перенес ОРВИ с повышением температуры тела до 38°С, ознобом, появлением кашля с мокротой, развитием правосторонней нижнедолевой пневмонии (подтверждена рентгенографией легких). Проводилась антибактериальная терапия (амоксициллин — 1000 мг/сут, внутрь, в течение 10 дней), применялись муколитики (ацетилцистеин — 600 мг/сут, внутрь, в течение 7 дней), в результате чего нормализовалась температура тела, исчезли хрипы в легких и признаки инфильтрации легочной ткани (по данным контрольной рентгенографии органов грудной клетки). Но при этом отмечены снижение уровня Hb до 10,0 г/дл, TSAT до 18%, повышение уровня креатинина сыворотки до 2,3 мг/дл (СКФ — 31,4 мл/мин/1,73 м2), АД — до 160/90 мм рт. ст. (на фоне приема прежних доз антигипертензивных препаратов). Масса тела уменьшилась на 2 кг (с 60 до 58 кг), выявлено нарушение нутритивного статуса умеренной степени: ИМТ — 18,9 кг/м2, сывороточный уровень альбумина — 32 г/л. Пациент жаловался на утомляемость при минимальной физической нагрузке, потерю трудоспособности.
Доза эпоэтина бета вновь была увеличена до 6 тыс. ЕД/кг в неделю подкожно, но при этом вводили железо внутривенно капельно в дозе 200 мг (10 мл) 1 раз в неделю. В результате уровень Hb повысился до 11,9 г/дл, TSAT — до 35%. Из-за гиперкалиемии (уровень калия —5,9 мэкв/л) доза фозиноприла уменьшена до 5 мг/сут, а амлодипина — увеличена до 15 мг/сут. Для коррекции нарушений нутритивного статуса больному была назначена диета с ограничением белка до 0,75 г/кг в сутки (0,6 г/кг обычного пищевого белка и 0,15 г/кг — высокоочищенного соевого белка в составе высококалорийной смеси). Калорийность пищевого рациона составляла в среднем 34 ккал/кг в сутки.
При обследовании через 2 мес (март 2007 г.) уровень Hb восстановился до целевого (11,8—12,0 г/дл), нормализовалось содержание железа (TSAT — 30%), в связи с чем доза эпоэтина бета вновь уменьшена до поддерживающей — 4 тыс. ЕД в неделю, а доза железа — до 100 мг в неделю. Достигнута стабилизация АД (140/80 мм рт. ст.), нормализовался ИМТ (19,6 кг/м2), уровень креатинина сохранялся в пределах 2,5 мг/дл (29,9—24,2 мл/ мин/1,73 м2). В результате применяемой диеты достигнута нормализация основных показателей нутритивного статуса: ИМТ составил 19,6 кг/м2, альбумин сыворотки крови — 35 г/л. При очередном обследовании (ноябрь 2007 г.) состояние пациента стабильное: Hb — 12 г/дл, TSAT — 28%, креатинин — 2,6 мг/дл (СКФ — 29,3 мл/мин/1,73 м2). АД — 140/90 мм рт. ст., протеинурия — 0,2 г/сут, ИМТ — 20 кг/м2, альбумин — 35 г/л. Самочувствие вполне удовлетворительное.
Состояние остается стабильным и в настоящее время. Так, при обследовании в марте 2008 г.: Hb — 12,5 г/дл, TSAT — 35%, сывороточный креатинин — 2,7 мг/дл, СКФ — 27,3 мл/мин/ 1,73 м2. АД — 140/90 мм рт. ст., ИМТ — 20 кг/м2, альбумин — 35 г/л. При контрольном ЭхоКГ-исследовании отмечена отчетливая тенденция к регрессу ГЛЖ эксцентрического типа (ИММЛЖ — 134 г/м2; ОТС — 0,47).
Ю. Милованов. Второе наблюдение демонстрирует, что добавление к МБД высокоэнергетической питательной смеси и назначение оптимального комплекса незаменимых кето- и аминокислот Кетостерила дало возможность больному длительно соблюдать малобелковую диету без нарушений нутритивного статуса и обеспечило профилактику развития белково-энергетической недостаточности в течение всего периода наблюдения.
Развитие анемии при ХБП сопровождалось значительным ухудшением качества жизни и снижением общей трудоспособности, формированием ГЛЖ эксцентрического типа. В результате терапии эпоэтином бета подкожно в сочетании с приемом железа достигнута коррекция уровня Hb, при этом в первую очередь уменьшались утомляемость и склонность к депрессии, характеризующие качество жизни.
Ранняя коррекция анемии и нарушений нутритивного статуса с поддержанием нормального уровня АД позволила добиться замедления снижения СКФ на 1,4 мл/мин в год по сравнению с расчетной (4 мл/мин в год). Необходимо отметить, что коррекция анемии сама по себе способствовала снижению уровня систолического АД с отчетливой тенденцией к уменьшению ГЛЖ эксцентрического типа.
Проф. Н. Мухин. Таким образом, анализ течения ХБП у этих 2 больных наглядно демонстрирует, что в отличие от 1-го больного, по сути, с естественным течением ХБП, отягощенным, кроме того, множественными метаболическими нарушениями, которые, несомненно, способствовали прогрессированию болезни до терминальной ХПН, у 2-го больного оказалось возможным проведение нефропротективной стратегии, включавшей воздействие на основные механизмы прогрессирования ХБП — АД, анемию, нарушения нутритивного статуса. Второе наблюдение действи тельно подтверждает, что нефропротективная стратегия на додиализном этапе — это реальный путь торможения почечной недостаточности (на 1,4 мл/мин в год) при достаточно хорошем качестве жизни больного с сохранением долгое время трудоспособности и профессиональной деятельности.
Хотелось подробнее обсудить указанные направления нефропротекции при ХБП, и в первую очередь коснуться роли АГ при ХБП.
В. Фомин. Хорошо известно, что частота и выраженность АГ нарастают по мере снижения скорости клубочковой фильтрации, и к IV—V стадии ХБП стойкое повышение АД регистрируется более чем у 80% больных. Способствуя дальнейшему нарастанию почечной недостаточности, высокая АГ в ассоциации с общепопуляционными (курение, дислипопротеидемии, сахарный диабет типа 2) и так называемыми уремическими (анемия, нарушения фосфорно-кальциевого обмена) сердечно-сосудистыми факторами риска обусловливает значительное ускорение процесса дезадаптивного ремоделирования сосудистой стенки и миокарда, в итоге приводящего к потенциально фатальным осложнениям (хроническая сердечная недостаточность, мозговой инсульт, острый инфаркт миокарда).
Нефропротективная стратегия на додиализном этапе тормозит развитие почечной недостаточности при достаточно хорошем качестве жизни больного
Независимо от предшествующего заболевания почек (в том числе у пациентов с нормотензией), АГ при ХПН приобретает некоторые типичные признаки. К ним относят:
| Группа больных | >ХБП III стадии (30-59 мл/мин/1,73 м2) | ХБП IV стадии (15-29 мл/мин/1,73 м2) |
| число больных | ||
| 1-я | 31 | 65 |
| 2-я | 29 | 15 |
| Всего | 60 | 80 |
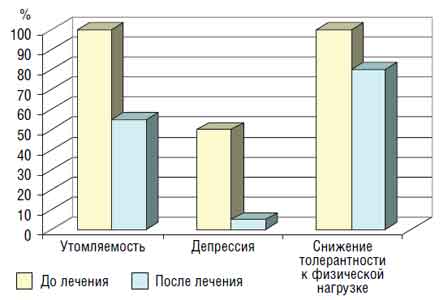 Рис. 3. Качество жизни больных ХБП IV стадии до и после лечения анемии В то же время без лечения анемии число таких больных увеличилось. При динамическом наблюдении за больными, у которых удалось длительно (более 6 мес; чаще в течение 12—18 мес) поддерживать целевой уровень Hb, нами отмечено статистически значимое торможение скорости прогрессирования почечной недостаточности по сравнению с таковой при отсутствии лечения анемии (табл. 2). Таблица 2 Динамика снижения СКФ (в мл/мин/1,73 м2) при ХБП IV стадии в группах с проведением лечения анемии и без такового (М±т),
Рис. 3. Качество жизни больных ХБП IV стадии до и после лечения анемии В то же время без лечения анемии число таких больных увеличилось. При динамическом наблюдении за больными, у которых удалось длительно (более 6 мес; чаще в течение 12—18 мес) поддерживать целевой уровень Hb, нами отмечено статистически значимое торможение скорости прогрессирования почечной недостаточности по сравнению с таковой при отсутствии лечения анемии (табл. 2). Таблица 2 Динамика снижения СКФ (в мл/мин/1,73 м2) при ХБП IV стадии в группах с проведением лечения анемии и без такового (М±т), | Группа больных | Период наблюдения | Л СКФ | ||||
| скрининг | 3 мес | 6 мес | 9 мес | 12 мес | мл/мин/ год | |
| Лечение эпоэтином бета (n=25) | 24,0±1,07 | 23,2± 1,03 | 22,3± 1,04 | 21,5± 1,03 | 20,6± 1,06 | 3,42±0,13 |
| Без лечения (n=15) | 24,5± 0,92 | 23,4± 0,95 | 22,4± 0,89 | 21,1± 0,56 | 20,52± 0,9 | 3,98±0,11(p<0,05) |
 Рис. 4. Варианты диет у больных с III-IV стадией ХБП Суточная калорийность пищевого рациона в диетах № 1 и 2 составляла 33 ккал/кг, в диете № 3 — 34 ккал/кг. Все 3 варианта сбалансированной малобелковой диеты оказались безопасны: ни в одной группе за время наблюдения не развились нутритивные нарушения. Диеты № 1 и 2 вполне удовлетворительно переносились больными, благодаря чему их могли принимать длительно — более полугода (1/3 больных — до 2,5 года). В то же время диета № 3 переносилась значительно хуже — несмотря на добавки, больные смогли соблюдать ее в среднем только 3 мес. Мотивации отказа: она безвкусна, существенно меняет образ жизни, вызывает подавленность настроения. У больных с нарушением нутритивного статуса применяли диету с ограничением белка до 0,7 г/кг в сутки (0,6 г/кг обычного пищевого белка и 0,1 г/кг соевого белка в составе высококалорийной смеси). Обязательно назначали кетоаналоги незаменимых аминокислот (Кетостерил). Достигнутая калорийность пищевого рациона составляла в среднем 31 ккал/кг в сутки. В результате в группе больных с выявленными исходно нарушениями нутритивного статуса через 3 мес от начала применения этой диеты достигнута нормализация основных его показателей как у женщин, так и мужчин, у которых нарушения были более выраженными. Для оценки влияния МБД на прогрессирование ХПН мы сопоставили малобелковые диеты № 1 и 2 с обычной (рис. 5).
Рис. 4. Варианты диет у больных с III-IV стадией ХБП Суточная калорийность пищевого рациона в диетах № 1 и 2 составляла 33 ккал/кг, в диете № 3 — 34 ккал/кг. Все 3 варианта сбалансированной малобелковой диеты оказались безопасны: ни в одной группе за время наблюдения не развились нутритивные нарушения. Диеты № 1 и 2 вполне удовлетворительно переносились больными, благодаря чему их могли принимать длительно — более полугода (1/3 больных — до 2,5 года). В то же время диета № 3 переносилась значительно хуже — несмотря на добавки, больные смогли соблюдать ее в среднем только 3 мес. Мотивации отказа: она безвкусна, существенно меняет образ жизни, вызывает подавленность настроения. У больных с нарушением нутритивного статуса применяли диету с ограничением белка до 0,7 г/кг в сутки (0,6 г/кг обычного пищевого белка и 0,1 г/кг соевого белка в составе высококалорийной смеси). Обязательно назначали кетоаналоги незаменимых аминокислот (Кетостерил). Достигнутая калорийность пищевого рациона составляла в среднем 31 ккал/кг в сутки. В результате в группе больных с выявленными исходно нарушениями нутритивного статуса через 3 мес от начала применения этой диеты достигнута нормализация основных его показателей как у женщин, так и мужчин, у которых нарушения были более выраженными. Для оценки влияния МБД на прогрессирование ХПН мы сопоставили малобелковые диеты № 1 и 2 с обычной (рис. 5). 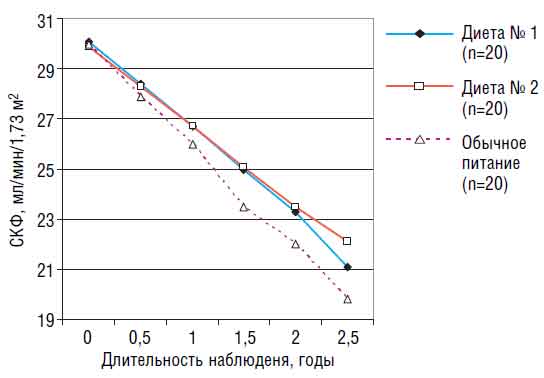 Рис. 5. Влияние разных вариантов диеты на скорость прогрессирования ХПН у больных ХБП III-IV стадии У больных группы контроля, получавших обычную диету, к концу года кривая падения СКФ была близка к расчетной — 4 мл/мин в год. Именно больные группы контроля составили большинство (4 из 5) больных, поступивших к концу 3,5-летнего наблюдения на лечение гемодиализом. У больных, принимавших указанные скорригированные малобелковые диеты не менее 1 года, нами отмечено замедление падения СКФ по сравнению с расчетной в среднем на 0,8 мл/мин в год в группе находившихся на малобелковой диете при применении препарата «Кетостерил» и на 0,6 мл/ мин в год — с добавлением высококалорийной смеси. При этом у больных, соблюдавших указанные диеты более 2,5 года, разница в степени замедления была еще более заметной и составила соответственно 2,4 и 2,2 мл/мин. Естественно, что малобелковую диету следует сочетать с другими мерами, направленными на замедление прогрессирования ХБП: коррекцией анемии, нарушений нутритивного статуса, с применением средств с антигипертензивным, кардио- и нефропротективным действием. Таким образом, несмотря на то что малобелковая диета дороже обычной пищи и требует больших затрат времени, меняет образ жизни и может вызвать депрессию, ее применение у больных ХБП в додиализном периоде оправданно и ее следует включать в общую нефропротективную стратегию. Проф. Н. Мухин. Настоящий клинический разбор убедительно продемонстрировал, что в настоящее время имеются возможности для торможения прогрессирования ХБП и отдаления диализного периода. Это чрезвычайно важно, в том числе с экономической точки зрения, так как посчитано, что даже несколько месяцев продления додиализного периода течения ХБП дают ощутимую экономию материальных затрат. Необходимо дальнейшее объединение усилий специалистов разного профиля — не только нефрологов, но и общих терапевтов, кардиологов, хирургов, клинических фармакологов, диетологов — для осуществления программ профилактики и рационального лечения пациентов с ХБП.
Рис. 5. Влияние разных вариантов диеты на скорость прогрессирования ХПН у больных ХБП III-IV стадии У больных группы контроля, получавших обычную диету, к концу года кривая падения СКФ была близка к расчетной — 4 мл/мин в год. Именно больные группы контроля составили большинство (4 из 5) больных, поступивших к концу 3,5-летнего наблюдения на лечение гемодиализом. У больных, принимавших указанные скорригированные малобелковые диеты не менее 1 года, нами отмечено замедление падения СКФ по сравнению с расчетной в среднем на 0,8 мл/мин в год в группе находившихся на малобелковой диете при применении препарата «Кетостерил» и на 0,6 мл/ мин в год — с добавлением высококалорийной смеси. При этом у больных, соблюдавших указанные диеты более 2,5 года, разница в степени замедления была еще более заметной и составила соответственно 2,4 и 2,2 мл/мин. Естественно, что малобелковую диету следует сочетать с другими мерами, направленными на замедление прогрессирования ХБП: коррекцией анемии, нарушений нутритивного статуса, с применением средств с антигипертензивным, кардио- и нефропротективным действием. Таким образом, несмотря на то что малобелковая диета дороже обычной пищи и требует больших затрат времени, меняет образ жизни и может вызвать депрессию, ее применение у больных ХБП в додиализном периоде оправданно и ее следует включать в общую нефропротективную стратегию. Проф. Н. Мухин. Настоящий клинический разбор убедительно продемонстрировал, что в настоящее время имеются возможности для торможения прогрессирования ХБП и отдаления диализного периода. Это чрезвычайно важно, в том числе с экономической точки зрения, так как посчитано, что даже несколько месяцев продления додиализного периода течения ХБП дают ощутимую экономию материальных затрат. Необходимо дальнейшее объединение усилий специалистов разного профиля — не только нефрологов, но и общих терапевтов, кардиологов, хирургов, клинических фармакологов, диетологов — для осуществления программ профилактики и рационального лечения пациентов с ХБП. Комментарии
ПРАКТИКА ПЕДИАТРА
