Безопасность ингибиторов протонной помпы
СтатьиОпубликовано в журнале:
«Клинические перспективы гастроэнтерологии, гепатологии», 2009, №4, с. 22-28
Т.Л. Лапина
Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х.Василенко Московской медицинской академии им. И.М.Сеченова
Цель обзора. Представить данные о возможных лекарственном взаимодействии и побочных эффектах ингибиторов протонной помпы(ИПП).
Последние данные литературы. Спектр нежелательных эффектов ИПП широко представлен в научной литературе, и по результатам многих крупномасштабных исследований, по своим характеристикам мало отличается от нежелательных эффектов блокаторов H2-рецепторов гистамина и плацебо. Наиболее значимо лекарственное взаимодействие с антагонистами витамина К, бензодиазепинами и фенитоином. Показано взаимодействие на уровне изоэнзима 2C19 цитохрома P450 с клопидогрелем, в результате которого снижается антиагрегантный эффект последнего. Прием ИПП может быть связан с увеличением риска развития остеопороза и внебольничной пневмонии, однако механизмы и клиническая значимость этих фактов требуют дальнейшего изучения.
Заключение. Высокая эффективность ИПП делает этот класс лекарственных средств одним из наиболее широко распространенных. Имеющиеся данные о лекарственном взаимодействии, основанные на большом клиническом опыте и результатах научных исследований, позволяют с высокой степенью достоверности спрогнозировать риск развития нежелательных эффектов для каждого конкретного пациента.
Ключевые слова: ингибиторы протонной помпы, клопидогрель, остеопороз, пневмония.
Ингибиторы протонной помпы (ИПП) следует рассматривать как базисные препараты в лечении больных с широко распространенными и социально значимыми кислотозависимыми заболеваниями. ИПП принимают миллионы людей. При таких заболеваниях, как рефлюкс-эзофагит, синдром Золлингера–Эллисона, требуется длительное лечение – месяцы, годы, а иногда пожизнено. При условии большой потребности населения в этих препаратах и часто продолжительном их назначении, вопросы безопасности ИПП приобретают особую актуальность.
Избирательность действия ИПП
Фармакологическая основа безопасности ИПП обеспечивается избирательностью их распределения и накопления в организме, а также специфичностью их взаимодействия с молекулой-мишенью – Н+-, К+-зависимой АТФазой – протонным насосом париетальной клетки желез желудка. Чем выше избирательность действия лекарственного средства, тем оно лучше переносится и вызывает меньшее число нежелательных реакций. ИПП распределяются главным образом внеклеточно и имеют небольшой объем распределения. После перорального приема всасывание ИПП происходит в тонкой кишке (лекарственные формы препаратов энтеросолюбильны) и он попадает в кровоток. Производное бензимидазола транспортируется к месту действия – слизистой оболочке желудка, и путем диффузии накапливается в просвете секреторных канальцев париетальной клетки. Там происходит протонирование атома азота пиридинового кольца молекулы ИПП и переход в активную форму – сульфенамид, благодаря чему становится возможным связывание с тиоловыми группами цистеина в составе протонной помпы и блокирование этого фермента. Принципиальным свойством этого класса лекарственных препаратов является избирательное накопление в кислой среде секреторных канальцев париетальной клетки. Заряженные (протонированные) формы замещенных бензимидазолов проникают через биологические мембраны хуже, чем незаряженные, поэтому они концентрируются там, где рН ниже рК и происходит их протонирование. В живой клетке есть компартменты с кислой средой – лизосомы, нейросекреторные гранулы и эндосомы, где рН 4,5–5,0. При полной стимуляции париетальной клетки рН секреторного канальца составляет 0,8. Таким образом, для избирательного накопления именно в секреторном канальце рК ИПП должен быть ниже 4,5. Концентрация этих препаратов в секреторных канальцах париетальной клетки в 1000 раз превосходит их концентрацию в крови [2, 19].
ИПП и взаимодействие лекарственных средств
Так как метаболизм ингибиторов протонной помпы совершается в печени цитохромом Р450, то эти препараты могут влиять на печеночный метаболизм других лекарственных средств. В клинической практике лекарственное взаимодействие с участием замещенных бензимидазолов редко имеет существенное значение (табл. 1). Тем не менее, например, рекомендуется тщательно наблюдать за пациентами, одновременно принимающими омепразол и фенитоин или варфарин. Возможно, что лансопразол влияет на метаболизм теофиллина через CYP1A2 [1].
Таблица 1. Взаимодействие лекарственных средств [1]
| Лекарственное средство | Результат взаимодействия |
|
Ингибиторы протонной помпы |
|
| Противогрибковые: | |
| итраконазол | Возможно снижение абсорбции итраконазола |
| кетоконазол | Снижение абсорбции кетоконазол |
| Сердечные гликозиды: | |
| дигоксин | Возможно повышение плазменных концентраций дигоксина |
|
Лансопразол |
|
| Антациды и сукральфат | Снижение абсорбции лансопразол |
| Эстрогены и прогестагены: | |
| контрацептивы пероральные | Может ускоряться метаболизм пероральных контрацептивов |
| Противоэпилептические | Взаимодействие с лансопразолом варьирует |
|
Омепразол |
|
| Бензодиазепины: | |
| диазепам | Омепразол ингибирует метаболиз диазепама (возможно усиление действия) |
| Противоэпилептические: | |
| фенитоин | Усиление действия фенитоина |
Другой вариант лекарственного взаимодействия обусловлен активным влиянием ингибиторов протонной помпы на интрагастральный рН: препараты, абсорбция которых может меняться в зависимости от рН, скорее всего, неустойчивы в кислой или щелочной среде, относятся к слабыми основаниями или слабым кислотами, или имеют рН-зависимую лекарственную мформу. Увеличение абсорбции (для дигоксина, нифедипина, аспирина, мидазолама, диданозина, метадона, панкреатических ферментов), как правило, не имеет клинического значения. Снижение абсорбции описано для кетоконазола, итраконазола, цефподоксима, эноксацина, индинавира. Есть сообщения о снижение клинической эффективности кетоконазола и итраконазола при сочетанном применении их с ИПП.
Оценка важности лекарственных взаимодействий для омепразола, лансопразола и пантопразола за время прошедшее с момента их появления на рынке (более 10 лет) в практическом здравоохранении представлена в табл. 2. Официально зарегистрированы единичные клинически значимые случаи лекарственного взаимодействия на миллионы выписанных рецептов [13].
Таблица 2. Официальная статистика о взаимодействии лекарственных средств
| Лекарственное средство | Kоличество проданных в мире упаковок, абс. число |
Официально зарегистрированные случаи лекарственного взаимодействия (по данным FDA, США) | |||
| Антагонисты витамина К | Бензодиазепины, абс. число | Фенитоин, абс. число | |||
| Абс. число | Частота на 1 млн проданных упаковок | ||||
| Омепразол | 950 100 000 | 81 | 0,09 | 5 | 3 |
| Лансопразол | 195 400 000 | 21 | 0,11 | 8 | 2 |
| Пантопразол | 79 600 000 | 9 | 0,11 | 1 | 1 |
Представляется принципиально важным и значимым обнаруженное недавно взаимодействие ИПП и клопидогреля: имеются серьезные данные о том, что ИПП снижают антиагрегантный эффект клопидогреля, что несет риск развития соответствующих осложнений. Механизм такого взаимодействия изучается. Возможно, что омепразол ингибирует образование активного метаболита клопидогреля, который и обеспечивает собственно антиагрегантный эффект, возможно это взаимодействие на уровне цитохрома P450 в печени (субъединица CYP2C19).
У больных, госпитализированных по поводу острого коронарного синдрома, ретроспективно (по данным 2003–2006 гг.) оценивали исходы при лечении клопидогрелем в сочетании с ИПП, назначенными для предотвращения нежелательных эффектов на слизистую оболочку желудка и двенадцатиперстной кишки, и без назначения ИПП. При одновременном приеме клопидогреля и ИПП смерть и повторная госпитализация по поводу острого коронарного синдрома наступили у 29,8%, без ИПП – у 20,8%. Показатель отношение шансов (ОШ) составил 1,25 (95% ДИ 1,11–1,41). При анализе вторичных исходов больший риск повторных госпитализаций также наблюдался у лиц, которые одновременно принимали клопидогрель и ИПП (14,6% против 6,9%; ОШ 1,86; 95% ДИ 1,57–2,20), как и больший риск вмешательств для реваскуляризации (15,5% против 11,9%; ОШ 1,49; 95% ДИ 1,30–1,71). Повышение риска общей смертности зафиксировано не было (19,9% против 16,6%; ОШ 0,91; 95% ДИ 0,80–1,05). Прием ИПП без клопидогреля не был ассоциирован с риском смерти или повторной госпитализации (для n = 6450 ОШ 0,98; 95% ДИ 0,85–1,13) [9]. Общество интервенционной кардиологии (SCAI) на своей ежегодной конференции в мае 2009 г. выпустило пресс-релиз, в котором представлены итоги еще одного широкомасштабного исследования (16 690 больных, получавших клопидогрель после стентирования) и высказываются предостережения относительно одновременного назначения клопидогреля или тиклодипина и ИПП. Также приводятся данные о повышение частоты сердечно-сосудистых осложнений при применении такой комбинации препаратов.
Побочные эффекты ИПП
Сами по себе ИПП редко вызывают побочные эффекты, скорее речь идет о нежелательных явлениях (adverse events), о которых сообщают пациенты, участвующие в клинических исследованиях, в том числе устанавливающих профиль безопасности препарата. Насколько эти нежелательные явления относятся непосредственно к эффекту бензимидазолов можно судить не всегда, тем более, что нередко частота побочных эффектов такая же, как и в плацебо-группе. Описываемые побочные эффекты, как правило, выражены незначительно и носят обратимый характер. Со стороны желудочно-кишечного тракта указывают диарею, запор, боль в животе, тошноту, преходящее повышение активности аминотрансфераз; со стороны центральной и периферической нервной системы – головную боль, головокружение, сонливость.
Встречаются кожные реакции в виде сыпи и(или) зуда. Для различных ИПП имеются единичные наблюдения о выраженных побочных эффектах, непереносимости и идеосинкразии.
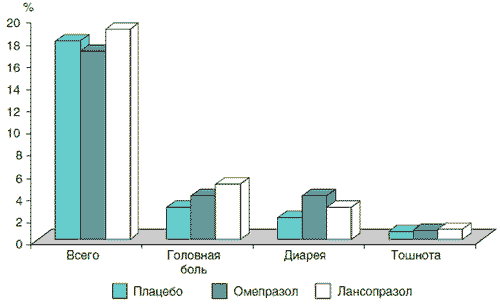
Доступны данные сравнения безопасности ИПП с ранее широко распространенными антисекреторными препаратами – блокаторами Н2-рецепторов, чьи фармакологические характеристики и особенности краткосрочного и длительного применения были хорошо изучены. Результаты анализа наиболее частых (превышающих 1%) нежелательных явлений при назначении омепразола (n=2818) и ранитидина (n=1572) на срок от 2 до 12 нед при язвенной болезни и рефлюкс-эзофагите представлены на рис. 1 [10]. По данным W. Creutzfeldt, профиль безопасности омепразола в клинических исследованиях за 10 лет, включивших 25 000 больных, такой же, как у блокаторов Н2-рецепторов гистамина [3]. Имеются результаты сравнения безопасности различных ИПП между собой и с плацебо (рис. 2) [6]. Заключением этих исследований является то, что частота и профиль побочных эффектов этих лекарственных средств такой же, как у плацебо.
Рис. 1. Наиболее частые нежелательные явления при применении омепразола (n=2818) и ранитидина (n=1572) [10]
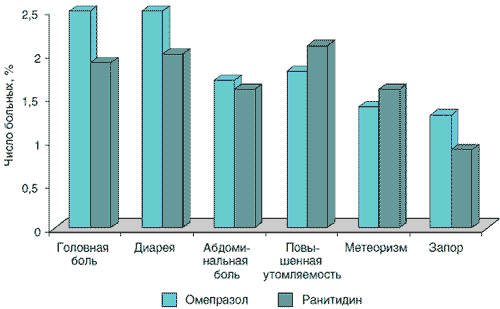
Рис. 2. Частота регистрации нежелательных явлений при кратковременном применении омепразола 20 мг (n=431), лансопразола 30 мг (n=422) и плацебо (n=213) [6]
Из исследований, посвященных анализу длительного лечения ИПП, обратимся к результатам E.C. Klikenberg-Knol и соавт.: омепразол в дозе 20–40 мг использовали в качестве поддерживающего лечения больных с тяжелой формой гастроэзофагеальной рефлюксной болезни (ГЭРБ) [11]. Средний срок наблюдения 6,5 лет, максимальный – 11,2 года. Средняя частота нежелательных явлений в год лечения составила 0,52%, что позволило авторам сделать вывод о безопасности длительной поддерживающей терапии омепразолом больных с рефлюкс-эзофагитом при высокой эффективности сохранения ремиссии (в среднем 1 эпизод обострения на 9,4 года наблюдения) [11].
Противопоказанием к назначению ИПП является только непереносимость препаратов этой группы. Коррекции дозы ИПП при почечной недостаточности не требуется, осторожность необходима только при выраженном нарушении функции печени.
Побочные эффекты ИПП как мощных антисекреторных препаратов
Особого обсуждения заслуживают вопросы безопасности ИПП, связанные с их мощным антисекреторным эффектом. При применении препаратов этой группы развивается обратимая гипергастринемия, обусловленная реакцией G-клеток на повышение внутрижелудочного рН. Кислотная продукция регулируется по механизму отрицательной обратной связи: при сдвиге рН в щелочную сторону происходит активизация гастринпродуцирующих клеток и секреция гастрина, который воздействует и на париетальные клетки непосредственно, и на энтерохромаффино-подобные (ECL) клетки. Гастрин и гистамин, продуцируемый ECL-клетками, служат активирующими стимулами для париетальных клеток – возобновляется кислотная продукция. При назначении ИПП интрагастральный рН находится под лекарственным контролем, а ответная гипергастринемия является ожидаемым эффектом.
Какими могут быть последствия гипергастринемии при длительном назначении ИПП? В эксперименте на крысах при долговременном введении ИПП показано существенное увеличение уровня гастрина и возможность возникновения карциноидных опухолей, исходящих из ECL-клеток. Причем гиперплазия ECL-клеток зависит от дозы ИПП и от пола животного [4, 7]. В дальнейшем были выделены существенные различия между вероятностью развития опухолей из ECL-клеток в эксперименте на крысах и при применении ИПП у человека: различная подверженность повреждению слизистой оболочки желудка гипергастринемии (в эксперименте гипергастринемия развивается лишь при пожизненном приеме ИПП) и видовая генетическая предрасположенность ECL-клеток крыс к гиперплазии [5].
Обобщая опыт применения ИПП у человека за все истекшие годы, следует констатировать, что не зафиксировано ни одного случая возникновения не только карциноида, но даже предстадий карциноида. Терапия лансопразолом длительностью до 4 лет, омепразолом – до 7 лет не была связана с каким-либо неопластическим или диспластическим процессом в эндокринных или неэндокринных клетках желудка.
Интересные данные получены при синдроме Золлингера–Эллисона: через 5 лет лечения омепразолом в высоких дозах (до 360 мг в сутки) повышение уровня гастрина было обусловлено только самим заболеванием, и на фоне терапии не возрастало [16, 18].
В уже упоминавшемся 11-летнем исследовании больных ГЭРБ с поддерживающей терапией омепразолом изучали уровень гастрина. Оказалось, что на фоне приема ИПП в группе больных, инфицированных H. pylori, среднее значение гастрина по сравнению с исходным составило 200%, в группе больных, не инфицированных H. рylori, – 161%. Отдельно рассматривали 2 случая высокой гипергастринемии (рост от исходных повышенных значений 430% и 173% до 6320% и 9650% соответственно), которая наблюдалась у людей старческого возраста с выраженной атрофией слизистой оболочки тела желудка, причем оба пациента были H. pylori-позитивными. Негативного клинического или морфологического значения гипергастринемия не имела [11]. Высказывается предположение, что гипергастринемия связана с инфицированием H. pylori. Так, по данным B. Schenk и соавт. (1998), среди больных, получавших омепразол и сохранявших нормогастринемию, H. pylori обнаружен в 14,2% случаев, а при гипергастринемии H. pylori обнаружен в 75% случае, что сопровождалось более выраженным гастритом с атрофией слизистой оболочки фундального отдела желудка [21].
В дальнейшем ряд авторов опубликовали данные об ускоренном развитии атрофии слизистой оболочки желудка, особенно в области тела, при поддерживающей терапии блокаторами Н2-рецето-ров гистамина и ИПП [12, 14]. Почему этот факт должен насторожить врачей с точки зрения безопасности терапии? Дело в том, что атрофический гастрит – это предраковое заболевание. При более подробном изучении взаимоотношения атрофического гастрита и ИПП оказалось, что ИПП не оказывают никакого влияния на морфологию слизистой оболочки желудка. Причина хронического гастрита – инфекция H. pylori. ИПП, оказывая существенное антисекреторное влияние, повышают рН в микроокружении бактерии, делая их практически нежизнеспособными. При монотерапии ИПП H. pylori перераспределяется по слизистой оболочке желудка – из антрального отдела переходят в тело желудка с более низкими значениями рН.
Для уточнения этого вопроса было спланировано исследование 309 больных ГЭРБ с рандомизированными группами – на фоне поддерживающей терапии омепразолом в течение 3 лет и после операции фундопликации. Оказалось, что никакой связи между прогрессированием атрофического гастрита и примемом омепразола нет. В обоих группах прогрессирование атрофического гастрита шло обычными темпами лишь на фоне наличия в желудке H. pylori [17]. B.E. Schenk и соавт. [22] исследовали характеристики гастрита при ГЭРБ в течение 12 мес на фоне лечения омепразолом по 40 мг в сутки в трех группах больных: В первую группу вошли H. pylori-позитивные больные, которым провели эрадикационную терапию. Вторую группу составили H. pylori-позитивные больные, которые вместо эрадикационной терапии получали плацебо. В третью группу включены пациенты, у которых инфекция H. pylori не обнаружена. При сохранении H. pylori активность воспаления увеличилась в теле желудка, уменьшилась в антральном отделе. При успешной эрадикации H. рylori активность воспаления уменьшилась и в теле желудка, и в антральном отделе. У больных исходно без инфекции H. pylori никаких гистологических изменений не выявлено [22].
Одной из «классических» функцией кислоты желудочного сока считается бактерицидная. При назначении ИПП, обладающих мощным антисекреторным эффектом, следует опасаться того, что эта функция будет нарушена. Действительно, среди причин синдрома избыточного бактериального роста в тонкой кишке называют и прием ИПП. J. Leonard и соавт. провели систематический обзор для определения значения ИПП для развития кишечных инфекций. При анализе 2948 случаев колита, вызванного Clostridium difficile, оказалось, что антисекреторная терапия действительно служит фактором риска. Причем прием ИПП в большей степени увеличивает риск развития кишечных инфекций, чем блокаторы Н2-рецепторов. Отношение шансов при псевдомембранозном колите для ИПП составило 1,96 (95% ДИ 1,28–3,00), а при анализе 11 280 случаев инфекции Salmonella, Campylobacter и др. – 3,33 (95% ДИ 1,84–6,02). Авторы обзора отмечают выраженную гетерогенность результатов анализируемых исследований и делают осторожный вывод о том, что имеется ассоциация между кислотсупрессивной терапией и риском кишечных инфекций, которая нуждается в дальнейшем изучении [15].
Некоторые процессы абсорбции требуют нормальной кислотной продукции, кроме того всасывание зависит от состояния бактериальной микрофлоры. Неоднократно проверялась гипотеза воз можной мальабсорбции при приеме ИПП. В специальных исследованиях не удалось убедительно показать мальабсорбцию жира или минеральных веществ. У некоторых пациентов, годами находящихся на лечении ИПП, оказывается сниженным уровень витамина В12. Клиническая значимость такого снижения вызывает вопросы. Так, у 46 больных с синдромом Золлингера–Эллисона и у 15 человек с желудочной гиперсекрецией (базальная кислотная продукция >15 ммоль/ч), длительно принимавших лансопразол (до 18 лет приема препарата), в 10% случаев было выявлено снижение сывороточного витамина В12 без признаков гиперхромной анемии [8].
При применении ИПП, тем не менее, подозревают снижение абсорбции кальция, а следовательно и минеральной плотности костной ткани. Вместе с тем имеются единичные сообщения о том, что омепразол снижает резорбцию кости путем ингибирования H+-,K+-АТФазы остекластов. Для того, чтобы оценить эти противоречивые данные в аспекте остеопороза, было предпринято исследование «случай–контроль», которое использовало базу данных врачей общей практики Великобритании (General Practice Research Database), включавшую 9,4 млн человек. Были выделены когорты – лица старше 50 лет, принимавшие ИПП в стандартной дозе и не принимавшие ИПП. В качестве случая был выбран исход – перелом шейки бедра. При анализе базы данных выявлено 13 556 случаев переломов шейки бедра (10 834 у лиц, не принимавших ИПП, и 2722 у лиц, принимавших ИПП), 135 386 человек вошло в группу контроля. ОШ для перелома шейки бедра при приеме ИПП более чем 1 год составило 1,44 (95% ДИ 1,30–1,59); ОШ для ИПП в высокой дозе 2,65 (95% ДИ 1,80–3,90). Риск менялся в зависимости от длительности приема ИПП: ОШ при приеме ИПП 1 год – 1,22; 2 года – 1,41; 3 года – 1,54; 4 года – 1,59. Интересно, что ОШ для мужчин составил 1,78, а для женщин был ниже 1,36, хотя женский пол служит фактором риска остеопороза [25]. Несмотря на то, что в исследовании P. Vestergaard и соавт. [24] также выявлено увеличение риска переломов шейки бедра, эта группа авторов не смогла выявить связи ни с дозой, ни с продолжительностью назначения ИПП. L.E. Targownik и соавт. [23] выявили увеличении риска перелома шейки бедра только после 5-летнего постоянного приема ИПП, а любого другого перелома вследствие остеопороза – лишь через 7 лет (!) непрерывного приема ИПП. По данным этой группы авторов, 4-летний (или менее продолжительный) прием ИПП не был связан с остеопорозом и переломами, а вычисленный ими риск переломов при приеме ИПП сравним с влиянием на этот показатель табакокурения, низкого индекса массы тела или избыточного приема алкоголя.
Таким образом, разные исследования, показавшие связь ИПП с остеопорозом и переломами костей, находятся в противоречии в оценке этого риска. Принципиальным кажется установление значения продолжительности приема ИПП, так как очевидно, что изменение процессов костного ремоделирования и существенного снижения минеральной плотности костей требует весьма продолжительного времени для того, чтобы эти показатели имели значимый клинический исход.
Также с использованием административной базы данных врачей общей практики Великобритании, было предпринято изучение частоты развития внебольничной пневмонии в зависимости от приема ИПП. Было выявлено 80 066 случаев пневмонии, в контрольную группу вошли 799 881 человек. Вычислено ОШ при текущем приеме ИПП, оно составило 1,02 (95% ДИ 0,97–1,08, недостоверно). В случае начала приема ИПП за 2 дня до заболевания пневмонией ОШ составило 6,53 (ДИ 3,95–10,80), за 7 дней – 3,79 (ДИ 2,66–5,42), за 14 дней – 3,21 (ДИ 2,46–4,18). Авторы делают вывод о том, что начало приема ИПП в течение 30 дней, предшествующих заболеванию, связано со случаями внебольничной пневмонии [20]. Данная исследовательская группа (анализ частоты переломов шейки бедра и развития внебольничной пневмонии сделан одними и теми же авторами) не претендует на описание механизмов или причин, которые бы могли объяснить выявленную ассоциацию. Вместе с тем, очевидно – факт установления связи, не означает, что эта связь причинно-следственная.
В завершение следует отметить, что ИПП относятся к одному из наиболее безопасных классов лекарственных средств. Опубликованные и официально зарегистрированные компетентными органами данные по побочным реакциям доступны практикующему врачу, что позволяет в каждом конкретном случае оценить пользу и риск для каждого пациента, исходя из необходимой ему дозы и продолжительности лечения. Персональный риск для конкретного больного представляется крайне малой величиной. Исключение, пожалуй, составляют пациенты, которым показано назначение клопидогреля или двойной терапии клопидогрелем и аспирином. Следует признать, что сочетание клопидогреля и ИПП (и для профилактики гастропатии, и для лечения, например, ГЭРБ) небезопасно, хотя в доступной на июнь 2009 г. информационной базе нет официального запрещения такой комбинации лекарственных средств.
Требуется взвешенный подход к назначению ИПП, как и любого другого лекарственного средства, особенно на длительное время (годы), в дозах больших, чем стандартные, обязательно с учетом возможной индивидуальной непереносимости препаратов. Вместе с тем объективно доказано на примере многих тысяч больных, что рутинное назначение ИПП в составе эрадикационной терапии H. pylori (14 дней) для заживления язв или эрозий, в том числе индуцированных приемом нестероидных противовоспалительных средств (14–56 дней), лечения функциональной диспепсии (14–28 дней) и даже для курсового (28–56 дней) и поддерживающего лечения ГЭРБ (6–12 мес и больше), отвечает не только требованиям эффективности, но и безопасности.
ЛИТЕРАТУРА
1. Белоусов Ю.Б., Леонова М.В.Основы клинической фармакологии и рациональной фармакотерапии // М., ОАО Изд-во «Бионика». – 2002. – С. 254 – 258.
2. Ивашкин В.Т.// М., Изд-во «Литтерр-ра». – 2003. – С….
3. Creutzfeldt W. Efficacy and safety of proton pump inhibitors during long-term treatment // In: Olbe L., Iton J. Safety and efficacy of proton pump inhibitors. – Amsterdam: Excerpta Medica. – 1993. – P. 23–36.
4. Ekman L., Hansson E., Havu N. et al. Toxicological studies on omeprazole. // Scand. J.Gastroenterol. – 1985. – Vol. 20 (Suppl. 108). – P. 53–69.
5. Freston J.W., Borch K., Brand S.J.et al. Effects of hypochlorhydria and hypergastrine-mia on structure and function of gastrointestinal cells: a review and analysis // Dig. Dis. Sci. – 1995. – Vol. 40 (Suppl). – 50S–62S.
6. Freston J.W., Rose P.A., Heller C.A. et al. Safety profile of lansoprazole // Drug safety. – 1999. – Vol. 20. – P. 195–205.
7. Havu N.Enterochromaffin-like cell car-cinoids of gastric mucosa in rats after life-long inhibition of gastric secretion // Digestion. – 1986. – Vol. 35 (Suppl. 1). – P. 42–55.
8. Hirschowitz B.I., Worthington J., Mohnen J. Vitamin B12 deficiency in hyper-secretors during long-term acid suppression with proton pump inhibitors //Aliment. Pharmacol. Ther. – 2008. – Vol. 27, N 11. – P. 1110-21.
9. Ho P.M., Maddox T.M., Wang L. et al. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome // JAMA. – 2009. – Vol. 301, N 9. – P. 937–44.
10. Joelson S., Joelson I.-B., Lundborg P. et al. Safety experience from long-term treatment with omeprazole // Digestion. – 1992. – Vol. 51 (Suppl 1.). – S. 93–101.
11. Klikenberg-Knol E.C., Nelis F., Dent J. et al. Long-term omeprazole treatment in resistant gastroesophageal reflux disease: efficacy, safety and influence on gastric mucosa // Gastroenterology. – 2000. – Vol. 118. – P. 661–9.
12. Kuipers E.J., Lundell L., Klikenberg-Knol E.C. et al. Atrophic gastritis and Helicobacter pylori infection in patients with reflux oesophagitis treated with omeprazole or fundoplication // N. Engl. J. Med. – 1996. – Vol. 334. – P. 1018–22.
13. Labenz J., Peterson K.U., Rosch, Koelz. A summary of Food and Drug Administration – reported adverse events and drug interactions occurring during therapy with omeprazole, lansorazole and pantoprazole // Aliment. Pharmacol. Ther. – 2003. – Vol. 17. – P. 1015–9.
14. Lambert R., Creutzfeldt W., Struber H.G. et al. Long-term omeprazole therapy in peptic ulcer disease: gastrin, endocrine cell growth, and gastritis // Gastroenterology. – 1993. – Vol. 104. – P. 1356–70.
15. Leonard J., Marshall J.K., Moayyedi P. Systematic review of the risk of enteric infection in patients taking acid suppression. // Am. J. Gastroenterol. – 2007. – Vol. 102, N 9. – P.2047–56.
16. Lloyd-Davies K.A., Rutgerssonet K., Solvell L. Omeprazole in Zollinger-Ellison syndrome: four-year international study // Gastroenterology. – 1986. – Vol. 90. – 1523 (abstract).
17. Lundell L., Meittinen P., Myrvold H.E. et al. Lack of effect of acid suppression therapy on gastric atrophy // Gastroenterology. – 1999. – Vol. 117.–P. 319–26.
18. Maton P., McArthur K., Wank S.et al. Long-term efficacy and safety of omeprazole in Zollinger-Ellison syndrome // Gastroenterology. – 1986. – Vol. 90. – 1537 (abstract).
19. Modlin I.M., Sachs G. Acid related diseases. Biology and treatment. // Schnetztor-Verlag Gmbh, Konstanz. – 1998. – P. 126–42.
20. Sarkar M., Hennessy S., Yang Y.X. Proton-pump inhibitor use and the risk for community-acquired pneumonia // Ann. Intern. Med. - 2008. – Vol.149, N6. – P. 391–8.
21. Schenk B., Kuipers E., Klikenberg-Knol E.C. et al. Hypergastrinaemia during long-term omeprazole treatment: influences of vagal nerve function? Gastric emptying and Helicobacter pylori infection // Aliment. Pharmacol. Ther. – 1998. – Vol. 12. – P. 605–12.
22. Schenk B., Kuipers E., Nelis G.F.et al. Effect of Helicobacter pylori eradication in chronic gastritis during omeprazole therapy // Gut. – 2000. – Vol. 46. – P. 615–21.
23. Targownik L.E., Lix L.M., Metge C.J. et al. Use of proton pump inhibitors and risk of osteoporosis-related fractures // CMAJ. – 2008. – Vol. 179, N 4. doi:10.1503/cmaj.071330.
24. Vestergaard P., Rejnmark L., Mosekilde L. Proton pump inhibitors, histamine Н2-receptor antagonists, and other antacid medications and the risk of fracture // Calcif. Tissue. Int. – 2006. – Vol. 79. – P.76–83.
25. Yang Y.X., Lewis J.D., Epstein S., Metz D.C. Long-term proton pump inhibitor therapy and risk of hip fracture // JAMA. – 2006. – Vol. 296, N24. – P. 2947–53.
Комментарии
ПРАКТИКА ПЕДИАТРА
