Эффективность и безопасность Мовалиса в лечении заболеваний опорно-двигательного аппарата
СтатьиОпубликовано в журнале:
«ФАРМАТЕКА», 2009, № 11, с. 28-33
Н.В. Чичасова
Кафедра ревматологии ФППОВ ММА им. И.М. Сеченова, Москва
Лечение хронических заболеваний опорно-двигательного аппарата является сложной врачебной проблемой. Преимущественно пожилой возраст больных, наличие сопутствующих заболеваний и необходимость в связи с этим соответствующего лечения осложняют проведение противовоспалительной и обезболивающей терапии. Однако наиболее часто применяемые классические нестероидные противовоспалительные средства помимо положительного лечебного действия часто вызывают развитие побочных эффектов со стороны желудочно-кишечного тракта, печени, почек, бронхов, что значительно лимитирует проведение адекватной терапии. Представитель класса селективных ингибиторов циклооксигеназы-2 мелоксикам (Мовалис) имеет сходную с классическими препаратами эффективность, но гораздо лучше переносится, в т. ч. и лицами пожилого возраста. Представлены результаты научных исследований и реальной клинической практики, свидетельствующие об эффективности и безопасности Мовалиса.
Ключевые слова: ревматические заболевания, противовоспалительная терапия, нестероидные противовоспалительные средства, селективные ингибиторы циклооксигеназы-2, побочные явления, мелоксикам
Миллионы людей страдают от болей в суставах и позвоночнике при ревматоидном артрите (РА), спондилоартропатиях и остеоартрозе (ОА) – наиболее частых артрологических заболеваниях. Боли в периартикулярных тканях и мышцах сопровождают многие заболевания либо возникают как самостоятельное страдание. В различные периоды жизни боль в связи с поражением компонентов опорно-двигательного аппарата встречается у 20–45 % населения земного шара, чаще у женщин, чем у мужчин, и в старших возрастных группах [1]. Болевой синдром может быть острым при травмах, инфекционном поражении, микрокристаллических артропатиях. Но при артрологических заболеваниях боль, как правило, носит хронический характер различного генеза: чаще всего воспалительного, а также механического, сосудистого, нейрогенного, психосоматического, что требует непрерывной многомесячной и многолетней терапии для улучшения качества жизни больных.
Хронический характер болевого синдрома большинства ревматических заболеваний (РЗ) обусловлен развитием воспаления в синовиальной оболочке суставов в связи с гиперпродукцией большого количества провоспалительных агентов, модуляцией функции иммунокомпетентных клеток и их пролиферацией, деструктивным действием протеаз [2]. Даже ОА – заболевание, принятое относить к дегенеративным поражениям суставов, характеризуется развитием синовита и является показанием к назначению препаратов, купирующих воспалительный процесс. Болевой синдром неизбежно сопутствует воспалению в суставе, хотя его интенсивность не всегда коррелирует с выраженностью воспалительного процесса.
Требования к медикаментозной терапии, способной уменьшить выраженность воспаления и боли, с учетом необходимости длительного приема препаратов определяются выраженностью анальгетического и противовоспалительного эффектов и безопасностью. Наиболее сложными для лечения являются хронические артриты, к которым относят РА, анкилозирующий спондилоартрит, или болезнь Бехтерева, и псориатическую артропатию. Эти заболевания характеризуются многолетним персистированием активности воспаления, что приводит к деструктивным процессам в суставах и постепенной утрате функции опорно-двигательного аппарата. Лечение хронических артритов требует многолетней комплексной противовоспалительной терапии с использованием симптоматических (нестероидных [НПВС] и стероидных противовоспалительных препаратов) и базисных противовоспалительных средств (цитостатиков, сульфасалазина и др.). Во-первых, необходимо уменьшать боли в суставах и облегчать состояние больного, во-вторых, следует замедлять прогрессирование необратимых анатомических изменений в суставах.
Таким образом, несмотря на определенные успехи в разработке методов купирования болевого синдрома, существуют конкретные проблемы в проведении противовоспалительной терапии РЗ, основные из которых можно сформулировать следующим образом:
- разнообразие причин болевого синдрома при РЗ:
- воспаление синовиальной оболочки и сухожилий;
- деградация хряща и изменения в субхондральной кости;
- спазм периартикулярных мышц;
- изменения сосудов в тканях, окружающих сустав;
- периферическая невропатия и невриты;
- преимущественное развитие РЗ у лиц пожилого возраста, имеющих сопутствующие заболевания, в первую очередь сердечнососудистой системы и желудочно-кишечного тракта (ЖКТ) [2];
- отрицательное действие ряда анальгетических средств на внутренние органы и системы, на гомеостаз хряща [3];
- отрицательные последствия применения при хронических воспалительных заболеваниях суставов симптоматических средств в сочетании с медленнодействующей агрессивной терапией.
Проблема коморбидности всегда беспокоит клиницистов. В последние годы появляются все новые данные о частоте сопутствующей патологии у пациентов с заболеваниями опорно-двигательного аппарата, в первую очередь у больных ОА. Данные обследования более 9000 больных РЗ, проведенного в Сербии, приведены на рис. 1 [4].
Рис. 1. Сопутствующие заболевания у 9704 пациентов, леченных НПВС врачами общей практики
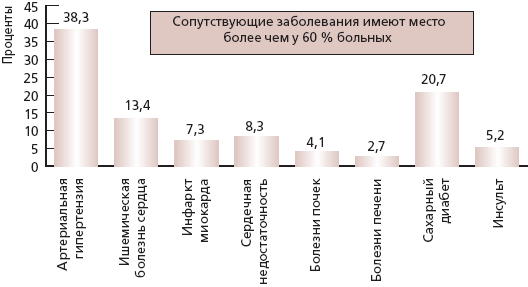
НПВС назначают практически облигатно при всех РЗ. Эти препараты обладают способностью накапливаться в местах воспаления и в определенных органах: ЖКТ, печени, почках, эндотелии сосудов, слизистой оболочке бронхов. При неселективном подавлении функции циклооксигеназы (ЦОГ) 1-го и 2-го типов именно в этих органах реализуются побочные эффекты при приеме НПВС. Наиболее часто развиваются осложнения НПВС-терапии в ЖКТ [5]. Кроме того, использование НПВС именно у пациентов с воспалительными заболеваниями суставов чаще всего сопряжено с желудочно-кишечными осложнениями [6].
Факторы риска развития желудочно-кишечных кровотечений:
- пожилой возраст (старше 65 лет);
- “язвенный” анамнез;
- желудочно-кишечное кровотечение в анамнезе;
- тяжелое поражение печени, почек со снижением их функции;
- сопутствующие кардиоваскулярные заболевания;
- прием ацетилсалициловой кислоты, антикоагулянтов, кортикостероидов.
Частота желудочно-кишечных кровотечений при приеме НПВС в зависимости от числа факторов риска приведена в табл. 1 [7].
Таблица 1. Частота желудочно-кишечных кровотечений в зависимости от числа факторов риска
| Число факторов риска | Желудочно-кишечные кровотечения, % |
| 0 | 0,8 |
| 1 | 2,0 |
| 2 | 8,6 |
| 3 | 18,0 |
По современным представлениям, наличие хотя бы одного фактора риска развития побочных эффектов НПВС является показанием к использованию селективных ингибиторов ЦОГ-2 или неселективных НПВС в комбинации с ингибиторами протонной помпы. При наличии нескольких факторов риска непереносимости НПВС выбор врача с учетом данных, приведенных в табл. 1, должен быть однозначно сделан в пользу назначения селективных препаратов.
Таким образом, выбор НПВС зависит от риска развития осложнений, возраста пациента, нозологической формы. Так, при ОА, т. е. у лиц преимущественно пожилого возраста крайне нежелательно применение классических НПВС, особенно с большим периодом полураспада, в первую очередь пироксикама, а также производных индол/инденуксусной кислоты – индометацина – в связи с доказанным отрицательным их влиянием на прогрессирование деградации хряща при ОА. Применяют их только для купирования синовита (т. е. при воспалительном типе боли) и в невысоких дозах в отсутствие факторов риска желудочно-кишечных осложнений. Предпочтительнее и у этих больных использовать селективные ингибиторы ЦОГ-2.
Селективный ингибитор ЦОГ-2 мелоксикам (Мовалис) широко используется в медицинской практике. Он является производным оксикамовой кислоты и имеет большой период полувыведения: максимальная концентрация (Cmax) в плазме после приема 15 мг мелоксикама достигается через 7 часов, время полувыведения составляет 20–24 часа, поэтому препарат назначают 1 раз в сутки в дозе 7,5 или 15,0 мг, что удобно для пациента. Мовалис, структурно отличаясь от других ЦОГ-2 ингибиторов, например “коксибов”, связывается с верхней, а не с боковой частью канала ЦОГ-2, как целекоксиб. Эффективность Мовалиса при лечении больных ОА равна таковой неселективных НПВС (диклофенака, пироксикама) [8], а переносимость намного лучше [9]. Мелоксикам хорошо связывается с белками плазмы (99,5 %) и легко проникает в синовиальную жидкость, где его концентрация составляет 45–57 % от таковой в плазме [10]. Препарат продемонстрировал равнозначную эффективность с неселективными НПВС и при РА, и при анкилозирующем спондилоартрите [11, 12].
В рандомизированных клинических исследованиях показана высокая безопасность мелоксикама. Однако реальная клиническая практика, когда лечение проводится пациентам самого различного возраста, имеющих сопутствующие и подчас тяжелые заболевания и получающих различные медикаменты, ставит перед врачом сложные задачи. Представленные Zeidler H. и соавт. [13] результаты лечения 13 307 пациентов с патологией суставов в обычной врачебной практике в Германии позволяют оценить место мелоксикама на основании мнения 2155 врачей. Большинство (60 %) пациентов до назначения мелоксикама получали другие НПВС: в 43,2 % случаев их применение не было эффективным, а у каждого 5-го больного – непереносимым. В этой группе пациентов частота побочных эффектов, приведших к отмене мелоксикама в дозе 7,5 мг/сут, составила 0,7 %, а 15 мг/сут – 0,6 %; развитие осложненных язв ЖКТ отмечено у 2 из 8652 больных, получавших 7,5 мг/сут мелоксикама и еще у 2 из 4448 больных при суточной дозе мелоксикама 15 мг. Напомним, что применение неселективных НПВС приводит к развитию язв верхних отделов ЖКТ в 12–19 % случаев, а осложненных язв – примерно у 0,4 % больных [14].
Проблемы НПВС-гастропатии довольно часто обсуждаются в литературе. Реже приводятся данные об осложнениях со стороны почек. Неселективные НПВС вызывают снижение уровня простагландинов в почках, что приводит к нарушению экскреции Na, задержке жидкости, развитию артериальной гипертензии или ухудшению ее течения. При этом уменьшается эффективность антигипертензивных препаратов, что диктует необходимость тщательного мониторинга артериального давления и коррекции дозы β-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента, диуретиков. По результатам патологоанатомических исследований, у больных РА, вынужденных годами принимать полноценные терапевтические дозы неселективных НПВС, в 60–100 % случаев развивается интерстициальный нефрит. Возможно развитие острой почечной недостаточности (ОПН). Тщательный анализ риска развития ОПН у больных пожилого возраста проведен в США [15].
По программе оценки эффективности и безопасности лекарственных средств, назначенных между 1999 и 2004 гг. лицам старше 65 лет, были изучены побочные эффекты НПВС при условии их приема 6 и более месяцев. Больные, получавшие два НПВС одновременно, из исследования были исключены. Из 183 446 пациентов, средний возраст которых составил 78 лет, ОПН, приведшая к госпитализации, отмечена у 870. Наиболее частым НПВС, используемым в этой группе больных, был целекоксиб, его принимал каждый третий пациент. В табл. 2 приведены относительный риск (ОР) и 95 % доверительный интервал (ДИ) развития ОПН при приеме различных НПВС по сравнению с целекоксибом. Достоверное увеличение риска развития ОПН на 50 и 100 % получены для ибупрофена и индометацина соответственно. Из табл. 2 видно, что мелоксикам ассоциируется с наименьшим риском развития ОПН среди проанализированных селективных и неселективных НПВС.
Таблица 2. Ассоциация между ОПН и приемом НПВС (ОР и 95 % ДИ) [15]
| Препарат | Конечная точка – ОПН, приведшая к госпитализации (n = 870) | Конечная точка – все случаи ОПН (n = 962) |
| Целекоксиб | 1,0 | 1,0 |
| Рофекоксиб | 1,50 (1,25–1,81) | 1,45 (1,21–1,73) |
| Вальдекоксиб | 1,02 (0,74–1,40) | 1,01 (0,74–1,38) |
| Диклофенак | 0,88 (0,57–1,39) | 0,98 (0,6–1,41) |
| Ибупрофен | 1,42 (1,12–1,89) | 1,57 (1,25–1,96) |
| Индометацин | 3,12 (2,40–4,04) | 2,84 (2,21–3,65) |
| Мелоксикам | 0,83 (0,60–1,14) | 0,93 (0,56–1,55) |
| Напроксен | 1,07 (0,82–1,41) | 1,13 (0,87–1,48) |
Обе эти сводки представляют несомненный интерес для клиницистов, т. к. базируются не на результатах научных исследований, а на основании сообщений практикующих врачей.
В последнее время во врачебную практику внедрены парентеральная форма мелоксикама для внутримышечного введения и его ректальные суппозитории. Необходимость создания внутримышечной формы мелоксикама связана с тем, что при значительном времени полувыведения его концентрация при приеме таблетированной формы стабилизируется в крови пациента только на 3–4-е сутки. Фармакокинетические исследования показали, что внутримышечное введение мелоксикама приводит к более быстрой абсорбции препарата, чем при его пероральном применении; максимальная плазменная концентрация достигается уже через 1,5 часа после внутримышечного введения по сравнению с 5–7 часами после перорального применения [16]. При этом 90 % Cmax достигается уже через 30–50 минут после инъекции.
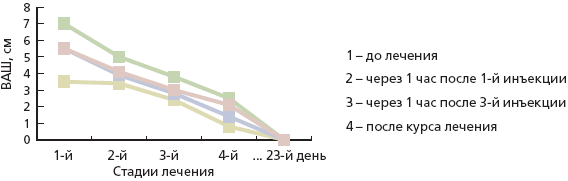
Российское многоцентровое исследование по изучению эффективности внутримышечной формы мелоксикама в лечении 670 пациентов с патологией суставов (ОА – 384 больных и РА – 286 больных) показало (рис. 2), что эффект развивается у большинства больных уже после 1-й инъекции в течение часа. Далее анальгетический эффект увеличивается в течение первых 3 дней и продолжает нарастать при переходе на пероральную форму препарата [17]. Такой ступенчатый способ назначения мелоксикама – внутримышечные инъекции препарата в течение 3 дней и последующий переход на таблетированную форму, может быть полезен при лечении артроза межпозвонковых суставов и при других причинах болей в спине. Ректальные формы НПВС в последние годы используются не столь часто, хотя они имеют ряд преимуществ. Наличие развитой венозной сети в ректальной области определяет быстрое попадание действующего препарата из суппозитория в кровеносное русло, минуя печень. Быстрое развитие выраженного эффекта является реальным преимуществом при использовании ректальной формы мелоксикама. При этом мелоксикам в форме суппозиторий не оказывает местно-повреждающего действия на слизистую оболочку желудка и верхних отделов кишечника. Применение ректальных форм НПВС способно уменьшать частоту диспепсий, что является одной из самых частых причин отмен НПВС – примерно у каждого второго больного. При сравнении переносимости свечевых форм 15 мг мелоксикама и 20 мг пироксикама локальная переносимость мелоксикама была примерно в 2 раза выше, чем пироксикама (частота таких локальных нежелательных явлений, как боли в области анального отверстия, трещины слизистой оболочки ануса, составила соответственно 6,9 и 11,9 %) [18].
Рис. 2. Динамика клинических симптомов на фоне внутримышечного лечения мелоксикамом (М ± SD) [17]
| Симптом | 1-я | 2-я | 3-я | 4-я |
| Боль при движении | 5,3 ± 2,2 | 3,6 ± 2,1* | 2,3 ± 1,8* | 1,1 ± 1,5* |
| Боль в покое | 7,0 ± 1,8 | 4,9 ± 2,1* | 3,3 ± 1,9* | 2,0 ± 1,6* |
| Выраженность синовита | 3,6 ± 2,5 | 3,3 ± 2,4* | 2,1 ± 1,9* | 0,7 ± 1,2* |
| Нарушения функции | 5,2 ± 2,3 | 4,0 ± 2,2* | 2,7 ± 1,9* | 1,5 ± 1,6* |
* р
Мелоксикам наиболее часто назначают больным дегенеративными заболеваниями суставов и позвоночника, что определяется его достаточной эффективностью у этой категории больных и явно лучшей переносимостью по сравнению с неселективными НПВС. Пациенты с воспалительными заболеваниями позвоночника нуждаются в препаратах с выраженным анальгетическим и противовоспалительным эффектом, что приводит к наиболее частому назначению этим больным индометацина или пироксикама – наиболее опасных при длительном лечении средств. Поэтому равнозначная с неселективными средствами эффективность мелоксикама при лечении воспалительных болезней позвоночника является особенно важной. Это дает возможность безопасного обезболивания у больных воспалительными спондилопатиями. Появление парентеральной (ампулированной) и ректальной форм Мовалиса увеличивает возможности индивидуального подбора противовоспалительной терапии у больных различного возраста и с различной переносимостью НПВС. При этом впервые врачи имеют парентеральный препарат для купирования и острого болевого синдрома с селективным ингибированием ЦОГ-2.
ЛИТЕРАТУРА
1. Насонов Е.Л. Болевой синдром при патологии опорно-двигательного аппарата // Врач. 2002. № 4. C. 15-19.
2. Scott D. Text book of rheumatology. Philadelphia. 1999.
3. Чичасова Н.В. Лечение остеоартроза: влияние на хрящевую ткань различных противовоспалительных препаратов // РМЖ. 2005. Т. 13. № 8. C. 539-542.
4. Damjanov M. VI International Meeting, Crete, 2008.
5. Насонов Е.Л., Лазебник Л.Б., Беленков Ю.Н. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. М., 2006. 88 с.
6. Janssen M, Dijkmans B, van der Sluijs FA. Upper gastrointestinal complaints and complication in chronic rheumatic patients in comparison with other chronic diseases. Br J Rheum 1992;31:747-52.
7. Henry D, Lim L, Garcia Rodriguez L, et al. Variability in risk of gastrointenstinal com-plcations with individual non-steroidal anti-inflammatory drugs: results of a collaborative meta-analysis. BMJ 1996;312: 1563-66.
8. Yocum D, Fleishmann R, Dalgin P, etal. Safety and efficacy of meloxicam in the treatment of osteoarthritis: a 12-week, double-blind, multiple doses, placebo-controlled trial. The Meloxicam Osteoarthritis Investigators. Arch Int Med 2000;160:2947-54.
9. Martin RM, Biswas P, Mann RD. The incidence of adverse events and risk factors for upper gastrointestinal disorders associated with meloxicam use amongst 19087 patients in general practice in England: cohort study. Br J Clin Pharmacol 2000; 50:35-42.
10. Lapisque F, Vergne P, Jouzeau J-I, et al. Articular diffusion of meloxicam after a single oral dose: relationship to cyclo-oxygenase inhibition in synovial cells. Clin Pharmokinet 2000;39:369-82.
11. Haskisson EC, Ghozlan R, Kurthen R, et al. A long-term study to evaluate the safety and efficacy of meloxicam therapy in patients with rheumatoid arthritis. Br J Rheum 1996;35(Suppl. 1):29-34.
12. Dougados M, Gueguen A, NakacheJ-P, et al. Ankylosing spondilitis: what is the optimum duration of a clinical study? A one-year versus 6-weeks nonsteroidal antiinflammatory drug trial. Rheumatology 1999;38:235-44.
13. Zeidler H, Kaltwasser JP, Leonard JP, et.al. Prescription and tolerability of meloxicam in day-to-day practice: postmarceting observational cohort study of 13307 patients. J Clin Rheum 2002;8:305-15.
14. Singh G, Triadafilopoulos G. Epidemiology of NSAIDs induced gastrointestinal complications. J Rheum 1999;26(Suppl. 56):18-24.
15. Winkelmeyer WC, Waikar SS, Mogun H, et al. Nonselective and Cyclooxygenase-2-Selective NSAIDs and acute kidney injury. Am J Med 2008;121:1092-98.
16. Davies NM, Skjodt NM. Clinical pharmacokinetics of meloxicam: a cyclo-oxygenase-2 preferential nonsteroidal anti-inflammatory drug. Clin Pharmacokinet 1999;36: 115-26.
17. Цветкова Е.С. Эффективность и переносимость ступенчатой терапии мовалисом (мелоксикамом) при ревматических заболеваниях // Терапевтический архив. 2004. № 12. C. 78-80.
18. Carraba M, Paresce E, et al А comparison of the local tolerability, safety and efficacy of meloxicam and piroxicam suppositories in patients with OA: a single-blind, randomized, multicenter study. Curr Med Res Opin 1995;13(6):343-55.
