Эффективность агомелатина при генерализованном тревожном расстройстве: рандомизированное, двойное-слепое, плацебо-контролируемое исследование
СтатьиEfficacy of Agomelatine in Generalized Anxiety Disorder: A Randomized, Double-Blind, Placebo-Controlled Study
Dan J. Stein, MD, PhD,* Antti A. Ahokas, MD*, Christian de Bodinat, MD**
*Department of Psychiatry, University of Cape Town, South Africa;
**Laakarikeskus Mehilainen, Helsinki, Finland; Institut de Recherches Internationales Servier (IRIS), Paris, France.
J Clin Psychopharmacol 2008;28:561-566
Обоснование: Агомелатин является новейшим препаратом, который действует на мелатонинергические (МТ1, MT2) рецепторы и серотонинергические (5-HT2C) рецепторы. В соответствии с преклиническими данными и результатами клинических исследований при большой депрессии предполагается, что агомелатин обладает анксиолитическими свойствами. Настоящее рандомизированное, двойное-слепое, плацебо-контролируемое исследование направлено на оценку эффективности агомелатина при генерализованном тревожном расстройстве (ГТР).
Методы: 121 пациентыс диагнозом ГТР по критериям Диагностического и статистического руководства по психическим расстройствам 4-й редакции без коморбидных расстройств были рандомизированы для терапии агомелатином (25-50 мг/сут) или плацебо в течение 12 недель. Главным показателем был балл Шкалы тревоги Гамильтона. Для дополнительных измерений использовались следующие инструменты: Шкалы общего клинического впечатления, Вопросник для оценки сна Leeds, Шкала дезадаптации Шихана. Оценка безопасности предусматривала регистрацию всех спонтанно сообщаемых пациентами нежелательных явлений, наблюдение за лабораторными параметрами и измерения по Шкале связанных с отменой терапии признаков и симптомов для оценки симптомов отмены.
Результаты: Данные ковариационного анализа изменений инициальных суммарных баллов Шкалы тревоги Гамильтона на момент финальной оценки подтверждают достоверное превосходство агомелатина 25 - 50 мг в сравнении с плацебо (E [SE] = -3.28 [1.58]; 95% доверительный интервал = -6.41 to -0.15; P = 0.040). результаты оценки дополнительных показателей, включая клинический эффект, симптомы инсомнии и улучшение показателей адаптации также свидетельствуют об эффективности агомелатина. По результатам анализа безопасности агомелатин переносится так же хорошо, как плацебо, и не вызывает симптомов отмены.
Заключение: Результаты исследования свидетельствуют об эффективности агомелатина в терапии ГТР при хорошей переносимости. Необходимы дальнейшие исследования с активными препаратами сравнения и более длительными периодами терапии для уточнения места агомелатина в современном арсенале средств фармакотерапии тревожных расстройств.
Агомелатин является новейшим препаратом, который действует на мелатонинергические (MT1, MT2) рецепторы и серотонинергические (5-HT2c) рецепторы.[1] Собственно мелатонинергического агонизма недостаточно для достижения значимого антидепрессивного эффекта, однако взаимодействие агомелатина с MT1, MT2 и 5-HT2C рецепторами, по всей видимости, происходит по принципу синергического действия. В настоящее время проводится III фаза международной программы развития агомелатина.
Преклинические данные свидетельствуют, что агомелатин оказывает не только антидепрессивное действие эффектом, но также обладает анксиолитическими свойствами, подтвержденными на многих моделях, включая поднятый плюс-лабиринт, тест конфликтов Vogel и тест конфликтов Geller. [2-4] По результатам клинических исследований агомелатин эффективен в терапии большой депрессии [5-7] и способен редуцировать сопутствующие симптомы тревоги, а также корректировать нарушения сна, типичные для многих аффективных и тревожных расстройств.[8,9]
В консенсусных экспертных заключениях и систематических анализах накопленных данных подчеркивается роль антидепрессантов в фармакотерапии генерализованного тревожного расстройства (ГТР).[10-13] Антидепрессанты, зарегистрированные для терапии ГТР, не только эффективны, но и могут быть более безопасными в сравнении с бензодиазепинами. Тем не менее, необходимо отметить, что при использовании доступных на сегодня фармакологических средств многие пациенты с ГТР не обнаруживают эффекта, плохо переносят или страдают от симптомов отмены.[14,15]
Учитывая высокую распространенность ГТР и дезадаптацию, связанную с этим расстройством,[16,17] сохраняется потребность в усовершенствовании методов фармакотерапии ГТР. Генерализованное тревожное расстройство представляет собой хроническое расстройство, которое часто требует длительной терапии, поэтому создание эффективных препаратов с хорошей переносимостью имеет особо важное значение. Преклинические данные о потенциальной анксиолитической активности агомелатина, а также данные о его эффективности в отношении тревоги и расстройств сна при депрессии, определяют целесообразность клинических исследований агомелатина при ГТР. Кроме того, агомелатин обладает исключительно благоприятным профилем переносимости и не вызывает значимых симптомов отмены,5 что также указывает на обоснованность подобных исследований.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты
В исследовании был включен 121 соматически здоровый амбулаторный пациент мужского и женского пола в возрасте 18 - 65 лет с основным диагнозом ГТР по критериям Диагностического и статистического руководства по психическим расстройствам 4-й редакции, Редактированный текст (DSM-IV-TR; American Psychiatric Association, 2000); отбор пациентов осуществлялся в Финляндии (5 центров, 80 пациентов) и Южной Африке (6 центров, 4 пациента).
Исследование проводилось в соответствии с принципами Качественной клинической практики (Good Clinical Practice) и Хельсинской декларации. Пациенты подписывали информированное согласие до начала их участия в исследовании в согласии с рекомендациями этических комитетов соответствующих учреждений.
Для диагностики ГТР и выявления любых потенциальных коморбидных расстройств использовалось Краткое международное нейропсихиатрическое интервью (Mini International Neuro-psychiatric Interview)[8]. Для включения пациентов требовалось минимум 22 балла по Шкале тревоги Гамильтона (HAM-A)[9], минимум 2 балла по двум первым пунктам HAM-A (тревожное настроение) и 2 (напряжение), минимум 11 баллов по Госпитальной шкале тревоги и депрессии (Hospital Anxiety and Depression (HAD) Scale)[20] , балл тревоги > балл депрессии по HAD, и не более 16 баллов (включительно) по Шкале депрессии Монтгомери-Асберг (MADRS)[21] . Пациенты с редукцией стартового балла HAM-A более чем на 20% в течение 1-й недели простого-слепого вводного периода исключались из исследования. В исследование не включались пациенты с другими психическими расстройствами, биполярными и психотическими расстройствами в анамнезе, неврологическими расстройствами, тяжелыми расстройствами личности (антисоциальное или пограничное), признаками злоупотребления/зависимости от алкоголя и наркотических средств (критерии DSM-IV-TR), суицидальным риском по оценке клинициста (на основании данных анамнеза и обследования), более 3-х баллов по пункту 10 (суицидальные мысли) шкалы MADRS или совершившие серьезную суицидальную попытку за прошедший год. Кроме того исключались пациенты с тяжелыми или неконтролируемыми общемедицинскими заболеваниями, беременные или кормящие грудью. Также не включались в исследование пациенты, принимающие психотропные средства, психоактивные препараты на основе трав и другие средства терапии, способные повлиять на функции центральной нервной системы или оценки в исследовании, а также пациенты, начавшие психотерапию. Гормонозаместительная терапия в менопаузе допускалась при условии стабильности дозы в течение минимум 3-х месяцев до инициальной оценки и далее на протяжении всего периода исследования.
Таблица 1. Среднее изменение стартовых показателей на финальной оценке по завершении 12 недель терапии
| Отличие от плацебо | |||||||
| Терапевтическая группа | n | Среднее | SD | Оценка | SE | 95% CI | P |
| HAM-A суммарный балл | |||||||
| Агомелатин | 63 | -16.6 | 8.9 | ||||
| Плацебо | 58 | -13.2 | 9.5 | -3.28 | 1.58 | [- 6.41; -0.15] | 0.04* |
| HAM-A, балл соматической тревоги | |||||||
| Агомелатин | 63 | -7.7 | 4.0 | ||||
| Плацебо | 58 | -5.8 | 4.5 | -1.90 | 0.77 | [- 3.43; -0.38] | 0.015† |
| HAM-A, балл психической тревоги | |||||||
| Агомелатин | 63 | -8.9 | 5.7 | ||||
| Плацебо | 58 | -7.3 | 6.0 | -1.58 | 1.06 | [- 3.67; 0.52] | 0.138† |
†Двусторонний t тест Стьюдента для независимых выборок.
Измерения
Пациенты рандомизировались для терапии агомелатином или плацебо в течение 12 недель. Рандомизация была сбалансированной и стратифицированной по факторам центра исследования и предшествующей психофармакотерапии (бензодиазепины и/или антидепрессанты) и проводилась с использованием Интерактивной голосовой системы (Interactive Voice Response System). Таблетки агомелатина и плацебо имели идентичный внешний вид для гарантии слепого метода исследования. Пациенты обследовались с интервалами по 2 недели. На визитах выполнялись измерения тяжести симптомов и регистрировались побочные эффекты. По завершении первых 2-х недель терапии допускалось повышение дозы агомелатина с 25 до 50 мг в сутки при недостаточном улучшении в соответствии с заранее разработанным алгоритмом коррекции дозы, который оставался неизвестным для исследователей и пациентов. В случаях преждевременной отмены терапии пациенты оставались под наблюдением в течение 1-й недели после приема последней дозы препарата исследования.
Главным показателем был суммарный балл HAM-A, который оценивался на каждом визите(-1, 0, 2, 4, 6, 8, и 12). Дополнительными показателями служили баллы Шкалы общего клинического впечатления (CGI),[22] баллы субшкал психической (пункты 1-6 и 14) и соматической (пункты 7-13) тревоги шкалы HAM-A,[20] баллы Шкалы тяжести симптомов ГТР по DSM-IV,[23] баллы Вопросника для оценки сна Leeds[24] и баллы Шкалы дезадаптации Шихана(SDS).[25] В исследовании участвовали опытные психиатры, для которых было организовано совещания с обсуждением процедур измерений с целью согласования оценок до начала исследования.
Показатели безопасности включали регистрацию нежелательных явлений на каждом визите, витальных показателей (частота сердечных сокращений, артериальное давление, масса тела, ИМТ), параметров электрокардиограммы в 12-ти отведениях и стандартных лабораторных анализов (биохимия, гематология) при включении и на 12-й неделе (или на катамнестическом визите в случае преждевременного исключения из исследования). Кроме того на катамнестическом визите проводились измерения по Шкале связанных с отменой терапии признаков и симптомов (DESS)[26].
Статистические анализы
Анализы эффективности проводились в выборке рандомизации, в которую вошли все пациенты, рандомизированные через Интерактивную голосовую систему (n = 121). Главный анализ предусматривал оценку различий между агомелатином и плацебо по степени изменений стартовых суммарных баллов HAM-A с помощью 3-направленного ковариационного анализа, в котором суммарный балл HAM-A использовался в качестве коварианты, а также учитывались факторы терапии и центра (случайный эффект), предшествующей психофармакотерапии (фиксированный эффект) и отсутствие взаимодействия (смешанная модель). Также с целью оценки точности результатов анализировались нескорректированные различия с помощью двустороннего t теста Стьюдента для независимых выборок.
Дополнительные анализы предусматривали оценку различий между агомелатином и плацебо по суммарным баллам HAM-A на каждом визите с помощью вариационного анализа с повторными измерениями по фактору времени (с коэффициентом Бонферрони). Группы агомелатина и плацебо также сравнивались по показателям респондеров (пациенты с минимум 50% редукцией стартового суммарного балла HAM-A) и пациентов в ремиссии (пациенты с суммарным баллом HAM-A < 7)[27] с помощью теста хи-квадрат на момент финальной оценки и теста log-rank на момент первого явления.
Наконец, оценивались различия между терапевтическими группами по другим дополнительным показателям с помощью двустороннего t теста Стьюдента для независимых выборок и, в адекватных случаях (SDS) - также с помощью теста Манна-Уитни.
Рис 1. Средние суммарные баллы HAM-А по визитам (среднее ± SEM) за 12 недель исследования в выборке рандомизации.
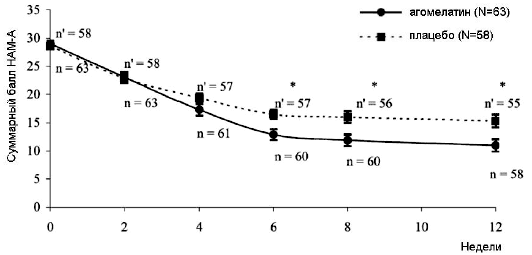
n = число пациентов с доступными данными в группе агомелатина
n' = число пациентов с доступными данными в группе плацебо
*р < 0,01 (вариационный анализ с повторными измерениями)
Рис 2. Время до первого эффекта терапии (минимум 50% редукция стартового суммарного балла НАМ-А)
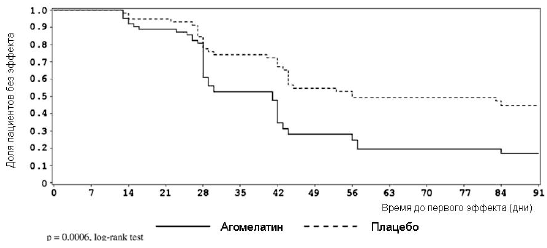
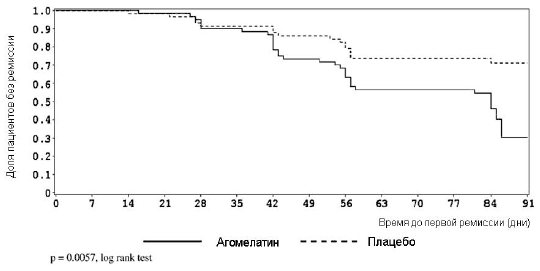
Рис 3. Время до первой ремиссии (HAM-A суммарный балл < 7).
РЕЗУЛЬТАТЫ
Пациенты
Из 130 пациентов, прошедших скрининг, 121 пациент был рандомизирован для терапии агомелатином (63 пациента) или плацебо (58 пациентов) в течение 12 недель. Только 9 пациентов не завершили исследование (92.6% завершили полностью); различий в частоте преждевременных исключений из исследования между агомелатином и плацебо не обнаружено.
Причинами преждевременного исключения были недостаток эффективности (4.8% в группе агомелатина, 5.2% в группе плацебо), consent withdrawal (1.6% в группе агомелатина, 1.7% в группе плацебо) и нежелательные явления (1.6% в группе агомелатина, ни одного в группе плацебо). Случае утраты контакта с пациентом в периоде исследования не было.
В выборке рандомизации, включавшей 121 пациента, средний ± SD возраст составил 41.7±12.2 лет; преобладали пациенты женского пола (68.6% против 31.4% мужчин). Средняя ± SD длительность симптомов ГТР равнялась 9.6±10.5 лет, однако более половины пациентов (56.2%) ранее не получали психофармакотерапии. Средний ± SD стартовый суммарный балл HAM-A составил 29.0±4.4 в группе агомелатина и 28.6±3.8 в группе плацебо. Средние ± SD стартовые баллы MADRS были 11.6±2.9 в группе агомелатина и 11.7±2.1 в группе плацебо. Различий в демографических и клинических показателях между группами не обнаружено.
Из 119 пациентов, продолживших исследование после первых 2-х недель терапии у 51 (42.9%) зафиксировано повышение дозы вследствие недостаточного улучшения при отсутствии различий между группами агомелатина (26/62 или 41.9%) и плацебо (25/57 или 43.9%) по частоте коррекции дозы.
Эффективность
В выборке рандомизации (n = 121) снижение среднего суммарного балла HAM-A за 12 недель исследования зафиксировано в обеих группах. Агомелатин обеспечивал достоверно более выраженную редукцию баллов HAM-A на момент финальной оценки (E [SE] = -3.28 [1.58]; 95% доверительный интервал [CI] = -6.41 to -0.15; P = 0.040; Таблица 1). Причем различия между группами в пользу агомелатина были статистически достоверными уже начиная с 6 недели терапии (Рисунок 1). Такое преимущество агомелатина было подтверждено результатами нескорректированного анализа различий финальных значений (E [SE] = -3.48 [1.68]; 95% CI = -6.81 to -0.15; P = 0.040).
Результаты дополнительных анализов эффективности также подтверждают итоги главного анализа. Доля респондеров была выше в группе агомелатина, начиная с 2-й недели (11.1% против 6.9%) и далее, вплоть до 12-й недели исследования (70.7% против 47.3%). Выявлены достоверные различия между группами в пользу агомелатина при сравнении с финальных дополнительных показателей эффективности (66.7% против 46.6%; E [SE] = 20.1 [8.8]; 95% CI =2.8-37.4; P = 0.026). Результаты подтверждены тестом log-rank (P = 0.0006; Рисунок 2).
Сходные данные были получены при сопоставлении долей респондеров, квалифицированных по другому критерию - балл шкалы CGI-Улучшение < 2. При финальной оценке процент респондеров по данному критерию был достоверно выше при терапии агомелатин в сравнении с плацебо (41.3% против 22.4%; E [SE] = 18.9 [8.3]; 95% CI = 2.6-35.1; P = 0.027), причем преимущество агомелатина нарастало на протяжении всего периода лечения (Рисунок 3).
ТАБЛИЦА 2. Средние баллы CGI-S на инициальном и финальном визите, CGI-S
| Стартовое значение | Финальное значение | Отличие от плацебо | |||||||
| Терапевтическая группа | n | Среднее | SD | Среднее | SD | Оценка | SE | 95% CI | P |
| Агомелатин | 63 | 4.9 | 0.7 | 2.7 | 1.4 | -0.51 | 0.25 | [-1.01; 0.00] | 0.049* |
| Плацебо | 58 | 4.7 | 0.6 | 3.2 | 1.4 | ||||
На фоне терапии агомелатином отмечалась редукция субшкал соматической и психической тревоги шкалы HAM-A. На момент финальной оценки при терапии агомелатином соматические симптомы редуцировались в достоверно большей степени в сравнении с плацебо (P = 0.015). Психические симптомы также уменьшались, на отличие от плацебо не было статистически достоверным по результатам анализа наблюдаемых случаев (P = 0.048; Таблица 1). Через 12 недель терапии различия в средних баллах CGI - Тяжесть заболевания (CGI-S) были статистически достоверными в пользу агомелатина (E [SE] = -0.51 [0.25]; 95%CI= -1.01 to -0.00; P = 0.049; Таблица 2).
Улучшение по показателям Вопросника для оценки сна Leeds было более выраженным в группе агомелатина в сравнении с плацебо, включая пункты засыпания (30.3 ± 17.5 против 42.3 ± 15.2 мм при финальной оценке для группы агомелатин и группы плацебоs соответственно, P < 0.001), качества сна sleep (31.2 ± 21.3 против 43.1 ± 18.9 мм, P = 0.002) и ночные пробуждения (34.8 ± 20.4 против 49.1 ± 16.7 мм, P < 0.0001). Среднее баллы всех подшкал SDS на 12-й неделе исследования были ниже в группе агомелатина в сравнении с плацебо, достигая статистически достоверных различий по семейной подшкале (P = 0.035) и статистической тенденции по субшкале работы (P = 0.069) и социальной подшкале (P = 0.063). После применения теста Манна-Уитни статистически достоверные различия были установлены по всем субшкалам SDS (Таблица 3).
Сходным образом ,средние баллы по каждому из 8 пунктов Шкалы тяжести симптомов ГТР по DSM-IV были ниже в группе агомелатина, чем в группе плацебо.
Переносимость
Не обнаружено различий в процентах пациентов со связанными с терапией нежелательными явлениями между группами агомелатина (38.1% пациентов) и плацебо (34.5% пациентов), а также между группами агомелатина 25 мг (36.1% пациентов) и 50 мг (38.5% пациентов). Наиболее типичными связанными с терапией нежелательными явлениями, которые чаще встречались в группе агомелатина в сравнении с группой плацебо, были головокружение (7.9% против 3.4%) и тошнота (4.8% против 1.7%). В большинстве случаев эти нежелательные явления были легкими или умеренными.
За период терапии не выявлено клинически значимых изменений в стартовых показателях витальных функций, электрокардиограммы и лабораторных анализов. По шкале DESS доля пациентов с минимум 1-м связанным с терапией симптомом, возникшим после отмены терапии, была ниже в группе агомелатина в сравнении с плацебо (39.5% против 43.8%). Суммарное количество DESS симптомов также было меньше в группе агомелатина, чем в группе плацебо (среднее ± SD, 1.8 ± 2.9 против 2.0 ± 3.5). За весь период исследования не зафиксировано ни одного случая серьезного нежелательного явления или смерти.
ТАБЛИЦА 3. Средние баллы шкалы SDS при инициальной оценке и на 12-й неделе
| Исходно | Н12 | Отличие от плацебо | ||||||||||
| Терапевтическая группа | n | Медиана | Среднее | SD | n | Медиана | Среднее | SD | Оценка | SE | 95% | P |
| Семья | ||||||||||||
| Агомелатин | 62 | 6.0 | 6.0 | 2.1 | 57 | 2.0 | 2.7 | 2.3 | -0.95 | 0.44 | [- 1.83; -0.07] | 0.042* |
| Плацебо | 58 | 6.0 | 5.7 | 2.1 | 54 | 4.0 | 3.6 | 2.4 | ||||
| Работа | ||||||||||||
| Агомелатин | 57 | 6.0 | 5.9 | 2.1 | 53 | 2.0 | 2.6 | 2.5 | -0.85 | 0.46 | [-1.76;0.07] | 0.039f |
| Плацебо | 57 | 6.0 | 5.8 | 2.1 | 53 | 3.0 | 3.5 | 2.3 | ||||
| Социальная | ||||||||||||
| Агомелатин | 62 | 7.0 | 6.1 | 2.2 | 57 | 2.0 | 2.7 | 2.5 | -0.85 | 0.45 | [-1.76;0.05] | 0.038f |
| Плацебо | 58 | 6.0 | 6.0 | 1.8 | 54 | 3.0 | 3.6 | 2.3 | ||||
ОБСУЖДЕНИЕ
Результаты исследования свидетельствуют, что агомелатин эффективен и хорошо переносится при терапии пациентов с ГТР. Учитывая высокую распространенность ГТР и сопутствующую этому расстройству выраженную адаптацию[16], а также существенные ограничения современных методов терапии ГТР полученные данные представляются достаточно убедительными и должны стимулировать дальнейшие исследования эффектов агомелатина при ГТР.
Следует отдельно указать на целый ряд важных результатов, полученных в исследовании. Во-первых, если первичное действие большинства антидепрессантов, эффективных при ГТР, направлено на психические, а не соматические симптомы, регистрируемые в шкале HAM-A, то агомелатин оказывает эффективное воздействие на обе группы симптомов тревоги, особенно на соматические симптомы, хотя данное исследование не имело достаточной мощности для подтверждения эффектов по подшкалам психической и соматической тревоги. Также представляются полезными эффекты агомелатина на нарушения сна, поскольку инсомния является ключевым симптомом ГТР.
Во-вторых, несмотря на относительно малый объем выборки и кратковременность исследования установлено, что агомелатин эффективно улучшает не только главные симптоматические показатели ГТР, но также и более общие параметры, включая доли респондеров, пациентов в симптоматической ремиссии и сопутствующую дезадаптацию. В совокупности полученные данные позволяют предположить, что агомелатин будет эффективным средством лечения ГТР в клинической практике. Хотя редукция симптомов, несомненно, является основным показателем для измерений, накапливается все больше данных о важности таких показателей, как ремиссия и качество жизни.
В третьих, агомелатин очень хорошо переносился пациентами с минимальными отличиями от плацебо, как во время терапии, так и после отмены. Эти данные согласуются с результатами предыдущих исследований агомелатина[6,15]. Отсутствие значимых отличий от плацебо по переносимости не только является фактором валидизации двойного-слепого метода нашего исследования, но также позволяет предположить, что агомелатин может занять уникальное положение в арсенале средств фармакотерапии тревожных расстройств. Современные препараты, зарегистрированные для терапии ГТР, также безопасны, но не всегда хорошо переносятся или свободны от симптомов отмены - ситуация, которая далеко не идеальна для достижения оптимальной комплаентности к терапии.
Заслуживают внимания и некоторые недостатки данного исследования. Во-первых, пациенты, включаемые в исследования ГТР, как и пациенты, участвующие в других регистрационных исследованиях, не обязательно репрезентативны относительно популяций больных психиатрической или общей медицинской практики, для которых характерен высокий уровень коморбидности с депрессией и другими расстройствами. Тем не менее, в данное исследование включались пациенты с тяжелыми симптомами ГТР (по шкалам HAM-A и CGI-S), с хроническим течением расстройства и выраженными нарушениями адаптации (по шкале SDS), в связи с чем полученные результаты можно считать клинически значимыми. Во-вторых, полная оценка профилей эффективности и безопасности агомелатина требует более масштабных и длительных исследований. Например, выборки нашего исследования было недостаточно для подтверждения превосходства агомелатина над плацебо на раннем этапе терапии. Дальнейшие исследования помогут уточнить место агомелатина в арсенале средств психофармакотерапии ГТР. Накопленные на сегодня предварительные данные позволяют предположить, что агомелатин несомненно следует рассматривать как весьма перспективное средство терапии ГТР, не только в связи с его отчетливой эффективностью, но также с учетом очень хорошей переносимости.
ВЫРАЖЕНИЕ БЛАГОДАРНОСТИ
Авторы выражают благодарность всем исследователям, участвовавшим в проведении исследования в Финляндии: R. Jokinen, MD, Turku; M.-L. Junnila, MD, Lainsi-Suomen, Turku; A.E. Savela, MD, Klaarakeskus, Helsinki; A.M. T. Timonen, MD, Espoo; и Южной Африке: C. Maud, MD, Durban; L. Nel, MD, Pretoria; H. Russouw, MD, Somerset West, PA. Strong, MD Cape Town; G. Brink, MD, Johannesburg, и Agnes Fabiano.
ОГЛАШЕНИЕ ИНФОРМАЦИИ ОБ АВТОРАХ
Доктора Stein и Ahokas получают консультативные гонорары от компании Servier. Д-р Stein также получал исследовательские гранты и/или консультативные гонорары от компаний AstraZeneca, Eli Lilly, GlaxoSmithKline, Johnson & Johnson, Lundbeck, Orion, Pfizer, Pharmacia, Roche, Solvay, Sumitomo, Tikvah, и Wyeth. Д-р de Bodinat является штатным сотрудником компании Servier.
Список использованной литературы
