Лечение первично выявленного распространенного рака предстательной железы
Статьи| »» Содержание | Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев |
Глава 9. Лечение первично выявленного распространенного рака предстательной железы
К распространенному раку предстательной железы принято относить местно-распространенную опухоль (T3-4) или опухоль с метастазами, или сочетание первого и второго. Больным распространенным раком показана гормонотерапия, которая включает два подхода: монотерапия (кастрация, эстрогенотерапия, антиандрогены) или комбинированное лечение, включающее сочетание кастрации (хирургической или медикаментозной) с антиандрогенами. Цель лечения - создание максимальной андрогенной блокады (МАБ).
Рак предстательной железы (РПЖ) - это гормонально зависимая опухоль, на которую в первую очередь влияет тестостерон. Тестостерон превращается в функционально активный андроген - дигидротестостерон (ДГТ) в клетках предстательной железы. Чтобы понять механизм действия противоопухолевой терапии при раке предстательной железы, важно уяснить взаимодействие гормонов в эндокринной системе мужчины.
Тестостерон. Яички продуцируют около 95% всех андрогенов в виде тестостерона. В яичках он продуцируется клетками Лейдига в ответ на стимуляцию лютеинизирующим гормоном (ЛГ), который секретирует аденогипофиз в ответ на высвобождение рилизинг гормона лютеинизирующего гормона гипоталамуса. Соотношение гормонов определяется состоянием гипоталамо-гипофизарно-тестикулярной системы (рис. 20).
Рис. 20. Продукция тестостерона. Гипоталамо-гипофизарно-тестикулярная ось.
КП - кортикатропин релизинг гормон
АКТГ - адренокортикотропный гормон
Механизм отрицательной обратной связи заключается в том, что при снижении уровней тестостерона гипоталамус высвобождает ЛГРГ, который в свою очередь стимулирует секрецию ЛГ, и, в конце концов, повышается секреция тестостерона. Механизм обратной связи приводит к возрастанию концентрации тестостерона, при этом уменьшаются выбросы ЛГРГ гипоталамусом.
Андрогены надпочечников. Надпочечники - это второй источник, на долю которого приходится выработка примерно 5% всех андрогенов. Под стимулирующим действием адренокортикотропного гормона (АКТГ) надпочечники секретируют андрогены - андростендион и дегидроэпиандростерон, которые превращаются в тестостерон в периферических тканях и в предстательной железе.
Большая доля циркулирующего тестостерона в крови связана глобулином, связывающим половые гормоны (ГСПГ), и альбумином. Небольшая часть (2-3%) циркулирующего тестостерона не связана и, как считается, является функционально-активной формой тестостерона, который проникает в ткани предстательной железы. Свободный тестостерон пересекает мембрану клетки предстательной железы, а затем в цитозоле ферментом 5альфа-редуктазой превращается в ДГТ (рис. 21).
Рисунок 21. Механизм стимуляции функции клеток предстательной железы андрогенами.
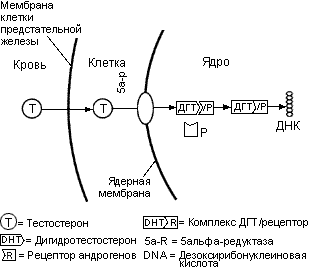
Внутриклеточный ДГТ - это гормон, по андрогенной активности в 2.5 раза превосходящий тестостерон. Он связывается с рецептором внутри клеточного ядра и активирует клеточные функции. Несмотря на то, что кастрация (орхидэктомия или применение аналогов ЛГРГ) вызывают 95% снижение уровня тестостерона в сыворотке, уровень ДГТ в тканях предстательной железы изменяется меньше. Концентрация андрогенов в клетках злокачественной опухоли предстательной железы после кастрации на 30-40% выше, чем в нормальных.
Таким образом, у мужчин имеется два источника андрогенов: яички и надпочечники. Существуют данные, что андрогены надпочечников способны стимулировать опухоль предстательной железы после падения концентрации тестостерона в результате хирургической или медикаментозной кастрации. В надпочечниках тестостерон образуется в процессе прямого синтеза, кроме того тестостерон образуется в периферических тканях из других гормонов надпочечников - андростендиона и дегидроэпиандростерона и их сульфатов. Тестостерон, синтезируемый в клетках надпочечников, превращается в ДГТ в клетках предстательной железы и, следовательно, продолжает стимулировать рост рака предстательной железы. Результаты экспериментальных исследований и открытых исследований больных раком предстательной железы показывают, что ингибирование андрогенов надпочечников вместе с кастрацией (хирургической или медикаментозной) улучшает частоту ответа на лечение и выживаемость по сравнению с одной только кастрацией.
Современные концепции лечения распространенного рака предстательной железы. Вопросы лечения гормонально-зависимых опухолей предстательной железы не могут решаться однозначно в связи со значительными изменениями, происходящими в организме больного. Это выдвигает необходимость всестороннего подхода к проблеме лечения рака предстательной железы, которая содержит еще целый ряд противоречивых вопросов.
Несмотря на то, что с тех пор, как Huggins и Hodges показали гормональную зависимость рака предстательной железы, прошло уже более 50 лет, гормонотерапия остается ведущим методом лечения распространенных форм этой опухоли. Однако эффект лечения в этих случаях временный. При наличии отдаленных метастазов рецидив заболевания возникает обычно в течение первых двух лет, а продолжительность жизни после появления рецидива обычно исчисляется месяцами. Сразу после внедрения гормонотерапии в клиническую практику начались споры об оптимальном времени ее проведения. В настоящее время гормонотерапию при распространенном раке предстательной железы стараются назначать как можно раньше в надежде на более позднее появление болевого симптома и увеличение продолжительности жизни. Однако правильность такого подхода ставится под сомнение некоторыми исследователями (Lepor Н., et al., 1982).
Некоторые авторы предлагают альтернативную тактику лечения. Они считают, что проведение гормонотерапии можно отложить до появления признаков прогрессирования заболевания. В этом случае лечение может позволить добиться ремиссии, и продолжительность жизни больного будет не меньше, чем при немедленном начале лечения (Byar D.P., 1973). Пожилые же больные за этот период времени могут умереть от интеркуррентных заболеваний. На основании данных рандомизированных исследований Объединенной группы исследований в урологии - The Veterans Administration Cooperative Urological Research Group (VACURG) Byar D.P. делает вывод, что "гормонотерапия при раке предстательной железы может быть отсрочена...". В этих работах не было выявлено неблагоприятных последствий отсроченного лечения и было отмечено, что многие больные с распространенным раком предстательной железы (по данным VACURG - 41 %) умирают от сопутствующих заболеваний. Таким образом, на сегодняшний день целый ряд исследователей считает, что отсроченная гормонотерапия при раке предстательной железы имеет преимущества перед начатой сразу после постановки диагноза (Kirk D., 1987).
В 1985 году было начато исследование по сравнению немедленной и отсроченной гормонотерапии у больных с бессимптомным течением диссеминированного и местно-распространенного рака предстательной железы (Рабочая группа по изучению рака предстательной железы Совета по исследованиям в медицине, Англия). Набор больных был прекращен в конце 1993 года. Предварительные результаты этой работы были опубликованы в 1997 году. Авторы исследования получили данные о 934 больных. В группе больных, которым гормонотерапия проводилась отсрочено, 51 больной умер от сопутствующих заболеваний еще до начала лечения (только пять из этих больных были моложе 70 лет), еще 29 больных умерли до начала лечения от основного заболевания. Показанием для начала лечения одинаково часто служили как рост первичной опухоли, так и отдаленные метастазы. Появление отдаленных метастазов и боли в костях чаще наблюдались у больных, которым гормонотерапия проводилась отсрочено (р < 0.001). В этой группе необходимость трансуретральной резекции предстательной железы по поводу роста первичной опухоли возникла у 141 больного по сравнению с 65 больными, которым гормонотерапия была начата сразу после постановки диагноза (р < 0.001). Патологические переломы, сдавление спинного мозга, сдавление мочеточников и появление метастазов другой локализации, помимо метастазов в кости, в два раза чаще наблюдались у больных, которым гормонотерапия проводилась отсрочено. Рак предстательной железы стал причиной смерти 67 умерших больных. В группе, в которой гормонотерапия проводилась отсрочено, умер 361 больной; в группе, в которой гормонотерапия проводилась сразу после постановки диагноза - 328 (р = 0.02), при этом от основного заболевания в этих группах умерли 257 и 203 больных соответственно (р = 0.001). Эти различия были особенно заметны в подгруппах больных, у которых на момент постановки диагноза отсутствовали отдаленные метастазы: от рака предстательной железы в них умерли 119 и 81 больной соответственно (р < 0.001). Полученные результаты позволили авторам сделать вывод о более высокой эффективности раннего начала гормонотерапии, сразу после постановки диагноза. Однако данные для подгрупп больных, у которых на момент постановки диагноза отсутствовали отдаленные метастазы, еще не окончательны.
Большинство методов эндокринотерапии рака предстательной железы со времен Hugginsn Hodges (1941) направлено на снижение уровня тестостерона в крови путем подавления его синтеза в яичках и коре надпочечников. Возможные варианты и методы андрогенной блокады представлены в табл. 41.
Таблица 41. Методы андрогенной блокады.
1. Билатеральная орхидэктомия
2. Эстрогенная терапия
3. "Чистые" антиандрогены
4. Стероидные антиандрогены
5. Агонисты (аналоги) ЛГРГ
6. Орхидэктомия + антиандрогены
7. Антиандрогены + эстрогены
8. Агонисты (аналоги) ЛГРГ + антиандрогены
Идеальная терапия рака предстательной железы включает блокаду действия андрогенов на клеточном уровне предстательной железы, что реализуется снижением связывания дигидротестостерона с ядерным рецептором при конкурентном торможении или снижении концентрации цитоплазматического рецептора андрогенов. Орхидэктомия является эффективным методом снижения в крови основного биологического активного андрогена - тестостерона, но не оказывает действия на продукцию адренальных андрогенов. Препараты эстрогенного действия подавляют продукцию тестостерона яичками путем торможения секреции гонадотропинов и не действуют на секрецию адренальных андрогенов.
С появлением антиандрогенов и аналогов ЛГРГ открылась новая перспектива в лечении больных раком предстательной железы,
В 1977 году Auclair С. et аl., сообщили, что ежедневное введение агонистов ЛГРГ больным мужчинам приводило к снижению концентрации лютеинизирующего гормона (ЛГ) и тестостерона в плазме. В результате этого и других исследований были собраны доказательства о потенциальной возможности агонистов (аналогов) ЛГРГ стать на практике вполне приемлемой альтернативой орхидэктомии при лечении диссеминированного рака предстательной железы. Данный метод получил право на жизнь после того, как его терапевтический эффект был оценен и признан сравнимым с таковым от орхидэктомии (Kaisari A.V. et аl., 1991; Peeling W., 1989 и др.).
Аналоги ЛГРГ вызывают ответную реакцию гипофиза, образуя комплекс с рецепторами клеточной мембраны. Первоначальное введение препарата обычно приводит к развитию характерной ответной реакции, известной клиницистам как "феномен вспышки". Однако длительное присутствие аналога гонадотропин-рилизинг гормона ведет в конечном итоге к снижению чувствительности рецепторов клеток гипофиза, снижению продукции ЛГ и, таким образом, к падению уровня тестостерона в сыворотке. Длительное введение аналогов ЛГРГ приводит к снижению концентрации сывороточного тестостерона до посткастрационного уровня. Наличие в арсенале методов данного вида терапии оказывается чрезвычайно важным у пациентов с гормонально независимым типом опухоли. Тот факт, что на начальном этапе лечения невозможно идентифицировать пациентов с гормонально независимым типом опухоли, делает терапию аналогами ЛГРГ особенно привлекательной. Начальная терапия такими препаратами в течение некоторого периода (обычно 2-3 месяца) позволяет сделать вывод о гормональной чувствительности опухоли на основе ответной клинической реакции. В дальнейшем же клиницист по своему усмотрению может решить продолжать ли постоянное введение аналогов ЛГРГ или заменить их орхидэктомией.
Однако препятствием к широкому внедрению данного метода лечения служили трудности введения препарата. Для достижения медикаментозной кастрации были необходимы ежедневные подкожные инъекции препарата или многократные (6 раз) интраназальные аппликации аналогов ЛГРГ, что было в какой-то степени обременительно для больных и не создавало равномерного снижения концентрации ЛГ и тестостерона в плазме крови.
С 1983 года появились длительно действующие депо-формы аналогов ЛГРГ. Ежемесячное внутримышечное или подкожное введение гарантирует надежность "химической" кастрации. Уже через три недели наступает снижение уровня тестостерона в плазме крови до посткастрационных значений. Последующие (через каждые 28 дней) введения препарата стабильно удерживают нужный уровень тестостерона в течение 1,5-3 лет наблюдения (Kaisari A.V. et аl., 1991). Подробнее о препаратах агонистах (аналогах) ЛГРГ будет сказано ниже.
В лечении диссеминированного рака предстательной железы в последние годы нашло широкое распространение использование комбинации кастрации (хирургической или медикаментозной) и антиандрогенов. Такая комбинация получила название максимальной андрогенной блокады (МАБ).
После публикации работы Labrie F. в 1982 году , сообщающей о фантастических преимуществах МАБ (94% частичных регрессий и 6% стабилизации), интерес к этой проблеме стал повсеместным.
Позже были проведены 3 крупных исследования, результаты которых подтвердили преимущества МАБ перед стандартной кастрацией в отношении общей и безрецидивной выживаемости. Это исследование Национального института рака (NCI) Крауфорд (Crawford et al., 1989), исследование Европейской организации по изучению и лечению рака (EORTC) Дени (Denis et аl., 1993), исследование Янкнегта (Janknegt et аl., 1993), а также мета-анализ Бертагна (Bertagna et аl., 1994).
Максимальная андрогенная блокада (МАБ). Крупное плацебо-контролируемое исследование Национального ракового института (NCI) (Crawford et аl., 1989) проводило сравнение эффективности МАБ (комбинация ЛГРГ-аналога и флутамида в дозе 250 мг 3 раза в сутки) и ЛГРГ-аналога в сочетании с плацебо в лечении распространенного рака предстательной железы. В исследовании приняли участие около 300 пациентов в каждой группе. В результате было показано, что МАБ обеспечивает достоверное удлинение общей выживаемости на 7.3 мес., по сравнению с медикаментозной кастрацией (35.6 мес. против 28.3 мес. р = 0.035) , а также достоверно удлиняет безрецидивную выживаемость (16.5 против 13.9 мес., р = 0.039). Преимущество МАБ оказалось более выраженным у больных с менее тяжелой формой заболевания и общим хорошим состоянием - МАБ удлиняла выживаемость до 19,5 месяцев по сравнению с выживаемостью в группе кастрации как монотерапии.
В рандомизированном исследовании EORTC (Denis L.J. et аl.,1993) проводилось сравнение эффективности МАБ (золадекс + флутамид) с хирургической кастрацией у 310 больных раком предстательной железы с метастазами. Исследователи обнаружили, что у больных, получавших золадекс и флутамид, субъективные и объективные симптомы прогрессирования заболевания появлялись позже, чем у больных после кастрации. Результаты исследования продемонстрировали достоверное удлинение выживаемости при применении МАБ (при учете только онкологической летальности) (43.9 против 28.8 мес., р = 0.007) а также достоверное удлинение времени до прогрессирования. Анализ выживаемости, основанный на оценке распространенности опухоли, показал, что наилучшие результаты наблюдались у больных с менее тяжелой формой заболевания и удовлетворительным общим состоянием.
Другое большое рандомизированное многоцентровое двойное - слепое исследование (Janknegt et аl., 1993) также демонстрирует преимущества МАБ перед кастрацией. В исследование были включены две группы сравнения. Больные одной группы получали после кастрации антиандроген нилутамид (анандрон 300 мг/сут), другие плацебо. Авторы показали, что медиана общей выживаемости была достоверно выше в группе МАБ (37 мес. против 30 мес.). Медиана времени до прогрессирования была так же достоверно выше в группе МАБ (20.8 мес. против 14.9 мес, р = 0.05). Объективные признаки регрессии были также более выражены в гуппе МАБ -41% по сравнению с контрольной 24%, Недавно Dijkman G.A. et аl., (1997) сообщили, что после 8-летнего наблюдения у больных в группе МАБ значительно снижался риск прогрессирования (р = 0,0024) заболевания по сравнению с группой больных после кастрации. При анализе лечебного эффекта между группами отмечено значимое различие выживаемости в пользу группы МАБ (р > 0.033).
Представляет интерес мета-анализ 7 клинических исследований, проведенной группой Бертагна (Bertagna et аl., 1994)., в которых оценивали сравнительную эффективность МАБ (кастрация + нилутамид) и комбинацию кастрации с плацебо. Мета-анализ продемонстрировал достоверное преимущество МАБ в плане удлинения общей и безрецидивной выживаемости. Кроме того, применение МАБ достоверно увеличивало частоту ремиссии (50% против 33% р < 0.001) и достоверно снижало риск прогрессирования (частота риска 0.84 р = 0.05). Авторы пришли к заключению, что комбинация нилутамида с кастрацией облегчала боли, связанные с метастазами, снижала концентрацию опухолевых маркеров, в частности ПСА, объективно улучшала исход лечения и удлиняла выживаемость.
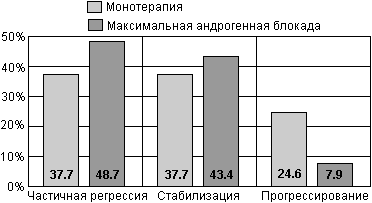
В отделении урологии Онкологического научного центра им. Н.Н. Блохина проводилось изучение различных нестероидных антиандрогенов (флуцином, анандрон, касодекс) как в режиме монотерапии, так и в сочетании с хирургической или медикаментозной кастрацией - максимальной андрогенной блокады. Несколько лучшие результаты были получены при использовании МАБ. Так при данном режиме достоверно уменьшалась частота прогрессирования с 24.6% (при монотерапии) до 7.9% (р < 0.02). Результаты этого исследования представлены на рис. 22.
Рис. 22. Результаты лечения больных раком предстательной железы антиандрогенами в монотерапии и в режиме максимальной андрогенной блокады (данные ОНЦ).
Ряд других исследований, проведенных в последнее время, показали, что комбинированное лечение по эффективности не уступает кастрации. Ни в одном из них эффективность кастрации как монотерапии, не была выше, чем эффективность МАБ.
Однако не все исследователи считают МАБ "золотым стандартом" лечения распространенного рака предстательной железы. По сообщению Юго-Западной Группы исследований в онкологии США (SWOG 8894) МАБ не обладала преимуществами при сравнении комбинации орхидэктомии и флутамида (n = 687) с комбинацией орхидэктомия плюс плацебо (n = 700) у больных распространенным раком предстательной железы с метастазами (Eisenberger V. et аl., 1997). В этом исследовании было показано, что если в качестве компонента МАБ выполнялась орхидэктомия, то флутамид значимо не повышал эффективность лечения. Хотя уровень ПСА нормализовался у большего числа больных в группе МАБ (74% и 62% соответственно, р = 0.0002), это никак не повлияло на выживаемость. Результаты мета-анализа 22 рандомизированных исследований, в которые были включены 5710 пациентов, опубликованные в 1995 г. показали некоторое, статистически незначимое, удлинение выживаемости больных после МАБ при сравнении с эффективностью кастрации. Однако недавний мета-анализ 9 исследований (Caubet J.F. et аl., 1997) поддерживает преимущества МАБ с использованием нестероидных антиандрогенов в сравнении с орхидэктомией.
Tyrrel C.J. et аl., (1991), провели проспективное, рандомизированное испытание в нескольких медицинских центрах, охватившее 571 больного распространенным раком предстательной железы. В задачи исследования входило сравнить эффективность и переносимость золадекса 3.6 мг депо, назначавшегося каждые 28 дней, и золадекса 3.6 мг депо, назначавшегося каждые 28 дней в комбинации с флутамидом (250 мг 3 раза в сутки). При начале исследования у 57% больных отмечались отдаленные метастазы. Средний возраст пациентов, получавших золадекс, депо в дозе 3,6 мг (n = 284) составил 72.6 лет; среди больных, получавших комбинированное лечение (N = 287) - 72.2 года. При регистрации группы больных были сравнимыми по симптоматике, стадии заболевания и гистологической градации опухоли. Результаты исследования представлены в табл. 42.
Таблица 42. Эффективность терапии распространенного рака предстательной железы Золадексом в монотерапии и комбинации с флутамидом.
| Ответ (%) | Рандомизированная терапия золадексом 3.6 мг депо | |
| Монотерапия (n = 287) | В комбинации с флутамидом (n = 287) | |
| Полная/частичная ремиссия | 67 | 65 |
| Отсутствие изменений | 21 | 24 |
| Прогрессирование болезни | 7 | 5 |
| Не поддающаяся оценке | 5 | 6 |
При оценке объективных показателей ответа на лечение, медианы времени до прогрессирования заболевания и времени до неудачи терапии, статистически значимых различий между двумя группами лечения не обнаружено.
По сравнению с группой, подвергнутой монотерапии золадексом 3.6 мг депо, в группе, получавшей дополнительно флутамид, зарегистрировано большее число пациентов с проявлениями печеночной токсичности и нарушениями со стороны желудочно-кишечного тракта, что привело к исключению из исследования 44 (15%) пациентов. При уточнении данных по выживаемости, проводившемся при обследовании больных в середине исследования (через 56.2 недели), различия в выживании больных из обеих групп были статистически незначимыми (р = 0.14); медиана выживаемости составила 37.7 месяцев в группе подвергнутой монотерапии золадексом и 42.4 месяца в группе, получавшей комбинированную терапию.
Fourcade R.O. et аl., (1990). проводившие рандомизированное исследование по двойному слепому методу 245 больных с распространенным раком предстательной железы, наблюдавшихся в 8 центрах Франции, а так же Iversen P., et al., (1993), наблюдавшие 262 больных, пришли к заключению, что комбинация золадекса и флутамида не обладает существенными клиническими преимуществами для лечения распространенного рака предстательной железы по сравнению с двусторонней орхидэктомией.
Интермиттирующая андрогенная блокада в лечении диссеминированного рака предстательной железы.Периодическая регуляция уровней тестостерона в крови путем циклического назначения эстрогенов была впервые предложена Klotz L.H. et аl., 1996. Теоретически этот метод лечения должен был иметь определенные преимущества, как, например, периодическое восстановление уровней тестостерона в плазме и восстановление половой активности, снижение риска сердечно-сосудистых осложнений и, по данным Noble R.L., (1977), возможное замедление опухолевого роста при уровнях тестостерона выше посткастрационных. В предварительном клиническом исследовании 19 больным с распространенным раком предстательной железы назначали диэтилстильбестрол (ДЭС) до появления признаков клинического эффекта, затем лечение отменяли до возобновления симптомов. Одному больному по такому же принципу назначали флутамид. Медиана длительности лечения составила 30 месяцев (в диапазоне от 2 до 70 месяцев). Субъективное улучшение отмечено у всех больных в первые 3 месяца лечения. После отмены лечения у 12 из 20 больных симптоматика возобновилась в среднем через 8 месяцев (в диапазоне от 1 до 24 месяцев), и впоследствии повторное лечение этих больных вновь оказалось эффективным. Импотенция как результат лечения исчезла у 10 мужчин в течение 3 месяцев после отмены лечения. Более высокое качество жизни было достигнуто за счет уменьшения общей дозы ДЭС, и тяжелых побочных эффектов не наблюдалось.
Akarura K. et al., (1993), провел исследования влияния многократной андрогенной блокады и заместительной терапии андрогенами на восстановление апоптоза. Был использован обратимый характер изменений во время комбинированной терапии, включающей периодическое назначение аналогов рилизинг-фактора лютеинизирующего гормона (ЛГРГ) и антиандрогенов. У 4 больных со стадией С и трех больных со стадией D рака предстательной железы андрогенную блокаду начинали с назначения ципротерона (100 мг/сутки) и ДЭС (0.1 мг/сутки), а затем переходили на поддерживающую терапию ципротероном в комбинации с золадексом (3.6 мг/месяц), аналогом ЛГРГ. Через 6 и более месяцев после подавления уровней ПСА до нормы лечение прерывали на 2-11 месяцев. После восстановления функции яичек андрогенную блокаду возобновляли, если уровни ПСА возрастали выше 20 мкг/литр. Такой цикл повторяли от двух до четырех раз в течение 21-47 месяцев, причем опухоль не утрачивала гормональную зависимость.
Чтобы расширить предварительные результаты упомянутого подхода, Goldenberg S.L. et аl., (1995), изучил влияние циклической андрогенной блокады на группе из 47 больных раком предстательной железы [клинические стадии: D2 (14), D1 (10), С (19), В2 (2) и А2 (2)] при среднем периоде наблюдения 125 недель. Лечение начинали с комбинированной андрогенной блокады и продолжали в течение минимум 6 месяцев, пока уровни ПСА не снижались до стойкого минимума. Затем лечение отменяли, пока уровни ПСА не возрастали в среднем до 10-20 мкг/литр. Такой цикл "лечение + перерыв" повторяли, пока изменения ПСА не утрачивали зависимость от уровней андрогенов. Характерные изменения уровней ПСА и их восстановление при описанном подходе иллюстрирует рис. 23 для первых двух циклов. Последний анализ результатов по 51 больному представлен в табл. 43.
Рис. 23. Интермиттирующая андрогенная блокада. (Обобщенные результаты лечения 47 больных раком предстательной железы, 30 из которых прошли один цикл лечения, 15-2 цикла и двое до сих пор получают первый цикл лечения. Цикл включает период лечения, за которым следует перерыв (Goldenberg S.L. et аl., 1995).
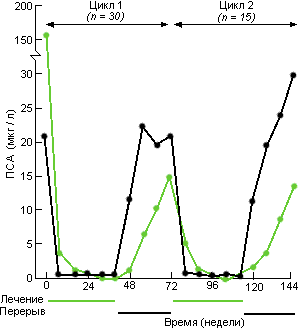
Таблица 43. Интермиттирующая андрогенная блокада: анализ по циклам.
| Полный цикл | ||||
| 1 | 2 | 3 | 4 | |
| Число больных | 51 | 19 | 8 | 2 |
| Средний уровень ПСА до начала лечения (мкг/л) | 150 | 14 | 12 | 28 |
| Средний период времени до снижения ПСА до самой низкой величины (месяцы) | 5 | 4 | 5 | 5 |
| Минимальная величина уровня ПСА 2,0 мкг/л (% больных) | 95 | 89 | 88 | 100 |
| Средняя длительность цикла (месяцы) (диапазон) | 21 (9-54) | 19 (10-39) | 18 (10-26) | 13 (11-16) |
| Средняя длительность перерыва в лечении (месяцы) | 10 | 9 | 8 | 5 |
| Средняя длительность перерыва в лечении (%) | 45 | 46 | 48 | 40 |
Длительность четырех последовательных курсов лечения составила 21, 19, 18 и 13 месяцев; общая длительность времени лечения составила 45, 46, 48 и 40 месяцев соответственно. Уровни ПСА в начале каждого цикла лечения соответствовали 150, 14, 12 и 28 мкг/литр. Период времени до падения уровней ПСА до стойкого минимума составил 5, 4, 5 и 5 месяцев, причем этот уровень не превышал 2.0 мкг/литр у 88% и более больных.
Уровни тестостерона в сыворотке восстанавливались до нормы в течение 8 недель (в диапазоне от 1 до 26 недель) после отмены лечения. Во время перерывов в лечении во всех циклах у больных улучшалось самочувствие, и у тех больных, которые вели нормальную (или почти нормальную) половую жизнь до начала лечения, восстанавливались половое влечение и потенция. У семи больных со стадией D2 заболевания, опухолевый рост стал гормонально независимым. Средняя величина и медиана периода времени до прогрессирования заболевания составили 128 и 108 недель соответственно. Семь больных умерли (один из них по причине, не связанной с раком предстательной железы), и средняя величина и медиана продолжительности жизни составили 210 и 166 недель соответственно. Это исследование показало, что гормональную зависимость опухолевого роста можно поддерживать путем интермиттирующей андрогенной блокады, что обеспечивает многократную регрессию опухоли за счет апоптоза при строго регулируемых условиях.
Когда следует прерывать лечение? Теоретически андрогенную блокаду следует продолжать в течение периода времени, за который регрессия опухоли за счет апоптоза становится максимальной, до появления гормонально-независимого фенотипа опухоли. После начала андрогенной блокады уровни ПСА в сыворотке могут быстро снизиться вследствие прекращения экспрессии гена ПСА, регулируемого андрогенами, а затем падение уровней ПСА замедляется за счет элиминации ПСА-продуцирующих клеток.
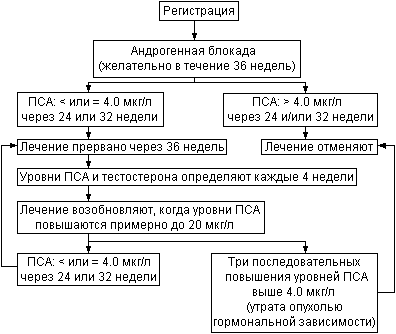
Признаком благоприятного эффекта лечения является начальное падение уровней ПСА в сыворотке, часто до нормальных пределов, в первые 10 недель, за чем следует более медленное снижение уровней ПСА в течение последующих 30-40 недель. Необходимо минимум 32 недели лечения, чтобы снизить уровни ПСА до нормы у большинства больных со стадией D2 рака предстательной железы (Bruchovsky N. et аl., 1993). Падение уровней ПСА до стабильной или снижающейся минимальной величины в пределах нормы - важный показатель эффективности лечения. Если уровни ПСА остаются в пределах 4 мкг/л между 24 и 32 неделями лечения, медиана продолжительности жизни соответствует 18 месяцам. С другой стороны, если уровни ПСА в сыворотке падают ниже 4 мкг/л между 24 и 32 неделями лечения, медиана продолжительности жизни намного больше (до 40 месяцев). Интермиттирующую андрогенную блокаду считают показанной тем больным, у которых уровни ПСА остаются стабильными или продолжают снижаться в пределах нормы между 24 и 32 неделями лечения. Схема принятия решения о том, следует ли прервать лечение больного со стадией D2 рака предстательной железы, представлена на рис. 24.
Рис. 24. Интермиттирующая андрогенная блокада при диссеминированном раке предстательной железы (стадии D2).
Длительность лечения больных раком предстательной железы более ранних стадий должна быть такой же. Gleave M.E. et аl., (1996), в группе из 50 больных раком предстательной железы без диссеминации обнаружил, что длительность неоадъювантной андрогенной блокады, необходимая для падения уровней ПСА до минимальной величины, часто превышала 6 месяцев. При чувствительности метода определения ПСА 0.2 мкг/л уровни ПСА в сыворотке снижались до минимума только у 34% через 3 месяца после начала лечения, у 60% - через 5 месяцев, у 70% - через 6 месяцев и у 84% - через 8 месяцев. У 16% больных уровни ПСА продолжали снижаться через 8 месяцев после начала лечения. Доля больных с минимальными уровнями ПСА, не превышающими 0.2 мкг/л, увеличивалась с 14% через 2 месяца до 34% через 3 месяца, 56% через 5 месяцев и 66% через 8 месяцев. При исследовании предстательной железы после радикальной простатэктомии, клеточных клонов, способных к андроген-независимому росту, не выявлено. Эти наблюдения подтверждают предположение, что андрогенную блокаду можно продолжать до 9 месяцев, достигая максимального эффекта лечения без трансформации опухоли в гормонально-независимое состояние.
Когда следует возобновлять лечение? Оптимальное время для возобновления андрогенной блокады пока неизвестно и определяется исходя из опыта. У больных с распространенным раком предстательной железы уровни ПСА в сыворотке могут варьировать от верхней границы нормы до нескольких тысяч мкг/литр. У больных с уровнями ПСА в сыворотке ниже 20 мкг/л до начала лечения целесообразно начинать второй цикл лечения, когда уровни ПСА возрастают до исходных. Если уровни ПСА до начала лечения превышают 20 мкг/литр, авторы предлагают начинать второй цикл лечения, когда уровни ПСА в сыворотке возрастают примерно до 20 мкг/л, как показано на рис. 24. При идеальной эффективности андрогенной блокады больной должен получить лечение в течение 8-9 месяцев. Уровни ПСА падают до предела чувствительности метода - 0.1 мкг/л - через 24 недели после начала лечения; та же величина определяется и через 32 недели лечения, что указывает на стабильный минимальный уровень ПСА в пределах нормы. Затем через 36 недель лечение прерывают, отмечая начало перерыва; уровни тестостерона в сыворотке восстанавливаются до нормы через 8-14 недель. Однако в отличие от восстановления уровней тестостерона в сыворотке, уровни ПСА повышаются не так быстро, что обеспечивает перерыв в лечении длительностью 8-9 месяцев.
Уровни ПСА. Теоретически интермиттирующая андрогенная блокада целесообразна у неоперабельных больных, а также в случаях частичной резекции опухоли и при рецидивах заболевания, особенно после неудачной лучевой терапии. Стандартная схема лечения больных раком предстательной железы стадии D2 (рис. 24) была несколько изменена для случаев неудачных попыток радикальной простатэктомии или лучевой терапии, а также после неудачного комбинированного лечения (простатэктомия + лучевая терапия), что подтверждает повышение уровней ПСА в сыворотке.
Хотя интермиттирующая андрогенная блокада первоначально планировалась для лечения распространенного рака предстательной железы с минимальным объемом опухолевых очагов, применение этого подхода расширилось и включило другие показания, как показано в табл. 44. Поскольку уровни ПСА невозможно применять универсально во всех случаях рака предстательной железы, вопрос о том, как классифицировать больных и оценивать эффективность лечения, ориентируясь на уровни ПСА, остается открытым. Более того, измерение ПСА основано на предположении, что полученные величины отражают объем опухолевых очагов (Stamey TA. et аl., 1989; Gleave M.E. et аl., 1992). Однако это не всегда справедливо, так как ПСА появляется в сыворотке как конечный продукт нескольких клеточных процессов. Необходимо помнить о следующих соображениях: во-первых, синтез ПСА может угнетаться во время интермиттирующей андрогенной блокады без ускорения апоптоза опухолевых клеток; во-вторых, синтез ПСА может не изменяться в отсутствие андрогенов, но при значительном уменьшении популяции злокачественных клеток общая продукция ПСА будет снижаться; в-третьих, падение уровней ПСА может отражать сочетание прекращения синтеза и ускоренной гибели клеток. Хотя имеющиеся данные подтверждают третье соображение, необходима дополнительная информация из клинических исследований с применением интермиттирующей андрогенной блокады до того, как можно будет точно оценить значение изменений (падения или возрастания) уровней ПСА.
Таблица 44. Ориентировочные уровни ПСА при интермиттирующей андрогенной блокаде.
| Стадия | Состояние | Уровни ПСА в сыворотке (мкг/л) | ||||
| В начале цикла 1 | 24 недели | 32 недели | Перед началом цикла 2 | He поддающееся лечению заболевание, 3 повышения выше | ||
| А2, В или С | Нелеченное | ~6 | 0.2 или < 0.2 | 0.2 или < 0.2* | ~1 | 0.2 |
| D1 или В2 | Нелеченное | > 20 | 4 или < 4 | 4 или < 4* | ~20 | 4 |
| В2 или С | Неудачный исход лучевой терапии | > 6 | 4 или < 4 | 4 или < 4* | ~10 | 4 |
| А2, В или С | Неудачный исход простатэктомии | 0.8-1 | 0.2 или < 0.2 | 0.2 или < 0.2* | ~1 | 0.2 |
| А2, В или С | Неудачный исход простатэктомии и лучевой терапии | > 1 | 1 или < 1 | 1 или < 1* | ~1 | 1 |
Качество жизни и выживаемость. Нет сомнений в том, что применяя циклическое назначение МАБ, можно улучшить качество жизни. В перерывах возможно восстановление половой активности и улучшение эмоционального самочувствия. Другие преимущества включают сохранение андроген-зависимого состояния опухоли, уменьшение стоимости лечения, уменьшение токсичности препаратов и возможность сочетать интермиттирующую андрогенную блокаду с другими препаратами, как, например, ингибиторы 5альфа-редуктазы, препараты, влияющие на дифференцировку, цитостатики, а также генной терапией. Однако до сих пор неизвестно, как периодическая андрогенная блокада влияет на выживаемость, и это предстоит установить в будущих рандомизированных клинических исследованиях. Среди 14 больных раком предстательной железы, стадия D2, в исследовании, проведенном Goldenberg S.L. et аl., (1995), медиана периода времени до прогрессирования заболевания и выживаемость оказались сравнимы с результатами постоянной андрогенной блокады.
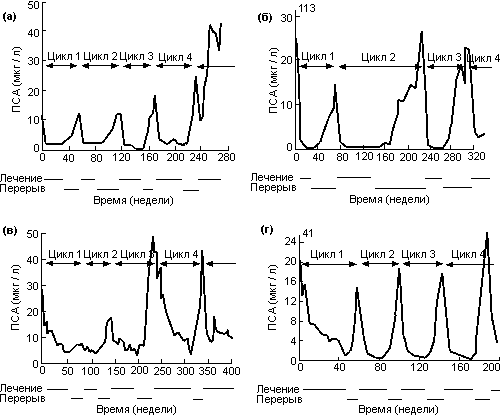
Хотя остается не доказанным, что периодическая андрогенная блокада более безопасна и эффективна в плане увеличения выживаемости, у небольшого числа больных с распространенным раком предстательной железы уже проведены многократные курсы лечения, как показано на рис. 25. На графике А представлены четыре полных курса лечения длительностью более 250 недель у 57-летнего больного с местно-распространенной опухолью после лучевой терапии на стадии С и одиночным метастазом в поясничном отделе позвоночника. На графике Б показано три цикла лечения длительностью более 310 недель у 69-летнего больного со стадией В и высокими исходными уровнями ПСА; этому больному лечение ранее не проводили. На графике С представлено четыре цикла лечения за период 340 недель у 51-летнего больного с не леченной ранее стадией D1 заболевания.
Рис. 25. Многократные циклы периодической андрогенной блокады:
а) больной с местно-распространенной аденокарциномой стадии С после лучевой терапии и метастазом в поясничный отдел позвоночника (заболевание не поддается лечению во время 5-го цикла);
б) больной с аденокарциномой стадии С, ранее нелеченный (в настоящее время получает 4-й цикл лечения);
в) больной с аденокарциномой стадии D2 и метастазами в грудной отдел позвоночника и тазовые кости, ранее нелеченный (в настоящее время получает 5-й цикл лечения);
г) больной c аденокарциномой стадии D1, ранее нелеченный (в настоящее время получает 5-й цикл лечения). Bruchovsky N., 1998.
В настоящее время неизвестно, по каким характеристикам больного и опухоли, а также по уровням ПСА предсказать длительность и число циклов лечения. По мере включения все большего числа больных в исследования с применением интермиттирующей андрогенной блокады этот вопрос прояснится.
Дилеммы. Во время лечения могут возникнуть обстоятельства, которые потребуют изменить метод лечения. Такие обстоятельства перечислены в таблице 45.
Таблица 45. Дилеммы во время интермиттирующей андрогенной блокады.
| Проблема | Клинический ответ |
| Сохранение повышенных уровней ПСА | Увеличить дозу антиандрогена или сменить антиандрогенный препарат |
| Быстрое повышение уровней ПСА после отмены лечения | Назначить финастерид на время перерыва до следующего цикла лечения |
| Очень медленное повышение уровней ПСА | Продолжать наблюдать, но обследовать больного в отношении других признаков прогрессирования заболевания |
| Повышение уровней ПСА при сохранении низких уровней тестостерона | Избегать вторичного обострения симптоматики, повысить дозу антиандрогена, сменить антиандроген, начать химиотерапию |
| Уровни ПСА при других клинических ситуациях | См. таблицу 44 |
Все больше утверждается мнение, что хирургическая кастрация или любой другой метод, который вызывает необратимый дефицит андрогенов у больных раком предстательной железы, - это "избыточное" лечение, по крайней мере в некоторых случаях. Это мнение сложилось на основании растущего числа наблюдений длительной ремиссии после относительно кратковременной андрогенной блокады. Прерывая лечение и восстанавливая нормальные уровни тестостерона, можно уменьшить побочные физиологические эффекты кастрации. Они включают атрофию скелетных мышц, остеопороз, падение уровней гемоглобина, ощущение хронической усталости, слабость, депрессию и потерю полового влечения и потенции. Кастрация также опасна в отношении биологических свойств рака предстательной железы, так как она стимулирует прогрессирование опухоли и утрату зависимости от андрогенов. В отличие от кастрации, периодическая андрогенная блокада, в которой используются преимущества обратимости изменений, вызванных аналогами ЛГРГ и антиандрогенами, предполагает длительное лечение рака предстательной железы с минимальными физиологическими и биологическими побочными эффектами, характерными для кастрации. По этой причине периодическую андрогенную блокаду все больше будут включать в схемы длительного лечения рака предстательной железы. Эти меры увеличат вероятность излечения, если их предпринимать в виде длительной неоадъювантной терапии, предшествующей радикальной простатэктомии или лучевой терапии. Если достичь излечения не удается, следует сосредоточить внимание на лечебных методах, которые позволяют поддерживать стабильное состояние без прогрессирования опухоли. Интермиттирующая андрогенная блокада займет важное место при таких подходах, особенно в том случае, если появятся режимы длительных циклов лечения.
Возможно интермиттирующая андрогенная блокада станет альтернативой радикальной простатэктомии или лучевой терапии как основного лечения рака предстательной железы ранних стадий у больных, которые отказываются от традиционных методов лечения, а также у пожилых больных, ожидаемая продолжительность жизни которых не превышает 10 лет.
Дебаты об эффективности МАБ продолжаются, тем не менее, этот метод лечения представляет новые возможности в лечении больных распространенным раком предстательной железы. В настоящее время МАБ достаточно широко применяется в клинической практике как первая линия лечения распространенного рака предстательной железы.
Различные методы гормонотерапии распространенного рака предстательной железы и компоненты МАБ будут рассмотрены ниже.
Хирургическая кастрация. Кастрацию начали применять как лечебный метод с 1890 годов, за 40 лет до того, как выяснили, что тестостерон - это гормон, продуцируемый яичками. У мужчин с увеличением предстательной железы, связанной с возрастом, лечение оказалось весьма эффективным - атрофия предстательной железы отмечалась в 87% случаев (White J.W., 1895). Однако кастрация приводила не только к высокой летальности (18%), но также вызывала психические расстройства и эмоциональные потрясения, которые не соответствовали объему хирургического вмешательства (Cabot А.Т., 1896). К лечебной кастрации вновь обратились в 40-х гг. и стали использовать ее в лечении диссеминированного рака предстательной железы (Huggins С., Hodges C.V., 1941). Поскольку этот метод был эффективным и вызывал стойкую ремиссию у большинства больных, не отмечалось особого интереса к менее заметным физиологическим изменениям, которые развивались после андрогенной блокады, в том числе психологическое благополучие больных. Помимо утраты полового влечения и потенции, снижения качества жизни больных отмечались такие побочные эффекты лечения, как остеопороз, атрофия мышц, гинекомастия, анемия, рост уровней липопротеидов высокой плотности и депрессия.
Хотя пока не существует метода лечения, который при раке предстательной железы был бы равен или превосходил кастрацию по эффективности, остается непонятным, почему гибель клеток, вызванная андрогенной блокадой, не вовлекает всю популяцию злокачественных клеток (Bruchovsky N. et аl., 1990).
В большинстве стран двусторонняя орхидэктомия до сих пор считается методом выбора лечения распространенного рака предстательной железы. Долгое время орхидэктомия занимала основное место среди возможных альтернатив. Эта относительно простая операция, которую можно выполнить под местной или неглубокой общей анестезией.
В результате подобного оперативного вмешательства концентрация циркулирующего тестостерона снижается на 95%, и часто, уже на первые сутки, после нее может быть получен благоприятный эффект. Хирургическая кастрация позволяет избежать некоторых трудностей с несоблюдением пациентом медицинских рекомендаций (в частности, нерегулярного приема лекарств), однако для многих пациентов она является неприемлемой.
Хотя орхидэктомия оказывает паллиативный эффект у 70-80% пациентов, само хирургическое вмешательство не лишено недостатков. Орхидэктомия -необратима и ее благоприятное воздействие для тех 20-30% пациентов, опухоль которых не является гормонально зависимой, может быть оспорено. Кроме того, большинство больных раком предстательной железы - это люди пожилого возраста и поэтому само по себе хирургическое вмешательство и общая анестезия представляют порой существенный риск для их жизни. Для более молодых пациентов, это, кроме того, тяжелая психологическая травма. Побочные эффекты кастрации - это утрата полового влечения и приливы.
Другой недостаток традиционных методов андрогенной блокады - это изменения свойств самой опухоли, которая прогрессирует и становится андроген-независимой. В среднем через 2 года после начала лечения развивается рецидив, повышаются уровни простатического специфического антигена (ПСА), и андрогены утрачивают влияние на опухолевый рост. Интермиттирующая андрогенная блокада позволяет время от времени облегчать психологические эффекты кастрации и может временно замедлять превращение опухоли в гормонально-независимую форму.
Эстрогенотерапия. 40-е годы текущего столетия - начало эры гормонального лечения рака предстательной железы. После серии известных работ Huggins и Hodges (1939-1941 гг.) долгое время наиболее распространенным методом лечения рака предстательной железы являлась и остается эстрогенотерапия и/или билатеральная орхидэктомия, так как в основе концепции гормонального лечения рака предстательной железы лежит нейтрализация мужских половых гормонов, то есть эндогенного тестостерона. Хороший клинический эффект при лечении рака предстательной железы с помощью кастрации и эстрогенов обусловил широкое распространение этого метода. Основное место в гормонотерапии отводилось синтетическим аналогам женских половых гормонов - эстрогенам.
Наиболее известные и давно апробированные за рубежом эстрогены, их эффективность и токсичность приведены в табл. 46.
Таблица 46. Дозировка, эффективность и токсичность эстрогенов (сводные литературные данные по Craurford E.D. et аl., 1996).
| Препарат | Дозировка | Эффективность | Токсичность |
| Диетилстилбестрол | 0.2 мг в день р/о | незначительная | незначительная |
| Диетилстилбестрол | 1.0 мг в день р/о | значительная | средняя |
| Диетилстилбестрол | 3.0 мг в день (1х3) | значительная | выраженная |
| Диетилстилбестрол | 5.0 мг в день р/о | значительная | чрезмерная |
| Премарин | 2.5 мг в день р/о | значительная | средняя |
| Эстрадурин | 80-160 мг в/м | незначительная | средняя |
| Эстрадурин | 240-320 мг в/м | вероятная | средняя |
| Хонван | 100 мг в день р/о | вероятная | значительная |
В России большинство урологов придерживаются рутинной схемы лечения (Мариенбах Е.Б., 1980, Бельчиков И.С., 1986, Свиридова Т.В. ,1994 и др.). Первый курс лечения эстрогенами начинается с больших доз и может сочетаться с билатеральной орхидэктомией. Долгое время рекомендовалось, а в некоторых учреждениях и поныне начинают лечение с применения синэстрола и хонвана (фосфэстрола). Масляный 2% раствор синэстрола вводят внутримышечно по 3-4 мл (то есть 60-80 мг) ежедневно в течение 2-2,5 месяцев. Хонван вводится внутривенно с возрастающей дозировкой с 250 мг до 750 мг - 1 гр. Суммарная курсовая доза хонвана (фосфэстрола) составляет 30-36 гр.
После достижения клинического эффекта в результате первого курса лечения, больных переводят на поддерживающую терапию, которая состоит в применении меньших доз тех же эстрогенов, назначаемых внутрь или в виде инъекций с периодическими интервалами. Наиболее удобными для поддерживающей терапии являются эстрадурин, назначаемый внутримышечно по 80 мг 2 раза в месяц, а также микрофоллин, хлортрианизен или туристерон - для перорального применения.
Результаты лечения у впервые выявленных больных с распространенным раком предстательной железы по данным разных авторов составляют: полная регрессия - 2%, частичная регрессия - 44%, одногодичная выживаемость - 70-78%, пятилетняя выживаемость - 20-30%.
Однако эстрогенотерапия имеет ряд очень существенных недостатков, а именно: осложнения со стороны сердечно-сосудистой системы, желудочно-кишечного тракта, свертывающей системы крови, угнетается иммунитет. Данные литературы свидетельствуют о высоком проценте летальности при лечении больных раком предстательной железы эстрогенными препаратами. Больные погибают именно от осложнений, связанных с применением синтетических препаратов эстрогенного действия. По сводной статистике L.O. Madsen и соавторов (1970) от осложнений эстрогенной терапии умирает больше больных, чем непосредственно от рака предстательной железы.
В патогенезе сердечно-сосудистых осложнений при эстрогенотерапии рака предстательной железы ведущее место занимают нарушения в системе гемокоагуляции. У больных раком предстательной железы, получавших эстрогенотерапию, обнаружено повышение агрегации тромбоцитов крови, снижение концентрации антитромбинового фактора III и фибринолитической активности.
Так Е. Warenhorst et al. (1981) показали тесную взаимосвязь между эстрогенотерапией рака предстательной железы и тромбоэмболическими осложнениями. Наиболее высок риск тяжелых сердечно-сосудистых осложнений в первые 6 месяцев лечения. По мнению экспертов Европейской организации по исследованию и лечению рака дополнительными факторами, способствующими развитию этих осложнений, является пожилой возраст, ожирение и особенно заболевания сердечно-сосудистой системы в анамнезе.
Ю.А. Пытель еще в 1973 году доказал, что синэстрол ингибирует печеночные энзимы, которые метаболизируют лекарственные препараты, что способствует развитию токсического гепатита у больных раком предстательной железы в результате применения эстрогенных препаратов в больших дозах. При введении больным раком предстательной железы одновременно с эстрогенами других лекарственных препаратов (сульфаниламиды, антибиотики, противодиабетические средства и т.д.), особенно при нарушении деятельности печени, могут возникнуть тяжелые реакции, проявляющиеся острой почечно-печеночной недостаточностью, вплоть до летального исхода. Экспериментальные исследования показали, что при применении синэстрола и эстрадурина у животных возникают не только расстройства уродинамики, но и значительные дистрофические изменения в почках.
Эстрогенные препараты угнетающе влияют на физиологическую систему иммунитета, что ухудшает результаты лечения. Диэтилстильбэстрол оказывает повреждающее действие на функциональную активность физиологической системы иммунитета.
Данные литературы и наш опыт свидетельствуют о высокой частоте осложнений, представленных в табл. 46а, и неудовлетворительной эффективности рутинной эстрогенной терапии.
Таблица 46а. Осложнения эстрогенотерапии (сводные данные литературы).
| Осложнения со стороны сердечно-сосудистой системы | 60-70% |
| Гепато-ренальная токсичность | 80-85% |
| Гинекомастия | 49-80% |
| Иммунодепрессия | 80-100% |
| Импотенция | 97-100% |
| Нарушения свертывающей системы крови | 30-40% |
| Периферические отеки | 16-23% |
| Приливы | 11-17% |
| Тошнота, рвота | 4-16% |
Таким образом, исходя из сказанного выше следует, что несмотря на определенную эффективность, эстрогенотерапия обладает серьезными недостатками в виде большого количества побочных эффектов. Все это привело к тому, что рутинная эстрогенотерапия, как первая линия лечения распространенного рака предстательной железы, практически оставлена. Однако, никто не отрицает возможности ее применения в качестве второй линии, в случае неэффективности или прогрессирования заболевания на фоне максимальной андрогенной блокады, или в комбинации с другими видами лечения, например, с лучевой терапией. Непременным условием при лечении эстрогенами является постоянный контроль состояния сердечно-сосудистой системы, антиагрегантная терапия, контроль функции печени и почек.
Компоненты максимальной андрогеннаой блокады.
Антиандрогены. В связи с недостатками стандартных методов лечения больных раком предстательной железы возникли альтернативные методы эндокринотерапии, которыми являются лечение антиандрогенами. Синтезировано значительное количество стероидных и нестероидных компонентов для получения более активных и специфических гормонов и антигормонов в лечении больных раком предстательной железы. Определение свойств рецепторного связывания этих субстанций in vitro с биологическими исследованиями in vivo позволило получить высокоэффективные гормональные препараты и добиться определенных достижений при лечении больных раком предстательной железы. Расширилось понимание молекулярных основ андрогенного действия гормонов, что привело к новым положениям в лечении больных раком предстательной железы. Одним из них явилось использование аналогов гонадотропин-рилизинг гормона, которые в фармакологических дозах снижают концентрацию тестостерона в крови до посткастрационных уровней путем десенситизации гипофизарных рецепторов гонадотропин-рилизинг гормона. Наряду с этим гормональная зависимость клеток рака предстательной железы дала основание выработать более эффективный метод лечения, основанный на подавлении биосинтеза андрогенов или предотвращении связывания эндогенных гормонов с их рецепторами в предстательной железе. Препараты, обладающие этими свойствами, объединены в группу антиандрогенов.
Стероидные антиандрогены. Ципротеронацетат (Андрокур). Впервые интерес к антиандрогенам возник в начале 60-х годов этого столетия, когда в лабораториях фирмы "Шеринг" ФРГ, а затем США, была обнаружена антиандрогенная активность ципротеронацетата (Wiechert R., Neumann F., 1965). Данное средство более широко известно под названием андрокур. Эффективность этого препарата подтверждается и в настоящее время. Первое сообщение об использовании ципротеронацетата (ЦПА) в качестве противоракового средства принадлежит W. Scott, Н. Schirmer (1966). В последующем терапевтический эффект андрокура при раке предстательной железы II-IV стадии был подтвержден многочисленными наблюдениями. Препарат оказался одинаково активным при пероральном и внутримышечном введении, поэтому предпочтение отдано первому способу. Хорошие результаты получены как при монотерапии, так и при сочетании с кастрацией. Андрокур назначается в суточной дозе 100-300 мг на протяжении нескольких месяцев и даже лет. Субъективное улучшение выражается в уменьшении болевого синдрома, улучшении оттока мочи, повышении аппетита. Эффективность лечения подтверждается объективными данными: регрессией опухоли и ее метастазов в лимфатических узлах, костях, легких и других органах либо стабилизацией злокачественного роста, прибавкой массы тела, а также показателями лабораторных исследований: снижением активности кислой фосфатазы и содержания тестостерона в крови. Следует отметить, что эффективность терапии андрокуром по большинству показателей в 1.5 раза выше у ранее не лечившихся больных. В некоторых случаях лечение андрокуром дает благоприятный результат, несмотря на безуспешность предшествующей эстрогенотерапии. Напротив, встречаются больные, положительно реагирующие на лечение эстрогенами, но устойчивые к антиандрогенам. Неоднородность результатов связана, вероятно, со многими факторами: индивидуальными особенностями всасывания и метаболизма антиандрогена, различной степенью гормональной зависимости опухолевой ткани и т.д.
По итогам всестороннего клинического изучения сделан вывод, что по своей эффективности при раке предстательной железы андрокур не уступает эстрогенам, и по отношению к ним может рассматриваться как альтернативный вариант лечения (Neumann F. et al., 1983).
При исследовании возможностей сочетанного применения андрокура с аналогами ЛГРГ, в частности с золадексом у 525 больных показало, что режим МАБ не имел статистически значимых преимуществ в отношении времени до прогрессирования по сравнению с монотерапией золадексом (Thorpe S.С. et al., 1996) . Другое рандомизированное исследование, включающее 368 пациентов, показало отсутствие существенного различия сочетания ЦПА с бусерелином (аналог ЛГРГ) по сравнению с орхидэктомией (De Voogt H.J. et аl., 1994).
К побочным явлениям андрокура относятся кардиоваскулярная токсичность, наблюдаемая у 4-10% (Osborne D.R. et al., 1990); дислипидемия (Gillat D.A. et аl., 1993); при длительной терапии андрокуром отмечены явления гепатотоксичности, в ряде случаев, приводящие к фатальному исходу (Curr. Problebs Pharmacovig, 1995), кроме того, он способен вызывать гинекомастию и угнетать либидо.
Из других стероидных соединений, обладающих антиандрогенной активностью и успешно применявшихся для лечения рака предстательной железы, необходимо упомянуть хлормадинонацетат, мегестролацетат, спиронолактон. Эти препараты, в особенности мегестролацетат и хлормадинонацетат, действуют в нескольких направлениях. Они угнетают гонадотропную функцию гипофиза, снижают содержание тестостерона в крови и вмешиваются в реализацию биологического действия мужского полового гормона на клеточном уровне, конкурируя с рецепторами андрогенов и уменьшая образование 5а-дигидротестостерона. Они реже, чем эстрогены, вызывают гинекомастию, но могут оказывать побочное действие. В частности, сердечно-сосудистые осложнения и гепатотоксичность при лечении хлормадинонацетатом встречаются столь же часто, как и при лечении эстрогенами (Neri R.O. et аl., 1982).
Определенная настороженность в отношении риска побочных реакций при лечении стероидными антиандрогенами продолжает сохраняться. Даже слабая андрогенная активность, свойственная ципротеронацетату, ограничивает его возможности как противоракового средства ввиду того, что для стимуляции роста опухоли предстательной железы достаточно минимального андрогенного воздействия (Geller J. et аl., 1986) . Все это заставило искать альтернативные методы лечения рака предстательной железы и привело к созданию нестероидных антиандрогенов.
Нестероидные антиандрогены. В настоящее время в клинической практике используют нестероидные (флутамид, анандрон, касодекс) и стероидные (мегестролацетат, ципротеронацетат) антиандрогены. Механизмы действия каждого из них значительно отличаются друг от друга и являются, по-видимому, более сложными, чем достижение лишь блокады андрогенного эффекта.
Различие в механизмах действия стероидных и нестероидных антиандрогенов наглядно демонстрирует таблица 47.
Таблица 47. Биологические эффекты, вызываемые стероидными (ЦПА) и "чистыми" (флуцином) антиандрогенами у здоровых мужчин и самцов крыс.
| Биологический эффект | ЦПА | Флуцином |
| Человек | ||
| Тестостерон | снижает | повышает |
| Дигидротестостерон | снижает | повышает |
| Эстрадиол | снижает | повышает |
| ЛГ | снижает | повышает |
| Объем ВРН | снижает | снижает |
| Гинекомастия | - | + |
| Либидо | снижает | + |
| Потенция | снижает | + |
| Крысы | ||
| Вентральная доля предстательной железы | уменьшается | уменьшается |
| Клетки Лейдига | атрофия | гипертрофия |
В то же время общим свойством антиандрогенов является торможение клеточного метаболизма циркулирующих андрогенов. Антиандрогены блокируют активность ферментов на всем этапе биосинтеза андрогенов тестикулярного и адренального происхождения на клеточном уровне предстательной железы. В организме человека надпочечники являются важным источником андрогенов с более слабой биологической активностью по отношению к тестикулярнымандрогенам (Eichler O. et al., 1974, Martini L, 1977 и др.). Авторы в своих публикациях отмечают, что в то же время андрогены превращаются в тестостерон и дигидротестостерон в клетках предстательной железы и таким образом реактивируют опухолевой рост. Орхидэктомия не подавляет секрецию адренальных антиандрогенов. В связи с этим для достижения тотальной андрогенной блокады целесообразно сочетать орхидэктомию с введением антиандрогенов. Нестероидные антиандрогены имеют преимущества перед стероидными в избирательности связывания с рецепторами андрогенов в ткани предстательной железы, тогда как стероидные антиандрогены связываются в значительной степени с другими гормональными рецепторами (прогестин, глюко- и минералокортикоидные). Нестероидные антиандрогены лишены гормональной или антигормональной активности и могут рассматриваться как "чистые" антиандрогены. Основными требованиями к "чистым" антиандрогенам являются: высокая антиандрогенная активность, отсутствие свойств андрогенов, отсутствие способности образования связи с неандрогенными рецепторными протеинами в простатической клетке.
Флутамид (Флуцином). Одним из первых нестероидных антиандрогенов, внедренных в клиническую практику, для лечения распространенного рака предстательной железы стал флутамид синтезированный фирмой "Шеринг-Плау" США (синонимы - эулексин, эуфлекс, флуцином). Препарат лишен свойств андрогенов, эстрогенов, антизстрогенов, прогестинов и адренокортиальной активности. Антиандрогенный эффект проявляется в ткани предстательной железы при его превращении в гидроксиметаболит, который тормозит поглощение тестостерона или дигидротестостерона с ядерным рецептором. В результате этого процесса устраняется биологический эффект андрогенов на уровне опухолевой клетки. В связи с торможением механизма обратной связи в системе яички-аденогипофиз при лечении флутамидом отмечается повышение в крови уровней тестостерона. Это объясняет сохранение половой функции и полового влечения при лечении этим препаратом. Побочное действие флутамида выражено значительно меньше, чем у препаратов эстрогенного действия, и проявляется гинекомастией, болезненностью молочных желез, в редких случаях наблюдаются нарушения функции печени, тошнота, рвота. Флутамид применялся также для выявления роли андрогенов в тромбообразовании. Флутамид препятствовал усилению агрегации тромбоцитов под влиянием андрогенов у морских свинок. Эти данные согласуются с клиническими наблюдениями, которые не выявили сосудистых осложнений у больных при раке предстательной железы, принимавших флутамид в течение продолжительного времени. Разовая доза флутамида при лечении больных раком предстательной железы 250 мг, суточная 750 мг. Neri R., 1987, при изучении зависимости эффекта лечения от различных доз препарата в интервале от 750 мг до 1500 мг, существенной разницы не выявил.
Эффективность препарата флутамид оценивалась разными исследователями многих стран. Некоторые сведения о результатах лечения флутамидом в монотерапии представлены в таблице 48.
Таблица 48. Результаты лечения больных распространенным раком предстательной железы флутамидом в режиме монотерапии (сводные данные литературы).
| Автор | Год | Кол-во больных | Частичная регрессия | Стабилизация | Пpoгpecсирование |
| Irwin and Prout | 1973 | 12 | 66% | 27% | 7% |
| Prout et al. | 1975 | 13 | 85% | 11% | 4% |
| Kassern et al. | 1981 | 108 | 87% | 10% | 3% |
| Sogani et al. | 1984 | 72 | 87% | 10% | 3% |
| Sogani and Whit | 1986 | 21 | 90% | 8% | 2% |
| Keating et al. | 1986 | 69 | 53% | 43% | 4% |
| Lungrem | 1987 | 10 | 20% | 70% | 10% |
| Daricello et al. | 1987 | 22 | 55% | 31% | 14% |
| Lund and Rasmus. | 1988 | 20 | 65% | 28% | 7% |
| Pavone-Macaluso | 1989 | 38 | 52% | 45% | 3% |
| Prout et al. | 1989 | 52 | 50% | 36% | 14% |
Группа исследователей - (Lund F. et аl, 1988), сравнивали эффективность флутамида и стильбестрола. Лечение проводилось 40 больным раком предстательной железы с метастазами в кости. Отмечена удовлетворительная субъективная оценка результатов лечения обоими препаратами. Через 12 месяцев лечения улучшение состояния было зарегистрировано у 13 из 20 больных, получавших флутамид, и у 8 из 20 получавших стильбестрол. Дозировка препаратов обычная, флутамид по 750 мг/д и стильбестрол 3 мг/д. Отмечено, что при лечении эстрогенным препаратом наблюдали более высокий процент побочных действий со стороны сердечно-сосудистой системы, сами реакции носили более тяжелый характер, чем у принимавших флутамид. Один из первопроходцев клинического испытания флутамида Neri R., 1986, на большом количестве больных (283 больных) запущенной формой рака предстательной железы через 12 месяцев наблюдения у 43% отметил частичную регрессию процесса, у 24% стабилизацию и только у 12% прогрессирование. Положительную характеристику препарата при лечении больных раком предстательной железы дают и другие исследователи (Flamm J. et аl., 1988, Sogani P.S. et al., 1984 и др). При этом они в 5-8% случаев отметили полную регрессию опухоли и метастазов, в 11-71% частичную регрессию опухолевого процесса, в 14-74% стабилизацию и 12-45% прогрессирование в течение 12 месяцев наблюдения.
В урологическом отделении Онкологического научного центра им. Н.Н. Блохина РАМН при лечении пациентов диссеминированным раком предстательной железы флутамидом в режиме монотерапии через 12 месяцев были получены следующие результаты: частичная регрессия - у 42,4%, стабилизация - у 33,3%, прогрессирование - у 24,3% больных (Б.В. Бухаркин, 1995).
Интересны результаты лечения больных раком предстательной железы, когда флутамид применялся в комбинации с кастрацией (табл. 49). F. Labrie в 94% случаев отметил частичную регрессию опухоли и метастазов, а в 6% - стабилизацию. Менее оптимистичны данные других исследований проведенные несколько позже. Так Rosier, (1987), наблюдая 31 больного, в 29% случаев отметил частичную регрессию, в 60% - стабилизацию, в 21% - прогрессирование. Flamm, (1988), пролечив 55 больных, в 35% случаев наблюдал частичную регрессию, в 48% - стабилизацию, в 18% - прогрессирование. Bouffoux, (1989), у 47 больных, в 70% случаев отмечает частичную регрессию, в 12% - стабилизацию, в 18% - прогрессирование.
Таблица 49. Результаты лечения больных распространенным раком предстательной железы флутамидом в режиме МАБ (сводные данные литературы).
| Автор | Год | Кол-во больных | Частичная регрессия | Стабилизация | Пpoгpecсирование |
| Labrie F. | 1982 | 68 | 94% | 6% | - |
| Rossler I. | 1987 | 31 | 29% | 66% | 5% |
| Flam J. | 1988 | 55 | 40% | 55% | 5% |
| Boutfoux A. | 1989 | 47 | 70% | 26% | 4% |
Таким образом, нестероидный антиандроген флутамид убедительно доказал свою эффективность как при применении в монотерапии, так и в комбинации с кастрацией. Причем разница успеха лечения в монотерапии и в комбинации была совсем невелика.
В ОНЦ РАМН проведен анализ результатов лечения больных диссеминированным раком простаты флутамидом в комбинации с хирургической кастрацией, при котором частичная регрессия наблюдалась в 47,6% случаев, стабилизация - в 45,2%, а прогрессирование - лишь в 7,2%.(Б.В. Бухаркин, 1995). При сравнении флутамида с другим нестероидным антиандрогеном - касодексом в режиме максимальной андрогенной блокады, оказалось, что на период наблюдения в 160 недель, отсутствовали признаки прогрессирования у 71% пациентов в группе касодекса и у 72% в группе флутамида. Таким образом, оба препарата показали равную эффективность в отношении времени до прогрессирования заболевания (Schelhammer P.F. et аl., 1996).
Значительным преимуществом антиандрогенов, в частности, флутамида, перед эстрогенотерапией является низкая кардиотоксичность, однако этот препарат имеет свои побочные действия. Наиболее частым осложнением лечения являются гастроинтестинальные дисфункции, диарея, тошнота, анорексия, которые приводят к отмене терапии в 10-20% случаев. Кроме того, сообщается о достаточно высокой гепатотоксичности, повышении трансаминаз, а также смертельных случаях лекарственного гепатита на фоне лечения флутамидом (Wysowki D.K. et аl., 1993).
Некоторые сравнительные данные, отражающие частоту побочных действий флутамида и ципротеронацетета (ЦПА), опубликованные Schroder F.H. et аl. в 1997 году на основании результатов протокола EORTC 30892 (март 1996), приведены в табл. 50.
Таблица 50. Побочные действия флутамида и ЦПА (EORTC 30892).
| Побочные действия | Флутамид (n = 130) | ЦПА (n = 134) | ||
| n | % | n | % | |
| Гинекомастия | 59 | 45.4 | 10 | 7.5 |
| Диарея | 30 | 23.1 | 13 | 9.7 |
| Тошнота | 25 | 19.2 | 8 | 6 |
| Нарушение ф-ции печени | 13 | 10 | 6 | 4.5 |
| Тромбозы, эмболии | - | - | 6 | 4.5 |
Анандрон (нилутамид). Другой нестероидный антиандроген - анандрон, был предложен для испытаний французской фирмой Руссель Юклаф. В 1983 г. появились первые сведения о попытках лечения рака предстательной железы препаратом из группы нестероидных антиандрогенов - RU 23908 (Rajnaud J.-P., 1977). Препарат назначали 3 больным в связи с рецидивом болезни, наступившем после кастрации. У 2 из них отмечалась кратковременная (4-5 мес) ремиссия, у одного - более продолжительная стабилизация размеров опухоли. Однако перспективы клинического применения анандрона в то время стали вызывать сомнения. С 1983 года авторы метода отказались от применения анандрона, так как у 70% больных он вызывал побочные явления, вынуждавшие прекратить лечение. Вместе с тем Moguilewsky M. et al., (1986) пришли к выводу, что анандрон надо вводить дополнительно с хирургической или медикаментозной кастрацией для нейтрализации стимулирующего действия на предстательную железу циркулирующих в крови остаточных андрогенов надпочечникового и тестикулярного происхождения. Как сообщают авторы этого метода, ремиссия отмечалась у 95% из 53 больных, ранее не лечившихся, у 50%, прежде получавших эстрогены, в том числе у 30%, ранее перенесших кастрацию. Преимущества метода, считают они, состоят в возможности быстро нейтрализовать циркулирующие андрогены, появляющиеся в сыворотке крови в первые 5-15 суток после выполнения кастрации, этим повысить частоту ремиссии и снизить в опухоли количество клонов клеток, резистентных к гормонотерапии. Исследования в этом направлении ведутся и J.-P. Raynaud., Т. Oiasso., (1986, 1991), что свидетельствует о сохраняющемся интересе к анандрону в рассматриваемом аспекте.
По своему механизму действия анандрон, как и флутамид, лишен гормональной и антигормональной активности и рассматривается как "чистый" антиандроген. Препарат не блокирует процесс превращения тестостерона в дигидротестостерон, но тормозит транслокацию в ядро андроген-рецепторного комплекса и этим снижает поглощение андрогенов в ткани-мишени. Препарат быстро абсорбируется при приеме внутрь, период полураспада длительный, чем и объясняется его медленное выделение из организма. Результаты экспериментальных исследований на кастрированных крысах-самцах показали, что при приеме внутрь анандрона в дозе 10 мг/кг лишь 20-49% андрогенных связывающих локализаций в предстательной железе остаются не занятыми. При этом отмечается значительное нарастание содержания цитозольных андрогенрецепторов и ослабление удержания стероидно-рецепторного комплекса в ядре. В противоположность этому, агонист андрогенов-тестостерона пропионат повышает в ткани предстательной железы уровень ядерных рецепторов андрогенов, что приводит к стимуляции активности простатической клетки. Эти же авторы выявили, что особенности кинетики и метаболизма анандрона (медленное выделение из крови и низкая скорость метаболизма препарата) обеспечивают сохранность постоянно высокого уровня препарата вблизи клетки-мишени. По мере диссоциации комплекса анандрон-цитоплазматический рецептор андрогена препарат способен повторно ассоциироваться с цитоплазматическим рецептором андрогена. Таким образом, при лечении анандроном создаются условия, препятствующие реализации влияния андрогенов на уровне простатической клетки. Это ценное свойство препарата и используются для адъювантной терапии при кастрации (хирургической или медикаментозной) для нейтрализации эффекта адренальных андрогенов. Адренальные андрогены включают 30-40% тройной активности тотальных андрогенов, оказывающих влияние на предстательную железу, и свойство анандрона блокировать их влияние является ценным преимуществом перед эстрогенами. Отмечается эффективность препарата при лечении больных раком предстательной железы в связи с рецидивом после предшествующей эстрогенотерапии. При этом отмечается необходимость использования более высоких доз, чем при адъювантной терапии, т.к. у больных, леченных эстрогенами, концентрация рецепторов андрогенов в ткани опухоли более высокая, чем после орхидэктомии. Проведенные клинические испытания анандрона с хирургической кастрацией (Ramanath R.B. et аl., 1988) на 72 больных раком предстательной железы с метастазами в кости в 52% случаев имелся выраженный эффект в виде регрессии первичной опухоли и метастазов. Но у больных ранее не леченных эстрогенами лечебная реакция была более выраженной, чем у леченных эстрогенами. Важное клиническое значение имеет своевременная кастрация больного хирургическим или медикаментозным путем, т.к. в первые сутки применения анандрона в крови идет повышение количества тестостерона, что может дать прогрессирование роста рака предстательной железы. Препарат анандрон в сочетании с билатеральной орхидэктомией при лечении больных раком предстательной железы был испытан разными исследователями. Некоторые результаты приведены в таблице 51.
Таблица 51. Результаты лечения больных распространенным раком предстательной железы анандроном в сочетании с билатеральной орхидэктомией (сводные данные литературы).
| Автор | Год | Кол-во больных | Частичная регрессия | Стабилизация | Пpoгpecсирование |
| Beland G. | 1991 | 10 | 180% | 16% | 4% |
| Janknegt P. | 1991 | 98 | 41% | 53% | 6% |
| Dionisius D.P. | 1991 | 128 | 63% | 36% | 1% |
| Desensi A.U. | 1991 | 84 | 68% | 30% | 2% |
Кроме того Namer M. et al., (1988), сравнивали лечение анандроном с лечением только кастрацией. Испытанию подверглись 98 больных раком предстательной железы с метастазами в кости. При лечении анандроном и кастрацией эффект отмечен в 92% случаев, по сравнению с 72% в другой группе. Betand G. et аl., (1988), рандомизированно исследовали 154 больных раком предстательной железы с метастазами в кости. Провели лечение: 1) орхидэктомия(ОЭ) + плацебо (77 больных); 2) ОЭ + анандрон (300 мг/д) (77 больных). Эффект достигнут у 61% больных в первой группе и у 84% во второй. Медиана выживаемости составила 18 и 23 месяца соответственно. Однако, при дальнейшем наблюдении эти различия оказались статистически не достоверными (Beland G. et al., 1990).
В отделении урологии ОНЦ РАМН при изучении результатов лечения анандроном в сочетании с хирургической кастрацией больных диссеминированным раком предстательной железы частичная регрессия выявлена у 50% пациентов, стабилизация - у 41,2%, прогрессирование - в 8,8% случаев (Б.В. Бухаркин, 1995).
Анандрон не имеет такой гастроинтестинальной токсичности, как флутамид, однако имеются сообщения о возможном нарушении аккомодации зрения у 40% пациентов во время приема препарата, а также нарушению толерантности к алкоголю (Beland G. et al., 1990). Decesi A.U. et al., (1991) сообщили о возможности возникновения интерстициального пульмонита. Тяжелую интерстициальную пневмонию у 4,5% пациентов на фоне лечения анандроном наблюдали Pfitrenmeyer P. et al., (1992), Chatelain С., (1994).
Наиболее часто встречаемые побочные явления анандрона в сравнении с медикаментозной или хирургической кастрацией демонстрирует таблица сводных литературных данных, приведенных Mahler Ch. et аl., (1997) (табл. 52).
Таблица 52. Сравнение наиболее часто встречающихся побочных действий анандрона в сочетании с кастрацией и кастрации с плацебо.
| Побочный эффект | Кастрация + плацебо (n-805) | Кастрация + анандрон (n-876) |
| Приливы | 36% | 43% |
| Нарушение световой адаптации | 4% | 27% |
| Тошнота, рвота | 5% | 12% |
| Головокружение | 4% | 8% |
| Снижение толерантности к алкоголю | 2% | 6% |
Как видно из представленных данных, превалирует такое побочное явление, как нарушение световой адаптации, практически не встречающееся при применении других антиандрогенов.
Касодекс (бикалутамид). Одним из последних, внедренных в широкую клиническую практику, препаратов этого ряда, является касодекс (бикалутамид), синтезируемый и производимый английской фирмой Zeneca. Касодекс - это пероральный нестероидный антиандроген, не обладающий никаким другим эндокринным действием. Для касодекса характерен длительный период полувыведения, что позволяет принимать его один раз в сутки. Касодекс в дозе 50 мг в сутки хорошо переносится, применяется, как правило, в комбинированном лечении распространенного рака предстательной железы вместе с хирургической или медикаментозной кастрацией.
Антиандрогенные свойства касодекса продемонстрированы в доклинических фармакологических исследованиях. В их числе - мощное угнетающее действие на рост клеточных линий рака предстательной железы человека и ответ андроген-чувствительных опухолей предстательной железы крыс линии Dunning. Касодекс связывается с рецепторами андрогенов в предстательной железе и гипофизе крыс. Доказано, что он обладает более низкой аффинностью, чем природный ДГТ, но более высокой, чем флутамид. Его аффинность к рецепторам андрогенов предстательной железы в 4 раза выше, чем аффинность 2-гидроксифлутамида - активного метаболита флутамида (Furr B.J.A., 1990, 1997). Однако естественно, что эти данные нельзя автоматически экстраполировать на человека. В исследованиях фармакологических свойств на животных моделях показано, что радиомеченный касодекс не пересекает гематоэнцефалический барьер и не действует на гипоталямус, который играет основную роль в механизме отрицательной обратной связи регуляции действия антиандрогенов. Furr B.J.A. (1990) показал, что касодекс - это сильно действующий нестероидный антиандроген, который не обладает другой эндокринной активностью. Этим же автором было проведено сравнение касодекса и флутамида после приема внутрь на крысах-самцах, исследовали дозы 1, 5 и 25 мг/кг обоих препаратов. Касодекс уменьшал массу вентральной предстательной железы при всех дозах, кроме того, он продемонстрировал более мощное антиандрогенное действие, чем флутамид. При сравнении эффективности касодекса и флутамида на снижении средней скорости роста опухоли, действие касодекса оказалось более значимым. Угнетение роста опухоли у крыс, вызванное касодексом, было сравнимо с хирургической или медикаментозной кастрацией.
При исследовании токсичности на животных моделях касодекс показал хорошую переносимость. Данные по доклиническому исследованию токсичности касодекса не выявили противопоказаний к длительному применению препарата у мужчин среднего и пожилого возраста при суточной дозе 50 мг.
Фармакокинетика. Антиандрогенная активность рацемической смеси в касодексе главным образом обусловлена правовращающим (R) изомером касодекса (Cocksott I.D., et аl., 1993). (Р)-касодекс медленно всасывается и очень медленно выводится, а (3)-касодекс отличается прямо противоположными свойствами. Поэтому любые проблемы, связанные с накоплением неактивного вещества, минимальны из-за быстрого выведения (S)-касодекса.
Длительный период полувыведения активного изомера (около одной недели), а также однократный суточный прием препарата повышают вероятность соблюдения больным врачебных назначений. Эффективная концентрация касодекса в крови достигается после первого приема. Всасывание касодекса не изменяется при наличии пищи в желудке. У больных пожилого возраста и пациентов с ранее леченной почечной недостаточностью клинически не отмечено изменений фармакокинетических свойств касодекса, что позволяет не изменять у них дозировки препарата. Касодекс у человека метаболизируется в печени. Хотя и нет данных о том, что умеренное нарушение функции печени влияет на фармакокинетику препарата, следует помнить, что у больных с тяжелой печеночной недостаточностью его выведение замедляется и может привести к коммуляции. Касодекс метаболизируется прямым путем. У человека он выводится с мочой и калом в равной степени.
Клинические результаты применения касодекса (50 мг) в комбинированном лечении. Касодекс исследован в многочисленных клинических испытаниях, которые убедительно продемонстрировали его эффективность в лечении распространенного рака предстательной железы. В программу испытаний касодекса включено 5000 мужчин, из которых касодекс получали 3893 больных в основном распространенным раком предстательной железы. Наиболее крупным исследованием, которое продемонстрировало эффективность касодекса в комбинации с медикаментозной кастрацией явилось исследование Schelhammer P.F. et аl., 1996. Его целью было сравнение эффективности и переносимости комбинации касодекса в дозе 50 мг с аналогом ЛГРГ (404 больных) и комбинации флутамида в дозе 750 мг в сутки с аналогом ЛГРГ (409 больных) у пациентов с ранее не леченным распространенным раком предстательной железы. Исследование было рандомизированным, многоцентровым и проводилось двойным слепым методом. Больные были отобраны в онкологичеких центрах Канады и США.
Основным критерием эффективности лечения считали период времени до неудачи терапии (ВНТ). В двух предыдущих испытаниях ВНТ оценивали за период наблюдения 48 и 95 недель соответственно (Schelhammer P.F. et аl., 1995, 1996). Показателями эффективности лечения при длительности наблюдения 160 недель была выживаемость (период времени от начала лечения до летального исхода) и период времени до прогрессирования заболевания (Schelhammer P.F. et al., 1997). Критериями прогрессирования служили: выявление одного или более новых костных метастазов при сканировании костей скелета; увеличение любого из уже существующих костных метастазов; появление одного или более внекостных метастазов или увеличение минимум на 25% одного из имевшихся внекостных метастазов. Субъективное состояние оценивалось с помощью анкетирования через 1 и 3 месяца от начала рандомизации, затем каждые 3 месяца.
Анализ переносимости включал данные по побочным действиям и анализ существенных лабораторных показателей.
Медиана наблюдения составила 160 недель, т.е. более 3 лет. Процент умерших больных в группе касодекса составил 53%, а в группе флутамида - 57%. Соответственно медиана времени до смерти 180 и 148 недель, медиана времени до прогрессирования 97 и 77 недель, медиана времени лечения - 72 и 59 нед.
Таким образом, данное исследование показало, что эффективность комбинированного лечения касодексом и флутамидом в сочетании с аналогом ЛГРГ по меньшей мере является равной в обеих группах.
Анализ побочных действий показал, что самым частым побочным явлением были приливы (53% в обеих группах). Достоверно различались группы лишь по частоте возникновения диареи в группе касодекса - 12%, а в группе флутамида - 26%, т.е. более чем в два раза.
При средней длительности наблюдений 160 недель у 107 больных лечение было отменено из-за побочных явлений, в группе касодекса - у 41, в группе флутамида - у 66 больных. Причины отмены лечения из-за побочных действий представлены в табл. 53.
Таблица 53. Причины отмены лечения из-за побочных явлений.
| Побочные явления | Число больных | |
| Касодекс + аналог ЛГРГ (n = 401) | Флутамид+ аналог ЛГРГ (n = 407) | |
| Диарея | 2 (0.5%) | 25 (6.1%) |
| Нарушение ф-ции печени | 6 (1.5%) | 10 (2.5%) |
| Тошнота и рвота | 3 (0.7%) | 8 (2.0%) |
| Приливы | 4 (1.0%) | 2 (0.5%) |
| Прочие | 26 (6.5%) | 21 (5.2%) |
| ВСЕГО | 41 (10.2%) | 66 (16.2%) |
Таким образом по результатам данного исследования выявлена тенденция к некоторому преимуществу касодекса в отношении общей выживаемости и времени до прогрессирования, однако статистически достоверных различий получено не было. Отмечается достоверное преимущество касодекса в плане переносимости.
Применение касодекса в монотерапии. Как было показано выше касодекс в дозе 50 мг эффективен в комбинированной терапии с кастрацией. Целью ряда международных исследований стало установление эффективности больших доз касодекса - 150 мг в монотерапии. Значительный интерес представляют результаты, приведенные Iversen P. et al., (1998), проведших сравнительный анализ монотерапии касодексом и кастрации (хирургической или медикаментозной). В исследование были включены 1453 пациента с распространенным раком предстательной железы T3-4 М0 или доказанным М1. Анализ проводился после 4 лет наблюдения. В результате было показано, что для пациентов без метастазов действие касодекса эквивалентно кастрации и может являться альтернативой как хирургической, так и медикаментозной кастрации. У пациентов с отдаленными метастазами продолжительность жизни была на 42 дня больше в группе кастрации. Однако анализ качества жизни продемонстрировал значительное преимущество касодекса. Так пациенты, получавшие 150 мг касодекса, сохраняли либидо и половую потенцию, а также физическую работоспособность на достоверно более высоком уровне, чем больные подвергнутые кастрации. Эти преимущества в качестве жизни чрезвычайно важны учитывая паллиативный характер лечения. Таким образом, некоторое уменьшение времени выживания компенсируется значительным улучшением качества жизни.
В другом исследовании (Ferraris V. et al., 1998), включавшем 220 пациентов с местно-распространенным и метастатическим раком предстательной железы, проведен сравнительный анализ монотерапии касодексом в дозе 150 мг и максимальной андрогенной блокады (флутамид по 750 мг в день + госерелин по 3,6 мг каждые 4 недели). Авторами этого не рандомизированного исследования было показано, что монотерапия касодексом была надежна и также эффективна как и максимальная андрогенная блокада, независимо от стадии заболевания, кроме того, она легче переносилась и обеспечивала лучшее качество жизни.
Аналогичные выводы сделаны Fourcade R.O. et аl., (1998), в рандомизированном исследовании, включавшем 120 пациентов леченных касодексом 150 мг и 115 пациентов, леченных комбинацией кастрации (хирургической или медикаментозной) и нилутамидом 300 мг. Монотерапия касодексом продемонстрировала эффективность равную максимальной андрогенной блокаде. Оценка побочных действий представлена в табл. 54.
Таблица 54. Побочные эффекты монотерапии касодексом 150 мг и МАБ (кастрация + нилутамид 300 мг).
| Побочный эффект | Касодекс | МАБ |
| Интерстициальная пневмония | 0 | 38% |
| Одышка | 2.2% | 11% |
| Нарушение визуальной адаптации | 2.9% | 23.7% |
| Алкогольная непереносимость | 2% | 11.9% |
| Приливы | 10.8% | 44.6% |
| Болезненность грудных желез | 12.9% | 0 |
| Гинекомастия | 36.7% | 3.1% |
Таким образом, переносимость обеих вариантов лечения авторы считают вполне удовлетворительными. Однако касодекс продемонстрировал меньшее количество серьезных побочных действий.
На XIII конгрессе Европейской ассоциации урологов в Барселоне (1998) Wirth М.Р. & Iversen P. сообщили о клинической программе, состоящей из 3 рандомизированных исследований, в которых будет проведен сравнительный анализ эффективности монотерапии касодексом 150 мг в сравнении с плацебо у пациентов с неметастазирующим раком предстательной железы. В эту, одну из крупнейших международных программ по раку предстательной железы в ранних стадиях, предполагается включить более 7500 пациентов.
Монотерапия антиандрогенами. Результаты всех исследований, в которых оценивали эффективность монотерапии антиандрогенами, предоставили убедительные доказательства активности и в целом хорошей переносимости нестероидных антиандрогенов. Важным остается вопрос, можно ли добиться повышения эффективности лечения при повышении дозы, и какова эффективность монотерапии антиандрогенами в сравнении с таким стандартным методом, как кастрация. В настоящее время, несмотря на то, что в некоторых исследованиях не выявлено статистически значимых различий, существуют и другие работы, которые показывают недостатки монотерапии антиандрогенами. Следовательно, в каждом конкретном случае решение о назначении монотерапии антиандрогенами должно приниматься только после информированного согласия больного. Возможно, что при регулярном определении уровней ПСА потребуется переход от монотерапии антиандрогенами на традиционный метод лечения, то есть МАБ, если, например, через 12 недель после начала лечения уровни ПСА не снизятся минимум на 90% или не достигнут нормальных пределов (Furr B.J. et al., 1994). Такой подход позволит сохранить больному половую активность и извлечь максимум из эффективности традиционных методов лечения.
Целесообразно изучить, почему монотерапия антиандрогенами не столь эффективна в отношении периода времени до прогрессирования заболевания и выживаемости, как кастрация. На это может влиять ряд факторов, первый из которых - соблюдение больным врачебных назначений. Все антиандрогены предназначены для приема внутрь от одного до трех раз в сутки. Многочисленные исследования показали, что лишь небольшая доля больных строго следует назначенной схеме лечения, поэтому степень андрогенной блокады может несколько колебаться у разных больных, получающих препараты для приема внутрь (Kaisary A.V, 1996).
Другим возможным объяснением недостаточно высокой эффективности может служить тот факт, что за счет механизма обратной связи в гипоталамо-гипофизарно-гонадной системе уровни тестостерона возрастают в 1,6 раз выше исходных (Mahler С. et al., 1990). Это резко отличает монотерапию антиандрогенами от кастрации, когда уровни тестостерона падают до кастрационных. Такое возрастание стимуляции андрогенных рецепторов может отчасти объяснять относительно низкую эффективность антиандрогенов, наблюдаемую в некоторых исследованиях.
И последний фактор, который может оказывать влияние на эффективность монотерапии антиандрогенами, - это объем опухолевых очагов. На основании результатов исследований с бикалутамидом 150 мг, и возрастающими дозами этого препарата, появились предположения, что у больных с меньшим объемом опухолевых очагов исход лучше (по сравнению с кастрацией), чем у больных с диссеминированным заболеванием. Это, в свою очередь, может объясняться числом андрогенных рецепторов, которые необходимо блокировать у больных с большим объемом опухолевых очагов, тогда как у больных с меньшим объемом опухоли необходимо блокировать меньшее число андрогенных рецепторов. Эта гипотеза в настоящее время проверяется в проспективном исследовании, в котором изучают связывание антиандрогенов у больных раком предстательной железы ранних стадий и стадией диссеминации с использованием позитрон-эмиссионной томографии.
Получение антиандрогенов предоставило клиницистам дополнительный выбор в методах лечения, обеспечивающих андрогенную блокаду при раке предстательной железы. Все клиницисты и больные должны быть готовыми к тому, чтобы обсудить оптимальный метод лечения в каждом конкретном случае, что позволяет самому больному выбрать приемлемый для него метод. Если больные предпочитают препараты для приема внутрь и желают сохранить половую активность, выбор можно остановить на монотерапии антиандрогенами.
Аналоги (агонисты) ЛГРГ.
Механизм действия. Секреция передней долей гипофиза гонадотропинов (лютеинизирующего гормона, ЛГ, и фолликулостимулирующего гормона, ФСГ) в кровяное русло происходит под воздействием ЛГРГ, образующегося в гипоталамусе. Тестостерон образуется в клетках Лейдига яичек в качестве реакции на стимуляцию, осуществляемую ЛГ и ЛГРГ.
У мужчин выделение ЛГРГ из гипоталамуса происходит эпизодически, при этом интервалы между импульсами составляют приблизительно 90 мин. ЛГРГ связывается с рецепторами ЛГРГ, расположенными на мембране клеток гипофиза, что приводит к освобождению ЛГ, и, следовательно, тестостерона в яичках. Препараты аналоги ЛГРГ имитируют действие ЛГРГ, и после однократной, болюсной инъекции очень высокая доля рецепторов ЛГРГ оказывается занятой. Это приводит к временному повышению концентрации ЛГ в плазме, и в результате, к кратковременному усилению продукции тестостерона в яичках.
В результате постоянного взаимодействия аналогов ЛГРГ с рецепторами ЛГРГ, эти рецепторы исчезают с поверхности клеток гипофиза; этот процесс называется понижающей регуляцией рецепторов. Несмотря на синтез и появление на поверхности клеток новых рецепторов ЛГРГ, постоянно находящиеся в организме препараты аналоги ЛГРГ немедленно занимают их и вызывают их исчезновение. Таким образом, они предотвращают повторное появление рецепторов ЛГРГ и, следовательно, подавляют секрецию ЛГ гипофизом и тестостерона яичками. Таким образом аналоги лютеинизирующего гормона рилизинг гормона (ЛГРГ) - это сильнодействующие аналоги естественного ЛГРГ человека, с помощью которых достигается обратимая медикаментозная кастрация.
Введение аналогов ЛГРГ вначале вызывает кратковременное повышение уровней ЛГ и ФСГ, а, следовательно, и тестостерона. Затем следует резкое падение концентрации сначала ЛГ, вследствие чего, в течении 21-28 суток снижается концентрация тестостерона до посткастрационных значений. Клинически медикаментозная кастрация столь же эффективна, как и орхидэктомия: клинический ответ наблюдается 60-80% наблюдений. Обратимый характер изменений, которые вызывает введение аналогов ЛГРГ, позволяет отдифференцировать гормононечувствительные опухоли, а затем принимать решение о последующем лечении. Побочные эффекты медикаментозной и хирургической кастрации в основном одинаковы, что связано со снижением уровня андрогенов, и выражаются в импотенции и приливах. Специфический побочный эффект лечения аналогами ЛГРГ, который наблюдается довольно редко, - это преходящее усугубление симптоматики, так называемый "феномен вспышки", наблюдаемый в первые недели после начала лечения. Он связан с первоначальным повышением уровня тестостерона и проходит к концу первого месяца лечения. Наиболее известные препараты этой группы представлены в табл. 55.
Таблица 55. Препараты аналоги ЛГРГ, применяемые для лечения диссемилированных форм рака предстательной железы.
| Название препарата | Действующее начало | Фирма изготовитель |
| Suprefact | Buserelin | Hoechst (ФРГ) |
| Carcilin | Leuprolid | Abbot |
| Decapeptil | D-Tr6-LHRH | Ferring (ФРГ) |
| Zoladex | Goserelin | Zeneca (Англия) |
| Enanton (Prostap) | Leuprorelin acetate | Takeda (Япония) |
Супрефакт. Одним из первых препаратов из группы агонистов гонадотропин-рилизинг гормона, нашедшим применение при лечении диссеминированного рака предстательной железы, явился супрефакт (Buserelin), производимый фирмой Hoechst (Германия).
Препарат относится к синтетическим аналогам гонадотропин-рилизинг гормона пролонгированного действия. Механизм его действия связан с блокадой рецепторов гонадотропинов на уровне аденогипофиза и характеризуется первоначальной стимуляцией с последующим ингибированием ФСГ и ЛГ. Это сопровождается повышением уровней тестостерона и дигидротестостерона в плазме крови с последующим снижением их секреции до посткастрационного уровня.
Недостатком препарата служит достаточно сложная форма введения -первоначальные подкожные введения, затем многократные интраназальные аппликации, не позволяющие точно дозировать препарат. Супрефакт вводится подкожно по 500 мкг 3 раза в сутки в течение первых 7 дней. С 8-го дня больные переводятся на интраназальное применение по 400 мкг 3 раза в сутки.
Декапептил. Декапептил-депо (производство фирмы Ferring, СО ORD-MED, GmbH, Germany), является аналогом естественного гонадотропин-рилизинг-гормона. Активным веществом препарата является трипторелин - синтетический агонистический аналог естественного гонадотропин-рилизинг гормона. Замена L-глицина на D-триптофан декапептила приводит к увеличению сродства с гонадотропин-рилизинг гормоном в гипофизе, вызывая потерю чувствительности рецепторов и, таким образом, приводя к снижению уровней лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов. Более того, замена приводит к длительному периоду полураспада аналогов, защищая молекулу от ферментного уничтожения пептидазами. Как и все полипептиды, декапептил неустойчив к ферментному лизису в желудочно-кишечном тракте, и поэтому его нельзя применять несколько раз в день. Для создания депо декапептила, его инкапсулируют в микрокапсулы, состоящие из материала, способного к биоразрушению. Эти микрокапсулы, содержащие активное вещество трипторелин, разводятся в растворителе и затем вводятся внутримышечно.
Декапептил-депо (трипторелин) является аналогом ЛГРГ секретируемого гипоталамусом, и стимулирующего синтез и высвобождение из гипофиза ЛГ и ФСГ.
В 1985 г. фирма сообщила о первых клинических результатах применения декапептил-депо (Parmar H.S., 1985). По данным литературы, применение депо-форм декапептила в паллиативном лечении распространенных форм рака предстательной железы после 3-6 мес. лечения позволило выявить следующие показатели объективного ответа опухоли: у 50-60% больных - полная или частичная регрессия опухоли, у 25-30% - стабилизация и у 20% - прогрессирование.
Золадекс. Золадекс (гозерелин) является синтетическим аналогом природного ЛГРГ. Он отличается от ЛГРГ в двух положениях полипептидной цепи: в 6-ом, где остаток глицина замещен на D-(о-терт-бутил-серил); и в 10-ом, где амид глицина замещен на aмид aзaглицинa (NH-NH-CO-NH2). Формула золадекса- D-Сер(Бут)6, Азгли10-LHRH. Золадекс приблизительно в 100 раз активнее природного LHRH.
Структурные формулы природного ЛГРГ и золадекса
Glp-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2 - ЛГРГ
Glp-His-Trp-Ser-Tyr-D-Ser-(But)-Leu-Arg-Pro-Azgly-NH2 - золадекс
Компания Zeneca Pharmaceuticals (Великобритания) производит 2 вида препарата-аналога ЛГРГ, обладающих пролонгированным действием золадекс - 10.8 мг депо и 3.6 мг депо. Каждый из них выпускается в виде имеющего небольшой объем депо, помещенного в удобный, стерильный и готовый к применению шприц, что обеспечивает инъекцию постоянной дозы гозерелина. Обе лекарственные формы обеспечивают постоянный и воспроизводимый уровень высвобождения препарата из депо.
Золадекс 3.6 мг депо, который вводят подкожно каждые 4 недели, позволяет поддерживать концентрацию тестостерона на посткастрационном уровне, что у большинства больных приводит к регрессии опухоли и симптоматическому улучшению. Этот препарат является простой и удобной альтернативой стандартной гормональной терапии, применяющейся для лечения рака предстательной железы.
Золадекс 10.8 мг депо выпускается в более удобной форме и обладает пролонгированным действием, с фармакодинамической точки зрения эквивалентным трем последовательным инъекциям золадекса 3.6 мг депо, однако его инъекции производятся только 1 раз в 12 недель. Переносимость золадекс 10.8 мгдепо аналогична переносимости золадекс 3.6 мг депо.
При длительном применении золадекс вызывает ингибирование секреции ЛГ в передней доле гипофиза, что ведет к снижению концентрации тестостерона в сыворотке крови у мужчин. Подобно другим аналогам ЛГРГ, золадекс первоначально может увеличивать концентрацию сывороточного тестостерона. Примерно через 21 день после первой депо-инъекции золадекса концентрация тестостерона у мужчин падает до уровня кастрации и остается на этом уровне при продолжительном лечении золадексом с введением последнего каждые 28 дней. Такое ингибирование тестостерона ведет к регрессии опухоли предстательной железы и симптоматическому улучшению у большинства больных.
Механизм действия золадекса представлен на рис. 26.
Рисунок 26. Механизм действия золадекса.
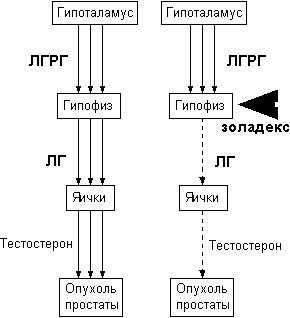
Золадекс снижает концентрацию тестостерона в сыворотке крови, действуя на гипоталамо-гипофизарно-гонадную ось
Лекарственная форма золадекс депо представляет собой подвергающийся биологическому разложению биосовместимый сополимер лактида-гликолида, в котором гомогенно диспергировано лекарственное средство. Депо имеет форму цилиндра небольшого размера (1.5 мм х 1.8 см золадекс 10.8 мг депо и 1.2 мм х 1.0 см золадекс 3.6 мг депо) кремового цвета.
Механизм выделения лекарства. После подкожного введения золадекса лекарственная форма депо входит в контакт с жидкой средой организма, и сополимер лактида-гликолида медленно растворяется, образуя природные молочную и гликолевую кислоты, которые впоследствии подвергаются разложению в ходе обычных метаболических процессов в организме. Биодоступность золадекса практически полная. Введение депо-препарата каждые 4 недели обеспечивает поддержание эффективной концентрации препарата при отсутствии кумуляции в тканях. Золадекс слабо связывается с белками и у людей с нормальной функцией почек имеет период полувыведения из сыворотки крови от 2 до 4 часов. У больных с нарушением почечной функции период полувыведения препарата увеличивается. Для вещества, вводимого ежемесячно в форме депо, это имеет минимальное значение. Таким образом, никаких изменений в дозировке у больных с нарушением почечной функции не требуется. Достоверного изменения фармакокинетики у больных с печеночной недостаточностью также не выявлено.
Фармакокинетика. Максимальная концентрация гозерелина в сыворотке крови достигается через 2 часа после инъекции золадекса депо; в течение следующих 12 недель концентрация препарата в сыворотке остается постоянной и поддерживается на уровне около 1 нг/мл, что свидетельствует о непрерывном освобождении гозерелина из депо. При последовательных инъекциях золадекс наблюдается воспроизводимый фармакокинетический профиль.
Препарат золадекс был одобрен для применения во всех развитых странах мира, и по некоторым оценкам на сегодняшний день, в настоящее время 200000 больных раком предстательной железы уже получили лечение препаратом золадекс 3.6 мг депо.
В современной литературе приводится множество фактов, подтверждающих высокую терапевтическую активность золадекса. В исследованиях, охвативших более 500 пациентов, была доказана равная эффективность золадекса и орхидэктомии (Kaisarj А.V. et аl. 1991, Vogelzang N.J., 1995).
Так Kaisarj A.V. et аl. 1991, представил результаты многоцентрового рандомизированного исследования, в которое были включены 292 больных распространенным раком предстательной железы. Задачей исследования было сравнение эффективности и переносимости золадекса 3.6 мг с соответствующими характеристиками орхидэктомии. В результате исследования было установлено, что в отношении подавления тестостерона в сыворотке крови и поддержании его на посткастрационном уровне золадекс оказался столь же эффективным как и орхидэктомия. Объективный ответ на лечение и сроки его развития представлены в табл. 56, 57.
Таблица 56. Объективный ответ на лечение распространенного рака предстательной железы золадексом в сравнении с орхидэктомией.
| Ответ (%) | Рандомизированная терапия | ||
| Золадекс 3.6 мг депо (n = 148) | Орхидэктомия (n = 144) | ||
| Полная и частичная ремиссия | 71 | 72 | н.д. |
| Стабилизация заболевания | 18 | 22 | н.д. |
| Прогрессирование болезни | 11 | 6 | н.д. |
Таблица 57. Сроки развития ответа на лечение.
| Параметр | Рандомизированная терапия | ||
| Золадекс 3.6 мг депо (n = 148) | Орхидэктомия (n = 144) | ||
| Медиана времени развития ответа на лечение (недели) | 9.0 | 10.2 | н.д. |
| Медиана продолжительность ответа (недели) | 53.7 | 50.1 | н.д. |
| Медиана времени до неудачи терапии (недели) | 26.9 | 40.3 | н.д. |
Как следует из представленных данных, медиана наблюдения за больными составила 2 года. При рассмотрении объективных показателей частоты ответа на лечение и выживаемость статистически значимых различий между двумя группами обнаружено не было. Медиана времени до развития субъективного ответа для обеих групп была также аналогична.
Анализируя побочные явления, авторы пришли к заключению, что они одинаковы в обеих группах и обусловлены супрессией андрогенов (табл. 58).
Таблица 58. Побочные эффекты супрессии андрогенов при использовании золадекса и орхидэктомии в лечении распространенного рака предстательной железы.
| Побочный эффект | Золадекс 3.6 мг депо | Орхидэктомия | ||
| Число больных | % | Число больных | % | |
| Снижение либидо* | 51 | 73 | 43 | 79 |
| Ухудшение эрекции* | 51 | 84 | 48 | 85 |
| Приливы** | 152 | 63 | 163 | 58 |
| Опухание груди** | 138 | 4.8 | 173 | 4.0 |
| Болезненность груди** | 167 | 0.6 | 173 | 1.2 |
На основании результатов этого исследования были сделаны следующие выводы: золадекс снижает концентрацию тестостерона в сыворотке крови до посткастрационного уровня; в отношении частоты объективного ответа и выживаемости золадекс оказался столь же эффективен, как и орхидэктомия; Золадекс хорошо переносится больными; в целом, для лечения больных метастазирующим раком предстательной железы золадекс представляет собой эффективную медикаментозную альтернативу.
В отделении урологии Онкологического научного центра им. Н.Н. Блохина РАМН (Б.В. Бухаркин, 1995) проведено исследование трех различных препаратов из группы аналогов гонадотропин-рилизинг гормона - супрефакт, декапептил и золадекс.
Анализ полученных данных показал, что в подавляющем большинстве случаев через 3-4 недели после начала применения аналогов гонадотропин-рилизинг гормона концентрация тестостерона в сыворотке крови снижается на 80-100% по сравнению с исходной и достигает посткастрационных значений. Пониженная концентрация тестостерона держится весь промежуток времени лечения. Кроме того, отмечено, что имеется явная тенденция к снижению концентрации ЛГ и кортизола в плазме крови.
На основании полученных результатов, установлено, что у больных, имеющих клиническое улучшение в процессе лечения, снижается концентрация кислой фосфатазы в пределах 38-45% от исходного уровня, простатической кислой фосфатазы - в пределах 40-76% и щелочной фосфатазы - в пределах 25-40% от исходного уровня. В группе же больных, у которых клинического эффекта отмечено не было и на фоне проводимого лечения отмечалось прогрессирование процесса, практически все вышеупомянутые показатели либо уменьшались менее чем на 10-12% от исходного уровня, либо практически не изменялись. В ряде случаев при явном клиническом прогрессировании имело место повышение концентрации щелочной и простатической кислой фосфатазы, что являлось крайне неблагоприятным прогностическим признаком.
Оценивая эффективность проведенного лечения, следует отметить следующее: ни в одном из наблюдений мы не отмечали полной регрессии опухоли, что вполне согласуется с данными литературы.
Частота частичных регрессий составляет от 19.0 до 33.3% к 3-му месяцу лечения, от 24 до 50.0% к 6-му месяцу лечения и от 9.5 до 16.7% к 12-му месяцу лечения. Существенных статистических различий между результатами лечения используемыми препаратами мы не отмечали, т.к. механизм действия их практически одинаков.
Значительный интерес представляет, на наш взгляд, частота стабилизации процесса, которая составила от 45 до 66.7% к 3-му месяцу лечения, от 23.3 до 42.7% к 6-му месяцу лечения и от 47.6 до 53.3% к 12-му месяцу лечения. Таким образом, с помощью аналогов гонадотропин-рилизинг гормона удается контролировать опухолевый процесс практически у каждого второго больного диссеминированным раком предстательной железы в течение года.
Анализ частоты прогрессирования заболевания на фоне лечения аналогами гонадотропин-рилизинг гормона также крайне интересен. Так прогрессирование отмечено от 0 до 27.5% к 3-му месяцу лечения, от 26.7 до 36.2% к 6-му месяцу лечения и от 30.0 до 42.9% к 12-му месяцу лечения. Из этих результатов следует вывод о том, что около 25-30% больных диссеминированным раком предстательной железы изначально нечувствительны к медикаментозной кастрации. Таким образом, рекомендуемая обычно при диссеминированном раке предстательной железы хирургическая кастрация, никаким образом не помогла бы этой группе больных. Отсюда следует заключение о том, что аналоги гонадотропин-рилизинг гормона могут являться "пробным" методом перед хирургическим вмешательством. Результаты этого исследования представлены на рис. 27.
Рис. 27. Результаты лечения больных диссеминированным раком предстательной железы аналогами гонадотропин-рилизинг гормона (данные ОНЦ).
Через 3 месяца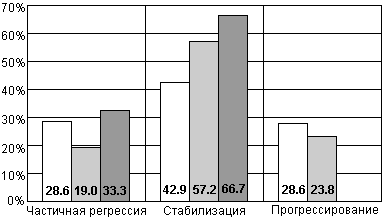
Через 6 месяцев
Через 12 месяцев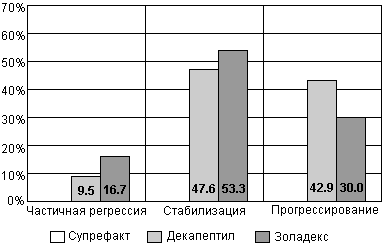
Подчеркивая еще раз положение о том, что существенной статистической разницы в терапевтическом действии различных аналогов гонадотропин-рилизинг гормона нет, мы считаем, что наиболее удобным в применении является золадекс.
Практическое отсутствие каких-либо побочных действий и противопоказаний делает аналоги гонадотропин-рилизинг гормона методом выбора в лечении диссеминированного рака предстательной железы.
Аналогичные данные были получены в целом ряде исследований. По сводной статистике при сравнении орхидэктомии и введения золадекса были получены следующие результаты: субъективный ответ в первой группе (орхидэктомия) составил 72-90%, во второй (золадекс) - 80-93%. Объективный ответ первичной опухоли через 3 месяца лечения - в I группе - 77%, во II - 80%; метастазов - 89% и 90% соответственно.
Поданным, приводимым Donelly R.J. и Milsted R. (1987) при лечении золадексом в течение минимум 12 недель частичная регрессия отмечалась у 51.2% из 387 больных раком предстательной железы, стабилизация процесса у 20.2% больных, прогрессирование отмечено у 28.6%. Peeling (1989) , изучив эффективность золадекса у 292 больных в рандомизированном многоцентровом исследовании пришел к заключению, что он равно эффективен орхидэктомии, как в отношении объективного и субъективного эффектов, так и в отношении выживаемости. И наконец, Vogelzang N.J. et аl., 1995, завершив многоцентровое рандомизированное исследование, включавшее 283 больных распространенным раком предстательной железы, полностью подтвердили данные предыдущих исследователей.
Значительный интерес заслуживает сообщение группы VAKURG (1990), изучивших сердечно-сосудистую токсичность аналогов ЛГРГ по сравнению с диэтилстилбестролом (ДЭС) и ципротеронацетатом (ЦПА). Авторы на основании исследования у 230 больных, дают заключение о том, что в отличие от ДЭС и ЦПА, золадекс не обладает какой либо сердечно-сосудистой токсичностью.
Наряду с исследованиями, подтвердившими, что медикаментозная кастрация с помощью золадекса 3.6 мг депо характеризуется аналогичными объективными показателями ответа на лечение и аналогичной медианой выживаемости, если сравнивать ее с орхидэктомией, в нескольких исследованиях показано также, что при наличии у пациентов выбора лечебного воздействия, большинство из них останавливаются на золадексе 3.6 мг депо, предпочитая его орхидэктомии.
Lungimayr G. и Girsch Е., 1987 проанализировали пожелания 57 больных с метастазирующим или местно-распространенным раком предстательной железы, которым требовалась гормональная терапия, и которые могли выбирать между орхидэктомией и золадексом 3.6 мг депо. Всех больных информировали о том, что обе программы лечения считаются высокоэффективными и эквивалентными с точки зрения побочных эффектов, включающих утрату либидо и эрекции. 49 больных (86%) выбрали золадекс 3.6 мг депо, и 8 (14%) - орхидэктомию. Беседы, проведенные с использованием стандартных анкет с целью анализа причин, лежащих в основе принятых решений, показали, что больные в основном руководствовались косметическими соображениями (63%). Другой основной причиной, названной 35% больных, оказался страх перед операцией. Минимальное значение придавалось обратимости лечения.
Soloway M.S. et al., (1990), провели аналогичное исследование. Они оценивали выбор пациентов, предлагая больным с распространенным раком предстательной железы выбирать для себя метод лечения. 147 больных отвечали на вопросы анкеты у себя дома, в 70% случаев обсуждая этот вопрос с семьей. После принятия решения, анкеты возвращали врачу. В целом 115 больных (78%) выбрали золадекс 3.6 мг депо и 32 (22%) - орхидэктомию. Большинство больных, выбравших золадекс 3.6 мг депо, указывали, что они приняли решение, опасаясь операции или желая избежать ее, а также потому что считали золадекс эффективным препаратом или способным предотвратить боль. Выбравшие орхидэктомию сообщили, что хирургическая процедура им больше подходит. Отвечая на вопросы анкеты спустя 3 месяца все больные из обеих групп, за исключением одного пациента из группы, выбравшей золадекс 3.6 мг депо, сообщили, что они бы сделали аналогичный выбор снова.
В исследовании с участием больных и специалистов-урологов, проведенном Samdal F. et аl., (1991), и посвященном выбору гормонотерапии при распространенном раке простаты, 25 из 36 больных (70%) предпочли орхидэктомии ЛГРГ-аналоги. Тринадцать больных (36%) сообщили, что основной причиной выбора золадекса для них явилась возможность избежать операции. Для других больных определяющее значения имели косметические соображения (22%) и обратимость терапии ЛГРГ-аналогами (11%). Когда этот же вопрос был задан урологам, то 26 из 40 (65%) опрошенных, ответили, что они предпочли бы золадекс орхидэктомии. Шестнадцать из них основной причиной назвали возможность прервать лечение в случае, если оно окажется неэффективным.
Представляют интерес исследования, в которых проводилось сравнение результатов лечения диссеминированного рака предстательной железы золадексом и другими препаратами. Так Thorpe C.S. et аl., (1996) провели сравнительное проспективное исследование, охватившее 525 больных с метастазирующим раком предстательной железы, не подвергабшихся ранее лечению. В задачи исследования входило сравнить эффективность золадекса 3.6 мг депо, назначавшегося подкожно каждые 4 недели, с эффективностью назначаемого перорально ципротерона ацетата (ЦПА) (300 мг/сутки), а также с эффективностью сочетания двух методов лечения. Каждая из групп лечения включала 175 больных. Средний возраст в каждой из групп составил: 1) ЦПА - 72 года (от 39 до 88 лет); 2) золадекс 3.6 мг депо - 70 лет (47-88 лет); и 3) группа комбинированной терапии - 71 год (46-87 лет).
На момент проведения анализа заболевание прогрессировало у 343 (65%) больных. У других 13 больных, продолжающих участие в исследовании на момент проводившегося через 48 месяцев после начала терапии итогового обследования, заболевание не прогрессировало; 27 больных продолжили свое участие в исследовании. Медианы времени до прогрессирования заболевания в группе получавших золадекс были достоверно больше, чем в группе, получавшей ЦПА (р = 0.019). Продемонстрировано, что сточки зрения эффективности (субъективных и объективных реакций) лечения, комбинация золадекса 3.6 мг депо и ЦПА не является более предпочтительным по сравнению с монотерапией золадексом 3.6 мг депо (табл. 59).
Таблица 59. Показатели объективного и субъективного ответа при лечении распространенного рака предстательной железы золадексом и ЦПА.
| Ответ (%) | Рандомизированная терапия | ||
| ЦПА (n = 175) | Золадекс (n = 175) | Золадекс+ЦПА (n = 175) | |
| Полная ремиссия | 5.7 | 12.6 | 9.1 |
| Частичная ремиссия | 47.4 | 46.3 | 56.0 |
| Субъективный ответ | 10.9 | 6.3 | 6.9 |
| Всего | 64 | 65.1 | 72.0 |
В целом у 29 больных наблюдались серьезные неблагоприятные эффекты, которые привели к исключению их из исследования. 15 больных из групп, принимавших ЦПА в форме монотерапии или в комбинации с золадексом, сообщили об одышке, которая для трех из них стала причиной отказа от участия в исследовании. В группе, получавшей золадекс, сообщения о неблагоприятных эффектах отсутствовали. В число не представляющих опасности побочных эффектов входили 13 случаев усиления симптомов и признаков, наблюдавшихся после лечения золадексом 3.6 мг депо и отсутствовавших после приема ЦПА. Результаты проведенных исследований позволили авторам сделать заключение, что в группе, получавшей золадекс, зарегистрировано статистически значимое увеличение времени до прогрессирования заболевания по сравнению с группой, принимавшей ЦПА (р = 0.019) и , что дополнение золадекса ципротерона ацетатом не дает каких-либо преимуществ по сравнению с монотерапией золадексом в отношении времени до прогрессирования.
Представляет интерес и сравнение эффективности золадекса с эстрогенами. Waymont В. et аl., (1992) провели открытое рандомизированное исследование, охватившее 250 больных с местно-распространенным или метастазирующим раком предстательной железы. В задачу исследования входило сравнить эффективность и переносимость золадекса 3.6 мг депо, назначаемого каждые 4 недели, и назначаемого перорально стилбестрола (3 мг/сутки). Средний возраст пациентов, получавших золадекс 3.6 мг депо (n = 124), составлял 72.4 года (от 45.6 до 86.6 лет); получавших стилбестрол (n = 126) - 72.6 лет (от 52.2 - 93.1 лет). Обе группы отличались высокой степенью соответствия в отношении наличия метастазирующей опухоли, степени дифференцировки опухоли и концентрацией тестостерона в сыворотке до проведения терапии.
Результаты лечения были следующими: в течение 4-х недель у 95% больных из обеих групп наблюдалось падение концентрации тестостерона в сыворотке крови до посткастрационного уровня. В группе, получавшей золадекс 3.6 мг депо, среднее время до первой реакции составило 3 месяца, тогда как в группе, принимавшей стилбестрол - 6 месяцев, что статистически достоверно (р = 0.035). Данные по объективной реакции на лечение, определенные у 248 больных, представлены в табл. 60.
Таблица 60. Сравнительная оценка эффективности лечения распространенного рака предстательной железы Золадексом и Стилбестролом.
| Ответ (%) | Рандомизированная терапия | |
| Золадекс 3.6 мг депо (n = 124) | Стилбестрол (n = 124) | |
| Полная ремиссия + Частичная ремиссия | 71 | 58.1 (р = 0.03) |
| Отсутствие реакции | 29.0 | 41.9 |
Хотя среднее время до неудачи терапии в группе, получавшей золадекс 3.6 мг депо, было на 3.1 месяца больше, чем в группе, получавшей стилбестрол (14.5 и 11.4 месяца, соответственно), это различие между двумя группами не было статистически значимым. В группе, получавшей золадекс 3.6 мг депо, умерло 84 пациента (68%), в то время как в группе, получавшей стилбестрол - 81 (64%). Различия между двумя группами и в этом случае не были статистически значимыми. Большинство неблагоприятных случаев, приведших к отказу больных от участия в исследовании, наблюдались в группе, получавшей стилбестрол (36/38). В группе, получавшей золадекс, зарегистрировано 22 неблагоприятных случая, в то время как в группе, получавшей стилбестрол - 54, из которых 16 были вызваны нарушениями сердечно-сосудистой системы. Выводами этого исследования послужили следующие: золадекс 3.6 мг депо достоверно эффективнее стилбестрола в отношении частоты ответа и времени его наступления; среди получавших этот препарат, у большего числа больных наблюдалась более ранний ответ на лечение, по сравнению с принимавшими стилбестрол; переносимость золадекса 3.6 мг депо больными лучше, чем переносимость стилбестрола. Аналогичные результаты были получены Citrin D.L. et al., (1991), при сравнении эффективности золадекса и ДЭС (диэетилстилбестрол).
Представляют интерес результаты двух рандомизированных исследований, в которых сравнивалась фармакодинамическая эквивалентность различных доз золадекса - 3.6 мг и 10.8 мг.
Сто шестьдесят больных с местно-распространенным или диссеминированным раком предстательной железы были рандомизированны в сравнительных исследованиях. Пациенты получали либо 3.6 мг золадекса каждые 4 недели в течение 12 недель, после чего следовало введение 10.8 мг золадекса каждые 12 недель, либо 10.8 мг золадекса-депо каждые 12 недель. Средний возраст больных в двух группах, получавших 3.6 мг и 10.8 мг золадекса-депо, составил 71 (n = 83) и 73 (n = 77) года соответственно. Профили уровней тестостерона в сыворотке в обеих группах больных, получавших лечение, были схожими и падали до посткастрационных уровней к 21 суткам после начала лечения. Профили переносимости 10.8 мг и 3.6 мг золадекса оказались схожими, причем самым частым побочным эффектов были приливы.
В табл. 61 суммированы данные по частоте, с которой эти явления встречались в сравнительном исследовании золадекса 3.6 мг депо и золадекса 10.8 мг депо.
Таблица 61. Побочные явления андрогенной супрессии при применении различных доз золадекса.
| Побочные явления | Недели с 0 по 12 | |
| Золадекс 10.8 мг депо (n = 78) (%) | Золадекс 3.6 мг депо (n = 84) (%) | |
| Приливы | 47.4 | 47.6 |
| Гинекомастия | 3.8 | 1.2 |
| Болезненность грудных желез | 2.6 | 1.2 |
| Импотенция | 2.6 | 0 |
| Костная боль | 2.6 | 2.4 |
Частота фармакологических неблагоприятных явлений во время лечения золадексом 10.8 мг депо сопоставима с соответствующими значениями после лечения золадексом 3.6 мг депо. Ни один из больных не прервал участие в исследовании из-за побочных эффектов терапии. Кроме того, через три месяца одинаковым в обеих группах было и снижение уровней простатического специфического антигена (ПСА). Заключением данного исследования послужил вывод о том, что золадекс в дозе 10.8 мг был фармакодинамически эквивалентен золадексу в дозе 3.6 мг; обе дозы переносились одинаково хорошо.
Таким образом, золадекс широко применяется как самостоятельно, так и в комбинации с антиандрогенами, увеличивая этим число вариантов лечения, предлагаемых на выбор врачам и пациентам.
Литература
Бельчиков И.С. Современные аспекты диагностики и лечения рака предстательной железы. В сб. "Профилактика злокачественных новообразований", Рига, 1986, с, 164-166.
Бухаркин Б.В. Современные методы лечения местнораспространенного и диссеминированного рака предстательной железы. Дисс. Докт. мед. наук, М.-1995.
Гориловский Л.М. Гормональная терапия больных раком предстательной железы. В кн.: Пленум Всеросс. общ. урологов. - Саратов, 1994. - с.151-152.
Маринбах Е.Б. Рак предстательной железы. Медицина. М., 1980.- 160 с.
Пытель А.Я. О влиянии функционального состояния печени на течение рака простаты и эффективность эстрогенотерапии. Урология и нефрология.- 1973.- N5.- С.47-49.
Резников А.Г., Варга С.В. Антиандрогены. - М. 1988.
Свиридова Т.В. Комплексное гормонально-лучевое лечение больных раком предстательной железы IV стадии. В кн.: Пленум Всеросс. общ. урологов.- Саратов, 1994. -С.170-171.
Auclair C., Kelly P., Labrie F. et al. Inlubition of testicular cuteinising hormonerelising hormone agonist or human chorionic gonadotropin. Biochem, Biophis. Res. Comm.- 1977. -N 76. -P.855-862.
Beland G., Elhilali M., Fradet Y. et al. Total androgen biocade for metastatic cancer of the prostate Amer. Amer. J. Clin. Oncol. - 1988. 11: N2,-С. 187-190. Urol. - 1991. -37, N2, -25-29.
Bertagna С., De Сurу A., Hucher M., Francois J.P., Zanirato J. Efficacy of the combination of nilutamide plus orchidectomy in patients with metastatic prostatic cancer. A metaanalysis of seven randomised double-blind trials (1056 patients). Br J Urol 1994; 73: 396-402.
Bertagna С., De Gery A., Hucher M. et al. Efficacy of the combination of nilutamide plus orchidectomy in patients with metastatic prostatic cancer. A meta-analisis of seven randomised double-blind trials (1056 patients). Br. J. Urol. - 1994.-73.- P 396-402.
Boufflox A., 1989 цит. по Flamm J., Sagaster P. et al., В кн.: Материалы симпозиума -Применение антиандрогена флютамид в лечении рака предстательной железы.- М., 1990. -С.15-30.
Citrin D.L, Fiesnick M.I., Guinan P., et al. A comparison of Zoladex and DES in the treatment of advanced prostate cancer: results of a randomised, multicenter trial. Prostate 1991; 18:139-46.
Crawford E.D., Eisenberger M.A., McLeod D.G. et al. A controlled trial of leuprolide with end without flutamide in prostatic carcinoma. N. Engl. J. Med.- 1989.- 321.- P419 - 424
Crawford E.D., Eisenberger M.A., McLeod D.G. et al. A controlled trial of leuprolide with and without flutamide in prostatic carcinoma. N Engl J Med 1989; 321: 419-24.
Denis L.J., Whelan P., Camerio de Moura J.L. et al. Goserelin acetate and flutamide versus bilateral orchiectomi: A Phase 111 EORTC trial (30853) Urology. - 1993.-42.- P 119-130.
Dijkman G.A., Debruyne F.M.J., Fernandezdel Moral P. et al. A randomised trial comparing the safety and efficacy of the Zoladex 10.8 mg depot, administered every 12 weeks, to that of the Zoladex 3.6 mg depot, administered every 4 weeks, in patients with advanced prostate cancer. Eur Urol 1995; 27: 43-6.
Dijkman G.A., Fernandez del Moral, Plasman W.M.H. et al. Anew extra long acting depot preparation of the LHRH analogue Zoladex. First endocrinological and pharmacokinetic data in patients with advanced prostate cancer. J Steroid Biochem Molec Biol 1990; 37: 933-36.
Donelly P., Milsted R. LHRH and its analogues. Vickery BH(ed) Zancaster, MPT Press. -1987. -P.397-409.
Eichler O., Faran A. et al. Farmacology. Vol. 35/2: Androgen 2. and antiandrogens. Berlin: Springer, 1974. - 625.
Ferraris V., Ponti U.D., Barichello M. et al. Bicalutamide monotherapy versus flutamide plus goserelin in prostate cancer patients preliminare resalts of an italian prostate cancer group stady. Abstr. From the XIII th congress of the EAU, Barselona, 1998.- 350.
Flamm J., Fischer M., Holtl W., Pfibger H., Tomschi W. Complete androgen deprivation prior to radical prostatectomy in patients with Stage T3 cancer of the prostate. Eur Urol 1991; 19:192-95.
Flamm J., Fischer M. Komplette androgenblokade (orchektomie + flutamide) versus androgenblocade mil zitostase (orchectomy + estramustin) in der bechandlung des virinellen fortgeschritten prostatakarzinems. Wieher KlinischeWochenschrift 100: 1988, 589-592.
Fourcade P.O., Chalclain C., Poterre M. An open multicentere randomised stady to compare the effekt and safety of casodex 150 mg monotherapy with castrathion plus nilutamide in metastatic prostate cancer. Abstr. From the XIII th congress of the EAU, Barselona, 1998.- 349.
Fourcade P.O., Cariou G., Cotoby P. et. al. Total androgen blockade with Zoladex plus flutamide vs. Zoladex alone in advanced prostate carcinoma: interim report of a multicenter, double-blind, placebo-controlled study. Eur Urol 1990; 18 (Suppl 3): 45-47.
Fourcade P.O., Colombel P., Sarramon J.P., Toubol J. Azab M. Study of neoadjuvant GnRH analogue Zoladex in locally advanced prostate cancer. Gynaecol Endocrinol 1993; 7 (Suppl 2): Abstr. III, 66.
Geller J. et al. J. Clin. Endocr. - 1967. - Vol. 27, N4. -P. 556-560., Ster. Biochem.- 1986 - Vol. 25: N5,-759-763.
Huggins C., Hodges C.V. The effects of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res 1941; 1: 292-97.
Huggins С., Hodges C.V. Studies on prostatic cancer. 1. Cancer Research 1: 1941, 293-297.
Iversen P., Rasmussen F., Klarskov P., Christensen I.J. Long-term results of Danish Prostatic Cancer Group Trial 86. Cancer 1993; 72 (Suppl): 3851-54.
Iversen P., Kaisari A. V., Tyrrell C. et al. A randomised comparison of bicalutamide 150 mg versus castration in the treatment of advansed prostate cancer. Abstr. From the XIII th congress of the EAU, Barselona, 1998.- 347.
Janknegt R.A.,Abbou C.C., Bartoletti R. et al. Orchiectomy and nilutamide or placeboas treatmen of metastatic prostatic cancer in a multinational double-blind randomised trial. J. Urol. -1993.-149.-P 77-83.
Janknegt R.A., Abbou C.C., Bartoletti R. et al. Orchiectomyand nilutamide or placebo as treatment of metastatic prostatic cancer in a multinational double-blind randomised trial. J Urol 1993; 149:77-83.
Kaisary A.V., Tyrrell C.J., Peeling W.B., Griffiths K. Comparison of LHRH analogue (Zoladex) with orchiectomy in patients with metastatic prostatic carcinoma. Br J Urol 1991; 67:502-8.
Labrie F., Dupont A., Belanger A. et al. New approaches in the treatment of prostate cancer: complete instead of partial withdrawal of androgens. Prostate 1983; 4: 579-94.
Labrie F., Dupont A., Belanger A. et al. Ann. endocr. -1983. -Vol. 44: N5. -P. 343-344.
Lund F. et al. Flutamide versus stilboestrol in the management of advanced prostatic cancer British J. of Urol. 61: 1988.
Lungimayr G., Girsch E. In: Chisholm GD, ed. 'Zoladex' - a new treatment for prostatic cancer. International congress and symposium series. 125. London: RSM Series. 1987; 47-51.
Martini L, Motta M. Androgens and antiandrogens -New York: Raven Press. 1977.-381 p.
Moguilewsky M., Fiet J. et al. How the study of the biological activities of antianrogens can beorientedtowardstheclinic Steroid. Biochem. - 1986. -Vol.24, N1-P. 139-146.
Namer M., Amiel J. et al. Anandron (Ru 23908) with orchiectomy in stage D prostate cancer.Amer. J. Clin. -Oncol. 1988. - 11, N2. -P. 191-196.
Neri R.O., Kassern N. Compete androgen biocade as treatment for advanced prostate cancer: clinical response and side - effects. Hormone Antagonist, Ed. M. K. Agarwal. -Berlin, 1982, -P. 247-268.
Neumann F. et al. J. Steroid. Biochem. - 1983.Vol. 19, N. 1A. -P. 391-402.
Peeling W. Urology.- 1989. -V 33. -N 5. -P.45-52.X.
Peeling W.B. In: Chisholm GD, ed. 'Zoladex' - a new treatment for prostatic cancer. International congress and symposium series. 125. London: RSM Series, 1987; 27-44.
Pilepich M.V., Caplan P, Byhardt R.W. et al. Phasellltrialofandrogensuppressionusing goserelin in unfavorable prognosis carcinoma of the prostate treated with definitive radio-therapy (Report of RTOG Protocol 85-31). Proc AM Soc Clin Oncol 1995; 14:239 Abstr. 631.
Prostate Cancer Trialists' Collaborative Group. Maximum androgen blockade in advanced prostate cancer: an overview of 22 randomised trials with 3283 deaths in 5710 patients. Lancet 1995; 346: 265-9.
Ftamanath R.B. et at. Efficacy and advantages in the use of low doses of anandron and estrogen combination in the treatment of prostate cancer J. Steroid Biochem, 1988. 31: N4.- P. 731-737.
Raynaud J.P. et al. J. Steroid Biochem. - 1986. - Vol. 25, N 5В.- P. 811-833.
Rossler D. et al. Historia natural del cancer de prostata. Prostate Cancer, 1987. - Vol. 34: 232-234.
Samdal F., Vada K., Lundmo P.I., Mjolnerod O.K. Orchidectomy or LHRH-analogue? Scand J Urol Nephrol 1991; 25: 197-99.
Schellhammer H.F., Sharif R., Block N.L. et al. Bicalutamide or flutamide, each combined with luteinzing hormone-releasing hormone analogue (LHRH-A) therapy, in patients with stage D2 prostate cancer: final results of a multicenter, randomized trial. Abstr. From the XIII th congress of the EAU, Barselona, 1998.- 184.
Schruder F.H., Boyle P. Screening for prostate cancer - necessity or nonsense? Eur J Cancer 1993; 29A: 656-61.
Schruder F.H. Prostate cancer: to screen or not to screen? Br Med J 1993; 306: 407-8.
Sogani P.C. et al. Experience with flutamide in patients with advanced prostatic cancer without prior endocrine therapy Cancer 54: 1984, 744-750.
Soioway M.S., Cassileth B.R., Vozelgang N.J., Schellhammer P.S., Seidmon E.J., Kennealey G.T. Patient's choice of treatment in Stage D prostate cancer. Recent Advances in Urological Cancers Diagnosis and Treatment. Paris, 1990; 72-4.
Thorpe S.C., Azmatullah S., Fellows G.J., Gingell J.C., O'Boyle P.J. et al. A prospective, randomised study to compare goserelin acetate (Zoladex) vs Cyprostat (cyproterone acetate) vs a combination of the two in the treatment of metastatic prostatic carcinoma. In press (Eur Urol).
Tyrrell C.J., Altwein J.E., Klippel F. et al. A multicenter, randomised trial comparing the luteinizing hormone-releasing hormone analogue goserelin acetate alone and with flutamide in the treatment of advanced prostate cancer. J Urol 1991; 146:1321-26.
Varenhorst E., Carlsson P., Pedersen K. Clinical and economic considerations in the treatment of prostate cancer. Pharmaco Econ 1994; 6: 127-41.
Vogelzang N.J., Chodak G.W., Soioway M.S. et al. Goaerelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a randomised trial. Urology 1995; 46: 220-6.
Warenhorst E., Halberg B., Wallent L, et al. Europ. Urol.- 198-1. -V7.-N4.- P.231-236.
Waymont B., Lynch Т.Н., Dunn J.A. et al. Phase III randomised study of Zoladex versus stilboestrol in the treatment of advanced prostate cancer Br J Urol 1992; 69: 614-20.
Wirth M.P., Iversen P. A. clinical programme consisting of 3 randomised trials comparing bicalutamide 150 mg with placebo in patients with nonmetastatic cancer. Abstr. From the XIII th congress of the EAU, Barselona, 1998. -541.
Комментарии
ПРАКТИКА ПЕДИАТРА

