Агонисты дофаминовых рецепторов – препараты выбора терапии ранних стадий болезни Паркинсона
СтатьиН.В. Федорова
Кафедра неврологии РМАПО
Центр экстрапирамидных заболеваний МЗ РФ
Традиционно лекарственные препараты для лечения болезни Паркинсона (БП) рассматривали как исключительно симптоматическую терапию. В сознании врачей укоренилась доктрина, что лечение на ранних стадиях БП не следует начинать до тех пор, пока симптомы паркинсонизма не начнут влиять на социальную, бытовую и профессиональную активность больного [36]. Однако достижения в понимании патогенеза БП и появление новых эффективных препаратов сделали такой подход не таким однозначным. Недавние исследования с применением нейровизуализационных методов показали, что латентный период от начала гибели нигростриарных нейронов до появления первых двигательных симптомов БП составляет от 6 до 7 лет [6]. Нарастание двигательных нарушений на ранней стадии БП происходит относительно быстро: за первый год наблюдения оценка по шкале UPDRS увеличивается на 8-10 баллов, что сопровождается значительным ухудшением качества жизни [8].
Некоторые авторы считают, что раннее назначение симптоматической терапии оказывает благоприятное влияние в отношении ближайшего и долгосрочного улучшения двигательных симптомов, качества жизни с уменьшением частоты моторных флуктуаций и дискинезий [41]. В настоящее время появились теоретические и практические основания для пересмотра традиционного взгляда на сроки начала дофаминергической терапии при БП. Начало лечения сразу после диагностики заболевания рассматривается в настоящее время как более перспективная и эффективная стратегия фармакотерапии БП.
Раннее начало терапии БП должно обеспечивать улучшение повседневной активности и качества жизни больных, возможно, замедлять прогрессирование заболевания и предотвращать в будущем развитие моторных флуктуаций и дискинезий.
Нефармакологическое лечение на ранних стадиях БП предусматривает обучение, психологическую и информационную поддержку больных и их родственников; лечебную гимнастику; сбалансированное питание, учитывающее пожилой возраст и сопутствующие соматические заболевания, а также предотвращающее потерю веса и мышечной массы.
При выборе противопаркинсонического препарата учитывают многие факторы: возраст больного, степень тяжести заболевания, наличие или отсутствие когнитивных расстройств, сопутствующие заболевания, стоимость лечения, социально-экономические факторы. Традиционно, терапия ранних стадий начинается с назначения агонистов дофаминовых рецепторов (АДАР), амантадинов, реже - ингибиторов МАО, холинолитиков.
К самому первому старейшему классу противопаркинсонических препаратов, применяемых с конца 19 века, относятся антихолинергические сред ства (холи но литики). В настоящее время они обычно назначаются относительно молодым пациентам (до 55 лет) с дрожательными формами БП при сохранных когнитивных функциях. Холинолитики незначительно влияют на ригидность и акинезию, постуральную нестабильность. Побочные эффекты при применении этой группы лекарственных средств встречаются значительно чаще (галлюцинации, дезориентация, нарушение аккомодации, повышение внутриглазного давления, задержка мочеиспускания, тахикардия и др.), чем при применении других препаратов (таб. 1).
Таблица 1. Достоинства и недостатки холинолитиков
| Достоинства | Недостатки |
| - Относительно высокая эффективность при треморе покоя - Уменьшение слюнотечения у некоторых больных |
- Незначительный контроль гипокинезии и ригидности - Высокая частота побочных эффектов - Ухудшение когнитивных функций |
Амантадины увеличивают синтез дофамина и его высвобождение в синаптическую щель, вызывают торможение обратного захвата дофамина; кроме того, они обладают незначительным холинолитическим эффектом. Амантадины являются антагонистами глутаматных рецепторов, с чем связывают возможные нейропротекторный и антидискинетический эффекты. Косвенным подтверждением нейропротекторного эффекта амантадинов является увеличение продолжительности выживания тех пациентов, которые длительное время принимали амантадины. Однако влияние на основные симптомы БП у амантадинов незначительное при их назначении в виде монотерапии (таб. 2).
Таблица 2. Достоинства и недостатки амантадинов
| Достоинства | Недостатки |
| - Возможный нейропротекторный эффект - Возможность парентерального введения при декомпенсация БП и акинетических кризах - Коррекция лекарственных дискинезий |
- Незначительный контроль гипокинезии, ригидности, тремора при монотерапии - Возможность развития толерантности при длительном приеме - Наличие побочных эффектов (галлюцинаций, дезориентировки) |
Ингибиторы моноаминооксидазы (МАО) типа В блокируют фермент, вызывающий окислительное расщепление моноаминов, в результате чего наличного дофамина в нейронах становится больше. Предполагается, что ингибиторы МАО типа могут уменьшать окислительный стресс и тормозить перекисное окисление липидов, т.е. воздействовать на основное патогенетическое звено развития БП.
Таблица 3. Достоинства и недостатки ингибиторов МАО типа В
| Достоинства | Недостатки |
| − Возможность нейропротекторного эффекта? − Наличие антидепрессивного эффекта − Удлинение действия леводопы при феномене истощения дозы |
− Малая эффективность при монотерапии − Возможность усиления лекарственных дискинезий и других побочных эффектов леводопы − Ограничение возможности назначения некоторых антидепрессантов |
Для повышения сниженной дофа-минергической активности с 1971 г. в качестве терапии больных БП применяются агонисты дофаминовых рецепторов (АДАР), являющиеся принципиально новым классом лекарственных средств. Агонисты дофаминовых рецепторов благодаря своим химическим свойствам напрямую стимулируют ДА-рецепторы, воспроизводя эффект дофамина. Исторически они сначала назначались больным БП в качестве дополнения к леводопе, однако в последующем было установлено, что на ранних стадиях АДР обладают сопоставимым по эффективности с леводопой эффектом. Кроме того, их раннее назначение приводит к уменьшению риска возникновения моторных флуктуаций и лекарственных дискинезий. Они эффективно контролируют основные симптомы БП, в том числе и тремор, уменьшают выраженность депрессии и тревоги, которые часто сопутствуют БП.
Открытие АДАР обеспечивает новую важную фармакотерапевтическую стратегию в лечении БП. Агонисты обладают способностью непосредственно стимулировать дофаминовые рецепторы в головном мозге, при этом вызывают селективную стимуляцию различных подтипов рецепторов. Фармакологический эффект препаратов этого класса осуществляется в «обход» дегенерирующих нигростриарных ней ронов и не связан с превращением леводопы в дофамин.
АДАР представляют собой разнородную по химическому составу группу препаратов. Эффект АДАР зависит от типа ДА-рецепторов, с которыми они взаимодействуют. Традиционно выделяют два основных типа ДА-рецепторов (D1 и D2), а в последние годы с помощью молекулярно-генетических методов исследования удалось выявить не менее 5 подтипов рецепторов, при этом некоторые из них имеют фармакологические свойства D1 рецепторов (D1, D5), другие – свойства D2 рецепторов (D2, D3, D4). Подтипы ДА-рецепторов отличаются различной локализацией на пре- и постсинаптических мембранах и разной чувствительностью к эндогенному ДА и к АДАР.
Рецепторы подтипа D2 локализуются на холинергических и ГАМК-ергических нейронах стриатума и на ДА-нейронах черной субстанции. Рецепторы подтипа D1 расположены на стриарных нейронах, дающих проекции на ретикулярную часть черной субстанции. Противопаркинсонический эффект связан со стимуляцией D2-рецепторов. Дофаминергические нейроны имеют пресинаптические ауторецепторы, влияющие на активность нейрона, синтез и высвобождение дофамина. Их роль выполняют выполняют D2 и D3 рецепторы. Предполагается, что с активацией именно этих рецепторов связан нейропротекторный эффект АДАР. Функция D4 и D5 рецепторов остается неизвестной. Некоторые из АДАР повышают умственную работоспособность, память, внимание за счет избирательного взаимодействия с D2\D3 рецепторами мезолимбической системы и уменьшения разрушения дофамина в лобной коре.
Существуют значительные различия между агонистами в продолжительности периода полувыведения в плазме крови, связывания с норадренергическими и серотонинергическими рецепторами [44].
Прямых сравнительных исследований эффективности различных АДАР не проводилось, что затрудняет выявление их специфических свойств. Некоторые данные позволяют предполагать определенные различия их клинического эффекта у больных БП. Например, было выявлено, что прамипексол обладает антидепресивным и антитреморным эффектами [7, 11, 31].
Действие АДАР на различные типы рецепторов представлено в таблице 4.
Таблица 4. Действие АДАР на различные типы ДА-рецепторов
| Препарат | D1 | D2 | D3 | D4 | D5 |
| Бромокриптин | - | ++ | + | + | + |
| Лизурид | +/- | ++ | ++ | ++ | ? |
| Перголид | + | +++ | +++ | +++ | + |
| Каберголин | + | ++ | ++ | + | ? |
| Прамипексол | - | +++ | ++++ | ++ | + |
| Ропинирол | - | ++ | +++ | ++ | ? |
| Пирибедил | - | +++ | +++ | ++ | + |
Таким образом, наибольшей селективностью взаимодействия с D2 и D3 рецепторами обладает прамипексол (Мирапекс).
Традиционно АДАР под раз деляют ся на две группы – эрголиновые и неэрголиновые производные (табл. 5).
Таблица 5. Агонисты ДА-рецепторов
| Название препарата | Коммерческое название | Содержание активного вещества в 1 таблетке (мг) | Суточная доза (мг) |
|
Эрголиновые |
|||
| 1.Бромокриптин | Парлодел | 2,5 | 10–40 |
| Бромокриптин | 2,5; 5; 10 | ||
| 2.Перголид | Пермакс | 0,05; 0,25; 1,0 | 0,75–5,0 |
| 3.Каберголин | Достинекс | 0,5 | 1,5–4,0 |
| Кабзар | 0,5 | ||
|
Неэрголиновые |
|||
| 1.Пирибедил | Проноран | 50 | 100–250 |
| 2.Прамипексол | Мирапекс | 0,125; 0,25; 1,0; 1,5 | 1,5–4,5 |
| 3. Ропинирол | Реквип | 0,25 | 3–12 |
В последнее десятилетие новые препараты группы АДАР стали широко использоваться на начальной стадии БП в виде монотерапии в связи с хорошим клиническим эффектом и предполагаемым нейропротекторным действием. С 1996 г. для терапии ранних и поздних стадий БП стал применяться прамипек-сол (мирапекс). С 1998 года по настоящее время проводятся широкие мультицентровые международные рандомизированные контролируемые исследования для изучения эффективности различных агонистов дофамина на ранних и развернутых стадиях заболевания. Двойные слепые контролируемые исследования эффективности прамипексола, ропинирола, перголида при назначеии в виде монотерапии на ранних стадиях БП продемонстрировали, что эти препараты оказывают выраженный антипаркинсонический эффект. Значительное количество больных БП оставались на монотерапии АДАР в течение 3 лет наблюдения, через пять лет - 35% пациентов с хорошим контролем двигательных нарушений.
Большинство АДАР назначается три раза в сутки, за исключением каберголина, который имеет длительный период полувыведения (48–65 часов), поэтому его назначают один раз в день (табл. 6).
Таблица 6. Период полувыведения АДАР
| Препараты | Период полувыведения (часы) | Кратность приема в сутки |
| Бромокриптин | 3–8 | 3 |
| Лизурид | 2–3 | 3 |
| Перголид | 3–20 | 3 |
| Каберголин | 48–65 | 1 |
| Ропинирол | 3–6 | 3 |
| Прамипексол | 7–9 | 3 |
| Пирибедил | 6–10 | 3 |
АДАР применяются в виде различных лекарственных форм: пероральной (бромокриптин, пирибедил, перголид, лизурид, ропинирол, прамипексол, каберголин); инъекционной для подкожного введения (апоморфин) и в виде накожного пластыря (ротиготин).
Период полужизни АДАР последнего поколения в 3–4 раза превышает период полужизни стандартных препаратов леводопы. Это обеспечивает более продолжительную, близкую к физиологическим условиям стимуляцию ДА-рецепторов, предупреждает или уменьшает выраженность уже развившихся двигательных флуктуаций и лекарственных дискинезий, связанных с колебанием уровня концентрации леводопы в крови и изменением чувствительности ДА-рецепторов. При лечении БП препаратами леводопы кратный прием лекарств не может обеспечить равномерного в течение суток синтеза и высвобождения дофамина, образовавшегося в нигростриарных нейронах. По мере прогрессирования дегенерации этих нейронов снижается и уровень фермента ДОФА-декарбоксилазы, необходимой для синтеза ДА. На поздних стадиях БП кругооборот дофамина в синапсах постепенно снижается и приобретает все более выраженный флуктуирующий характер.
Длительный прием препаратов леводопы неизбежно приводит к появлению двигательных флуктуаций и лекарственных дискинезий. В среднем, частота моторных флуктуаций возрастает на 10% в год при длительной леводопатерапии. Более того, согласно последним литературным данным, моторные флуктуации и лекаственные дискинезии диагностируются на более ранних этапах лечения, если для их выявления используются специальные шкалы. Так, в течение двухлетнего периода лечения леводопой больных БП истощение эффекта дозы наблюдается в 38-50%, феномен «включения-выключения» - в 5-10%, а лекарственные дискинезии - в 30% случаев. Частота двигательных флуктуаций зависит и от стадии БП: на 1 стадии заболевании она составляет 10%, на 2 стадии – 38%, а на 3 стадии – 50% случаев.
Патогенетическими факторами развития моторных флуктуаций и лекарственных дискинезий являются: пульсирующая нефизиологическиа стимуляция ДА-рецепторов, отражающая колебания концентрации леводопы в плазме; утрата буферной функции нигростриарных нейронов; нарушение способности сохранившихся нигростриарных нейронов к захвату, депонированию леводопы и синтезу из леводопы дофамина; изменение функции постсинаптических ДА-рецепторов.
АДАР не конкурируют с белками пищи при транспорте через желудочно-кишечный тракт и гематоэнцефалический барьер, в отличие от препаратов леводопы. Кроме того, у АДР - более длительный период полужизни в плазме, этот класс лекарственных средств обеспечивают более длительную, близкую к физиологическим условиям, избирательную стимуляцию дофаминовых рецепторов. Многие контролированные проспективные исследования продемонстрировали, что начальная монотерапия агонистами по сравнению с терапией леводопой значительно уменьшает риск и отодвигает сроки появления моторных флуктуаций и лекарственных дискинезий [25, 29, 28, 33].
При метаболизме АДР не образуются свободные радикалы, которые могут ускорять апоптоз нейронов при БП.
Хотя результаты контролируемых клинических испытаний предполагают, что фармакотерапевтическая эффективность и профиль побочных эффектов АДАР примерно те же самые, некоторые исследования показали, что эффективность различных агонистов у пациентов может отличаться между собой. В связи с этим иногда возникает необходимость перевода больного с одного агониста на другой.
Наиболее характерными побочными эффектами всех АДАР являются тошнота, рвота, диспепсия, постуральная гипотензия, сердечные аритмии; а также центральные побочные эффекты в виде галлюцинаций и психозов, нарушений сна и приступов дневной сонливости. Психотические расстройства наблюдаются чаще в пожилом и старческом возрасте при наличии выраженных когнитивных нарушений, поэтому этой группе больных следует с осторожностью назначать АДАР в меньших терапевтических дозах с более длительным периодом титрования суточной дозировки. В последние годы обсуждаются возможные побочные эффекты агонистов в виде развития патологических влечений (игромании, шопингомании, гиперсексуальности).
Эрголиновые производные гораздо чаще вызывают периферические побочные эффекты (эритромелалгия, легочный, ретроперитонеальный и перикардиальный фиброзы, плеврит, синдром Рейно, стенокардия, артариальная гипотензия). Большое количество исследований выявило поражение клапанов сердца при длительной терапии бромокриптином, перголидом и каберголином. Их назначение требует более длительного периода титрования суточной дозы, более пристального наблюдения за больным, периодического проведения трансторакальной эхокардиографии.
Необходимость замены АДАР возникает в случае появления побочных эффектов, снижения эффекта фармакотерапии, а также необходимости лечения специфических немоторных симптомов (депрессии, ортостатической гипотензии, нарушений сна, синдрома беспокойных ног и др.). Необходимое увеличение дозы назначенного АДАР при недостаточном контроле двигательных симптомов паркинсонизма часто ограничено риском возрастания нежелательных явлений, таких как тошнота, рвота, ортостатическая гипотензия, отечность голеней и стоп, галлюцинаций и дезориентации. Риск психиатрических симптомов возрастает у больных пожилого и старческого возраста, а также при наличии деменции.
При назначении того или иного АДАР следует учитывать сопутствующие соматические заболевания, особенно поражение печени, почек, сердца. Так, в случае наличия сопутствующего заболевания почек у пациента БП, следует назначить АДАР, который преимущественно метаболизируется в печени (таб. 8).
Таблица 7. Достоинства и недостатки АДР
| Достоинства | Недостатки |
| - Сопоставимая с леводопой эффективность на ранних стадиях при монотерапии - Влияние на тремор - Снижение риска развития моторных флуктуаций и лекарственных дискинезий - Возможность снижения дозы леводопы за счет аддитивного дофаминергического эффекта - Коррекция уже развившихся моторных флуктуаций и лекарственных дискинезий - Антидепрессивный эффект у ряда АДР - Улучшение когнитивных функций - Возможный нейропротекторный эффект |
- Относительно высокая частота побочных эффектов (нейропсихические расстройства, нарушения сна) |
Таблица 8. Пути метаболизма АДАР
| Препарат | Период полувыведения (час) | Органы |
| Перголид | 6 | Печень |
| Каберголин | 68 | Печень |
| Лизурид | 2-3 | Печень/Почки |
| Перголид | 16 | Печень/Почки |
| Прамипексол | 8-12 | Почки |
| Ропинирол | 6-9 | Почки |
На основе опубликованных данных и клинического опыта определены эквивалентные дозы АДАР (таб. 9)[15].
Таблица 9. Эквивалентные по эффективности дозы АДАР
| Препарат | Суточная доза мг | ||||||||
| Перголид | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 |
| Лизурид | 0,5 | 1 | 1,5 | 2 | |||||
| Каберголин | 0,8 | 1,5 | 2,25 | 3 | 3,75 | 4,5 | 5,25 | 6 | |
| Прамипексол | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 |
| Ропинирол | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| Бромокриптин | 5 | 10 | 15 | 20 | 25 | 30 | |||
Важным вопросом является способ перевода больного БП с одного АДАР на другой. Перевод пациента на другой агонист может происходить постепенно, в течение одной–двух недель методом снижения дозы одного препарата вплоть до полной его отмены с последующим введением нового агониста и наращиванием его дозы. Именно этот способ ретитрации распространен в повседневной практике [15]. Однако, при его применении неизбежно некоторое ухудшение симптомов паркинсонизма.
Другой способ – перевод больного с одного на другой агонист, назначаемый сразу на следующий день в эквивалентной дозе без периода ретитрации. По результатам некоторых немногочисленных исследований, и этот способ перевода является безопасным [10, 12]. К тому же, он не сопровождается временным нарастанием двигательных симптомов. В одном открытом клиническом исследование проводилось изучение безопасности быстрого способа перевода (на следующий день) на прамипексол 227 пациентов БП, получавших или бромокриптин, или перголид, или ропинирол в комбинации с леводопой [21]. После перевода больных на прамипексол отмечалось улучшение показателей шкалы UPDRS на 26–30% у всех пациентов БП, при этом удалось незначительно уменьшить суточую дозу леводопы.
Наконец, третий способ – снижение дозы предшествующего АДАР с постепенным введением и повышением дозы другого агониста. При этом способе два агониста назначаются совместно в течение 2 недель, в последующее время первый агонист вытесняется другим [41].
В большом исследовании, в которое вошли 1202 пациента, Reichmann H. с соавт. установили, что независимо от способов перевода больных БП с других агонистов на прамипексол во всех случаях отмечалось улучшение состояния больных [35]. Причиной перевода больных БП на прамипексол была необходимость коррекции тремора, депрессии и ангедонии.
Прамипексол (Мирапекс) – неэрголиновый АДАР, является синтетическим производным аминобензотиазола. Препарат избирательно воздействует на D2 и D3 рецепторы, лишь незначительно связываясь с недофаминергическими рецепторами. Экспериментальные данные показали, что низкие дозы прамипексола активируют пресинаптические D2 и D3 ауторецепторы, обеспечивая реализацию дофамина; в то же время, высокие дозы препарата взаимодействуют с постсинаптическими D2 и D3 рецепторами. Так как количество пресинаптических ДА-рецепторов значительно уменьшается при дегенерации нигростриарных нейронов, основной эффект прамипексола при БП реализуется за счет воздействия на постсинаптические рецепторы. Важно, что прамипексол не взаимодействует с D1 рецепторами, стимуляция которых, согласно экспериментальным данным, приводит к развитию лекарственных дискинезий.
Прамипексол быстро абсорбируется при пероральном приеме, его биодоступность очень высока – более 90%. Он удаляется в основном через почки, при этом минимально взаимодействует с энзимами печени (цитохромом Р 450), не вызывая взаимодействия с другими лекарственными препаратами, которые часто вынужден принимать пожилой пациент (сердечно-сосудистые, антиаритмические, антигипертензивные и другие средства).
Период полувыведения прамипексола составляет 8–12 часов. Клинические исследования выявили, что увеличение периода полувыведения прамипексола у пожилых людей не вызывает увеличения риска возникновения побочных эффектов препарата.
Клиническая эффективность прамипексола доказана в большом количестве длительных и коротких рандомизированных двойных слепых плацебо контролируемых исследований при лечении ранних и развернутых стадий БП.
При монотерапии прамипексолом ранних стадий снижалась степень выраженности двигательных нарушений: показатели рейтинговой шкалы UPDRS (III часть) уменьшались в среднем на 25% по сравнению с ухудшением на 6,9 % в группе больных, получавших плацебо. Кроме того, значительно улучшалась повседневная активность.
При прямом сравнении эффективности прамипексола и леводопы в качестве начальной терапии БП (исследование CALM-PD) прамипексол значительно уменьшал развитие двигательных флуктуаций и лекарственных дискинезий. Начальная терапия в течение 2 и 4 лет прамипексолом больных на ранней стадии БП уменьшала риск возникновения моторных флуктуаций (феноменов «истощения» эффекта дозы, «включения–выключения») на 30% по сравнению с леводопой; а лекарственных дискинезий – на 50%.
Продолжительные открытые исследования показали, что многие больные БП могут оставаться только на монотерапии прамипексолом в течение достаточно длительного срока (более трех лет), т.к. его эффективность на ранних стадиях почти сопоставима с препаратами леводопы.
Благодаря селективной стимуляции D3 рецепторов в мезолимбической дофаминергической системе прамипексол положительно влияет на нейропсихологические нарушения и уменьшает степень депрессивного синдрома (связывание с D3 рецепторами обеспечивает антидепрессивный и антиангедонический эффекты).
При БП в 40–90% случаев (по данным различных авторов) развиваются аффективные нарушения (тревога, депрессия). Основными причинами депрессии при БП являются биохимические нарушения (недостаток синтеза норадреналина и серотонина), а также появление психологической реакции больного на наличие хронического прогрессирующего неизлечимого заболевания и неблагоприятные социально-экономические перспективы.
Депрессия при БП ухудшает повседневную активность, качество жизни больных, а также приверженность пациента к назначенной терапии (комплаентность). Кроме того, депрессия отягощает течение заболевания и является одним из факторов риска развития в последующем когнитивных нарушений. Таким образом, важно, чтобы назначенная больному терапия АДАР вызывала уменьшение степени выраженности не только двигательных, но и аффективных расстройств.
Международные двойные слепые контролируемые исследования выявили наличие дозозависимого антидепрессивного эффекта прамипексола как при лечении психиатрических больных с депрессией, так и при терапии больных БП с аффективными нарушениями. При этом фармакотерапевтический эффект прамипексола был выше, чем у антидепрессантов флуоксетина и сертралена [7]. Кроме того, был выявлен и антиангедонический эффект прамипексола [19].
Прамипексол значительно уменьшает выраженность тремора при БП и позволяет добиться улучшения качества жизни больных с трудно курабельной дрожательной формой заболевания [23]. Тремор встречается у 70–75% больных БП, при этом он часто имеет постуральный и кинетический компоненты, что в значительной степени ограничивает качество жизни пациентов.
Суточная доза АДАР, так же, как и большинства других противопаркинсонических препаратов, подбирается постепенно, в течение 3–5 недель методом титрования (медленного наращивания) дозы. Суточная доза агонистов дофаминовых рецепторов становится стабильной при достижении терапевтического эффекта.
Например, подбор терапевтической дозы прамипексола (Мирапекса) осуществляется следующим образом:
1 неделя лечения – 0,125 мг 3 раза в день;
2 неделя лечения – 0,250 мг 3 раза в день;
3 неделя лечения – 0,5 мг 3 раза в день;
4 неделя лечения – 1 мг 3 раза в день;
и т.д. до достижения эффективной терапевтической дозы (максимально 4,5 мг/ сутки).
Прамипексол в меньшей степени, чем эрголиновые АДАР, стимулирует недофаминергические рецепторы (альфа-адренорецепторы, серотониновые и мускариновые рецепторы), реже вызывает периферические вегетативные, сердечно-сосудистые и гастроэнтерологические побочные эффекты. Неэрголиновая природа исключает такие осложнения, как язва желудка, периферический вазоспазм, легочный и забрюшинный фиброз. Однако нередко наблюдаются центральные побочные эффекты – галлюцинации, дезориентировка, приступы непреодолимой сонливости днем и нарушение сна.
Таким образом, АДР в настоящее время применяются на ранних стадиях заболевания в виде монотерапии (эффект этих препаратов сопоставим на ранних стадиях БП с препаратами леводопы) или в комбинации с амантадином, холинолитикои или селегилином.
Новая патофизиологическая концепция предполагает, что нефизиологическая дофаминовая стимуляция при приеме стандартных форм препаратов леводопы вызывает целый каскад патологических процессов: дизрегуляцию функции допаминергических и недофаминергических рецепторов стриатума; образование патологических иптрацеллюлярных импульсов в стриарных нейронах и базальных ганглиях; что в конечном итоге приводит к моторных флуктуциям и дискинезиям. Пульсирующая стимуляция ДА-рецепторов приводит к индуцированию различных изменений генной экспрессии в стриарных нейрона [34, 27].
Эти данные являются основанием для первого выбора в качестве лечения более молодых пациентов, а также больных пожилого возраста без декомпенсированных сопутствующих заболеваний именного агонистов ДА-рецепторов.
Одним из важных аргументов в пользу целесообразности начала терапии БП с назначения АДАР является их возможный нейропротекторный эффект. Взаимодействие между генетическими и внешними факторами является основой нейродегенеративного процесса при БП. Патофизиологические механизмы нейродегенерации реализуются с помощью оксидантного стресса, образования свободных радикалов, развития митохондриальной и протеосомальной дисфункции, а также воспалительных процессов [20]. Многочисленные исследования выявили антиоксидантные свойства АДАР in vitro и in vivo. Прямое воздействие на митохондриальные мембранные потенциалы и ингибирование апоптоза – еще один механизм нейропротекторного эффекта АДАР. Взаимодействие с пресинаптическими допаминергическими ауторецепторами приводит к уменьшению кругооборота дофамина; в результате окисления эндогенного дофамина образуются свободные радикалы, таким образом, АДАР предотвращают повреждение нейронов. Более того, агонисты связывают супероксидные и гидроксильные радикалы и противодействуют воздействию различных токсинов [37, 17].
Нейропротекторный эффект прамипексола подтвержден в экспериментальных исследованиях на животных и в культуре дофаминергических нейронов (in vivо, in vitro). Его связывают с уменьшением синаптического кругооборота дофамина; стимуляцией D1 рецепторов; синтезом белков с антиоксидантными свойствами, а также со стимуляцией аутотрофической активности нейронов, снижением тонуса расторможенных при БП подкорковых структур (субталамического ядра) и уменьшением выработки глутамата.
В последние годы с помощью методов функциональной нейровизуализации (SPECT) с применением различных маркеров мембранного переносчика дофамина исследовалась пресинаптическая мембрана дофаминергических синапсов. В качестве маркеров использовался радиолиганд дериват тропана – (123 I) b-CIT. Этому соединению требуется несколько часов для того, чтобы достичь в организме состояния равновесия. Сканирование, как правило, проводится на следующий день после инъекции этого препарата.
У больных БП связывание радио-лиганда (123 I) b-CIT снижается примерно на 10% в год. Это может быть интерпретировано как отражение нелинейной скорости гибели нигростриарных нейронов. Данные, полученные при проведении SPECT с (123 I) b-CIT выявили, что количество транспортера дофамина при лечении больных БП прамипексолом снижается с течением болезни достоверно в меньшей степени, чем при терапии леводопой, что, вероятно, отражает замедление прогрессирования заболевания (рис.1).
Рисунок 1. Уменьшение поглощения радиолиганда в стриатуме у больных БП
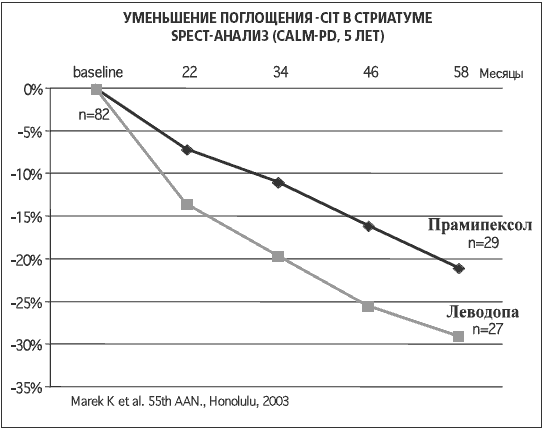
В настоящее время проводится уникальное исследование PROUD, которое планируется завершить в июле 2009 г. Целью этого исследования является выявление влияния более раннего назначения 1,5 мг прамипексола по сравнению с отсроченным его применением (через 6–9 месяцев) на темп прогрессирования двигательных симптомов у больных БП. Это мультицентровое двойное слепое плацебо-контролируемое исследование больных с ранними стадиями БП сопровождается нейровизуализацией (SPECT), определяющей уровень транспортера дофамина, отражающего процесс дегенерации дофаминергических нейронов [38].
Фармакоэкономическое исследование, проведенное в 2004 г., показало меньшую стоимость монотерапии Мирапексом больных БП по сравнению с леводопой в связи с уменьшением риска развития моторных флуктуаций и дискинезий [24].
Таким образом, к преимуществам АДАР нового поколения по сравнению с препаратами леводопы можно отнести следующие свойства:
- непосредственное стимулирование ДА-рецепторов;
- отсутствие метаболического преобразования;
- отсутствие конкуренции с аминокислотами пищи за всасывание в кишечнике и проникновение через гематоэнцефалический барьер;
- длительный период полувыведения, обеспечивающий стабильную и близкую к физиологической стимуляцию ДА-рецепторов, что снижает риск развития моторных флюктуаций и лекарственных дискинезий;
- отсутствие окислительного метаболизма АДАР, что, в свою очередь, не приводит к образованию свободных гидроксильных радикалов, которые могут вызывать разрушение молекул, содержащих ДНК, белки и мембранные липиды; а также ускорять апоптоз нейронов;
- потенциальный нейропротекторный эффект.
Дальнейшими перспективами изучения АДАР являются сравнительное исследование эффективности различных агонистов дофаминовых рецепторов; возможности их комбинированного применения. Появились первые исследования, которые выявили эффективность комбинации двух различных по фармакологическим свойствам АДАР – эрголинового производного каберголина и неэрголинового производного прамипексола или ропинирола у больных с моторными флуктуациями на фоне терапии леводопой и у больных без моторных флуктуаций [40].
Перспективными являются и исследования, которые могли бы подтвердить или опровергнуть некоторые данные о том, что на фоне монотерапии АДАР так же, как и при лечении препаратами леводопы, могут возникать моторные флуктуации [43, 24]. Как показано в ряде экспериментов, продолжительность симптоматического эффекта АДАР может быть короче, чем период полувыведения в плазме крови [14], что возможно, требует более частого, чем трехкратного, назначения АДАР в течение суток.
Кроме того, представляется важным продолжение исследования нейропротекторного эффекта АДАР в экспериментальных условиях и в клинической практике, их влияния на аффективные и когнитивные нарушения при болезни Паркинсона. Перспективно изучение эффективности АДАР и при других нейродегенеративных заболеваниях ЦНС с синдромом паркинсонизма.
Список литературы:
1. Артемьев Д.В., Обухова А.В. Современные подходы к лечению ранних стадий болезни Паркинсона. Консилиум Меди-кум. 2008. Т.10. № 7.С.89-92.
2. Левин О.С. Агонисты дофаминовых рецепторов в лечении болезни Паркинсона. Лечение нервных болезней. 2003. №4 (1).С.14-17.
3. Нодель М.Р., Артемьев Д.В., Яхно Н.Н.. Эффективность дофаминового агониста мирапекса при болезни Паркинсона.// Неврологический журнал, -1999.-№ 6. -т. 4. - с. 45-49.
4. Федорова Н.В., Кулуа Т.К. Опыт применения прамипексола в лечении болезни Паркинсона. Консилиум Медикум.2007. 9 (2).С. 103-107.
5. Федорова Н.В., Смоленцева И.Г., Левин О.С. Применение агонистов дофаминовых рецепторов при болезни Паркинсона //Русский медицинский журнал, 2000, том 8.- №15. С.643-647.
6. Chaudhuri K.R., Healy D.G., Schapira A.H. National Institute for Clinical Exellene. Non-motor symptoms of Parkinson’s disease: diagnosis and management./ Lancet Neurol. 2006. № 5. Р. 235-245.
7. Corrigan M.H. Denahan A.Q., Wright C.E., Ragual R.J. Comparison of pramipexole, fuoxetini, and placebo in patients with major depression. // Depress. Anxiety -2000 – V. 11. – P. 58-65
8. Fhan S., Oakes O., Shoulson I. et al. Levodopa and progression of Parkinson’s disease. /N. Engl. J. Med. 2004. №351. Р. 2498-2508..
9. Goetz C.G. Dopaminergic agonists in the treatment of Parkinson’s disease. // Neurology 1990. – 40 (Suppl 3). – P. 50-54.
10. Goetz C.G., Blasucci L., Stebbins G.T. Switching dopamine agonists in advanced Parkinson’s disease. Is rapid titration preferable to slow?/ Neurology 1999. 52. P.1227-1229.
11. Goldberg J.F., Frye M.A., Dunn R.T. Pramipexole in refractory bipolar depression./Am. J. Psychiatry .1999. №156. P.798.
12. Hauzer R., Reider C., Stacey M. et al. Acute versus gradual pramipexole to ropinirile switch. /Mov. Disord. 2000. №15. Sup.3. P.133.
13. Holloway R.G., Shoulson I., Kieburts K., et al. Pramipexole vs. levodopa as initial treatment for Parkinson’s disease - a 4-year randomized controlled trial./ Arch. Neurol. 2004. № 61. Р.1044-1053.
14. Jenner P. The MPTP-treated primate as a model of motor complications./ Neurology .2003. № 61. Suppl. 3. Р.4-11.
15. Junghanns S., Glockler T., Reichmann H. Switching and combing of dopamine agonists./J. Neurol.,2004.№ 251. Suppl.6. P.19-23.
16. Junghanns S., Glockler T., Reichmann H. Switching and combining of dopamine agonists./ J. Neurol. 2004. № 251.(Suppl. 6). Р.19-23.
17. King D.F., Cooper J.M., Schapira A.H. Pramipexole protects against MPP+toxicity in SHSY5Y cells by maintaining mitochondrial membrane potential./ Neurology .2001. № 56. Р.377-388.
18. Lang A.E. Are the new dopamine agonists better than the old ones? // 6th International congress of Parkinson’s disease and movement disorders Barcelona, Spain; 2000
19. Lemke M.R., Brecht H.M., Koester J. еt al. Anhgedonia, depression, and motor functioning in Parkinson’s disease during treatment with pramipexole./ J. of Neurops. And Clin. Neurosc. 2005. № 17. Р. 214-220.
20. Lev N., Dialdetti R., Melamed E. Initiation of symptomatic therapy in Parkinson’s disease: dopamine agonists vs. levodopa.J.Neurol. 2007. № 254 (suppl.5).- P.19-26.
21. Linazasoro G. Conversion from dopamine agonists to pramipexole./ J. Neurol. 2004. №251. P. 335-339.
22. Molho E.S., Factor S.A., Weiner W.J. et al. The use of pramipexole, a novel dopamine (DA) agonist, in advanced Parkinson’s disease. // J. Neural. Transm. – 1995. - (Suppl) V. 45. – P. 225-230.
23. Navan P. , Findley L.J., Pearce R.G. et al. A randomly assigned double-blind crossover study examining the relative anti-parkinsonian tremor effects of pramipexole and pergolide. Eur. J. Neurol. 2005.№ 12 (1). P.1-8.
24. Noyes K., Dick A., Holloway R.G. and the Parkinson Study Group. Pramipexole vs levodopa as initial treatment for Parkinson’s disease. A randomized clinical-economic trail./ Med. Decis. Making . 2004. №24. Р.472-485.
25. Oertel W.H. Pergolide vs Levodopa (PELMOPET). /Mov.Disord. 2000, №15 (Suppl.3). P86.
26. Oertel W.H., Wolters E., Sampaio C. еt al. Pergolide vs. levodopa monotherapy in early Parkinson’s disease patients: PELMOPET study./Mov. Disord. 2006.№ 21. Р.343-353.
27. Olanov C.W., Agid Y. , Mizuno Y. et al. Levodopa in the treatment of Parkinson’s disease:current controversies. /Mov.Disord. 2004. №19. Р .997-1005.
28. Parkinson Study Group. Pramipexole vs levodopa as initial treatment for Parkinson’s disease:A randomized controlled trial. / JAMA. 2000. № 284. Р.1931-1938.
29. Рarkinson Study Group. A randomized controlled trial comparing Pramipexole with Levodopa in early Parkinson’s disease: design and methods of the CALM-PD study. // J. Clin. Neuropharmakol. – 2000. – V. 23. - N. 1. – P. 34-44.
30. Pogarell O., Gasser T., Hilten J. et al. Pramipexole in patients with Parkinson’s disease and marked drug resistant tremor: a randomized, double-blind study, placebo controlled multicenter study. /J.Neurol. Neurosurg. Psychiatry. 2002. № 72. P. 713-720.
31. Pogarell O., Gasser T., van Hilten J. et al. Pramipexole in patients with Parkinson’s disease and marked drug resistant tremor: a randomized, double blind, placebo controlled multicentre study./ J. of Neurology, Neurosurgery and Psychiatry. 2002.№72. P. 713-720.
32. Rajput A.H. Adverse effects of ergot-derivative dopamine agonists. In Olanow C.W., Obeso J.A., eds. Dopamine agonists in early Parkinson’s disease. // Kent, - UK. -Wells Medical. - 1997. – P. 209-216.
33. Rascol O., Brooks D.J., De Deyn P. et al. Five-year study of the incidence of dyskinesia in patients with early Parkinson’s disease who were treated with ropinirole or levodopa./ N. Engl. Med. 2000. № 342. Р.1484-1491.
34. Rascol O., Rayoux P. , Ferreira J. Et al. The management of patients with early Parkinson’s didease. /Parkinonism Relat. Disord. 2002. №9. Р. 61-67.
35. Reichmann H., Odin P. , Brecht H.M. et al. Changing dopamine agonist treatment in Parkinson’s disease: experience with switching to pramipexole /.J.Neural. Transm. Suppl. 2006. №71. Р.17-25.
36. Samii A., Nutt J.G., Ranson B.R. Parkinson’s disease./ Lancet. 2004. №363. Р. 1783-1794.
37. Schapira A.H. Neuroprotection and dopamine agonists. /Neurology. №58. Sup.1 Р. 9-18.
38. Schapira A.H., Hsu H.H., Scrine K. et al. PROUD: The impact of early vs. delayed treatment with pramipexole on new onset Parkinson’s disease./ Mov. Disor. 2008. V.23. Supp.1. P.194.
39. Schapira A.H., Obeso J. Timing of treatment initiation in Parkinson’ disease: a need for reappraisal? /Ann. Neurol. 2006. № 59. Р. 562-564.
40. StocchiF., Berardelli A., Vacca L., et al. Combination of two different dopamine agonists in the management of Parkinson’s disease./ Neurol. Sci. 2002 №.23. Suppl. 2. Р.115-116.
41. Takahashi H., Nogawa S., Tachibana J. et al. Pramipexole safely replaces ergot dopamine agonists with either rapid or slow switching. /J. Int. Med. Res. 2008. № 36 (1). P. 106-114.
42. Tatton W.G., Ju W.Y.H., Wadia J. et al. Reduction of neuronal apoptosis by small molecules: promise for new approaches to neurological therapy. / In: Olanov C. W., Jenner P.,Youim MHB, eds. // Neurodegeneration and neuroprotection in Parkinson’s disease. – London – Academic Press. – 1996. – P. 202-220.
43. Thomas A. ,Bonanni L., Di Lorio A. et al. End-of-dose deterioration in non ergolinic dopamine agonist monoterapy of Parkinson’s disease. J. Neurol. 2006. № 253. P.1633-1639.
44. Uitti R.J., Ahlskog J.E. Comparative review of dopamine receptor agonists in Parkinson’s disease. /Drugs.1996. № 5. P. 369-388.
45. Wolters E.C., Tissingh G., Bergmans P.L.M. et al. Dopamine agonists in Parkinson's disease. // Neurology. – 1995. – V. 45 (Suppl. 3). – P. 28-34.
