Прекондиционирование миокарда триметазидином при операциях коронарного шунтирования с искусственным кровообращением
СтатьиОпубликовано в журнале:
«Врач», 2014, №4, с. 27-32 В. Пичугин1, доктор медицинских наук, профессор, Л. Анцыгина2, кандидат медицинских наук, П. Кордатов2, кандидат медицинских наук, А. Максимов2, кандидат медицинских наук Нижегородская государственная медицинская академия Специализированная кардиохирургическая клиническая больница, Нижний Новгород
Применение триметазидина у пациентов с ишемической болезнью сердца при операциях коронарного шунтирования в условиях искусственного кровообращения и фармакохолодовой кардиоплегии обеспечивает дополнительный кардиопротективный эффект.
Ключевые слова: фармакологическое прекондиционирование, триметазидин, защита миокарда.
Myocardial Preconditioning with Trimetazidine During Coronary Bypass Surgery under Extracorporeal Circulation
Professor V. Pichugin1, MD; L. Antsygina2, Candidate of Medical Science; P. Kordatov2, Candidate of Medical Sciences; A. Maksimov2, Candidate of Medical Sciences1Nizhny Novgorod State Medical Academy
2Specialized Cardiac Surgery Clinical Hospital, Nizhny Novgorod
Trimetazidine used in patients with coronary heart disease during coronary bypass surgery under extracorporeal circulation and pharmacological cold cardioplegia provides an additional cardioprotective effect.
Key words: pharmacological conditioning, trimetazidine, myocardial protection.
Большинство кардиохирургических операций проходят в условиях полного или частичного прекращения коронарного кровотока и как следствие – ишемии миокарда. Дисфункция миокарда вследствие его ишемического повреждения является одной из самых частых проблем у кардиохирургических пациентов [1].
Все методики защиты миокарда, основанные на применении кардиоплегической остановки и используемые в настоящее время, подвергают сердце влиянию так называемой мандаторной ишемии, когда сердце лишено коронарного кровообращения. В большинстве случаев это приводит к реперфузионному повреждению миокарда при открытии аорты и возобновлении коронарного кровотока [2].
В настоящее время, когда оперируют все больше пациентов из группы повышенного риска, становится очевидной необходимость развития альтернативных методов миокардиальной протекции, повышающих толерантность миокарда к ишемии и уменьшающих ее последствия.
Один из методов такой защиты – прекондиционирование миокарда (ПМ). Известны 2 вида ПМ – ишемическое и фармакологическое. Ишемическое ПМ достаточно давно и с успехом внедрено в кардиохирургическую практику [3]. Защитный эффект фармакологического ПМ, который возникает в ответ на использование тех или иных препаратов, изучен недостаточно и в основном – в экспериментальных исследованиях. В связи с этим наше внимание привлекло применение триметазидина как препарата, оптимизирующего энергетический обмен ишемизированного миокарда. Триметазидин способствует сохранению необходимого уровня аденозинтрофосфата в кардиомиоцитах, обеспечивает снижение внутриклеточного ацидоза и перегрузки клеток кальцием, уменьшает повреждение миокарда, вызываемое свободными радикалами, модулирует воспалительную реакцию и ограничивает зону некроза миокарда [4–8].
В ряде краткосрочных рандомизированных клинических исследований показаны кардиопротективные эффекты триметазидина, назначаемого перед стентированием коронарных артерий [9-14] и коронарным шунтированием [15-17]. Продемонстрировано, что назначение триметазидина накануне коронарного шунтирования позволяет не только ограничить ишемическореперфузионное повреждение в послеоперационном периоде, но и обеспечить улучшение систолической функции левого желудочка (ЛЖ) и повышение толерантности к физической нагрузке, а также снизить материальные затраты на ведение больных ишемической болезнью сердца (ИБС) при последующем 3-летнем применении препарата [18].
Вместе с тем отсутствуют комплексные клинические, функциональные и биохимические оценки эффективности фармакологического ПМ триметазидином в кардиохирургии.
В связи с этим нами проведена комплексная оценка эффекта ПМ триметазидином (Предуктал МВ 35 мг, Servier, Франция) у пациентов с ИБС при операциях коронарного шунтирования в условиях искусственного кровообращения (ИК) и фармакохолодовой кардиоплегии.
В проспективное рандомизированное исследование были включены 50 пациентов с ИБС (45 мужчин, 5 женщин) в возрасте от 45 до 79 лет, проходивших стационарное лечение в отделении хирургии ИБС Специализированной кардиохирургической клинической больницы Нижнего Новгорода. Все пациенты предоставили информированное согласие на участие в нем, а само исследование было одобрено этическим комитетом учреждения.
Показаниями к проведению коронарного шунтирования у пациентов, включенных в исследование, явились сохраняющиеся приступы стенокардии на фоне комбинированной антиангинальной терапии, гемодинамически значимое поражение коронарного русла, невозможность выполнения эндоваскулярного вмешательства или отказ пациента от него.
Пациенты были рандомизированы в 2 группы (рандомизация осуществлялась методом конвертов): больные 1-й группы (n=25) не принимали триметазидин в течение всего времени наблюдения и являлись группой сравнения (контрольная группа); больные 2-й группы (n=25) получали триметазидин МВ в дозе 70 мг/сут в течение 2 нед до вмешательства.
Все пациенты получали базисную терапию: антитромбоцитарные препараты, статины, b-адреноблокаторы, ингибиторы ангиотензенпревращающего фермента и антагонисты Ca2+. Структура медикаментозной терапии в группах не различалась и за период наблюдения не изменялась.
Основные показатели исходного состояния больных представлены в табл. 1.
Таблица 1. Общая характеристика больных; абс. (%)
| Показатель | 1-я группа | 2-я группа |
| Мужчины | 22 (88,0) | 23 (92,0) |
| Женщины | 3 (12,0) | 2 (8,0) |
| Возраст, годы: | 60,2±3,5 | 58,2±3,4 |
| Класс стенокардии: | ||
| II | 5 (20,0) | 4 (16,0) |
| III | 17 (68,0) | 16 (64,0) |
| IV | 3 (12,0) | 5 (20,0) |
| Стадия НК: | ||
| I | 5 (20,0) | 8 (32,0) |
| II A | 9 (36,0) | 9 (36,0) |
| ФВ ЛЖ, % | 48,2±3,7 | 48,7±3,5 |
| Всего | 25 (100) | 25 (100) |
| Примечание. НК – выброса. недостаточность кровообращения; ФВ – фракция | ||
Как следует из представленных данных, среди больных преобладали мужчины (88% - в 1-й группе, 92% - во 2-й) в возрасте в среднем около 60 лет, относящиеся к III функциональному классу стенокардии (68% – в 1-й группе, 64% – во 2-й), имеющие умеренные нарушения кровообращения и сохранную сократительную функцию миокарда ЛЖ. Группы не имели достоверных различий по исследуемым показателям.
Характер выполненных оперативных вмешательств представлен в табл. 2, основные показатели интраоперационного периода - в табл. 3.
Таблица 2. Характер выполненных операций
| Характер операции | 1-я группа (контроль) |
2-я группа (основная) |
| МАКШ | 23 | 22 |
| МАКШ + пластика ПИАС | 2 | 1 |
| МАКШ + пластика АК | – | 1 |
| МАКШ + пластика МК | – | 1 |
| Всего | 25 | 25 |
| Примечание. МАКШ – маммаро-аортокоронарное шунтирование; ПИАС – постинфарктная аневризма сердца; АК – аортальный клапан; МК – митральный клапан. |
||
Таблица 3. Основные показатели операционного периода (M±m)
| Показатель | 1-я группа (контроль) |
2-я группа (основная) |
| Средняя длительность ИК, мин | 80,1±11,3 | 97,1±12,7 |
| Средняя длительность пережатия аорты, мин | 54,8±7,4 | 66,7±8,8 |
МАКШ от 2 до 5 артерий выполнено у 92% больных 1-й группы и у 88% – 2-й; сочетанные операции (МАКШ + пластика ПИАС) произведены у 8% больных 1-й группы. У 3 (12%) пациентов 2-й группы также выполнены сочетанные операции (МАКШ + пластика ПИАС; МАКШ + пластика АК и МАКШ + пластика МК).
Все операции выполнялись в условиях ИК и фармакохолодовой кардиоплегии.
ИК осуществляли с помощью аппаратов фирм Jostra (Германия) и Stockert (Германия) с системами контроля давления, температуры, наличия воздушных пузырьков в магистралях и уровня перфузата в кардиотомном резервуаре. Применяли одноразовые перфузионные наборы, оснащенные мембранными оксигенаторами фирм Medtronic (США) и Dideco (Италия). Перфузии проводили в нормотермическом режиме с поддержанием центральной температуры 36,0±0,5°С. Объемная скорость перфузии составляла 2,4–2,6 л/мин/м2. Защита миокарда осуществлялась путем кристаллоидной фармакохолодовой кардиоплегии в корень аорты. Во всех случаях был использован раствор Консол (относится к внеклеточному типу кардиоплегических растворов). Раствор температуры 4–6°С вводили антеградно в объеме 600–1000 мл с одновременным внутриперикардиальным охлаждением и далее – 300–500 мл кардиоплегического раствора температуры 4–6°С каждые 20–30 мин.
Группы не имели достоверных различий по длительности ИК и пережатия аорты (ишемии миокарда).
Интра- и послеоперационные методы исследования включали в себя мониторинг: клинических критериев (характер восстановления сердечной деятельности после кардиоплегии; частота развития постишемических нарушений сердечного ритма; частота развития послеоперационной острой сердечной недостаточности – ОСН); функциональных критериев (показатели центральной гемодинамики и сократительной функции миокарда на этапах операции); биохимических критериев (МВ креатинфосфокиназы – КФК).
Для мониторинга (интра- и послеоперационного) использовали мониторы Infinity Delta (Draeger, Германия); исследовали полный набор критических параметров: ЭКГ в 6 отведениях; анализ сегмента ST; неинвазивное и инвазивное АД и центральное венозное давление; центральную и периферическую температуру; данные пульсоксиметрии.
Функциональная оценка сократительной функции миокарда осуществлялась с помощью монитора неинвазивной диагностики центральной гемодинамики в реальном времени Hemosonic 100 (Аrrow, США). Монитор центральной гемодинамики Hemosonic 100 обеспечивает компактность, простоту и наглядность постоянно обновляемых в автоматическом режиме параметров центральной гемодинамики (рис. 1), которые можно представить на экране в виде шкал, таблиц и графиков (за последние 24 ч); в памяти монитора сохраняются данные 12 последних исследований. Принцип его действия основан на одновременном независимом ультразвуковом измерении площади сечения аорты и скорости кровотока, что возможно благодаря наличию 2 ультразвуковых датчиков, расположенных на трансэзофагеальном зонде, который вводят пациенту через нос или через рот. Ультразвуковой датчик работает на частоте 10 МГц, датчик Допплера – на частоте 5 МГц. Каждый датчик представляет собой одновременно излучатель и приемник. Диаметр аорты измеряется в режиме М-Эхо, одновременно допплеровский датчик измеряет скорость кровотока в аорте. Глубина введения зонда – в среднем 35 см от резцов; она может быть определена индивидуально измерением расстояния от III межреберья парастернально, что соответствует уровню грудных позвонков Th5–Th6. Топографически аорта и пищевод в этом месте располагаются параллельно друг другу на протяжении примерно 5 см. Монитор измеряет среднюю скорость кровотока в аорте и рассчитывает сердечный индекс (СИ), ударный индекс (УИ), пиковую скорость кровотока (ПСК) и общее периферическое сосудистое сопротивление (ОПСС).
Рис. 1. Экран монитора центральной гемодинамики Hemosonic 100 и основные измеряемые параметры
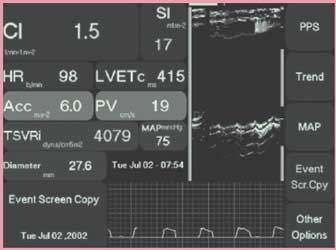
Введение датчика в пищевод производилось в операционной после индукции в анестезию; показатели (СИ, УИ, ускорение кровотока в аорте – АСС, ПСК, ОПСС) фиксировали на следующих этапах: в начале операции (1-й этап); после стернотомии и разведения грудины (2-й этап); перед началом ИК (3-й этап); после завершения ИК (4-й этап); в конце операции (5-й этап).
Биохимическое исследование заключалось в определение уровней газов крови, электролитов, гемоглобина и сатурации кислорода, кислотно-щелочного состояния крови; оно выполнялось на модульном анализаторе Cobas B121 (Roche, Швейцария).
Определение активности миокардиальной фракции КФК в сыворотке крови осуществлялось на селективном дискретном биохимическом анализаторе Cobas integra 400/400 PLUS (Roche, Швейцария). Тест заключается в иммуноингибировании с антителами в субъединицы СК-М и СК-В. Метод реализуется согласно рекомендациям Международной федерации клинической химии (IFCC), комитета по ферментам Скандинавского общества по клинической химии и клинической физиологии (SCE) и Deutsche Geselschaft fflr Klinische Chemie (DGKC). Кровь для определения уровня КФК (общей фракции и МВ-фракции) брали через 3, 8, 24, 48 ч после операции.
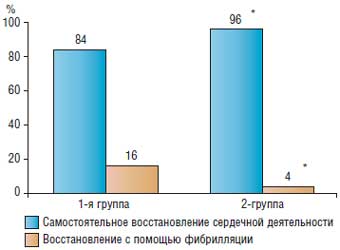
Статистическую обработку материала исследования осуществляли на персональном компьютере. Результаты исследования обрабатывали в соответствии с правилами вариационной статистики (Гланц Стентон А., 1999). Характер распределения данных оценивали с помощью критериев Колмогорова-Смирнова и Шапиро-Уилкса. Для нормально распределенных данных вычисляли среднее арифметическое (M) и ошибку среднего арифметического (m), для непараметрических данных – медиану. Анализ дискретных данных выполняли путем оценки критерия x2 или точного критерия Фишера (при числе наблюдений 2, Манна–Уитни). Для внутригрупповых сравнений с исходными показателями использовали критерий Уил-коксона. Количественные данные представлены в виде M±m, дискретные данные – в виде абсолютных или относительных величин. Результаты вычислений считали достоверными при критерии значимости pХарактер восстановления сердечной деятельности после выполнения основного этапа операции и снятии зажима с аорты представлен на рис. 2. Как следует из представленных данных, самостоятельное восстановление сердечной деятельности отмечено у 21 (84,0%) больного 1-й (контрольной) группы и у 24 (96,0%) - 2-й (основной). Лишь у 1 (4,0%) пациента 2-й группы возникла фибрилляция желудочков, которая была снята 1 разрядом дефибриллятора. Данный показатель достоверно ниже, чем в 1-й группе, в которой 4 (16,0%) больным потребовалось применение электроимпульсной терапии.
Рис. 2. Характер восстановления сердечной деятельности после ишемии; * - достоверность различий с контрольной группой
Характер течения восстановительного и постперфузионного периода (частота применения электрокардиостимуляции – ЭКС, применения катехоламинов непосредственно после ИК и в конце операции, их дозы) представлен в табл. 4. Частота применения ЭКС в 1-й группе составила 8,0% (у 2 больных), в то время как пациентам 2-й группы она не потребовалась. По окончании ИК катехоламины (адреналин) применялись у 28,0% больных 1-й группы и лишь у 12,0% – 2-й, причем их доза была выше у больных 1-й группы: 0,107±0,006 мкг/кг/мин. В конце операции частота применения катехоламинов снижалась в обеих группах, однако в контрольной группе она была выше (20,0 против 12,0%). Доза вводимого адреналина была почти в 2 раза ниже у пациентов 2-й группы, в которой была в 2 раза ниже, чем в 1-й группе, частота развития послеоперационной ОСН.
Таблица 4. Характер течения восстановительного и постперфузионного периода; абс. (%)
| Показатель | 1-я группа (контроль) |
2-я группа (основная) |
| Применение ЭКС | 2 (8,0) | 0 (0,0)* |
| Применение катехоламинов после ИК: | ||
| не применялись | 18 (72,0) | 22 (88,0)* |
| применялись | 7 (28,0) | 3 (12,0)* |
| Средняя доза катехоламинов после ИК, кг/кг/мин |
0,107±0,006 | 0,087±0,004* |
| Применение катехоламинов в конце операции: | ||
| не применялись | 20 (80,0) | 22 (88,0)* |
| применялись | 5 (20,0) | 3 (12,0)* |
| Средняя доза катехоламинов в конце операции, мкг/кг/мин |
0,078±0,005 | 0,043±0,006* |
| Частота ОСН | 2 (8,0) | 1 (4,0) |
| Примечание. * – различия с 1-й группой достоверны (р?0,05). | ||
Таким образом, клинический анализ течения восстановительного и постперфузионного периодов выявил бoльшее число случаев самостоятельного восстановления сердечной деятельности, а также снижение потребности в катехоламинах и их доз в конце оперативного вмешательства у пациентов 2-й группы, что косвенно свидетельствует о лучшей сохранности миокарда у этих больных.
Ишемия в период основного этапа операции и последующая реперфузия миокарда вызывают повреждения сердечной мышцы, затрагивающие глубинные метаболические процессы в ней и ее структурные характеристики, сказывающиеся на степени восстановления ее функциональной способности. Повреждения, связанные с реперфузией, вызывают истощение энергетических запасов миокарда, подавляют клеточное дыхание, нарушают процессы сокращения и расслабления кардиомиоцитов, что ухудшает функциональный статус миокарда.
Для сравнения эффективности защиты миокарда у больных 2 групп изучали изменения СИ, УИ, АСС, ПСК и ОПСС) (табл. 5).
Таблица 5. Показатели сократимости миокарда в 2 группах на этапах операции (M±m)
| Этап | Группа | СИ, л/мин/м2 | УИ, мл/удар | ACC, м/с2 | ПСК, см/с2 | ОПСС, дин/с/см5 |
| 1-й | 1-я | 2,50±0,17 | 38,01±2,86 | 11,59±1,56 | 57,81±9,40 | 1951,40±272,51 |
| 2-я | 2,30±0,43 | 36,53±2,50 | 11,01±1,43 | 55,62±5,91 | 1675,10±194,20 | |
| 2-й | 1-я | 2,47±0,12 | 36,31±2,68 | 10,61±1,34 | 52,51±6,29 | 1755,30±151,62 |
| 2-я | 2,31±0,30 | 37,74±1,47 | 10,47±1,11 | 56,32±5,12 | 1623,68±189,90 | |
| 3-й | 1-я | 2,17±0,16 | 32,12±2,82 | 13,02±1,88 | 53,91±6,62 | 2058,60±229,04 |
| 2-я | 2,34±0,22 | 35,91±2,12 | 16,03±2,71 | 62,85±5,24 | 1403,20±143,10* | |
| 4-й | 1-я | 2,78±0,21 | 37,51±2,97 | 13,41±1,63 | 61,01±3,49 | 1305,57±162,41 |
| 2-я | 3,50±0,40 | 46,03±2,05* | 20,18±1,52* | 78,86±3,21* | 1004,45±90,40 | |
| 5-й | 1-я | 2,92±0,21 | 39,31±3,41 | 13,48±2,12 | 69,41±3,57 | 1482,50±173,50 |
| 2-я | 3,63±0,39 | 45,89±2,89 | 20,07±1,91* | 82,03±3,12* | 972,80±96,35* | |
| Примечание. * – различия с аналогичным показателем на данном этапе в 1-й группе достоверны (p<0,05). | ||||||
Исходно СИ у пациентов был ниже нормы (в 1-й и 2-й группах соответственно на 23,0 и 16,3%), но его величины у больных выделенных групп не имели достоверных различий. После выполнения стернотомии не отмечено его изменений в сравнении с исходным значением, а также изменений соотношения групп по этому параметру. К моменту начала ИК СИ в 1-й группе снижался на 15,6% от исходного и был ниже аналогичного показателя во 2-й группе на 7,7%; во 2-й группе не наблюдалось существенных изменений СИ по сравнению с его величиной на предыдущем этапе. После восстановления сердечной деятельности и окончания ИК в 1-й группе СИ был выше исходного на 11,2%, однако ниже, чем во 2-й группе (на 20,5%), в которой этот показатель нормализовался и стал выше исходного на 51,9%. К концу операции продолжался рост СИ в обеих группах: в 1-й он вырос на 3,4% по сравнению с предыдущим этапом, но оставался ниже, чем во 2-й группе (на 19,3%), в которой он увеличился на 57,1% от исходного и на 3,4% по сравнению с предыдущим этапом.
Исходно УИ был ниже нормы у пациентов обеих групп, но группы по этому показателю не имели достоверных различий между собой. После выполнения стернотомии не отмечено изменений УИ по сравнению с исходным этапом, а также соотношения групп по этому параметру. К моменту начала ИК УИ в 1-й группе снизился на 15,6% от исходного и был ниже аналогичного показателя во 2-й группе на 10,6%, в которой не отмечено существенных изменений УИ по сравнению с таковыми на предыдущем этапе. После восстановления сердечной деятельности и окончания ИК в 1-й группе УИ не отличался от исходного, однако был ниже, чем во 2-й группе (на 18,5%), в которой происходила нормализация УИ и он стал выше исходного на 26,0%. К концу операции продолжался рост УИ в обеих группах: так, в 1-й группе он вырос на 4,6% по сравнению с предыдущим этапом, но оставался ниже, чем во 2-й группе, на 14,3%; во 2-й группе УИ вырос на 25,6% от исходного и не изменился по сравнению с таковым на предыдущем этапе.
Исходно показатель АСС в 1-й и 2-й группах не имел достоверных различий. После выполнения стернотомии АСС снижалось в обеих группах соответственно на 5,1 и 8,5%. Перед началом выполнения ИК отмечался его рост в обеих группах (соответственно на 31,3 и 11,0%), однако во 2-й группе АСС было больше такового в 1-й группе на 20,3%. После окончания ИК АСС в 1-й группе не отличалось от доперфузионных значений, а во 2-й группе возрастало на 20,5% по сравнению с периодом перед ИК и было достоверно выше (на 33,5%), чем в 1-й группе. В конце операции данный параметр в обеих группах не отличался от такового на предыдущем этапе и во 2-й группе был выше (на 32,8%), чем в 1-й.
Исходно ПСК в группах не имела достоверных различий, и после стернотомии значимо не изменялась у пациентов обеих групп. Перед началом выполнения ИК в 1-й группе отмечено снижение ПСК на 6,7% от исходного значения, тогда как во 2-й группе отмечен рост ПСК на 13,0% от исходной и данный показатель был на 16,6% выше, чем в 1-й группе. После ИК отмечен рост ПСК в обеих группах (на 25,5% – во 2-й группе и на 13,2% – в 1-й), причем во 2-й группе ПСК была достоверно выше, чем в контроле (на 29,6%). К концу операции сохранился рост ПСК в обеих группах, но во 2-й группе она была достоверно выше (на 18,2%), чем в 1-й.
Исходно ОПСС в группах не имело достоверных различий. После стернотомии отмечено незначительное (на 10,2% от исходного) его снижение в 1-й группе и снижение на 3,1% – во 2-й. Перед началом ИК в 1-й группе отмечено возрастание ОПСС на 17,2%, во 2-й группе – снижение на 13,4%, причем ОПСС в этой группе было достоверно ниже, чем в 1-й группе (на 31,7%). После ИК ОПСС снижалось в обеих группах (на 28,4% – во 2-й группе и на 36,7% – в 1-й). В конце операции оно снизилось в обеих группах (на 41,9% от исходного во 2-й группе и на 24,2% от исходного – в 1-й); достоверных различий между группами не было.
Таким образом, интраоперационные функциональные исследования выявили статистически значимо более высокие показатели сократительной функции миокарда на этапах постперфузионного периода у больных основной группы, что отражает лучшую функциональную сохранность кардиомиоцитов, а выявленный феномен может быть определен как функциональный эффект дополнительной миокардиальной защиты при использовании триметазидина.
КФК встречается в виде 3 изоферментов, которые содержатся в клетках: сердечной мышцы (СК-МВ – сердечный изофермент, изменяющийся при повреждении клеток миокарда), скелетной мускулатуры (СК-ММ – мышечный изофермент), головного мозга (СК-ВВ – мозговой изофермент, отражающий патологию клеток головного мозга). Органное распределение изоферментов существенно различается. Скелетные мышцы очень богаты изоферментом ММ, тогда как мозг, желудок, кишечник, мочевой пузырь и легкие содержат преимущественно изофермент ВВ. Изофермент МВ обнаруживается в значительных количествах (15–20%) только в ткани миокарда.
Были исследованы изменения активности изофермента МВ (СК-МВ) через 3, 8, 24 и 48 ч после операции (рис. 3).
Рис. 3. Активность изофермента СК МВ у больных 2 групп в послеоперационном периоде
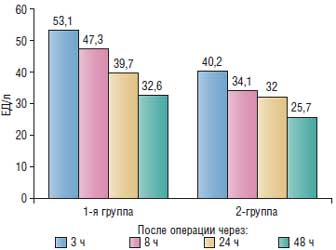
Через 3, 8, 24 и 48 ч после операции активность миокардиального изофермента СК-МВ была ниже в основной группе, чем в группе контроля (соответственно на 22,3;, 25,5; 17,0 и 18,4%). Характерен рост снижения активности СК МВ со временем в каждой группе: по сравнению с таковым через 3 ч после операции в основной группе – 14,4; 19,9 и 35,2% соответственно через 8, 24, 48 ч после операции, в контрольной группе – соответственно 10,7; 25 и 38,2%.
Меньший уровень СК МВ свидетельствует о меньшей степени ишемических и реперфузионных повреждений сердечной мышцы, что подтверждает дополнительный кардиопротекторный эффект при фармакологическом ПМ триметазидином.
Комплексное сравнительное исследование показало, что фармакологическое ПМ триметазидином (Предуктал МВ 35 мг, Servier, Франция) обеспечивало дополнительную кардиопротекцию при операциях коронарного шунтирования у больных ИБС в условиях ИК и фармакохолодовой кардиоплегии, а именно: благоприятный тип восстановления сердечной деятельности после ишемии (выявлена достоверная разница между основной и контрольной группами); снижение частоты развития послеоперационной ОСН (различия между группами достоверны); достоверно более высокие показатели сократительной функции миокарда на этапах постперфузионного периода; более низкую активность маркера повреждения миокарда – СК МВ – в течение всего послеоперационного периода.
ЛИТЕРАТУРА
1. Бокерия JI.A., Чичерин И.Н. Природа и клиническое значение «новых ишемических синдромов» / М.: НЦССХ им. А.Н. Бакулева РАМН, 2007; 302 с.
2. Weman S., Karhunen P., Penttila A. et al. Reperfusion injury associated with one-fourth of deaths after coronary artery bypass grafting // Ann. Thorac. Surg. -2000; 70: 807–12.
3. Jenkins D., Pugsley W., Alkhulaifi A. et al. Ischaemic preconditioning reduces troponin T release in patients undergoing coronary artery bypass surgery // Heart. - 1997; 77: 314–8.
4. Lagadic-Gossmann D., Le Prigent K., Feuvray D. Effects of trimetazidine on pH regulation in the rat isolated ventricular myocyte // Br. J. Pharmacol. - 1996 117 (5): 831-8.
5. Guarnieri C, Finelli C, Zini M. et al. Effects of trimetazidine on the calcium transport and oxidative phosphorylation of isolated rat heart mitochondria // Basic Res. Cardiol. - 1997; 92 (2): 90-5.
6. Maupoil V., Rochette L, Tabard A. et al. Direct measurement of free radica generation in isolated rat heart by electron paramagnetic resonance spectroscopy: effect of trimetazidine // Adv. Exp. Med. Biol. - 1990; 264: 373-6
7. Drake-Holland A., Belcher P., Hynd J. et al. Infarct size in rabbits: a modified method illustrated by effects of propranolol and trimetazidine // Basic Res. Cardiol - 1993; 88 (3): 250–8
8. Williams F., Tanda K., Kus M. et al. Trimetazidine inhibits neutrophi accumulation after myocardial ischaemia and reperfusion in rabbits // J. Cardiovasc. Pharmacol. - 1993; 22 (6): 828-33.
9. Kober G., Pennaforte S., Buck T. et al. Myocardial cytoprotection during percutaneous transluminal coronary angioplasty // Eur. Heart J. - 1993; 14 (Suppl G): 6-11
10. Birand A., Kudaiberdieva G., Batyraliev T. et al. Effects of trimetazidine on heart rate variability and left ventricular systolic performance in patients with coronary artery disease after percutaneous transluminal angioplasty // Angiology. - 1997; 48 (5): 413-22
11. Steg P., Grollier G., Gallay P. et al. A randomized double-blind trial of ntravenous trimetazidine as adjunctive therapy to primary angioplasty for acute myocardial infarction // Int. J. Cardiol. - 2001; 77 (2-3): 263-73.
12. Polonski L, Dec I., Wojnar R. et al. Trimetazidine limits the effects of myocardial ischaemia during percutaneous coronary angioplasty // Curr. Med. Res Opin. - 2002; 18 (7): 389–96
13. Labrou A., Giannoglou G., Zioutas D. et al. Trimetazidine administration minimizes myocardial damage and improves left ventricular function after percutaneous coronary intervention // Am. J. Cardiovasc. Drugs. - 2007; 7 (2): 143-50.
14. Bonello L, Sbragia P., Amabile N. et al. Protective effect of an acute oral loading dose of trimetazidine on myocardial injury following percutaneous coronary ntervention // Heart. - 2007; 93 (6): 703-7.
15. Tunerir B., Colak O., Alata§ O. et al. Measurement of troponin T to detect cardioprotective effect of trimetazidine during coronary artery bypass grafting // Ann. Thorac. Surg. - 1999; 68 (6): 2173-6
16. Vedrinne J., Vedrinne C, Bompard D. et al. Myocardial protection during coronary artery bypass graft surgery: a randomized, double-blind, placebocontrolled study with trimetazidine // Anesth. Analg. - 1996; 82 (4): 712–8.
17. Fabiani J., Ponzio O., Emerit I. et al. Cardioprotective effect of trimetazidine during coronary artery graft surgery // J. Cardiovasc. Surg. (Torino). - 1992; 33 (4) 486–91.
18. Лопатин Ю.М., Дронова Е.Н. Клинико-фармакоэкономические аспекты применения триметазидина модифицированного высвобождения у больных ИБС, подвергнутых коронарному шунтированию // Кардиология. - 2009; 49 (2): 1-7.
