Тиболон: назад в будущее
Статьи Опубликовано в журнале:
« Климактерий » №2, 2015г. Сметник В.П.
Список сокращений:
17β-HSD – 17-бета-гидроксистероиддегидрогеназы
AUC – площадь под фармакокинетической кривой
Е2 – эстрадиол
NETA – норэтистерона ацетат
CEE – конъюгированный лошадиный эстроген
MPA – медроксипрогестерона ацетат
АГ – артериальная гипертензия
ИМ – инфаркт миокарда
ЛПВП – липопротеиды высокой плотности
МГТ – менопаузальная гормональная терапия
МЖ – молочные железы
МПК – минеральная плотность костной ткани
ОХС – общий холестерин
РКИ – рандомизированное клиническое исследование
СД – сахарный диабет
ЭПТ – эстроген-прогестагенная терапия
ЭТ – эстрогенная терапия
В истории создания и клинического применения тиболона* можно выделить три важных исторических периода.
I период (1964–1989 гг.).
Синтез и уточнение свойств тиболона
Первое успешное клиническое исследование показало удивительные тканеселективные свойства тиболона: профилактика остеопороза и лечение симптомов климактерического синдрома без стимуляции эндометрия. Первоначально в 1964 г. тиболон был создан как производное 19-нортестостерона. В 1988 г. был выделен кристаллический тиболон [1]. В последующем введение 17-альфа-метильной группы дали этому веществу больше эстрогенных свойств, чем прогестагенных [1].
С помощью классических биологических методов оценки препарата фармакологи показали, что это вещество может демонстрировать активность 3 половых стероидных гормонов. Метаболиты тиболона (рис. 1) представлены двумя 3-гидроксиметаболитами, обладающими эстрогенными свойствами и связывающимися с эстрогенными рецепторами. Третий метаболит – дельта-4-изомер тиболона связывается с прогестагенными и андрогенными рецепторами [2].
* Коммерческое название тиболона - ливиал.
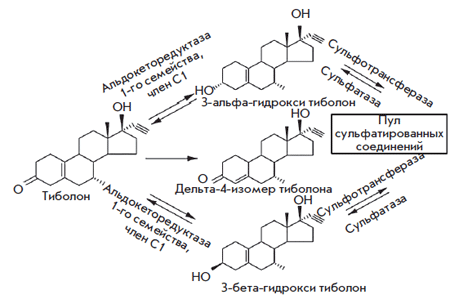
Рис. 1. Структура тиболона и его метаболитов
II период (1990–1999 гг.)
Проведены фундаментальные исследования о влиянии тиболона на молочные железы и эндометрий. Установлен локальный метаболизм тиболона в эндометрии. Показано, что прогестагенная активность тиболона и его дельта-4-изомера была подобна натуральному прогестерону. Однако сродство рецепторов прогестерона с тиболоном в эндометрии было очень низким.
Впервые было показано, что тиболон и его метаболиты локально метаболизируются в ткани эндометрия. При этом доминирует дельта-4-изомер, обладающий прогестагенной и андрогенной активностью. Кроме того, дельта-4-изомер стимулирует сульфотрансферазу и ингибирует сульфатазу (рис. 2).
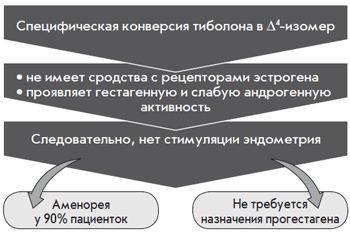
Рис. 2. Тканеселективное действие тиболона в эндометрии
Этим объясняется доминирование атрофических изменений в эндометрии [5]. Что касается молочных желез, то Pasqua-lini J.R. и соавт. убедительно показали, что тиболон и его метаболиты являются очень активными ингибиторами сульфатазы (рис. 3) [6].
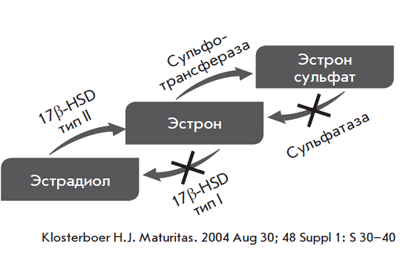
Рис. 3. Метаболизм эстрогенов в молочной железе при приеме тиболона
Установлено, что тиболон и его метаболиты оказывают антипролиферативное влияние на молочные железы и не повышают маммографическую плотность [7] в отличие от E2, Е2/ NETA и CEE/MPA, повышающих маммографическую плотность [8].
Проведено сравнительное клиническое исследование тиболона с эстроген-прогестагенной МГТ. Оба препарата оказывали подобное влияние на вазомоторные симптомы, но тиболон лучше влиял на настроение и кровянистые выделения. В этот же период начаты новые клинические исследования. Были проведены первые двойные-слепые плацебо-контролируемые исследования [3,4], которые позволили прийти к следующим заключениям:
- 2,5 мг тиболона ингибирует овуляцию у фертильных женщин и тормозит выделение гонадотропинов у постменопаузальных женщин;
- у постменопаузальных женщин тиболон не оказывает стимулирующего влияния на эндометрий, через 2 года лечения не было случаев гиперплазии эндометрия;
- тиболон оказывает избирательное воздействие на плотность костной ткани и ослабляет вазомоторные симптомы.
III период (с 2000 г. по настоящее время)
Результаты многочисленных больших РКИ показали дозозависимое влияние тиболона на симптомы климактерического синдрома, на кости, молочные железы и ЦНС. Тканеспецифический эффект тиболона позволяет представить тиболон как тканеселективный регулятор эстрогенной активности (STEAR) [10–12].
Влияние тиболона и его метаболитов на молочные железы опосредовано уменьшением воздействия на них эстрадиола вследствие блокады ферментов, участвующих в его синтезе при одновременной активации ферментов, способствующих образованию неактивных форм эстрадиола. Тиболон также стимулирует активность сульфотрансферазы, что способствует перерождению активных эстрогенов в неактивные, может блокировать сульфотазу и 17β-HSD-I, участвующих в синтезе активных форм эстрогенов.
В исследовании Nijland E.A. и соавт. была представлена сравнительная частота кровянистых выделений и масталгий при использовании тиболона 2,5 мг и Е2/NETA у постменопаузальных женщин с сексуальной дисфункцией. В исследовании приняли участие 403 женщины (средний возраст 56 лет). Вагинальные кровянистые выделения были отмечены у 11% женщин, принимавших Е2/ NETA, в отличие от тиболона, на фоне которого кровянистых выделений не было. Симптомы нагрубания молочных желез чаще обнаруживались в группе E2/NETA, чем на фоне тиболона (11% vs 4%). Все пациентки, принимавшие тиболон, закончили исследование, в то время как в группе Е2/NETA лечение было отменено у 8% женщин. На фоне тиболона было отмечено также более значительное улучшение сексуальной функции [12].
Данные 7 больших РКИ, посвященных изучению тиболона, были опубликованы после публикации консенсуса, предложившего рекомендации по применению тиболона в качестве постменопаузальной терапии в 2005 г. [13]. Эти исследования подтвердили, что тиболон является значительно более эффективным, чем плацебо [14] и таким же эффективным, как низкие дозы непрерывной терапии E2/NETA в отношении уменьшения выраженности вазомоторных симптомов.
Тиболон более выраженно улучшал сексуальное влечение по сравнению с E2/NETA и показал тенденцию к более значительному улучшению сексуальной функции [15]. Случаи влагалищных кровотечений и чувствительности/болезненности молочных желез встречались значительно реже на фоне приема тиболона, чем на фоне терапии E2/NETA или CEE/ MPA. Данные исследования конечных точек, включавших гистологию эндометрия и молочных желез на фоне терапии тиболоном в течение 2 лет в дозах 1,25 и 2,5 мг/сут без случаев гиперплазии эндометрия или рака в группе любой дозы [16]. Общее количество постменопаузальных пациенток составило 3240 (средний возраст – 54,4 года),в первой группе принимали тиболон (1,25 и 2,5 мг/сут), а во второй группе – CEE/MPA (0,625 и 2,5 мг/сут). После обработки данных авторы пришли к следующим выводам:
- тиболон не стимулирует эндометрий;
- не требует дополнительного приема гестагенов;
- частота аменореи высокая;
- частота кровянистых выделений из половых путей на фоне тиболона ниже, чем на фоне эстроген-прогестагенной терапии;
- стандартный контроль за состоянием эндометрия не требуется.
Повышенный риск инсульта, который еще более увеличивается с возрастом, наблюдался на фоне лечения тиболоном по сравнению с плацебо в исследовании LIFT [17]. Однако различия в абсолютном риске между группами лечения не были статистически значимыми, исследуемую популяцию составляли пациенты пожилого возраста (60–85 лет), и не наблюдалось никакого увеличения риска венозной тромбоэмболии. По сравнению с вышеуказанным исследованием риск развития инсульта не наблюдался в исследовании THEBES (средний возраст 54,4 года) и в исследовании Renoux C. и соавт. (средний возраст 70,3 года) [18], хотя число женщин, получавших тиболон, в последнем исследовании было небольшим. Исследователи, проводившие исследование LIFT, пришли к выводу, что тиболон не следует использовать женщинам пожилого возраста (>60 лет) или пациенткам, имеющим серьезные факторы риска развития инсульта, такие как АГ, курение, СД и фибрилляция предсердий [17].
В исследовании LIFT тиболон по сравнению с плацебо уменьшал риск развития РМЖ у женщин пожилого возраста, не имевших РМЖ в анамнезе [17].
Клиническое исследование LIBERATE было проведено с целью определения возможности назначения тиболона женщинам с РМЖ в анамнезе для облегчения симптомов менопаузы без увеличения риска их рецидива. Однако в данном исследовании был показан значительно более высокий риск рецидива РМЖ в группе тиболона по сравнению с группой плацебо, несмотря на тот факт, что большинство пациентов в исследуемой популяции получали адъювантную системную терапию. При включении в исследование пациентов из исследуемых популяций 66% получали тамоксифен, а 6% – ингибиторы ароматазы. Применение ингибиторов ароматазы увеличилось в ходе клинического исследования, и на момент завершения исследования около 80% получали адъювантную эндокринную терапию [14]. Анализы подгрупп позволили предположить, что негативное влияние тиболона у пациентов, получавших ингибиторы ароматазы, было более тяжелым, чем у пациентов, получавших тамоксифен, когда активация эстрогенных рецепторов эстрогенными метаболитами тиболона предотвращается за счет молекул гидрокси-тамоксифена с высоким сродством.
Исследователи пришли к выводу, что расхождения между этими данными и результатами исследования LIFT возникли потому, что обе исследуемые популяции различались во многих отношениях, включая гормональные факторы риска развития РМЖ, и потому что влияние тиболона на здоровые ткани МЖ, весьма вероятно, отличается от влияния на раковые клетки, так как тиболон может оказывать эстрогенное влияние на скрытые, «дремлющие» метастазы РМЖ. Согласно данным клинического исследования LIBERATE, тиболон противопоказан женщинам с установленным и предполагаемым РМЖ или при наличии РМЖ в анамнезе.
Исследование OPAL было посвящено изучению влияния тиболона на профилактику остеопороза и атеросклероза сонных артерий. Участники данного исследования были рандомизированы для получения тиболона, CEE/MPAи плацебо. Тиболон снижал уровень ОХС и ЛПВП в большей степени, чем плацебо, в то время как CEE/MPA увеличивал уровень ЛПВП [19]. Среднее увеличение толщины комплекса интима-медиа сонной артерии (ТКИМС), которое связано с риском развития ССЗ, было аналогичным при лечении тиболоном и CEE/MPA и более выраженным по сравнению с плацебо. Тем не менее, наблюдались несоответствия в данных по ТКИМС между европейской и американской когортами в этом исследовании [20]. Был сделан вывод о том, что ни один из препаратов не показал отрицательного или положительного влияния на развитие атеросклероза [19, 20]. В 5-летнем национальном когортном исследовании в Дании не было выявлено увеличения риска развития ИМ на фоне лечения тиболоном [21].
Согласно данным Я.З. Зайдиевой [25], прием тиболона способствует уменьшению толщины эндометрия. Показатели толщины маточного «эха» на фоне лечения тиболоном в течение 1 года снизились c 0,34 см (0,1–0,5) до 0,2 см (0,1–0,3). По данным гистологического исследования эндометрия установлено, что частота атрофии увеличилась с 72% (фон) до 91%, определение нефункционирующего эндометрия увеличилось с 15 до 3%. Случаев пролиферации и гиперплазии эндометрия выявлено не было.
С учетом клинических исследований азиатских женщин было опубликовано «Согласованное заявление по применению тиболона» в «Обновленных рекомендациях по применению тиболона у жительниц азиатских стран» (табл. 1).
Таблица 1
Согласованное заявление по применению тиболона и уровни подтверждающих доказательств [22]
| Обновленные заявления и/или новые доказательства, опубликованные, начиная с 2005 г. | Уровень доказательств |
|---|---|
| Тиболон является столь же эффективным, как и используемые в настоящее время режимы ЭПТ/ЭТ для лечения климактерических симптомов [23] | IB |
| Тиболон уменьшает местные вагинальные симптомы и лечит атрофию слизистой влагалища [23] | IB |
| Тиболон оказывает положительное влияние на сексуальное благополучие и является более эффективным, чем пероральная ЭПТ/ЭТ в некоторых отношениях, а именно: возбуждение, желание и удовлетворение [15, 23] | IB |
| Тиболон оказывает положительное влияние на настроение и качество жизни [15, 23] | IB |
| Тиболон предотвращает потерю костной массы и является настолько же эффективным, как и стандартные дозы ЭПТ/ЭТ, и более эффективным, чем ралоксифен [24] | IB |
| Тиболон снижает риск вертебральных и невертебральных переломов у пожилых женщин с остеопенией. Абсолютное снижение было более выражено у женщин, у которых в анамнезе уже отмечался вертебральный перелом, по сравнению с теми, у кого анамнез был не отягощен [17] | IB |
| Тиболон не оказывает стимулирующего влияния на эндометрий и не вызывает гиперплазию эндометрия или рак у женщин постменопаузального возраста в рандомизированных контролируемых клинических исследованиях и обладает более низкой частотой встречаемости кровотечений [12, 16, 23] | IB |
| Тиболон реже вызывал чувствительность МЖ или масталгию, чем ЭПТ [23] | IB |
| Тиболон не увеличивает маммографическую плотность | 2B |
| Тиболон, принимаемый женщинами с РМЖ в анамнезе, связан с повышением риска рецидивов РМЖ [14] | 1B |
| Тиболон в дозе 1,25 мг не увеличивал риск развития РМЖ у пожилых женщин с остеопорозом, не имевших РМЖ в анамнезе [16] | 1B |
| До сих пор не получено убедительных данных по конечным точкам относительно влияния тиболона на состояние ССС [17] | 1B |
| Тиболон оказывает влияние на липидный профиль, отличное от ЭПТ/ЭТ [19] | 1B |
| Тиболон увеличивает ТКИМС аналогично ЭПТ [19] | 1B |
| В одном рандомизированном контролируемом исследовании применение тиболона в дозе 1,25 мг у женщин пожилого возраста было связано с повышенным риском инсульта [17]. Следовательно, тиболон следует использовать с осторожностью пожилым женщинам (т. е. старше 60 лет) и не следует использовать пациентам, имеющим серьезные факторы риска инсульта | 1B |
| Тиболон не повышал риск развития инсульта, ВТЭ или ИМ в обсервационных исследованиях [18, 21] | 2B |
| * Определение уровня доказательств: 1B - отдельные рандомизированные клинические исследования; 2B -отдельные когортные исследования; ЭПТ - эстроген-прогестагенная терапия; ЭТ - эстрогенная терапия; ТКИМС - толщина комплекса интима-медиа сонной артерии; ВТЭ - венозная тромбоэмболия | |
Болдыревой Н.В. было установлено положительное влияние тиболона на увеличение МПК в поясничном отделе позвоночника (рис. 4) и в шейке бедра (рис. 5) [26]. В проведенном нами исследовании изучалось влияние тиболона на молочные железы, препарат принимался в течение 1 года. По данным исследования отмечалось положительное влияние тиболона на фиброзно-кистозную болезнь (рис. 6) [27].
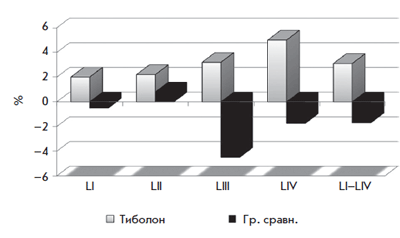
Рис. 4. Динамика МПК в поясничных позвонках на фоне тиболона
в течение 1 года у женщин в постменопаузе
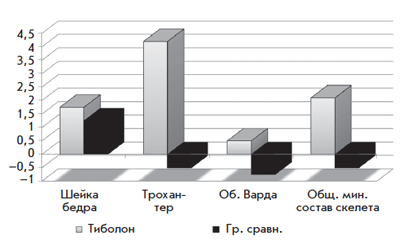
Рис. 5. Динамика МПК в проксимальном отделе бедра на фоне тиболона
в течение 1 года у женщин в постменопаузе
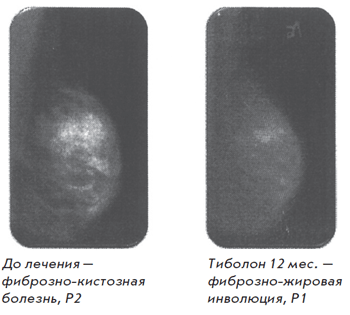
Рис. 6. Пациентка Г. И. П., 41 год
Известно, что на фоне МГТ могут наблюдаться мастодиния/масталгия и повышение маммографической плотности у 20–30% женщин, которые после 3 мес. приема уменьшаются или исчезают. Однако у части женщин на фоне длительной МГТ сохранялась масталгия/мастодиния, что может рассматриваться как своеобразный клинический маркер нарастания доброкачественных диффузных изменений молочных желез.
Наш собственный опыт перехода с эстрогенгестагенной МГТ на тиболон у подобных пациентов позволял добиться существенной положительной динамики в состоянии молочных желез. По данным маммографии отмечено нарастание инволюции, переход фиброзно-кистозной мастопатии в фиброзно-жировую инволюцию и уменьшение объема железистой ткани у 89% пациенток, что клинически сопровождалось значительным уменьшением субъективных ощущений [28].
Особенно выраженный положительный эффект отмечен у женщин после оварэктомии и со сниженным либидо (рис. 7).
Рис. 7. Влияние Тиболона на сексуальную функцию женщин в постменопаузе
Таким образом, имеющиеся клинические данные указывают на то, что женщины могут получить положительный эффект от перехода с МГТ на тиболон, если на фоне МГТ отмечались следующие симптомы:
1) усиление боли в молочных железах, несмотря на коррекцию дозы МГТ;
2) повышение плотности молочных желез, что привело к нечитабельности маммограмм;
3) низкое половое влечение;
4) расстройство настроения;
5) постоянные кровотечения (без каких-либо существующих гистопатологических причин).
В последние годы в России зарегистрирован дженерик оригинального препарата тиболона – ледибон (2,5 мг, Zentiva, Чехия). Препарат прошел полный цикл доклинических и клинических исследований. Патент и эксклюзивные права находились под защитой в течение 20 лет.
Препарат-дженерик – это лекарственный препарат, срок действия патентной защиты на который уже закончился, и он не является исключительной собственностью фармацевтической компании, которая его разработала или владела первой лицензией на его продажу. Копии – лекарственные препараты, которые представлены на рынках стран со слабой или отсутствующей патентной защитой химических молекул, а отсюда – активных ингредиентов лекарственных средств [29].
Дженерик содержит то же активное лекарственное вещество (активную субстанцию), что и оригинальный (патентованный) препарат, но отличается от него вспомогательными веществами (неактивными ингредиентами, наполнителями, консервантами, красителями и др.). Чтобы доказать, что дженерик такой же, как оригинальный препарат, необходимо доказать его эквивалентность.
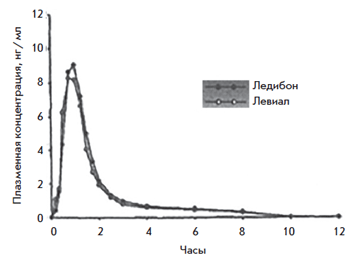
Рис. 8. Сопоставление концентрации 3α-гидрокситиболона
при однократном приеме Ледибона 2,5 мг vs Ливиала 2,5 мг
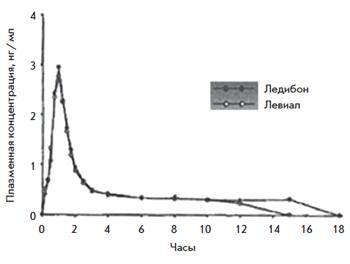
Рис. 9. Сопоставление концентрации 3β-гидрокситиболона при однократном приеме Ледибона 2,5 мг vs Ливиала 2,5 мг
Существует несколько разновидностей эквивалентности: фармацевтическая, биологическая и терапевтическая. Фармацевтическая эквивалентность – эквивалентность, при которой лекарственные препараты содержат одинаковые активные ингридиенты в одинаковой лекарственной форме, предназначены для одного способа введения и являются идентичными по силе действия или концентрации (активных веществ) [30].
Биологическая эквивалентность – эквивалентность, при которой лекарственные препараты имеют сравнимую биодоступность при исследовании в сходных экспериментальных условиях [30]. Терапевтическая эквивалентность – эквивалентность, при которой лекарственные препараты имеют одинаковую эффективность и безопасность [31]. Препарат считается биоэквивалентным оригинальному, если 90% средней AUC вещества входит в диапазон от 80 до 125% от средней AUC оригинального препарата [из правил регистрации дженериков GMP].
Изучение биоэквивалентности препарата Тиболон (Ледибон 2,5 мг vs Ливиал 2,5 мг)
В исследование, проведенное в Чехии в 2005 г., были включены женщины от 18 до 70 лет с естественной или хирургической постменопаузой. Изучалась концентрация 3α- и 3β-гидрокситиболона в плазме крови.
Исследование подтвердило биоэквивалентность ледибона (дженерик) и тиболона (оригинальный препарат) на основе оценки количества основных метаболитов. 90% средней AUC вещества входит в диапазон от 80 до 125% от средней AUC оригинального препарата. Необходимо продолжать накапливать данные о терапевтической эффективности.
Тиболон зарегистрирован в России в 1990 г., и клинический опыт применения его соответствует 25 годам. Применяется в 91 стране по основному показанию – лечение климактерических симптомов и в 55 странах – для профилактики остеопороза. В 2008 г. согласно международной анатомо-терапевтическо-химической классификации лекарственных средств (ВОЗ) тиболон переведен из группы G03D (прогестагенов) в группу G03CX (другие эстрогены). В 2005 г. в журнале Maturitas (51: 21–28) были опубликованы «Клинические рекомендации по применению тиболона». В 2010 г. в журнале Climacteric (4: 317–324) опубликованы «Клинические рекомендации по применению тиболона в странах Азии».
В последних клинических рекомендациях Международной ассоциации по менопаузе (2013) тиболон рекомендуется как средство профилактики и лечения постменопаузального остеопороза.
Заключение
Назначение тиболона (ледибон) предпочтительнее у женщин в постменопаузе, которые отмечают масталгию, нагрубание молочных желез, увеличение маммографической плотности и сексуальные проблемы, особенно после оварэктомии.
Противопоказания для терапии тиболоном такие же, как и для ЭПТ/ЭТ. Кроме того, тиболон следует назначать женщинам, не имеющим РМЖ в анамнезе. Пожилым женщинам (>60 лет) тиболон следует применять с осторожностью и он не должен использоваться пациентками, имеющими серьезные факторы риска развития инсульта. Список литературы 1. Kloosterboer H.J. Historical milestones in the development of tibolone (Livial®) // Climacteric. 2011 Dec; 14 (6): 609– 621.
2. Markiewicz L., Gurpide E. In vitro evaluation of estrogenic, estrogen antagonistic and progestagenic effects of a stero-idal drug (Org OD-14) and its metabolites on human endo-metrium // J Steroid Biochem. 1990 Apr; 35 (5): 535–541.
3. Tax L., Goorissen E.M., Kicovic P.M. Clinical profile of Org OD 14 // Maturitas. 1987; Suppl 1: 3–13.
4. Punnonen R., Liukko P., Cortes-Prieto J. et al. Multicen-tre study of effects of Org OD 14 on endometrium, vaginal cytology and cervical mucus in post-menopausal and oophorectomized women // Maturitas. 1984 Apr; 5 (4): 281–286.
5. Blom M.J., Wassink M.G., De Gooyer M.E. et al. Metabolism of tibolone and its metabolites in uterine and vaginal tissue of rat and human origin // J Steroid Biochem Mol Biol. 2006 Sep; 101 (1): 42–49.
6. Chetrite G., Kloosterboer H.J., Pasqualini J.R. Effect of tibo-lone (Org OD14) and its metabolites on estronesulphatase activity in MCF-7 and T-47D mammary cancer cells // Anticancer Res. 1997 Jan-Feb; 17 (1A): 135–140.
7. Colacurci N., Mele D., De Franciscis P. et al. Effects of ti-bolone on the breast // Eur J Obstet Gynecol Reprod Biol. 1998 Oct; 80 (2): 235–238.
8. Valdivia I., Ortega D. Mammographic density in postmeno-pausal women treated with tibolone, estriol or conventional hormone replacement therapy // Clin Drug Investig. 2000; 20 (2): 101–107.
9. Nathorst-Böös J., Hammar M. Effect on sexual life–a comparison between tibolone and a continuous estradiol-norethisterone acetate regimen // Maturitas. 1997 Jan; 26 (1): 15–20.
10. Kloosterboer H.J. Tissue-selectivity: the mechanism of action of tibolone // Maturitas. 2004 Aug 30; 48 Suppl 1: S30–40.
11. Reed M.J., Kloosterboer H.J. Tibolone: a selective tissue est-rogenic activity regulator (STEAR) // Maturitas. 2004 Aug 30; 48 Suppl 1: S4–6.
12. Nijland E.A., Nathorst-Böös J., Palacios S. et al. Improved bleeding profile and tolerability of tibolone versus trans-dermal E2/NETA treatment in postmenopausal women with female sexual dysfunction // Climacteric. 2009 Apr; 12 (2): 114–121.
13. Kenemans P., Speroff L. Tibolone: clinical recommendations and practical guidelines. A report of the International Tibolone Consensus Group // Maturitas. 2005 May 16; 51 (1): 21–28.
14. Kenemans P., Bundred N.J., Foidart J.M. et al. Safety and efficacy of tibolone in breast-cancer patients with vasomo- tor symptoms: a double-blind, randomised, non-inferiority trial // Lancet Oncol. 2009 Feb; 10 (2): 135–146.
15. Nijland E.A., Weijmar Schultz W.C., Nathorst-Böös J. et al. Tibolone and transdermal E2/NETA for the treatment of female sexual dysfunction in naturally menopausal women: results of a randomized active-controlled trial // J Sex Med. 2008 Mar; 5 (3): 646–656.
16. Archer D.F., Hendrix S., Gallagher J.C. et al. Endometrial effects of tibolone // J Clin Endocrinol Metab. 2007 Mar; 92 (3): 911–918.
17. Cummings S.R., Ettinger B., Delmas P.D. et al. The effects of tibolone in older postmenopausal women // N Engl J Med. 2008 Aug 14; 359 (7): 697–708.
18. Renoux C., Dell’aniello S., Garbe E. et al. Hormone replacement therapy use and the risk of stroke // Maturitas. 2008 Dec 20; 61 (4): 305–309.
19. Bots M.L., Evans G.W., Riley W. et al. The effect of tibolone and continuous combined conjugated equine oestrogens plus medroxyprogesterone acetate on progression of carotid intima-media thickness: the Osteoporosis Prevention and Arterial effects of tiboLone (OPAL) study // Eur Heart J. 2006 Mar; 27 (6): 746–755.
20. Clarkson T.B. Does tibolone exacerbate atherosclerosis? // Eur Heart J. 2006 Mar; 27 (6): 635–637.
21. Løkkegaard E., Andreasen A.H., Jacobsen R.K. et al. Hormone therapy and risk of myocardial infarction: a national register study // Eur Heart J. 2008 Nov; 29 (21): 2660–2668.
22. Huang K.E., Baber R. Asia Pacific Tibolone Consensus Group. Updated clinical recommendations for the use of tibolone in Asian women // Climacteric. 2010 Aug; 13 (4): 317–327.
23. Hammar M.L., van de Weijer P., Franke H.R. et al. Tibolone and low-dose continuous combined hormone treatment: vaginal bleeding pattern, efficacy and tolerability // BJOG. 2007 Dec; 114 (12): 1522–1529.
24. Delmas P.D., Davis S.R., Hensen J., Adami S. et al. Effects of tibolone and raloxifene on bone mineral density in os-teopenic postmenopausal women // Osteoporos Int. 2008 Aug; 19 (8): 1153–1160.
25. Зайдиева Я.З. Гормонопрофилактика и коррекция системных нарушений у женщин в перименопаузе [Текст]: Дис. ... докт. мед. наук: 14.00.01 / Зайдиева Янсият Зайдилаевна. М., 1997: 283: ил. Библиогр.: 244–283.
26. Болдырева Н.В. Гормонопрофилактика и терапия постменопаузального остеопороза [Текст]: Дис. ... канд. мед. наук: 14.00.01 / Болдырева Наталья Владимировна. М., 1998: 143: ил. Библиогр.: 129–143.
27. Новикова О.В. Состояние органов репродуктивной системы при длительном использовании заместительной гормонотерапии у женщин в постменопаузе [Текст]: Дис. ... канд. мед. наук: 14.00.01 / Новикова Ольга Валерьевна. М., 2002: 213: ил. Библиогр.: 189–213.
28. Медицина климактерия / Под ред. В.П. Сметник. Ярославль: Литера, 2006: 290–348.
29. Policy Relating to Generic Medicines in the OECD. Final report for the European Commission. NERA, S.J. Berwin&Co, YRCR Ltd., December, 1998.
30. FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000.
31. Методические рекомендации по проведению качественных клинических исследований биоэквивалентности лекарственных препаратов. МЗ РФ, 2001.
