Магнитная симпатокоррекция в лечении энуреза у детей
СтатьиОпубликовано в журнале:
«Практика педиатра», 2011 С.М. Шарков, С.П. Яцык, НУЗД РАМН; Т.В. Отпущенникова, МЗ Сартовской области; Ю.М. Райгородский, ООО "ТРИМА" (г. Саратов)
Энурез, или непроизвольное мочеиспускание, как правило, относят к нейрогенным дисфункциям мочевого пузыря (НДМП), которые проявляются разнообразными нарушениями его резервуарной и эвакуаторной функции. Механизмы регуляции мочеиспускания могут нарушаться на разном уровне: от коры головного мозга до интрамурального отдела [2].
Распространенность ночного энуреза (НЭ) у детей в возрасте от 3 до 5 лет велика и составляет 10–20%, снижаясь к 10-летнему возрасту до 6–12% [13].
Многочисленными исследованиями доказано участие симпатической нервной системы (СНС) в патогенезе расстройств мочеиспускания у взрослых, которые нередко развиваются на фоне артериальной гипертонии, метаболического синдрома. В патогенезе этих расстройств большое значение имеет симпатическая гиперактивность [8, 10]. Изменения резервуарной функции мочевого пузыря (МП) при повышенной активности СНС свидетельствует о том, что этому отделу вегетативной нервной системы (ВНС) принадлежит существенная роль в регуляции функции детрузора в фазе накопления. Объясняется это симпатической вазоконстрикцией и нарушениями пузырного кровообращения с которым связан энергетический метаболизм любого органа [3].
Медикаментозные методы лечения НЭ у детей являются доминирующими и направлены на расслабление гладкой мускулатуры детрузора, увеличение объема мочевого пузыря, а также на уменьшение образования мочи в ночное время. Набор лекарственных средств, разрешенных к использованию у детей, ограничен в первом случае антихолинолитиком оксибутинином (Дриптан), а во втором – гормональным препаратом адиуретином (Миринин) [7, 12]. Кроме того, наличие побочных эффектов у данных препаратов (головокружение, головная боль, тошнота, раздражительность, расстройство сна, двигательная расторможенность) и необходимость их длительного приема (2–3 месяца) требуют поиска иных подходов к лечению.
НЕМЕДИКАМЕНТОЗНАЯ КОРРЕКЦИЯ
Попытки немедикаментозной коррекции функции детрузора у детей с энурезом нами предпринимались и дали положительные результаты [12]. При этом есть основания полагать, что эффект обусловлен как коррекцией повышенной активности СНС, так и улучшением микроциркуляции в области малого таза [6, 10]. Это свидетельствует о перспективности дальнейшего изучения и расширения методов немедикаментозной коррекции НДМП, особенно у детей, где набор лекарственных средств строго ограничен, а использование разрешенных средств, особенно центрального действия, часто ведет к рецидиву заболевания после прекращения лечения [7].
Успешное применение транскраниальных методик магнито- и электровоздействия с помощью аппарата «АМО-АТОС-Э» у детей при НДМП побуждает к их совершенствованию [9, 11, 12]. Одним из вариантов снижения гиперфункции СНС может быть мягкое воздействие магнитным полем на шейные симпатические ганглии, которые откликаются на более грубое воздействие электрическим током; оно используется для подавления гиперактивности СНС в комплексе лечения многих заболеваний [4]. Целью исследования явилась оценка эффективности комбинированного воздействия бегущим магнитным полем транскраниально и на шейные симпатические ганглии для лечения энуреза при минимальном использовании лекарственных средств.
КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ
В исследование были включены 92 ребенка в возрасте от 6 до 15 лет (60 мальчиков и 32 девочки) с жалобами на ночное недержание мочи и учащенное мочеиспускание в дневное время. Средний возраст составил 9,4 года. Всем больным проводились уронефрологическое и неврологическое обследование, ультразвуковое исследование почек и мочевого пузыря. Для характеристики клинических признаков синдрома императивного мочеиспускания использовали опросник Е.Л. Вишневского, который в баллах оценивает степень позыва на мочеиспускание, императивного недержания мочи, НЭ, поллакиурию, ноктурию, уменьшение среднего эффективного объема МП, наличие и выраженность лейкоцитурии. Балльная оценка в диапазоне 0–45 баллов предусматривает 3 степени тяжести синдрома императивного мочеиспускания: легкую (1–10 баллов), среднюю (11–20 баллов) и тяжелую (более 21 балла).
Регистрировали ритм мочеиспусканий. С учетом значимости вегетативной регуляции в патогенезе НДМП исследовали состояние ВНС по данным кардиоинтервалографии (КИГ) [3]. Регистрировали 300 последовательных кардиоциклов в положении лежа и 100 кардиоциклов при ортостатической пробе. Исходный вегетативный тонус оценивали по индексу напряжения в горизонтальном положении, активность подкорковых нервных центров (АПНЦ) – по данным спектрального анализа. Фиксировали общую мощность спектра (ОМС), долю в спектре высокочастотных (ВЧ), низкочастотных (НЧ) и очень низкочастотных (ОНЧ) колебаний как маркер уровня адаптационных резервов. Снижение ОМС и ОНЧ расценивается как неблагоприятное изменение общих адаптационных возможностей организма [1].
Все исследования проводили до лечения и спустя месяц после окончания курса терапии. Отдаленные результаты оценивали через 6 месяцев. В исследование не включались больные с инфравезикальной обструкцией, неврологическими и иммунными заболеваниями, а также с воспалительными заболеваниями нижних мочевыводящих путей.
У большинства детей дисфункция МП с НЭ отмечалась с раннего возраста без «сухого» периода (48 чел., 52,2 %), у остальных давность заболевания колебалась от 3 месяцев до 3 лет. Различная патология мочевыводящей системы (пузырно-мочеточниковый рефлюкс, аномалии строения почек, нарушения обмена) выявлена у 38 (41,3 %) пациентов. Перинатальные поражения (асфиксия в родах, родовая травма, недоношенность) определены у 52 (56,5 %) обследованных детей.
При первичном обследовании детей на этапе оценки вегетативного статуса с помощью КИГ больных набирали таким образом, чтобы количество детей с разным вегетативным статусом было сопоставимо. При этом группы формировали из детей с различным вегетативным статусом рандомизированно. В результате было сформировано 3 группы. В первую (контрольную) группу попало 32 ребенка, которым оксибутинин (Дриптан) назначался в минимальной дозировке (2,5 мг 1 раз в день вечером), витамины группы В и плацебопроцедуры магнитной симпатокоррекции (МС) и транскраниальной магнитотерапии (ТкМТ), которые чередовали через день (соленоиды выключены). Вторая группа состояла из 30 детей, которым кроме медикаментозной терапии (аналогично группе 1) проводилась магнитная симпатокоррекция путем воздействия бегущим магнитным полем (БМП) на проекцию шейных симпатических ганглиев. Третья группа состояла также из 30 детей, у которых магнитная симпатокоррекция комбинировалась через день с транскраниальной магнитотерапией по битемпоральной методике.
Использованная для МС и ТкМТ воздействия аппаратура состояла из базового аппарата «АМО-АТОС-Э» (ООО «ТРИМА», г. Саратов; регистрационное удостоверение № ФСР 2009/04781) для магнитотерапии с помощью БМП. В состав аппарата входит несколько типов аппликаторов: оголовье выполненное в виде 2 терминалов облегающих височно-затылочные области головы; гибкий ленточный излучатель, оборачиваемый вокруг шеи пациента.
Выбор ТкМТ как дополнительного средства основывался на полученных ранее положительных результатах и способствующей нормализации электрогенеза головного мозга [11, 12]. В каждом аппликаторе имеется по 6 соленоидов (излучателей магнитного поля), последовательным включением которых управляет блок аппарата. Частота переключения соленоидов (частота движения поля) варьируется в диапазоне 1–16 Гц, что позволяет работать как на частоте нормального ритма ЧСС, так и альфа-ритма ЭЭГ мозга. Курс физиолечения состоял из 16 ежедневных сеансов, по окончании которых прием оксибутинина продолжался до завершения месячного периода. Спустя месяц и 5 месяцев исследования повторялись. Полученные данные статистически обрабатывались с помощью пакета прикладных программ XL Statistika 4.0.
Рисунок 1
Распределение детей по типам вегетативного статуса до и после лечения

I – симпатикотония, II – нормотония, III – ваготония * достоверные различия (р < 0,05) между показателями до и после лечения ** достоверные различия (р < 0,05) между группой контроля
РЕЗУЛЬТАТЫ
Исходно, по результатам КИГ, в группах 1, 2 и 3 в вегетативном статусе детей преобладала симпатикотония – соответственно 19, 17 и 20 детей (от 56,6 до 66,6%), нормотония наблюдалась от 15,6 до 25,5 %, ваготония – от 17,8 до 28,6 %. После лечения у большинства больных отмечена положительная динамика в изменении вегетативного статуса в сторону нормализации (рис. 1).
При этом основное увеличение числа детей с нормотонией и уменьшение с симпатикотонией получено в группе 2 (на 36,7 и 33,3% соответственно). Дополнительное увеличение этих значений (на 10 и 6,6%) наблюдалось в группе 3 за счет использования ТкМТ. В контрольной группе не произошло каких-либо значимых изменений в результате лечения.
Из общего количества исходно обследованных детей только 27 (29,3%) имели нормальную АПНЦ, а 52 (56,5%) усиленную. После лечения число детей в группе 2 с нормальной АПНЦ увеличилось с 9 до 19 (на 33%), в группе 3 – с 7 до 20 детей (на 43,3%). В контрольной группе увеличение составило 12,5%.
У детей с нормализованной АПНЦ зафиксированы изменения показателей ритмограммы, которые свидетельствуют о повышении адаптационных резервов организма. Так, доля ОНЧ-колебаний в спектре снизилась с 46,2 ± 3,9 до 28,3 ± 2,2%, доля НЧ-колебаний увеличилась с 26,5 ± 1,8 до 31,3 ± 1,3%.
На фоне изменения вегетативного статуса наблюдались выраженные изменения в клинической картине императивного мочеиспускания. При этом балльная оценка в группах 2 и 3 существенно опережала соответствующие значения в контрольной группе (табл.). Базовая терапия с однократным приемом оксибутинина в течение суток в минимальной дозировке позволила устранить симптомы НДМП и НЭ у 31,2% больных. Та же терапия на фоне МС увеличила число детей до 63,3 %, а дополнительное использование ТкМТ – до 76,6%. Спустя 6 месяцев результаты в группе 3 улучшились до 25 (83,3%) детей без энуреза, во группе 2 сохранились на достигнутом уровне, а в группе 1 ухудшились до 8 (25%). Полученные результаты можно объяснить коррекцией активности СНС в группах 2 и 3, улучшением психоэмоционального статуса пациентов и адаптационных резервов их ЦНС. Об этом свидетельствует анализ АПНЦ и ОМС. После лечения в группах 2 и 3 число детей с нормальной АПНЦ увеличилось с 27,1 до 65%. При этом в группе 3 увеличение было более выраженным по сравнению с группой 2 (28 детей против 11). Доля ОНЧ-колебаний в спектре снизилась с 44,2 ± 3,2 до 25,3 ± 2,3% (р < 0,05) в группах 2 и 3, а доля НЧ-колебаний увеличилась с 25,5 ± 1,8 до 30,4 ± 1,3% (р < 0,05). Полученные результаты свидетельствуют о двойственном, хотя и связаном между собой, механизме действия магнитотерапии. Магнитная симпатокоррекция улучшает вегетативный статус снижая напряжение СНС, а ТкМТ, воздействуя на корковые и подкорковые структуры, улучшает микроциркуляцию в области мочевого пузыря и биоэлектрогенез ЦНС [5, 11].
Благодаря использованию МС среднеэффективный объем мочевого пузыря увеличился со 108 до 158 мл (на 46,2%), а с добавлением ТкМТ – со 102 до 178 мл (на 71,1%). Спустя 6 месяцев отмечено некоторое снижение достигнутых показателей, которое было статистически значимым (р = 0,02) только для группы 1, а в остальных группах оставалось практически на уровне достигнутом в 1-й месяц (рис. 2). Число среднесуточных мочеиспусканий снизилось во группе 2 с 9,2 до 6,5 (на 29,3%) (р < 0,05). В группе 1 эти значения уменьшились с 9,5 до 8,8 (р = 0,11).
Одновременно с купированием симптомов основного заболевания наблюдалось улучшение психовегетативных реакций, сна, настроения, успеваемости в школе. Побочных реакций не наблюдалось. В одном случае на фоне ТкМТ сразу после процедуры наблюдалось некоторое снижение артериального давления и связанное с ним головокружение, которое прекратилось после 10 минутного отдыха в горизонтальном положении (этому ребенку было рекомендовано проводить процедуры лежа, остальным процедуры проводились в положении сидя).
Таблица
Динамика распределения больных по степени тяжести синдрома императивного мочеиспускания (в баллах, по Е.Л. Вишневскому)
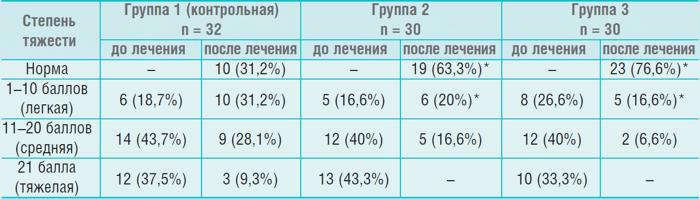
*р < 0,05 относительно контроля
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют о коррегирующем влиянии бегущего магнитного поля, действующего в проекции шейных симпатических ганглиев на основные симптомы НДМП и НЭ. Данная методика является эффективным и безопасным дополнением к лекарственной терапии (в минимальных дозировках) и обеспечивает терапевтический эффект НЭ на уровне 63,3%. Добавление к этому воздействию транскраниальной магнитотерапии путем ежедневного чередования увеличивает эффективность лечения до 76,6%, одновременно облегчая симптомы заболевания. С помощью аппарата «АМОАТОС-Э» предлагаемый метод легко реализуется в амбулаторных условиях. Список использованной литературы находится в редакции.
Рисунок 2Динамика изменения среднеэффективного объема мочевого пузыря при использовании различных вариантов лечения
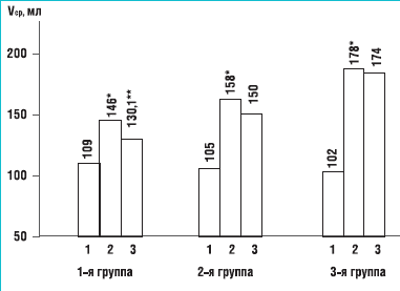
1 – до лечения, 2 – спустя 1 месяц после лечения, 3 – спустя 6 месяцев после лечения * р < 0,05 – достоверность различий с исходными значениями ** р < 0,05 – достоверность различий с результатами полученными спустя месяц после лечения

