Макролиды: новая парадигма - фармакодинамика / иммуномодуляция
СтатьиОпубликовано в журнале:
Клиническая фармакология и терапия, 2005, 14 (5)
О.И.Карпов
Институт фармакологии Санкт-Петербургского государственного медицинского университета им. акад. И.П.Павлова
Кажется, еще относительно недавно в качестве базисного понятия эффективного эрадикационного лечения во врачебный обиход вошел термин "взаимосвязь фармакодинамики/фармакокинетики антибиотиков", объясняющий принципы рационального назначения противомикробных средств. Успешное клиническое преломление термина существенно повысило интерес к фармакологии, как к практической дисциплине, и позволило продолжить научные поиски в направлении аспектов фармакодинамики многих уже известных антибиотиков. Теперь пришло время заявить о результатах новых исследований, требующих внедрения в лечебный процесс. Речь идет об экспериментально и клинически доказанном позитивном иммуномодулирующем действии некоторых антибиотиков макролидной группы: инфекционный процесс протекает на фоне различных, в том числе неблагоприятных, изменений в иммунной системе. Следует признать, что большая часть назначаемых иммуномодуляторов является таковыми лишь виртуально, без весомых доказательств клинического эффекта. Открытие позитивного воздействия макролидов на угнетенные звенья иммунитета является прорывом в науке и, как справедливо полагают, даст этим антибиотикам "второе дыхание" [1].
Влияние на иммунную систему проявляется в диапазоне обычных доз азитромицина, кларитромицина, рокситромицина и эритромицина. Гораздо меньше сведений о влиянии джозамицина и новых кетолидов, родственной макролидам группы. Это дает возможность утверждать, что внеантибиотический эффект большинства макролидов имеет характер парадигмы, которую мы условно назовем "взаимосвязь фармакодинамики/иммуномодуляции".
Макролиды в высоких концентрациях накапливаются в воспаленных клетках, включая фагоциты, которые быстро доставляют антибиотики в очаг инфекции. Особенно следует отметить свойства азитромицина (Сумамеда), который обнаруживается в воспаленных тканях уже через несколько часов после приема и сохраняется в высоких "эрадикационных" концентрациях в течение нескольких дней [2]. Указанное свойство позволило использовать препарат сначала коротким 3-дневным курсом, а в последнее время и однократно у взрослых и детей [3,4].
Воздействие макролидов на иммунную систему начинается с подавляющего влияния на диапедез активированных липополисахаридами бактерий лейкоцитов в инфекционном очаге. Благодаря этому уменьшается избыточная индурация тканей, которая может позднее привести к замещению соединительной тканью [5]. Лейкоциты движутся в ткани под влиянием хемотаксических факторов. Азитромицин, в отличие от некоторых других макролидов, например, кларитромицина, уже на раннем этапе способен подавлять продукцию интерлейкина-8, индуцирующего трансэндотелиальную миграцию нейтрофилов и моноцитов [6]. Азитромицин также обладает дополнительным опосредованным действием, замедляя процесс миграции лейкоцитов путем подавления специальной киназы, осуществляющей диапедез [7].
Азитромицин характеризуется самой высокой степенью проникновения в полиморфноядерные нейтрофилы и значительно дольше задерживается в них, что способствует более выраженному усилению фагоцитоза и антиинфекционной защиты [8]. Кларитромицин, эритромицин и телитромицин, по-видимому, удаляются из моноцитов своеобразной "эффлюксной" помпой, причина чего пока не установлена. Достоверно известно, что в отличие от азитромицина, действие указанных макролидов неспецифично и вследствие "эффлюкса" не продолжительно. С этой точки зрения азитромицин, оказывающий длительное и избирательное действие, способен в большей степени влиять на воспаление, в том числе хроническое или длительно текущее.
Азитромицин вызывает дегрануляцию нейтрофилов [9], доказательствами которой являются повышение уровня лизосомальных ферментов в плазме крови и снижение их активности в макрофагах после приема первой дозы азитромицина. После стандартного курса антибиотикотерапии (по 500 мг азитромицина в сутки в течение 3 дней) уровень ферментов в крови остается какое-то время высоким, и одновременно - по механизму обратной связи - происходит накопление гранул в нейтрофилах, обеспечивающее пролонгацию антиинфекционной защиты (рис. 1). В дополнение к клиническим данным, полученные результаты являются также и биохимическим доказательством достаточности 3-дневного курса терапии азитромицином для скептиков. Одновременно с повышением уровня лизосомальных ферментов индуцируется хемотаксис макрофагов - целенаправленное движение в сторону инфекционного очага [10]. Таким образом, происходит существенное повышение антиинфекционного барьера через вовлечение новых пулов лейкоцитов и активацию их функции.
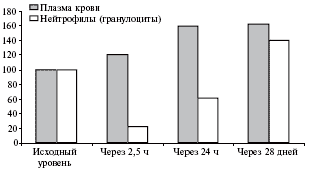
Рис. 1. Уровень (%) лизосомальных ферментов (N-ацетил-β-глюкозаминидазы) при приеме азитромицина по 500 мг/сут в течение 3 дней (*р<0,01 по сравнению с исходным уровнем) [9]
Отличительной чертой действия азитромицина является стимуляция "оксидативного взрыва" в макрофагах - потребления кислорода, необходимого для получения энергии и осуществления функций макрофагов. Этот эффект достаточно длительный и обеспечивает активацию фагоцитов (рис. 2), но угасает вовремя, не вызывая повреждения клеток хозяина и, что очень важно, эпителия бронхов [12]. Эта так называемая "ранняяреакция" иммуномодуляции присуща только азитромицину.
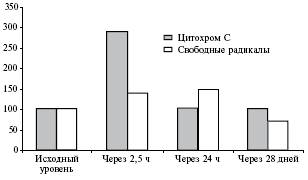
Рис. 2. Содержание (%) цитохрома С в нейтрофилах (отражает степень оксидативного взрыва) и свободных радикалов в плазме крови при приеме азитромицина по 500 мг/сут в течение 3 дней (* р<0,01 по сравнению с исходным уровнем) [9]
Макролиды восстанавливают баланс Т-хелперов различных типов и поддерживают их функции [15,16]. Указанный эффект имеет большое значение для регуляции синтеза провоспалительных цитокинов, уменьшая прессинг на клетки хозяина, снижая отек и препятствуя формированию застойной лимфоцитарной индурации.
Большинство изученных макролидов позитивно действуют на бронхиальный эпителий, слизистую оболочку полости носа и гайморовых пазух. Установлено, что рокситромицин уменьшает продукцию муцина в бронхах, что обусловлено его подавляющим эффектом на ряд стимулирующих слизеобразование факторов (в частности, NFkB) [17].
В основе эффектов азитромицина лежат несколько иные механизмы: уменьшение продукции фактора некроза опухоли, поддерживающего выработку муцина в качестве агента воспаления бронхиального эпителия [18].
Исключительно важной является не только стимуляция иммунной защиты, но и прекращение активации иммунитета по мере стихания инфекционного процесса. Уникальными с этой точки зрения являются возможности только азитромицина: после санации инфекции он фактически останавливает уже ненужную иммунную "атаку". Как это происходит? Азитромицин в этот период активирует апоптоз (биологически запрограммированную гибель) нейтрофилов [19]. Он подавляет процессы локального повреждения и препятствует вовлечению клеток хозяина в иммунный ответ. Описываемый эффект продемонстрирован у добровольцев и больных внебольничной пневмонией, вызванной пневмококком [20].
В целом иммуномодулирующий механизм действия азитромицина представлен на рис. 3.
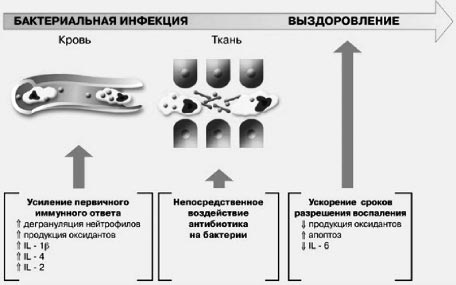
Рис 3. Основные эффекты иммуномодуляции инфекционного процесса азитромицином. Слева - ранняя фаза, в середине - антибиотическое действие, справа - поздняя фаза
Каковы же клинические точки приложения иммуномодуляции в практике врача? Начнем с инфекций верхних дыхательных путей: согласно нашим наблюдениям, азитромицин уменьшает симптомы (заложенность носа, отек носовых ходов, болезненность при надавливании в проекции пазух носа и др.) быстрее, чем защищенные пенициллины или пероральные цефалоспорины [21], что, вероятно, объясняется противовоспалительными свойствами препарата. В данную концепцию укладывается отсутствие рецидивов заболевания при длительном наблюдении за выздоровевшими пациентами. Использование краткосрочной терапии азитромицином и продолжительных курсов лечения другими макролидами стало возможным благодаря тому, что макролиды поздних генераций признаны наиболее безопасными антибиотиками для пациентов различных возрастных групп [23].
Макролидные антибиотики значительно снижают число лимфоцитов в бронхоальвеолярном смыве у больных с хронической обструктивной болезнью легких (ХОБЛ). При выраженном воспалении макролиды усиливают апоптоз, в отличие от фосфомицина, бета-лактамных антибиотиков, а также фторхинолонов [24].
Длительная (в течение нескольких месяцев) терапия азитромицином у взрослых и детей с муковисцидозом улучшала показатели проходимости дыхательных путей, уменьшая как количество образующейся бронхиальной слизи, так и ее качественный состав, что позволяло лучше откашливать образующуюся мокроту [30]. Следует отметить, что при муковисцидозе происходит колонизация дыхательных путей синегнойной палочкой, продуцирующей альгинат, который покрывает пленкой колонии микробов и делает их недоступными для анти-синегнойных антибиотиков. Макролиды нарушают продукцию альгината, лишая тем самым P. aeruginosa защитного покрытия, в результате чего улучшаются результаты лечения антисинегнойными противомикробными средствами.
При бронхиальной астме применение кларитромицина в течение 8 недель в сравнении с плацебо приводило как к значительному уменьшению числа эозинофилов в крови и тканях и вязкости бронхиальной слизи, так и к снижению числа приступов удушья, продолжительности удушья в ночное время, а также к улучшению показателей функции внешнего дыхания [28].
В плацебоконтролируемом исследовании применение рокситромицина в течение 12 недель у детей с бронхоэктатической болезнью вызывало уменьшение количества бронхиальной слизи, числа лейкоцитов в бронхо-альвеолярном смыве и небольшому, но достоверному улучшению функции легких [29]. Следует отметить, что причиной изменений частоты обострений заболеваний под действием некоторых фторхинолонов, вероятно, являются механизмы, отличные от иммуномодуляции [25,26]. Одним из самых животрепещущих вопросов является реализация иммуномодулирующего эффекта макролидов при внебольничной пневмонии вследствие скоротечности инфекции и социальной значимости указанной патологии. В последнее время все чаще обсуждается вопрос о сочетанном назначении макролидов с бета-лактамами при тяжелом течении заболевания, поскольку имеются весомые доказательства снижения летальности и продолжительности госпитализации, которые имеют отчетливое фармакоэкономическое значение [31]. При этом "временное окно", в течение которого должны быть назначены антибиотики, все время сужается. Полагают, что наилучшие результаты достигаются в том случае, если антибиотикотерапию начинают в течение не более 8 ч от начала заболевания. Из представленной выше взаимосвязи фармакодинамики/иммуномодуляции следует, что эффективность макролидов может быть обусловлена не только их антибактериальными свойствами, но и противовоспалительным эффектом. Характерная для азитромицина быстрота наступления указанного эффекта позволяет высказаться за безусловное включение этого антибиотика в схемы ведения таких больных.
Невозможно обойти вниманием важный вопрос, который уже поднимался нами неоднократно [32]. Речь идет о тождественности генериков оригинальным препаратам, которая, как известно, не всегда имеется. Все данные по иммуномодулирующему эффекту макролидов, опубликованные в этом обзоре, относятся исключительно к оригинальным препаратам и не подлежат автоматическому распространению на все другие имеющиеся в реестре средства, являющиеся генерическими.
Заключение
- Представленные в обзоре доказательства убеждают в актуальности и клинической эффективности терапии макролидными антибиотиками в качестве базового средства для лечения респираторных и иных инфекций. Периодически раздаются голоса, пугающие возрастающей резистентностью тех или иных патогенов, хотя ответ очевиден - для этих антибиотиков не подходит такая же мерка, как например для бета-лактамов: какой результат в чашке Петри, такой же и in vivo.
- Макролиды имеют уникальную внутриклеточную фармакодинамику и фармакокинетику, знания о которых постоянно пополняются новыми фактами.
- Многогранность действия азитромицина (Сумамеда) в сочетании с безопасностью, высокой приверженностью пациентов к лечению, наличие форм для внутривенного и перорального приема создают все условия для успешного применения препарата во всех возрастных категориях пациентов.
Литература
- Синопальников А.И. Новые горизонты применения макролидов при инфекциях дыхательных путей. Рос. мед. вести, 2004, 2, 16-22.
- Girard D., Finegan S., Dunne M., Lame M. Enhanced efficacy of single-dose versus multi-dose azithromycin regimens in preclinical infection models. J. Antimicrob. Chemother., 2005, 56 (2), 365-371.
- Karpov O.I. Single 1,5 g azithromycin dose in the treatment of tonsillitis in adults, a pilot study. Abstr. 4th Confer. ICMAS, Seville, Spain, 2000, 38.
- Харламова Ф.С., Богомильский М.Р., Гаращенко Т.И. и др. Короткие курсы азитромицина в лечении осложненных форм острых респираторных заболеваний у детей. Пособие для врачей. М.: МЗ РФ, 2004, 20 с.
- Parnham M. Immunomodulatory effects of antimicrobials in the therapy of respiratory tract infections. Curr. Opin. Infect. Dis., 2005, 18, 125-131.
- Uriate S., Molestina R., Miller R. et al. Effect of macrolide antibiotics on human endothelial cells activated by Chlamydia pneumoniae infection and tumor necrosis factor-alfa. J. Infect. Dis., 2002, 185, 1631-1636.
- Tsai W., Rodriguez M., Young K. et al. Azithromycin blocks neutrophil recruitment in Pseudomonas endobronchial infection. Am. J. Respir. Crit. Care. Med., 2004, 170, 1331-1339.
- Bosnar M., Kelneric Z., Munic V. et al. Cellular uptake and efflux of azithromycin, erythromycin, clarithromycin, telithromycin, and cethromycin. Antimicrob. Agents. Chemother., 2005, 49 (6), 2372-2377.
- Culic O., Erakovic V., Cepelak I. et al. Azithromycin modulates neutrophil function and circulating inflammatory mediators in healthy human subjects. Eur. J. Pharmacol., 2002, 450, 277-289.
- Labro M.T. Interference of antibacterial agents with phagocytic functions: immunomodulation or "immuno-fairy tales." Clin. Microbiol. Rev., 2000, 13, 615-660.
- Parnham M. Antibiotics, inflammation and its resolution: an overview. In: Rubin В., Tamaoki J. Eds. Antibiotics as anti-inflammatory and immunomodulatory agents. Basel: Birk. Verlag., 2004, 27-48.
- Amsden G. Anti-inflammatory effects of macrolides - an underappreciated benefit in the treatment of community-acquired respiratory tract unfections and chronic inflammatory pulmonary conditions? J. Antimicrob. Chemother., 2005, 55 (1), 10-21.
- Tamaoki J., Kadota J., Takizawa H. Clinical implications of the immunomodulatory effects of macrolides. Am. J. Med., 2004, 117 (Suppl. 9A), 5S-11S.
- Basyigit I., Yildiz R, Ozkara S. et al. The effect of clarithromycin on inflammatory markers in chronic obstructive pulmonary disease: preliminary data. Ann. Pharmacother., 2004, 38 (9), 1400-1405.
- Ortega E., Escobar M.A., Gorio J. et al. Modification of phagocytosis and cytokine production in peritoneal and splenic murine cells by azithromycin and josamycin. J. Antimicrob. Chemother., 2004, 53, 367-370.
- Pukhalsky A.L., Shmarina G.V., Kapranov N.I. et al. Anti-inflammatory and immunomodulating effects of clarithromycin in patients with cystic fibrosis lung disease. Med. Inflamm., 2004, 13, 111-117.
- Kim D.Y., Takeuchi K., Ishinaga H. et al. Roxithromycin supresses mucin gene expression in epithelial cells. Pharmacology, 2004, 72, 6-11.
- Shimuzu Т., Shimuzu S., Hattori R. et al. In vivo and in vitro effects of macrolide antibiotics on mucus secretion in airway epthelilal cells. Am. J. Respir. Crit. Care. Med., 2003, 168, 581-587.
- Kadota J., Mizunoe S., Kishi K. et al. Antibiotic-induced apoptosis in human activated peripheral lymphocytes. Int. J. Antimicrob. Agents, 2005, 25 (3), 216-220.
- Rolling U., Hansen R, Braun J. et al. Leucocyte response and anti-inflammatory cytokines in community-aquired pneumonia. Thorax, 2001, 56, 121-125.
- Карпов О.И. Сравнительная клинико-экономическая эффективность макролидов при остром синусите. Клин, фармакол. тер., 2004, 1, 23-26.
- Ragab S., Lund V., Scadding J. Evaluation of the medical and surgical treatment of chronic rhinosinusitis: a prospective, randomized, controlled trial. Laryngoscope, 2004, 114, 923-930.
- Карпов О.И. Комплаенс антибиотикотерапии инфекций дыхательных путей. Антибиотики и химиотерапия, 1999, 8, 37-45.
- Kadota J., Mizunoe S., Kishi К. et al. Antibiotic-induced apoptosis in human activated peripheral lymphocytes. Int. J. Antimicrob. Agents, 2005, 25 (3), 216-220.
- Карпов О.И. Макролиды при обострении хронического бронхита: есть ли перспективы? Consilium Medicum, 2005, 7 (4), 281-284.
- Дворецкий Л.И. Респираторные фторхинолоны в лечении обострений хронического бронхита. Consilium Medicum, 2005, 7 (4), 284-289.
- Preheim L., Olsen К, Yue M. et al. Effect of cirrhosis on antibiotic efficacy in a rat model of pneumococcal pneumonia. Diagn. Microbiol. Infect. Dis., 2005, 51 (2), 103-111.
- Amayasu H., Yoshida S., Ebana S. et al. Clarithromycin supresses bronchial hyperresponsiveness associated with eosinophilic inflammation in patient with asthma. Annals. Allergy. Asthma. Immunol., 2000, 84, 594-598.
- Koh Y, Lee M., Sun Y et al. Effect of roxithromycin on airway responsiveness in children with bronchiectasis: a double-blind, placebo-controlled study. Europ. Resp. J., 1997, 10, 994-999.
- Saiman L., Marshall В., Mayer-Hamblett N. et al. Azithromycin in patients with cystic fibrosis chronically infected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA, 2003, 290, 1749-1756.
- Карпов О.И. Перспективы применения современных макролидов. Кремлевская медицина. Клинический вестник, 2005, 1, 23-28.
- Карпов О.И. Оригинальные препараты и копии макролидов: тенденции противостояния. Фарматека, 2004, 3-4, 83-87.
Комментарии
ПРАКТИКА ПЕДИАТРА
