Фармакоэкономическая оценка эффективности препаратов железа при коррекции анемии в ходе подготовки пациентов к обширным плановым оперативным вмешательствам
Статьик.ф.н. Ряженов В.В.*, д.м.н. проф. Горохова С.Г.**, Емченко И.В.***
*Первый МГМУ им. И.М. Сеченова, кафедра фармакологии и фармацевтической технологии
** Первый МГМУ им. И.М. Cеченова, кафедра семейной медицины
*** Первый МГМУ им. И.М. Сеченова, кафедра организации и экономики фармации
Адекватная терапия анемии у хирургических больных относится к важнейшим задачам, решаемым в предоперационном периоде врачами различных специальностей. Это обусловлено широкой распространенностью анемии в хирургической практике и доказанной корреляцией уровня гемоглобина с ранними и отдаленными послеоперационными исходами. На сегодняшний день убедительно доказано, что уровень гемоглобина крови ниже 10 г/дл является независимым предиктором неблагоприятного исхода операции. В связи с этим, меры, направленные на предупреждение и коррекцию анемии в ходе предоперационной подготовки пациентов и на последующих этапах их ведения, потенциально снижают риск послеоперационной смерти, сердечно-сосудистых событий, пневмонии и других осложнений послеоперационного периода [1,2].
Этиология анемии у хирургических больных разнообразна. Она может быть обусловлена как острой кровопотерей, так и длительно существующим дефицитом железа, витамина В12, хроническим воспалительным процессом и т.д. При этом по данным ряда исследований, дефицит железа выявляется в предоперационном периоде с высокой частотой. Так, железодефицитная анемия обнаруживается у 37% больных, направляемых на кардиохирургические и ортопедические операции [3,4], у 52,1% – на операции по поводу рака желудка, у 40-58% - по поводу колоректального рака [5,6,7], у 70% – по поводу миомы матки [8]. Анемия в предоперационном периоде может привести к неблагоприятным последствиям: такие пациенты в последующем чаще нуждаются в проведении гемотрансфузий, что, в свою очередь, сопряжено с большим риском развития инфекционных осложнений и увеличению сроков госпитализации [9,10]. Этим объясняется необходимость коррекции анемии в предоперационном периоде с применением железосодержащих препаратов.
Тактика лечения железодефицитной анемии в предоперационном периоде строится с учетом необходимости быстрого восстановления уровня гемоглобина и депо железа в организме [11,12]. Несмотря на то, что в ряде случаев применение пероральных железосодержащих препаратов удобнее для пациента, они неэффективны при синдроме мальабсорбции и часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (у 10-40% пациентов). Кроме того, для достижения значимого эффекта необходим их длительный прием, что в итоге негативно влияет на приверженность к лечению. Вместе с этим, в последние годы получила распространение альтернативная стратегия: применение препаратов железа для внутривенного введения [13,14]. Данные препараты показаны в тех случаях, когда необходимо быстро восполнить запасы железа в организме, имеются нарушения всасывания железа в кишечнике или выявлена плохая переносимость пероральных железосодержащих препаратов [15].
Наиболее часто применяемыми препаратами для внутривенного введения, как в мире, так и в России являются карбоксимальтозат железа, сахарат железа, глюконат железа и декстран железа. Безопасность и эффективность указанных препаратов зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой (глюконат железа) менее стабильны и, соответственно, более легко высвобождают железо в плазму. «Свободное» железо в плазме может катализировать образование реактивных форм кислорода, которые способны вызвать перекисное окисление липидов и, как следствие, повреждение тканей, в частности, ткани печени [16]. Еще одним недостатком комплексов с низкой молекулярной массой является то, что значительная часть препарата выводится через почки в первые 4 часа после приема и недоступна для использования в процессах эритропоэза [17]. Кроме того, при использовании декстрана и глюконата железа могут развиваться тяжелые анафилактические реакции [18].
В связи с вышесказанным наибольший интерес вызывает новый препарат для внутривенного введения – железа карбоксимальтозат (Феринжект®, Vifor Pharma, Швейцария). Результаты рандомизированных клинических исследований продемонстрировали, что его применение позволяет быстро восполнить дефицит железа, избежать развития реакций гиперчувствительности, характерных для декстран-содержащих препаратов, и обеспечить медленное высвобождение железа, что снижает риск токсического воздействия [19,20]. В отличие от сахарата и глюконата железа, железа карбоксимальтозат может вводиться в более высокой дозе: за одну 15-минутную внутривенную капельную инфузию пациент может получить до 1 000 мг железа [21], в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 ч, а длительность инфузии максимальной дозы декстрана железа достигает 6 ч. Кроме того, перед первой инфузией или инъекцией сахарата и декстрана железа рекомендуется вводить тест-дозу препарата [22,23]. Очевидно, что применение большой дозы железа карбоксимальтозата позволяет сократить необходимое число инфузий и добиться коррекции анемии в короткие сроки, что и требуется при предоперационной подготовке больного.
Исходя из изложенного, целью настоящего исследования стал фармакоэкономический анализ эффективности карбоксимальтозата железа (КМЖ) и сахарата железа (СЖ) при коррекции железодефицитной анемии (ЖДА) в ходе подготовки пациентов к плановым обширным хирургическим вмешательствам.
Матералы и методы
Фармакоэкономический анализ применения препаратов железа для внутривенного введения, используемых для коррекции анемии при подготовке пациентов к плановой обширной операции, выполняли методом моделирования с определением затратной эффективности рассматриваемых медицинских технологий в рамках анализа влияния на бюджет [24]. Исследование проводили с позиции государственной системы здравоохранения.
При построении фармакоэкономической модели за основу были взяты данные многоцентрового проспективного исследования Bisbe и соавт. [25] с участием 76 пациентов с некардиальной хирургической патологией (рак толстой кишки, гинекологическая патология, артропластика) и анемией, получающих в предоперационном периоде для восполнения дефицита железа КМЖ (Феринжект®). Группу сравнения составили 84 пациента, получавшие в предоперационном периоде препарат СЖ (Венофер®). Анализируемые группы пациентов были сопоставимы по степени дефицита железа и исходному уровню гемоглобина (Табл. 1). С целью выявления различий между группами в качестве конечных точек исследования использовали следующие показатели: кумулятивная доза введенного железа, число введений препарата, конечный уровень Hb, частота восстановления уровня железа, коррекции анемии и потребность пациентов в проведении дополнительных медицинских вмешательств, в частности, гемотрансфузий (ГТ). По результатам исследования определено, что применение КМЖ для коррекции дефицита железа у пациентов с некардиальной хирургической патологией и анемией в рамках предоперационной подготовки является клинически более эффективной стратегией по сравнению с назначением СЖ. Особенность дозирования Феринжекта® обуславливает более высокую приверженность пациентов к лечению, что благотворно влияет на эффективность терапии. Так, при меньшем числе сеансов терапии (2 в группе КМЖ по сравнению с 5 в группе СЖ, p<0,001) у значительно большего числа пациентов в группе КМЖ удалось полностью восполнить дефицит железа: 82% в группе КМЖ по сравнению с 62% в группе СЖ (p=0,007). При этом целевого уровня гемоглобина (определяемого в соответствии с рекомендациями ВОЗ: ≥12 г/дл. для женщин и Hb ≥13 г/дл. для мужчин) в группе КМЖ достигло 72% пациентов по сравнению с 59% в группе СЖ (p<0,05). Также в ходе анализа было установлено, что пациенты, получавшие Феринжект®, достоверно реже (в 2,7 раза, p<0,05) нуждались в проведении гемотрансфузий как во время операции, так и в послеоперационном периоде (Табл. 1).
Таблица 1. Базовые характеристики пациентов и конечные точки исследования (E. Bisbe и соавт. [25])
| Показатель | Группа СЖ | Группа КМЖ | p |
| Число пациентов | 76 | 84 | - |
| Исходный уровень Hb, г/дл. | 10,1 | 10,4 | NS |
| Общий дефицит железа, мг | 1 000 | 950 | NS |
| Кумулятивная доза введенного железа, мг | 1 010 | 1 120 | NS |
| Число введений | 5 | 2 | <0,001 |
| Конечный уровень Hb, г/дл | 12,1 | 12,5 | NS |
| Восстановление уровня железа, % | 62 | 82 | 0,007 |
| Коррекция анемии**, % | 59 | 72 | <0,05 |
| Гемотрансфузии, % | 24 | 9 | <0,05 |
NS – различия между группами статистически недостоверны.
Соответственно этому, на первом этапе нашего исследования в рамках разработанной модели, рассматривали стратегии коррекции анемии в двух равных по числу (100 человек в каждой) и сопоставимых по клиническим и иным характеристикам группах пациентов, в предоперационном периоде получающих: 1-я группа – карбоксимальтозат железа (Феринжект®); 2-я группа – сахарат железа (Венофер®). Режим дозирования препаратов соответствовал требованиям инструкций по применению, средняя кумулятивная доза железа на 1 пациента и кратность введения препаратов определялись по данным исследования E. Bisbe и соавт. (Табл. 1). Пациенты группы КМЖ за 1 внутривенную инфузию получали от 500 до 1 000 мг железа (10-20 мл препарата) в зависимости от cтепени дефицита железа и массы тела пациента. В группе СЖ пациенты получали внутривенно 100-200 мг железа (5-10 мл препарата) 1-3 раза в неделю. Максимальная допустимая доза железа в неделю, вводимого в виде КМЖ, не превышала 1 000 мг, в виде СЖ – 600 мг. Средняя кумулятивная доза железа на одного хирургического пациента на курс терапии в группе КМЖ составила 1 120 мг, среднее число сеансов терапии – 2; в группе СЖ – 1 010 мг, вводимых за 5 сеансов.
В ходе исследования было принято, что коррекцию анемии у хирургических больных проводят на догоспитальном этапе, и в каждом случае препараты железа вводят под медицинским наблюдением в условиях дневного стационара.
На втором этапе исследования в рамках анализа влияния на бюджет оценивали затраты системы здравоохранения на этапах до и после внедрения новой технологии. Новой внедряемой технологией считали применение карбоксимальтозата железа (Феринжект®), текущей стратегией – использование сахарата железа (Венофер®).
Анализ эффективности. В качестве показателя клинической эффективности проводимой терапии в условиях модели считали число пациентов с восполненным дефицитом железа и достигнувших целевых уровней гемоглобина. Также учитывали вероятность проведения гемотрансфузий в зависимости от применяемой медицинской технологии.
Анализ затрат. Учитывали финансовые затраты на фармакотерапию ЖДА на догоспитальном этапе, а также ожидаемые затраты на проведение гемотрансфузий во время операции и в послеоперационном периоде. Расчет затрат на фармакотерапию сравниваемыми препаратами в условиях модели включал определение стоимости кумулятивной дозы препаратов, а также затраты на пребывание пациентов в дневном стационаре. Цены на препараты Венофер®, Ликферр100® и Аргеферр® были равны предельным отпускным ценам производителя, зарегистрированным в соответствии с Распоряжением Правительства РФ от 30 июля 2012 г. №1378-р «Об установлении перечня жизненно необходимых и важнейших лекарственных препаратов на 2013 год», по состоянию на 7 апреля 2013 года. Цена препарата Феринжект® соответствовала предполагаемой предельной отпускной цене производителя для включения в перечень ЖНВЛП (Табл. 2). Стоимость пребывания в дневном стационаре соответствовала нормативу финансовых затрат на 1 пациенто-день лечения, утвержденному территориальной программой государственных гарантий оказания гражданам РФ бесплатной медицинской помощи в городе Москва на 2013 год.
Таблица 2. Зарегистрированные предельные отпускные цены производителя на рассматриваемые препараты парентерального железа по состоянию на 7.04.2013 и расчетная стоимость 100 мг железа в условиях модели.
| Лекарственный препарат | Цена, руб. | Стоимость 100 мг железа в составе препарата, руб. |
| Феринжект®* р-р для инф. 50мг/мл 10мл фл. №1 р-р для инф. 50мг/мл 2 мл фл. №5 | 4 300,00* | 860,00 |
| Венофер® р-р для в/в введ. 20мг/мл 5мл амп. №5 | 3 423,79 | 684,76 |
| Ликферр100® р-р для в/в введ. 20мг/мл 5мл амп. №5 | 2 848,00 | 569,60 |
| Аргеферр® р-р для в/в введ. 20мг/мл 5мл амп. №5 | 3 423,00 | 684,60 |
Затраты на 1 сеанс гемотрансфузии были равны расчетным данным Е.Б. Жибурт и соавт. (2012 г.) и составили в условиях модели – 8 438,18 руб. (Табл. 3.).
Таблица 3. Стоимость медицинских услуг в условиях разработанной модели.
| Услуга | Стоимость, руб. | Источник |
| 1 пациенто-день лечения в условиях дневного стационара | 504,42 | ТПГГ* в г. Москва на 2013 г. |
| Гемотрансфузии, | 8 438,18 | Жибурт Е.Б. и соавт. [2012] |
Анализ «затраты-эффективность». Показатель «затраты-эффективность» (costeffectiveness ratio, CER) рассчитывали по формуле:
CER = C / Ef,
где С – стоимость фармакотерапии терапии всех пациентов в группе (в рублях); Ef – эффективность терапии.
Коэффициент эффективности приращения затрат (инкрементальный коэффициент, ICER), который демонстрирует объем средств, который необходимо затратить на достижение терапевтического эффекта у 1 дополнительного пациента при назначении более эффективной и более дорогостоящей медицинской технологии, рассчитывали по формуле:
ICER = (C1 – C2) / (Ef1 – Ef2),
где С1 и С2 – общие прямые затраты в сравниваемых группах (в рублях);
Ef1 и Ef2 – эффективность терапии в группах.
В рамках анализа чувствительности результатов исследования моделировали изменение цены препаратов Феринжект® и Венофер® в диапазоне от -30% до +30%. Кроме того, в фармакоэкономическую модель были введены препараты-дженерики СЖ, представленные на российском рынке: Ликферр100® (ФармФирма «Сотекс») и Аргеферр® (Genfa Medica). Поскольку, по данным ряда исследований, для достижения терапевтического эффекта, сопоставимого с таковым при терапии оригинальным препаратом СЖ (Венофер®), требуется увеличение кумулятивной дозы дженерика СЖ до 20-35% [25,26,27], рассматривали возможные изменения затратной эффективности терапии ЖДА и бюджетных расходов при увеличении исходной дозы СЖ (1 010 мг) на 10%, 20%, 30%, 40%.
Результаты
При моделировании затрат на фармакотерапию железодефицитной анемии (Табл. 4) в рассматриваемых группах было выявлено, что затраты в группе пациентов, получавших Феринжект®, составляли 1 064 084,00 руб. на 100 пациентов, в группе Венофера® – 943 815,58 руб. При этом анализ структуры медицинских затрат на коррекцию предоперационной анемии показал, что затраты на дневной стационар в группе карбоксимальтозата железа в 2,5 раза ниже в сравнении с группой Венофера® (100 884,00 руб. и 252 210,00 руб., соответственно) (Табл. 5).
Таблица 4. Затраты на терапию железодефицитной анемии из расчета на 1 пациента.
| Группа пациентов | Кумулятивная доза железа | Затраты на препарат | Число введений | Затраты на дневной стационар | Суммарные затраты |
| Феринжект® | 1 120 | 9 632,00 | 2 | 1 008,84 | 10 640,84 |
| Венофер® | 1 010 | 6 916,06 | 5 | 2 522,10 | 9 438,16 |
Таблица 5. Затраты в анализируемых группах в расчете на 100 пациентов и значения коэффициента «затраты-эффективность» по показателям частоты устранения железодефицитного состояния и коррекции анемии.
| Группа пациентов | Затраты на 100 пациентов, руб. | Восполнение дефицита железа | Коррекция анемии | ||
| Число пациентов | CER | Число пациентов | CER | ||
| Феринжект® | 1 064 084,00 | 82 | 12 976,63 | 72 | 14 778,94 |
| Венофер® | 943 815,58 | 62 | 15 222,83 | 59 | 15 996,87 |
На основании данных о стоимости и клинической эффективности терапии, нами была рассчитана затратная эффективность рассматриваемых медицинских технологий. Значение коэффициента «затраты-эффективность» по показателю частоты восполнения дефицита железа в группе Феринжекта® составило 12 976,63 руб., для Венофера® – 15 222,83 руб. на 1 пациента. Итоговый показатель CER с учетом частоты коррекции анемии для Феринжекта® – 14 778,94 руб., для Венофера® - 15 996,87 руб. на 1 пациента, достигшего целевого уровня гемоглобина (Табл. 5).
Таким образом, с точки зрения затратной эффективности, Феринжект® представляется предпочтительной стратегией. Коэффициент эффективности приращения затрат (ICER) в расчете на одного дополнительного пациента, достигшего при назначении Феринжекта клинического результата - восполнения дефицита железа или коррекции анемии, составил 6 013,42 и 9 251,42
При проведении анализа влияния на бюджет было выявлено, что затраты на коррекцию анемии в предоперационном периоде в группе КМЖ по сравнению с группой СЖ оказались выше в 1,4 раза (963 200,00 и 691 605,58 руб., соответственно). Однако, стратегия применения КМЖ является более предпочтительной за счет меньших затрат на дневной стационар (в 2,5 раза) и затрат на проведение гемотрансфузий (в 3 раза) (Табл. 6).
Таблица 6. Анализ влияния на бюджет в расчете на 100 пациентов.
| Группа пациентов | Этап оказания медицинской помощи | Суммарные затраты, руб. | ||
| Догоспитальный | Госпитальный | |||
| Затраты на препараты железа, руб. | Затраты на дневной стационар, руб. | Затраты на ГТ, руб. | ||
| Феринжект® | 963 200,00 | 100 884,00 | 75 943,62 | 1 140 027,62 |
| Венофер® | 691 605,58 | 252 210,00 | 202 516,32 | 1 146 331,90 |
Проведенный анализ чувствительности результатов исследования выявил устойчивость показателя затратной эффективности к изменению цены (Табл. 7, 8).
Таблица 7. Анализ чувствительности показателя «затраты-эффективность» в восполнении дефицита железа при изменении стоимости препаратов железа для внутривенного введения.
| Группа пациентов | Изменение стоимости препаратов | ||||||
| -30% | -20% | -10% | Базовый вариант | +10% | +20% | +30% | |
| Феринжект® | 9 452,73 | 10 627,37 | 11 802,00 | 12 976,63 | 14 151,27 | 15 325,90 | 16 500,54 |
| Венофер® | 11 876,35 | 12 991,85 | 14 107,34 | 15 222,83 | 16 338,32 | 17 453,82 | 18 569,31 |
Таблица 8. Анализ чувствительности показателя «затраты-эффективность» в коррекции анемии при изменении стоимости препаратов железа для внутривенного введения
| Группа пациентов | Изменение стоимости препаратов | ||||||
| -30% | -20% | -10% | Базовый вариант | +10% | +20% | +30% | |
| Феринжект® | 10 765,61 | 12 103,39 | 13 441,17 | 14 778,94 | 16 116,72 | 17 454,50 | 18 792,28 |
| Венофер® | 12 480,24 | 13 652,45 | 14 824,66 | 15 996,87 | 17 169,09 | 18 341,30 | 19 513,51 |
Анализ чувствительности результатов, предусматривавший выявление изменений бюджетных расходов и затратной эффективности терапии ЖДА при назначении воспроизведенных препаратов СЖ, показал, что при применении препарата Ликферр100® совокупные затраты в группе из 100 пациентов составляют от 1 030 022,32 до 1 361 024,72 руб., в то время как в группе Аргеферра® – от 1 146 172,32 до 1 523 634,72 руб. (Табл. 9). Затратная эффективность препаратов Ликферр100® и Аргеферр® в коррекции анемии находилась в диапазонах от 15 994,17 руб./ед. до 22 391,84 руб./ед. и от 14 025,53 руб./ед. до 19 635,74 руб./ед., соответственно. При этом назначение препарата Аргеферр® (15 994,17 руб./ед.) представляется менее затратно эффективным в сравнении с Феринжектом® - (14 778,94 руб./ед.) и равным по показателю CER Веноферу® (15 996,87 руб./ед.) даже в отсутствии изменений кумулятивной дозы препарата, а увеличение дозы Ликферра100® всего на 10% приводило к схожему результату (15 855,55 руб./ед.) (Рис. 1). Следует при этом отметить, что в клинических исследованиях [25,26] было показано, что для достижения терапевтического эффекта, сопоставимого с таковым при терапии оргигинальным препаратом СЖ, требуется увеличение кумулятивной дозы дженериков СЖ на 20-35%.
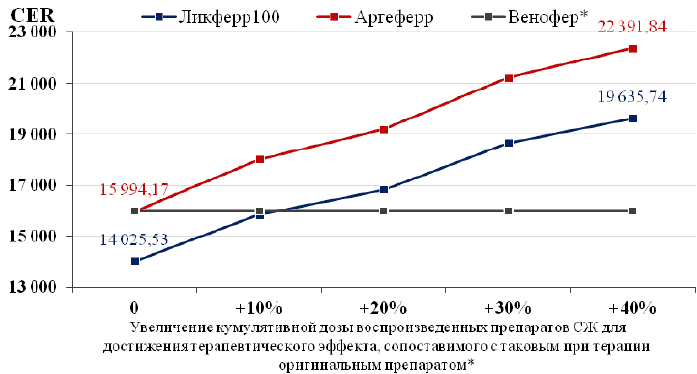
Рисунок 1. Анализ чувствительности результатов в группе сахаратов железа. Изменение показателя «затраты-эффективность» при увеличении кумулятивной дозы генерических препаратов СЖ для достижения терапевтического эффекта (коррекция анемии), сопоставимого с таковым при терапии оригинальным препаратом.
Таблица 9. Анализ влияния на бюджет для генерических препаратов сахарата железа.
| Группа пациентов | Этап оказания медицинской помощи | Суммарные затраты, руб. | ||
| Догоспитальный | Госпитальный | |||
| Затраты на препараты железа, руб. | Затраты на дневной стационар, руб. | Затраты на ГТ руб. | ||
| Ликферр100® | 575 296,00 – 805 414,40 | 252 210,00 – 353 094,00 | 202 516,32 | 1 030 022,32 – 1 361 024,72 |
| Аргеферр® | 691 446,00 – 968 024,40 | 1 146 172,32 – 1 523 634,72 | ||
Заключение
При сопоставлении рассмотренных стратегий фармакотерапии железодефицитной анемии у пациентов перед обширными оперативными вмешательствами очевидно клинико-экономическое преимущество препарата Феринжект®, при использовании которого показатели CER значительно ниже по сравнению с альтернативными медицинскими технологиями. Как оригинальный препарат сахарата железа, так и его аналоги уступают КМЖ. Результаты анализа влияния на бюджет продемонстрировали, что стратегия с применением КМЖ является наиболее предпочтительной за счет меньших совокупных затрат.
Фармакоэкономическое преимущество препарата КМЖ (Феринжект®) обусловлено, прежде всего, его высокой эффективностью по показателям частоты достижения коррекции анемии, превышающей таковые у препарата СЖ (Венофер®). Кроме того, важное значение имеют меньшие сопутствующие затраты, связанные с пребыванием в дневном стационаре.
При проведении исследования мы учитывали как прямые затраты на лекарственные средства и их введение, так и затраты, связанные с применением дополнительных медицинских вмешательств, в частности гемотрансфузий. Схожие данные были получены в европейском фармакоэкономическом исследовании Wilson P.D. et al (2013). [28], в котором при проведении анализа влияния на бюджет препарат Феринжект® был определен как ресурсосберегающая технология системы здравоохранения при применении у пациентов в условиях дневного стационара. В то же время, клинико-экономические аспекты применения КМЖ на территории РФ оставались неизученными. Проведенное нами исследование продемонстрировало, что карбоксимальтозат железа (Феринжект®) является наиболее клинически и экономически целесообразной стратегией для устранения железодефицитного состояния и коррекции ЖДА у пациентов в периоперационном периоде. Следует отметить, что при расчетах мы учитывали затраты на лечение в условиях дневного стационара. Очевидно, что различия в затратах могут возрастать, если оно будет проводиться в госпитальных условиях.
- Чичерин И.Н., Вязников В.А., Чичерина Н.И. Тактика проведения заместительной гемотрансфузии и лечения анемии на этапах периоперационного периода у кардиохирургических пациентов пожилого возраста // Анналы хирургии. – 2010. – №3. – С. 68-70.
- Kumar A. Perioperative management of anemia: Limits of blood transfusion and alternatives to it // Cleveland Clinic Journal of Medicine. – 2009. – №76(Suppl 4). – Pp. S112-118.
- Preoperative iron deficiency increases transfusion requirements and fatigue in cardiac surgery patients: a prospective observational study / P. Piednoir, N. Allou, F. Driss [et al] // European Journal of Anaesthesiology. – 2011 – №28(11) – Pp. 796-801.
- Grey D.E., Smith V., Finlayson J. Iron studies and red cell transfusion in cardiothoracic and orthopaedic surgical patients: a retrospective audit at a tertiary hospital // Vox Sanguinis. – 2012. – №102(2). – Pp. 150-158.
- Anemia after gastrectomy for early gastric cancer: long-term follow-up observational study / C.H. Lim, S.W. Kim, W.C. Kim [et al] // World Journal of Gastroenterology. – 2012. – №18(42). – Pp. 6114-6119.
- Multicenter cross-sectional study of anemia in patients with gastric and colorectal cancer before and after the operation / J.C. Yu , J.N. Ge, Y. Tang [et al] // Zhonghua Wai Ke Za Zhi. – 2011. – №49(1). – Pp. 53-56.
- Ho C.H., Yu Y.B., Wu P.H. The prevalence of iron deficiency anemia and its clinical implications in patients with colorectal carcinoma // Journal of Chinese Medical Association. – 2008. – №71(3). – Pp. 119-122.
- Бурлев В.А., Коноводова Е.Н., Барабанова О.Э.. Лечение железодефицитной анемии у больных с миомой матки // Гинекология. – 2003. – №4. – С. 174-178.
- Goodnough LT, Shander A, Spivak JL, et al. Detection, evaluation, and management of anemia in the elective surgical patient. Anesth Analg 2005; 101:1858–61.
- Dunne JR, Malone D, Tracy JK, Gannon C, Napolitano LM: Perioperative anemia: An independent risk factor for infection, mortality, and resource utilization in surgery. J Surg Res 2002; 102:237–44.
- Протокол ведения больных. Железодефицитная анемия. Утв. Министерством здравоохранения и социального развития РФ 22 октября 2004 г.
- Моисеев С.В. Железа карбоксимальтозат (Феринжект®) – новый внутривенный препарат для лечения железодефицитной анемии // Клиническая фармакология и терапия. – 2012. – №21(2). – С. 48-53.
- Preoperative use of intravenous iron: a new transfusional therapy / E. Bisbe, C. Rodriguez, A. Ruiz [et al] // Revista Espanola de Anestesiologia y Reanimacion. – 2005. – №52(9). – Pp. 536-540.
- Perioperative anaemia management: consensus statement on the role of intravenous iron / P. Beris, M. Munoz, J.A Garcia-Erce, // British Journal of Anaesthesia. – 2008. – №100(5). – Pp. 599-604.
- Management of anaemia in the pre-operative period. Oxford Regional Transfusion Committee. Draft Guidelines and protocols. – 2005. – 10 p. Available at: transfusionguidelines.org.uk/docs/pdfs/rtc-scent_p…
- Применение препаратов железа для внутривенного введения в лечении родильниц с анемией / Е.Н. Коноводова, А.А. Подымова, И.В. Закревская, Р.С.-Э.Докуева // Consilium Medicum – Т. 13. – №6. – 2011. – С. 18-20.
- Crichton R et al. Iron Therapy With Special Emphasis on Intravenous Administration. 4th edition. London, Boston: International Medical Publishers; 2008.
- Chertow, GM, Mason, PD, Vaage-Nilsen, O, et al. Update on adverse drug events associated with parenteral iron. Nephrol Dial Transplant 2006;21:378–382.
- Breymann C. Iron supplementation during pregnancy. Fetal and maternal medicine review 2002; 13(1):1–29.
- Kulnigg S. et al.Anjvel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT®) . Randomized controlled trial. Am J Gastroenterol 2007; 103(5):1182-1192.
- Инструкция по применению препарата Феринжект®.
- Интсрукция по применению препарата Аргеферр®.
- Инструкция по применению препарата Космофер®.
- Ряженов В.В., Горохова С.Г., Бунятян Н.Д. Анализ влияния на бюджет: особенности применения метода // Фармация. – 2011. – №1. – С. 41–44.
- A multicentre comparative study on the efficacy of intravenous ferric carboxymaltose and iron sucrose for correcting preoperative anaemia in patients undergoing major elective surgery / E. Bisbe, J.A. Garcia-Erce, A.I. Diez-Lobo // British Journal of Anaesthesia. – 2011. – 107(3). – Pp. 477-478.
- Do two intravenous iron sucrose preparations have the same efficacy? / J. Rottembourg, A. Kadri, E. Leonard [et al.] // Nephrology Dialysis Transplantation. – 2011. – №0. – Pp. 1–6.
- Comparison of adverse event profile of intravenous iron sucrose and iron sucrose similar in postpartum and gynecologic operative patients / E.S. Lee, B.R. Park, J.S. Kim [et al] // Current Medical Research & Opinion. – 2013. – №29(2). – Pp. 141–147.
- Wilson PD, Hutchings A, Jeans A, Macdougall IC. An analysis of the health service efficiency and patient experience with two different intravenous iron preparations in a UK anaemia clinic. J Med Econ. 2013;16(1):108-14
