Современные возможности противовоспалительной терапии в пульмонологии
СтатьиОпубликовано в журнале:
Врач 2'2012
Е. Шмелёв, доктор медицинских наук, профессор,
Н. Шмелёва, кандидат медицинских наук
ЦНИИ туберкулеза РАМН, Москва В работе представлены современные материалы по принципиально новому направлению противовоспалительной терапии больных хронической обструктивной болезнью легких с помощью ингибитора фосфодиэстеразы-4 рофлумиласта. Описаны механизмы действия препарата, показания к его применению. Рассматриваются результаты клинических исследований и возможность применения рофлумиласта при других болезнях легких.
Ключевые слова: хроническая обструктивная болезнь легких, хроническое воспаление, ингибитор фосфодиэстеразы-4, рофлумиласт, лечение.
Воспаление – хорошо известный патогенетический механизм, лежащий в основе большинства заболеваний органов дыхания. При этом если изначально воспаление можно рассматривать как форму избавления от чужеродного материала, проникшего во внутреннюю среду организма, то при многих хронических воспалительных заболеваниях респираторной системы (и не только респираторной) воспаление переходит рамки рационально-защитного и приобретает агрессивные формы, приводя к множеству последствий, угрожающих здоровью и жизни человека. При разных заболеваниях органов дыхания патогенное влияние воспаления обретает определенные формы: бронхообструкция (бронхоспазм, отек, гиперсекреция), деструкция паренхимы: абсцедирование, эмфизема, прогрессирующее фиброзообразование.
Теоретически, важнейшим принципом противовоспалительной терапии является прекращение действия этиологического фактора, что с успехом реализуется при остром воспалении: при пневмониях – с помощью антибиотиков, при остром вирусном бронхите – при применении противовирусных средств. Однако при хронических воспалительных процессах не всегда удается прекратить действие этиологических факторов, и воспаление приобретает самоподдерживающий характер, приводя к многочисленным последствиям, определяющим характер течения заболевания. К этой категории относятся хроническая обструктивная болезнь легких (ХОБЛ), бронхиальная астма (при невозможности элиминации этиологически значимого аллергена), саркоидоз и некоторые формы фиброзирующих альвеолитов. В большинстве случаев применение в качестве противовоспалительного средства глюкокортикостероидных (ГКС) гормонов оказывается достаточно эффективным и позволяет контролировать прогрессирование болезни. Исключение составляет ХОБЛ, при которой ГКС малоэффективны, и их длительное применение может обусловить хорошо известные нежелательные эффекты. К тому же ХОБЛ является самым распространенным недостаточно контролируемым хроническим заболеванием респираторной системы, и число больных постоянно растет.
Воспаление в сложной иерархии причинно-следственных отношений при ХОБЛ является главным патогенетическим механизмом. Современные концепции определяют ХОБЛ как хроническое воспалительное заболевание, связанное с воздействием неблагоприятных факторов внешней среды. Отличительной чертой воспаления при ХОБЛ является системный характер – оно захватывает все легочые структуры. Под влиянием провоспалительных цитокинов при ХОБЛ возникают поражения сердечнососудистой системы, скелетной мускулатуры (апоптоз миоцитов), анемический синдром, остеопении, депрессивные состояния, нарушения питания. Еще одна особенность ХОБЛ, связанная с воспалением, – неуклонное прогрессирование болезни, ведущее к нарастанию главного признака заболевания – хронической дыхательной недостаточности. Сказанное дает основание считать воспаление ключевым элементом патогенеза ХОБЛ.
На схеме показана последовательность патологических процессов, составляющих хроническое воспаление: 1-й этап – воздействие этиологических факторов на клеточные элементы, участвующие в воспалении; 2-й этап включает процессы повреждения и репарации, идущие одновременно и определяющие морфологические и функциональные проявления ХОБЛ. Практически все клеточные элементы респираторной системы под влиянием этиологических факторов активируются и участвуют в воспалительной реакции, которая, по сути, является результатом клеточной кооперации. В сложном переплетении межклеточных взаимоотношений, происходящих в разные фазы воспаления, ключевая роль принадлежит нейтрофилам.
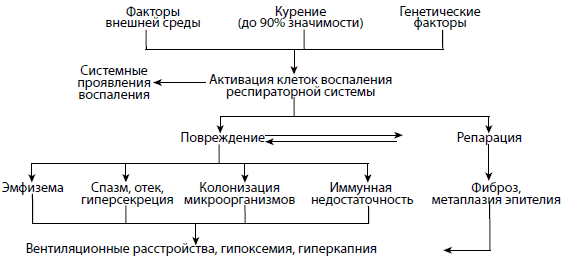
Место воспаления в патогенезе ХОБЛ
Курение ведет к 10-кратному увеличению содержания нейтрофилов в дистальных отделах респираторной системы. Под влиянием курения происходит полимеризация актина нейтрофилов, что существенно снижает их деформабельность. При этом задерживающиеся в капиллярах нейтрофилы окружены очень малым количеством плазмы, несущей антиоксидантный и антипротеолитический потенциал, что создает условия для патогенного действия нейтрофилов.
Нейтрофилы, проникая в межклеточное пространство, выделяют ряд провоспалительных медиаторов, вазоактивных простагландинов, а также субстанции, обладающие мощным деструктивным потенциалом, распространяющимся практически на все молекулярные компоненты тканей (липиды, белки, нуклеиновые кислоты); это прежде всего нейтральные протеазы (эластин) и кислородные радикалы.
В норме весь этот комплекс «патогенных» компонентов направлен на разрушение чужеродных субстанций. Но под влиянием факторов риска ХОБЛ, главным из которых является курение, запускается описанный выше механизм, нарушающий защитное действие нейтрофила.
В условиях гигантского скопления нейтрофилов в капиллярной сети альвеол, где местный антипротеазный и антиоксидантный потенциал, определяемый плазменными факторами, быстро истощается, происходят разрушение структурных элементов альвеол и формирование эмфиземы. В первую очередь разрушаются участки альвеолярных стенок, прикрепляющиеся к терминальным бронхиолам. Помимо этого, оксиданты и другие компоненты табачного дыма могут инактивировать α1-антипротеазный ингибитор, усугубляя тем самым локальный дефицит антипротеаз. Кроме того, эластаза разрушает эпителиальные клетки, ведет к метаплазии бокаловидных клеток.
Процессы повреждения и репарации, происходящие при ХОБЛ, составляют суть хронически текущего воспаления, регулируются огромным количеством экзогенных и эндогенных про- и противовоспалительных медиаторов и проявляются на всех уровнях и во всех структурах респираторной системы.
Реализация этих компонентов патогенеза в дебюте заболевания осуществляется под влиянием факторов риска ХОБЛ, а при сформировавшейся болезни принимает характер самоподдерживающегося процесса. Действие нейтрофилов усиливается другими элементами респираторной системы: лимфоцитами, макрофагами, эозинофилами, тучными и эпителиальными клетками, а также клетками сосудистого эндотелия. Выделяемые ими под воздействием факторов риска про- и противовоспалительные медиаторы вступают в сложные многоуровневые взаимоотношения со всеми структурами респираторной системы и за ее пределами, определяя так называемый системный эффект.
Известны 2 главных клинических показателя при ХОБЛ, определяющих прогноз течения заболевания, – частота обострений и активность хронического воспаления. Эти показатели тесно связаны, и современная пульмонология предлагает выделять особый, прогностически неблагоприятный фенотип – «ХОБЛ с частыми рецидивами».
Список средств и методов противовоспалительной терапии при ХОБЛ весьма скромен: борьба с курением, ГКС, вакцинация, фенспирид, статины и надежды на появление новых эффективных средств.
Важнейший элемент, без которого лечение ХОБЛ теряет эффективность и смысл, – это ограничение и (если это достижимо) прекращение действия факторов риска, из которых ведущим является табакокурение. Прекращение курения – единственный наиболее эффективный и экономически оправданный метод ограничения действия факторов риска развития ХОБЛ и торможения его прогрессирования.
Из всех применяемых при ХОБЛ противовоспалительных средств наиболее мощный потенциал у ГКС, однако именно при ХОБЛ они не могут проявлять его в полной мере, что связано с нарушением деацетилирования гистонов под влиянием факторов риска, что и формирует резистентность к противовоспалительному действию ГКС при сохранении всего набора нежелательных их проявлений. Эффективность ингаляционных форм ГКС повышается при их комбинации с пролонгированными β2-агонистами. И все же лечебный эффект ГКС при ХОБЛ выражен значительно меньше, чем при бронхиальной астме.
Вакцинация. Гриппозная вакцина способна на 50% уменьшить тяжесть течения ХОБЛ и смертность. Пневмококковая вакцинация рекомендована пациентам старше 65 лет, а для более молодых – при объеме формированного выдоха за 1 с (ОФВ1) <40% должной величины. Вакцинация является, с одной стороны, профилактической мерой обострений ХОБЛ, а с другой – оказывает противовоспалительное действие в период ремиссии вследствие подавления колонизации микроорганизмов и каскада воспалительных реакций респираторной системы в виде хронического воспаления.
Статины. В последние годы получена информация о противовоспалительном потенциале статинов. Их эффективность при ХОБЛ изучена более чем в 10 крупных исследованиях, которые установили, что при применении статинов течение ХОБЛ становится более благополучным [1].
Использование фенспирида у больных ХОБЛ продемонстрировало определенный противовоспалительный потенциал препарата, который, к сожалению, уступает ГКС.
Большие надежды возлагаются на новое поколение ингибиторов провоспалительных медиаторов или рецепторов к ним как средства противовоспалительной терапии для длительного применения у больных ХОБЛ. Блокаторы провоспалительных интерлейкинов (ФНОα, ИЛ1β, ИЛ6) находятся в стадии клинических испытаний. Среди множества подходов к поиску эффективной противовоспалительной терапии для больных ХОБЛ внимание привлекли ингибиторы фосфодиэстеразы (ФДЭ).
Принцип ингибиции ФДЭ при воспалительных процессах респираторной системы описан J. Hirsch и соавт. в 1922 г. Но применение неселективных ингибиторов ФДЭ – аминофиллина и теофиллина – было ограничено множеством лекарственных взаимодействий препаратов, узким терапевтическим диапазоном и большим числом сердечно-сосудистых и желудочно-кишечных побочных эффектов. В последние десятилетия интерес к ингибиторам ФДЭ возрос в связи с идентификацией 11 изоэнзимов ФДЭ. ФДЭ4 – это цАМФ-специфическая преобладающая изоформа, экспрессируемая иммунными и воспалительными клетками. ФДЭ4 – основной регулятор метаболизма цАМФ практически во всех провоспалительных и структурных клетках, вовлеченных в хроническое воспаление, лежащее в основе ХОБЛ. Много лет назад ФДЭ4 была идентифицирована как потенциальная терапевтическая мишень для снижения активности специфического при ХОБЛ воспаления (см. таблицу).
ФДЭ катализируют разрушение циклических пуриновых нуклеотидов (цАМФ, цГМФ) с образованием соответствующих 5’-монофосфатов нуклеотидов. Путем подавления фермента ФДЭ4 ингибиторы ФДЭ4 уменьшают активность разрушения цАМФ, что способствует поддержанию высокого внутриклеточного уровня цАМФ и снижению активности провоспалительных функций клеток (рис. 1).
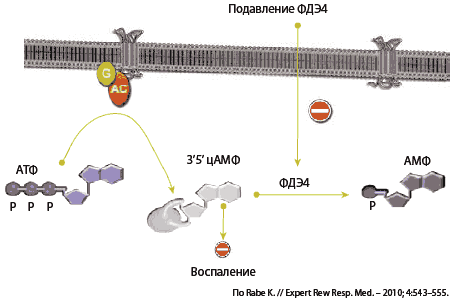
Рис. 1. Роль ФДЭ4 в подавлении воспаления
Эксперссия ФДЭ4 в ключевых воспалительных клетках, участвующих в патогенезе ХОБЛ
| Лейкоцит | Изоформа ФДЭ | Структурные клетки | Изоформа ФДЭ |
| Тучные клетки | 4,7 | Гладкие мышцы дыхательных путей | 1, 2, 3, 4, 5, 7 |
| Эозинофилы | 4,7 | Эпителиальные клетки | 1, 2, 3, 4, 5, 7, 8 |
| Нейтрофилы | 4,7 | Эндотелиальные клетки | 2, 3, 4, 5 |
| Моноциты | 1, 3, 4, 7 | Сенсорные нервы | 1, 3, 4 |
| Макрофаги | 1, 3, 4, 5, 7 | Холинерические нервы | 1, 3, 4 |
| Т-клетки (CD4+ и CD8+) | 3, 4, 7 |
Наряду с подавлением всех фаз воспаления (синтез и продукция провоспалительных цитокинов, выделение свободных радикалов, пролиферация фибробластов, выделение протеолитических ферментов) ингибиция ФДЭ4 ведет к нарастанию глюкозозависимой секреции инсулина и усилению липолиза.
Широкий диапазон противовоспалительной активности ингибиторов ФДЭ4 инициировал исследования по созданию новых эффективных препаратов, но лишь 2 из них достигли III фазы клинических испытаний – это циломиласт и рофлумиласт. Однако, несмотря на противовоспалительное действие при применении циломиласта, из-за большого количествам желудочно-кишечных осложнений его дальнейшее испытание при ХОБЛ прекращено. Разные этапы испытаний проходят новые пероральные ингибиторы ФДЭ4 – оглемиласт и тетомиласт; эффективность последнего, кроме ХОБЛ, изучена при язвенном колите. На ранних стадиях исследования находятся ингаляционные формы ФДЭ 4 – ибубиласт и тофимиласт. Для широкого клинического применения доступен рофлумиласт (препарат зарегистрирован в Европе под названием «Даксас», в США – «Далиресп»).
После однократного приема стандартной дозы рофлумиласта (500 мг) препарат быстро всасывается, максимальная концентрация в плазме крови достигается в течение 1 ч. Затем рофлумиласт метаболизируется цитохромом Р450 в его активный метаболит – рофлумиласт N-оксид. Этот метаболит обладает активностью, аналогичной таковой рофлумиласта, и определяет 90% эффективности принятого per os препарата. Рофлумиласт после однократного приема сохраняется в циркуляции 3–4 дня, а рофлумиласт N-оксид – в течение 6 сут.
Противовоспалительные эффекты рофлумиласта у пациентов с ХОБЛ изучены в 4-недельном двойном слепом рандомизированном плацебоконтролируемом, перекрестном исследовании [2]. Пациенты получали рофлумиласт в дозе 500 мг или плацебо 1 раз в сутки в течение 4 нед. Затем всем пациентам давали плацебо в периоде вымывания, и в следующие 4 нед больным, получавшим ранее рофлумиласт, назначали плацебо, и наоборот. Образцы индуцированной мокроты и анализ функции легких проводили у пациентов на исходном этапе, до лечения и через 2 и 4 нед после него. В 4-недельном перекрестном исследовании в образцах мокроты у пациентов после приема рофлумиласта отмечено достоверно меньше эозинофилов (p=0,0005) и нейтрофилов (p=0,0017), чем в группе плацебо, а также достоверно более низкие уровни медиаторов воспаления, в том числе ИЛ8 и эластазы нейтрофилов. Уменьшение активности специфического для ХОБЛ воспаления сочеталось с достоверным улучшением при лечении рофлумиластом функции легких: до приема бронходилататора ОФВ1 увеличился на 79,5 мл (p<0,0001 в сравнении с плацебо), после приема – на 68,7 мл (p=0,018), что подтверждает направленное воздействие рофлумиласта на воспаление, лежащее в основе ХОБЛ.
В 2005 г. опубликованы результаты исследования RECORD [3] – двойного слепого многоцентрового плацебоконтролируемого исследования с участием 1411 больных ХОБЛ разной степени тяжести (ОФВ1 – в пределах 80–30% должных величин), продолжавшегося 24 нед. Больные были рандомизированы в 3 группы: принимавшие 250 мг и 500 мг рофлумиласта, а также плацебо. В результате у больных, получавших рофлумиласт, ОФВ1 увеличился: на 74 мл в группе получавших рофлумиласт в дозе 250 мг и на 97 мл – у получавших его по 500 мг (р<0,0001). Среднее число обострений (легких, умеренных и тяжелых) на 1 пациента было достоверно меньше у пациентов, принимавших рофлумиласт, чем в группе плацебо (p=0,0029), причем при приеме препарата в более высокой дозе (500 мг) – меньше на 34%. Частота обострений служила вторичной конечной точкой в этом исследовании, что потребовало изучения влияния рофлумиласта на этот показатель в исследованиях III фазы (рис. 2).
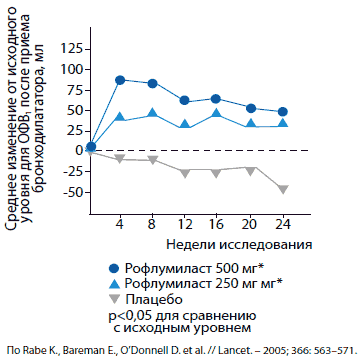
Рис. 2. Улучшение функции легких у пациентов с умеренной и тяжелой степенью ХОБЛ при использовании рофлумиласта (данные исследования RECORD)
Позже опубликованы результаты 2 одинаковых по дизайну рандомизированных плацебоконтролируемых двойных слепых исследований. В параллельных группах (прием рофлумиласта или плацебо 1 раз в сутки в течение 12 мес) участвовали 2686 пациентов (1173 – в исследовании M2-111 и 1513 – в исследовании M2-112) с ХОБЛ (ОФВ1 после применения бронходилататора была ≤50% от должной; ОФВ1/ФЖЕЛ ≤70%). Отметим, что в отличие от основных 12-месячных исследований III фазы для включения в это исследование не требовалось наличия у пациента симптомов хронического бронхита или обострений в анамнезе [4]. При этом около 60% больных получали ингаляционные ГКС (ИГКС). Как и в предыдущем исследовании, отмечено существенное (р=0,001) нарастание ОФВ1 у обследованных с малообратимой бронхиальной обструкцией. При раздельном анализе ранних клинических исследований III фазы статистически значимых различий между группами рофлумиласта и плацебо по частоте обострений (умеренных или тяжелых) не обнаружено. Однако при объединенном анализе было выявлено статистически значимое снижение частоты обострений на 14,3% (p=0,00257). Ретроспективный анализ объединенных данных 2 клинических исследований III фазы с целью выявления подгрупп пациентов с наибольшей пользой от лечения рофлумиластом позволил обнаружить, что наличие бронхитического фенотипа ХОБЛ (симптомы хронического кашля с мокротой) коррелирует с более выраженным снижением частоты обострений. В целом у пациентов с бронхитическим фенотипом ХОБЛ частота обострений снизилась на 26,2%, тогда как у пациентов с эмфизематозным типом – на 1,1% [5].
При ретроспективном анализе объединенной базы данных 12-месячных клинических исследований рофлумиласта было установлено, что он достоверно снизил среднюю частоту обострений (на 1 пациента в год) во всех группах. Наиболее выраженным эффект рофлумиласта оказался у пациентов с 2 или более обострениями за предыдущий год (1,51 – для группы рофлумиласта и 1,95 – для плацебо; различие – 22,3%) [6]. У пациентов, получавших рофлумиласт, достоверно возрастало время до начала любого обострения.
В серии исследований изучалась возможность сочетанного применения рофлумиласта со стандартными методами лечения больных ХОБЛ. В одном из них пациенты были рандомизированы в группы с применением рофлумиласта 500 мкг 1 раз в сутки (n=1537) или плацебо (n=1554) в течение 52 нед. После рандомизации пациентов обследовали каждые 4 нед до 12-й недели, а затем – каждые 8 нед. Пациенты могли при необходимости принимать короткодействующие β2-агонисты и продолжить лечение длительно действующими β2-агонистами (ДДБА) или короткодействующими антихолинергическими препаратами в стабильных дозах. Применять в ходе исследования ИГКС и длительно действующие антихолинергические препараты не разрешалось. Анализ проводили с учетом назначенного лечения. Пациенты были стратифицированы в группы в зависимости от статуса курения, предшествующего применения ИГКС (их отменили перед началом исследования) и лечения ДДБА.
Данные двух 12-месячных исследований (М2-111 и М2-112) анализировали как по отдельности, так и после их объединения [7]. Приблизительно 50% пациентов в этих исследованиях продолжали принимать ДДБА в период лечения рофлумиластом. Последний снизил частоту обострений независимо от того, принимали пациенты сопутствующую поддерживающую терапию ХОБЛ или нет. Анализ выявил, что частота обострений у пациентов, получавших рофлумиласт, была в группе ДДБА на 21% меньше, чем при применении плацебо (p=0,0011) (рис. 3).
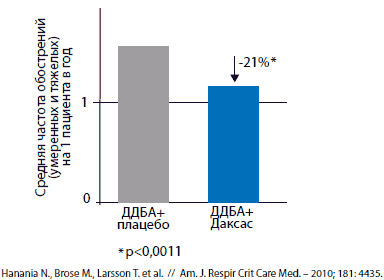
Рис. 3. Достоверное снижение частоты обострений ХОБЛ при добавлении Даксаса к терапии β2-агонистом
Кроме того, анализ объединенной базы данных основных 12-месячных исследований (M2-124 и M2-125) позволил оценить влияние рофлумиласта на функцию легких в группе принимавших ДДБА. По сравнению с плацебо лечение рофлумиластом достоверно улучшило показатели ОФВ1 до и после применения бронходилататора у всех пациентов, независимо от того, получали они одновременно ДДБА или нет. Эти данные свидетельствуют о том, что благоприятное действие рофлумиласта на функцию легких является аддитивным (добавочным) к такому же действию бронходилататоров [7].
В другом исследовании (M2-128) рофлумиласт при добавлении к тиотропию достоверно улучшил показатели ОФВ1 до и после применения бронходилататора по сравнению с плацебо (p<0,0001) (рис. 4). Улучшение показателей функции легких становилось очевидным уже через 4–8 нед лечения рофлумиластом и сохранялось на протяжении всего исследования [8].
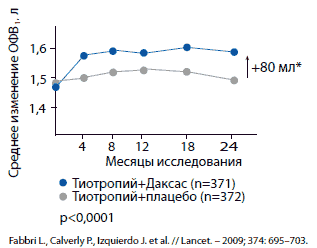
Рис. 4. Достоверное улучшение функции легких при добавлении Даксаса к терапии тиотропием
По данным объединенного анализа исследований (M2-111 и M2-112), у пациентов, получавших ИГКС, рофлумиласт снизил частоту умеренных или тяжелых обострений на 18,8%. Это подтверждает, что рофлумиласт отличается от ИГКС механизмом противовоспалительного действия. Тенденцию к более высокой эффективности препарата у пациентов, получающих ИГКС, можно частично объяснить тем, что последний добавляют в комплекс лечения при более тяжелой стадии ХОБЛ, когда риск обострения у пациентов выше (об этом свидетельствует более высокая частота обострений в группе плацебо у пациентов, получааших ИГКС, чем у пациентов, не получавших их, – соответственно 0,89 против 0,46); таким образом, у этих пациентов легче продемонстрировать влияние лечения на частоту обострений. У больных с бронхитическим фенотипом, которые получали ИГКС, рофлумиласт снизил (по сравнению с плацебо) частоту умеренных или тяжелых обострений на 30,2% [9].
Таким образом, серии разнообразных клинических исследований рофлумиласта установили ряд основных закономерностей лечебного действия препарата:
- рофлумиласт обладает выраженным противовоспалительным эффектом;
- в результате противовоспалительного действия рофлумиласта снижается частота обострений ХОБЛ и удлиняются периоды ремиссий;
- рофлумиласт успешно сочетается со стандартными средствами лечения ХОБЛ: пролонгированными β2-агонистами и антихолинергиками, а также с ИГКС, усиливая их действие;
- под влиянием рофлумиласта происходит существенное увеличение ОФВ1;
- наиболее эффективен рофлумиласт при бронхитическом типе ХОБЛ с частыми обострениями.
Клиническое применение любого препарата, особенно нового, предполагает оценку риска возникновения при его использовании нежелательных побочных явлений. В клинических исследованиях нежелательные явления отмечались приблизительно у 16% пациентов, получавших рофлумиласт, и 5% пациентов, получавших плацебо. Наиболее частыми нежелательными реакциями были диарея, снижение массы тела, тошнота, боль в животе и головная боль; большинство из них были легкими или умеренными, возникали в основном в первые несколько недель лечения и проходили при его продолжении. В 12-месячных клинических исследованиях у пациентов, получавших рофлумиласт, средняя масса тела снизилась на 2,09 кг, а в группе плацебо отмечена прибавка массы тела на 0,08 кг; различие между группами по средней массе тела составило 2,17 кг (p<0,0001). Масса тела в основном снижалась в первые 6 мес лечения, в дальнейшем скорость снижения уменьшалась. В ходе 12-недельного наблюдения у 126 пациентов со снижением массы тела контролировали эти изменения (из группы рофлумиласта – 91, плацебо – 35 больных). У большинства пациентов, получавших рофлумиласт, масса тела постепенно вернулась к норме, что свидетельствует об обратимости снижения после прекращения лечения рофлумиластом. Наибольшее абсолютное снижение массы тела наблюдалось у пациентов с ожирением (индекс массы тела – ИМТ >30 кг/м2), получавших рофлумиласт [10, 11]. ИМТ постепенно снижался у пациентов в группе рофлумиласта, пока не достиг плато примерно через 18 мес лечения (среднее снижение составило 0,73 кг/м2). У пациентов, получавших плацебо, в течение 24-недельного периода лечения значимого снижения ИМТ не наблюдалось (среднее снижение составило 0,03 кг/м2), различие с группой рофлумиласта – 0,76 кг/м2; p<0,0001. При измерении биоимпеданса после лечения выявлены лишь минимальные изменения индекса безжировой массы тела (ИБМТ) в группах рофлумиласта и плацебо. На начальном этапе значимого снижения ИБМТ в группе рофлумиласта не отмечалось, через 4 нед лечения выраженного (>0,2 кг) снижения в каждой из групп также не было, как и значимых различий изменения ИБМТ между группам. Эти данные показывают, что снижение массы тела, связанное с применением рофлумиласта, было преимущественно обусловлено уменьшением жировой массы тела и, очевидно, не связано с продолжительным снижением мышечной массы. Это свидетельствует о высокой безопасности рофлумиласта.
Таким образом, можно констатировать появление нового направления противовоспалительной терапии больных ХОБЛ. Ориентировочно установлены контингенты лиц, у которых рофлумиласт наиболее эффективен: это больные бронхитическим типом ХОБЛ с частыми обострениями, т. е. пациенты с большей скоростью прогрессирования и наименее благоприятным прогнозом. Другими словами, успешное применение рофлумиласта может менять фенотип больного ХОБЛ.
С учетом универсальности хронического воспаления при многих заболеваниях респираторной системы можно надеяться, что применение рофлумиласта откроет новые возможности в лечении саркоидоза и некоторых форм фиброзирующих альвеолитов. Что же касается его использования при ХОБЛ, то здесь предстоит решить еще некоторые вопросы, среди них:
- влияние рофлумиласта на системные проявления ХОБЛ;
- возможности восстановления чувствительности к ГКС у больных ХОБЛ под влиянием рофлумиласта;
- возможности применения рофлумиласта в ранних стадиях ХОБЛ для профилактики прогрессирования болезни.
Литература
- Blamoun A.; Batty G., DeBari V. et al. Khan. Statins May Reduce Episodes of Exacerbation and the Requirement for Intubation in Patients With COPD: Evidence From a Retrospective Cohort Study // Int. J. Clin. Pract. – 2008; 62 (9): 1373–1378.
- Grootendorst D., Gauw S., Verhoosel R. et al. Reduction in sputum neutrophils and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD // Thorax. – 2007; 62: 1081–1087.
- Rabe K., Bateman E., O’Donnell D. et al. Roflumilast–an oral antiinflammatory treatment for chronic obstructive pulmonary disease: a randomised controlled trial // Lancet. – 2005; 366: 563–571.
- Calverley P., Sanchez-Toril F., McIvor A. et al. Effect of 1-year treatment with roflumilast in severe chronic obstructive pulmonary disease // Am. J. Respir. Crit. Care Med. – 2007; 176: 154–161.
- Martinez F., Calverley P., Goehring U. et al. Defining patient populations in COPD: Experience with roflumilast. COPD7 2010; poster 12. Available at: www.copdconferences.org.
- Bateman E., Calverley P., Fabbri L. et al. Efficacy of roflumilast in patients with a history of frequent exacerbations: Pooled data from pivotal 12-month studies // Eur. Respir. J. – 2010; 36: P4003.
- Calverley P., Rabe K., Goehring U. et al. Roflumilast in symptomatic chronic obstructive disease: two randomised clinical trials // Lancet. – 2009; 374: 685–694.
- Fabbri L., Calverley P., Izquierdo-Alonso J. et al. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with longacting bronchodilators: two randomised clinical trials // Lancet. – 2009; 374: 695–703.
- Martinez F., Calverley P., Goehring U. et al. Defining patient populations in COPD: Experience with roflumilast. COPD7 2010; poster 12. Available at: www.copdconferences.org 10. Calverley P., Rabe K., Goehring U. et al. Roflumilast in symptomatic chronic obstructive disease: two randomised clinical trials // Lancet. – 2009; 374: 685–694.
- Martinez F., Rabe K., Wouters E. et al. Time course and reversibility of weight decrease with roflumilast, a phosphodiesterase inhibitor // Am. J. Respir. Crit. Care Med. – 2010; 181: A4441.
