Эффективность терапии хронической отраженной соматической боли в спине препаратом Катэна (габапентин)
Статьи Опубликовано в издании:
«ПСИХИАТРИЯ И ПСИХОФАРМАКОТЕРАПИЯ» Том 15, № 4
Н.С.Николаева, А.А.Фролов, А.Б.Данилов
ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ
Резюме. Цель исследования – оценить эффективность Катэны (габапентина) при лечении пациентов с отраженной соматической болью в спине. Препарат Катэна (габапентин) применялся для лечения 30 больных с отраженной соматической болью в спине на пояснично-крестцовом уровне. Курс терапии составил 1,5 мес. Габапентин применялся в суточной дозировке 300 мг/сут с последующим титрованием дозы до 1800 мг/сут. Интенсивность боли оценивали по ряду показателей, основными из которых были показатели визуальной аналоговой шкалы. Для оценки влияния габапентина на ноцицептивную и антиноци- цептивную системы применялась регистрация ноцицептивного флексорного рефлекса. Отмечена хорошая переносимость препарата Катэна, выявлены предикторы эффективности.
Ключевые слова: отраженная соматическая боль, хроническая боль в спине, габапентин, Катэна.
The effectiveness of drug Katena (gabapentin) for the treatment of chronic somatic reffered back pain
N.S.Nikolaeva, A.A.Frolov, A.B.Danilov
I.M.Sechenov First Moscow State Medical University, Department of Neurology
Summary. To assess the efficacy of Katena (gabapentin) in patients suffering from somatic reffered pain. Katena (gabapentin) was used to treat 30 patients with somatic reffered pain at the lumbosacral level. The treatment duration of each patient was 1,5 mounth. Gabapentin was used at a dose of 300 mg/day with subsequent dose titration to 1800 mg/day. Visual analog scale was the primary efficacy parameter. To assess the effect of gabapentin on the nociceptive and antinociceptive systems used in registration of nociceptive flexion reflex. Katena was well tolerated, was identified predictors of efficacy.
Key words: somatic reffered back pain, chronic back pain, gabapentin, Katena.
Боль в спине является ведущим состоянием в структуре обращаемости за медицинской помощью. Порядка 37,1% жалоб на первичном приеме у врача приходится на боль в спине. Около 7% населения испытывают выраженную боль и около 9% – инвалидизированы из-за нее, при этом боль в спине хотя бы раз на протяжении жизни развивалась у 85,5% людей [1]. Согласно статистике от 60 до 80% работоспособного населения страдает от болей в пояснично-крестцовой области [2–4].
Разработано множество способов оценки болевого синдрома, предложены различные схемы лечения, но консенсус между неврологами и другими специалистами до сих пор не достигнут. Многочисленные исследования показывают значительные вариации в использовании диагностических тестов и методов терапии данной патологии. Несмотря на различия в практическом подходе, результаты оказываются аналогичными и до сих пор не разработано единого эффективного метода терапии.
Вследствие того, что боль по-разному реагировала на различные лекарственные средства, возникла потребность в формировании нового взгляда на болевой синдром. Такие распространенные препараты, как нестероидные противовоспалительные препараты (НПВП) и анальгетики, в ряде случаев оказывались неэффективными. Ввиду данной проблемы возникло деление боли по механизмам возникновения.
Традиционно боль может быть представлена тремя основными патофизиологическими составляющими – ноцицептивной, нейропатической и психогенной [5, 6]. Ноцицептивная боль в спине связана с активацией болевых рецепторов – ноцицепторов. Одним из наиболее часто встречающихся состояний, связанных с формирование ноцицептивной боли, является спондило-артропатический болевой синдром, а также миофасциальный болевой синдром [7]. Боль, являющаяся прямым следствием заболевания или повреждения соматосенсорной системы, называется нейропатической. Нейропатическая боль в спине связана с повреждением нервной системы, например с поражением корешков при формировании грыжи межпозвоночного диска [8]. Психогенная боль (соматоформное болевое расстройство) «в чистом виде» встречается редко и крайне сложна для диагностики [9].
C.Woolf предлагает выделение еще одного типа боли дисфункционального, в основе которого ведущую роль в формировании клинических симптомов имеют центральные механизмы даже при наличии ноцицептивного или периферического нейропатического компонента [10]. При дисфункциональной боли главными патофизиологическими механизмами являются дезингибиция и центральная сенситизация [11]. Также важное значение имеют психосоциальные факторы. Таким образом, для адекватного лечения данного вида боли необходимо иметь данные о ведущем механизме формирования болевого синдрома в каждом конкретном случае.
К дисфункциональному типу боли относятся головная боль напряжения, фибромиалгия.
Отраженные боли представляют собой болевые ощущения в периферических областях при патологических процессах в глубоко расположенных тканях или внутренних органах. При этом могут возникать локальные гипералгезия, гиперестезия, напряжение мышц, местные вегетативные реакции. По патофизиологическим механизмам отраженная боль является скорее всего смешанной, с участием ноцицептивного и дисфункционального компонентов (центральная сенситизация). Отраженная боль бывает 2 типов:
1. Отраженная соматическая боль, которая проецируется от позвоночника в области, находящиеся в пределах близлежащих дерматомов.
2. Отраженная висцеральная боль, проецирующаяся от внутренних органов таза и брюшной полости (зоны Захарьина–Геда).
Поскольку источник отраженной боли в спине заключается в соматических тканях поясничного отдела, этот вид боли был назван соматической отраженной болью. Несмотря на все усилия международной ассоциации по изучению боли, все еще остается дискуссионным вопрос об определении локальной боли в спине, отраженной боли и корешковой боли (N.Bogduk).
Ноцицептивная боль в спине
По определению ноцицептивной болью должна быть боль, вызванная патологической импульсацией от структур поясничного отдела позвоночника. Наиболее мощным источником экспериментально индуцированной боли является задняя поверхность поясничных межпозвоночных дисков. Все проведенные экспериментальные исследования показали, что нанесение стимулов вызывало тупые, ноющие боли в спине [12]. Следовательно, когда такая характеристика встречается на практике, этот тип боли должен быть отнесен к ноцицептивной боли в спине.
Соматическая отраженная боль
Патологические импульсы от структур поясничного отдела позвоночника могут продуцировать отраженную боль в дополнение к боли в спине. Боль распространяется в нижние конечности и воспринимается в регионах, иннервируемых не теми нервами, которые иннервируют места, продуцирующие патологические стимулы, – это и есть основа отраженной боли [13]. Поскольку источник отраженной боли в спине заключается в соматических тканях поясничного отдела, этот вид боли был назван соматической отраженной болью [14], для того чтобы отличать ее от висцеральной отраженной боли и корешковой боли. Соматическая отраженная боль не связана со стимуляцией нервных корешков. Это вредные стимулы, продуцируемые нервными окончаниями таких структур, как межпозвоночные диски, фасеточные суставы, крестцово-подвздошные сочленения.
Отраженная боль не является обусловленной компрессией нервных корешков, ведь нет никаких неврологических знаков компрессии.
Соматическая отраженная боль тупая, ноющая, грызущая, иногда давящая, распирающая. Она распространяется в широких пределах, которые сложно локализовать. Первые исследования выделили несколько моделей сегментарного распределения отраженной соматической боли [15] (рис. 1).
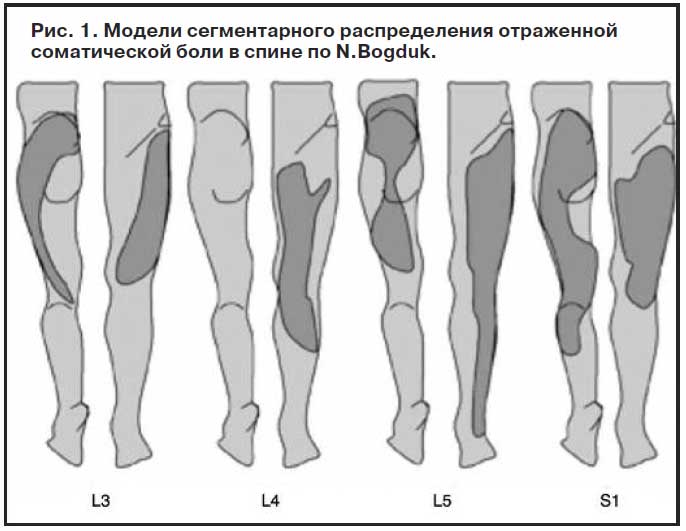
Таким образом, когда у пациента тупая ноющая боль в спине, распространяющаяся на нижнюю конечность и имеющая относительно фиксированную локализацию, следует говорить об отраженной соматической боли [16].
Корешковая боль
Корешковая боль отличается от соматической отраженной боли как механизмом образования, так и клиническими проявлениями. Физиологически эта боль связана с эктопическими разрядами от задних нервных корешков и ганглиев [17]. Грыжа диска является наиболее частой причиной, и воспаление поврежденного нерва является основой патофизиологического процесса [5, 18]. Боль этого типа является стреляющей по характеру и проходит по всей длине нижней конечности, но не более 2–3 см в ширину. Это единственный тип боли, полученный путем стимуляции нервных корешков [19]. Таким образом, только боли такого типа должны интерпретироваться как корешковые.
Неспособность различать отраженные соматические боли от корешковых болей может привести к ошибочному диагнозу и неправильному лечению. Ошибочно принимаемые отраженные боли за корешковые и создают впечатление, что корешковые боли являются наиболее распространенными. Распространенность корешковых болей на самом деле составляет около 12% или менее [16].
В настоящее время доминирующим является подбор терапии в зависимости от механизма образования болевогсиндрома, такой подход позволяет добиться целенаправленной и дифференцированной фармакотерапии.
Деление боли на нейропатическую, ноцицептивную и дисфункциональную важно с точки зрения подбора «механизмобусловленной терапии» (C.Woolf) [11].
При ноцицептивной боли главными патофизиологическими механизмами являются воспаление и мышечный спазм, и наиболее эффективны для лечения НПВП. Если речь идет о нейропатической боли, то в этом случае НПВП будут неэффективны, так как воспалительная реакция, на которую они влияют, не играет существенной роли при этом виде боли.
Механизмами нейропатической боли являются периферическая сенситизация, при которой особая роль принадлежит избыточной экспрессии и активности вольтажзависимых натриевых каналов на мембранах сенсорных периферических нейронов, и центральная сенситизация (гипервозбудимость центральных сенсорных нейронов), которая клинически проявляет себя, прежде всего, аллодинией и вторичной гипералгезией. Поэтому с точки зрения фармакотерапии обоснованно применение препаратов, действующих на эти звенья патогенеза, – антидепрессантов, габапентина, прегабалина, флупиртина [20, 21].
При дисфункциональной боли главными патофизиологическими механизмами являются дезингибиция и центральная сенситизация. Соответственно, необходим выбор препаратов, действующих на эти механизмы, например габапентин, прегабалин. Также важна при данном виде боли психосоциальная адаптация пациента. Габапентин изначально был синтезирован как структурный аналог γ-аминомасляной кислоты (ГАМК) и относится к широко используемым антиэпилептическим препаратам. По результатам, полученным на экспериментальных моделях животных, показано, что препарат усиливает синтез ГАМК, обладает модулирующим действием на N-метил-D-аспартат, блокирует α2δ-субъединицу кальциевых каналов, снижает высвобождение моноаминов, уменьшает синтез и транспорта глутамата, способствует уменьшению частоты потенциалов действия периферических нервов.
Таким образом, при торможении поступления ионов кальция в нейроны предотвращается дальнейший каскад биохимических изменений, ведущих к развитию стойкой гипервозбудимости ноцицептивных нейронов и развитию центральной сенситизации. Препарат хорошо переносится и редко вызывает побочные реакции (в основном головокружение, сонливость). Признаков серьезного взаимодействия габапентина с другими препаратами не зарегистрировано. Концентрация габапентина достигает пика через 2–3 ч после приема. Интервал дозирования не должен превышать 12 ч, биодоступность составляет 60%. Препарат выводится преимущественно почками и не метаболизируется в печени. При нарушении функции почек дозу габапентина подбирают с учетом клиренса креатинина.
Таким образом, габапентин как препарат, влияющий на центральные механизмы формирования боли, может быть эффективен в отношении отраженной соматической боли.
Материалы и методы
Обследованы 30 пациентов (16 мужчин, 14 женщин), средний возраст 41,2±7,3 года.
Критерии включения в исследование:
1. Мужчины и женщины в возрасте 21–80 лет на момент включения.
2. Способность выполнять процедуры исследования на всем его протяжении.
3. Установленный диагноз дорсопатия пояснично-крестцового отдела позвоночника с болевым синдромом неспецифического генеза.
4. Отсутствие компрессии нервного корешка при неврологическом осмотре, подтвержденное данными магнитно-резонансной томографии пояснично-крестцового отдела.
5. Наличие отраженной соматической боли в спине, согласно критериям N.Bogduk: локализация боли, не связанная с анатомическим повреждением; иррадиация болевого синдрома в прилежащие области; характер боли – ноющий, тупой, давящий.
6. Хроническое или подострое течение заболевания.
7. Пациент согласен на участие в исследовании, подписал информированное согласие.
Критерии исключения из исследования:
1. Болевой синдром специфического генеза (онкология, воспалительный процесс на спинальном уровне, синдром «конского хвоста»).
2. Наличие тяжелой соматической патологии.
3. Отказ пациента от участия в исследовании.
До включения в исследование все пациенты проходили терапию НПВП и/или миорелаксантами без видимого эффекта.
Всем пациентам проводилось полное клинико-неврологическое обследование до и после лечения: традиционный неврологический осмотр, оценка болевого синдрома по ВАШ, опросникам DN4, pain DETECT, оценка феномена взвинчивания (wind up). Для определения качества жизни (КЖ) использовался опросник Роланда–Морриса. Для объективизации болевого синдрома и оценки антиноцицептивных и ноцицептивных влияний проводилась регистрация НФР до и после лечения. Оценка боли по ВАШ проводилась ежедневно в течение 1-й недели, в последующем 1 раз в неделю.
Феномен wind up (временная суммация боли) исследовался при помощи нанесения серии из 10 уколов на участок кожи площадью 1см2. Индекс wind up рассчитывался как отношение интенсивности серии уколов по шкале ВАШ к интенсивности первого единичного укола. Так как нет данных о том, какой индекс wind up говорит о наличии центральной сенситизации, мы использовали группу контроля для получения нормативных данных. В нашем исследовании нормативный индекс феномена взвинчивания составил 12,34±7,5.
НФР относится к группе защитных рефлексов. Доказано, что у здорового человека имеется связь между порогом субъективного болевого ощущения и порогом возникновения НФР (J.Willer, 1983; G.Sandrini и соавт., 1993). Стимулирующие электроды располагают по ходу малоберцового нерва. Регистрирующие электроды располагают на брюшке m. Biceps femoris capitis brevis (катод) и на сухожилии этой мышцы (анод).
Исследование начиналось с подачи стимулов малой интенсивности с постепенным усилением. При появлении ответа (непроизвольное мышечное сокращение) фиксируется порог рефлекса (ПР), т.е. величина электрического тока, при которой он появился. Фиксируют также порог субъективной боли (ПБ), т.е. величину электрического стимула, при которой пациент говорит о появлении локализованной острой боли в области расположения стимулирующих электродов. Еще один показатель, применяемый при исследовании НФР, – коэффициент ПБ/ПР, который у здоровых равен примерно 0,9–1,0.
НФР имеет 2 последовательных компонента – R2 и R3. Нормальные пороговые величины, по данным литературы, составляют 5,0–7,0 мА для R2-ответа и 7,5–13,1 мА – для R3. Коэффициент ПБ/ПР равен 0,9–1,0.
Все пациенты находились на монотерапии габапентином и не получали других препаратов, используемых для лечения боли.
Результаты
Показатели интенсивности боли по ВАШ до лечения, в период лечения и через 1,5 мес лечения представлены на рис. 2.
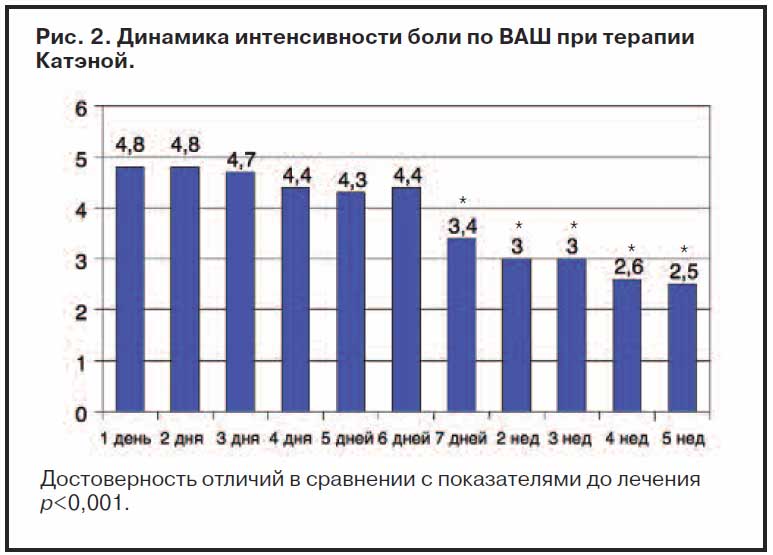
Как видно из рис. 2, достоверное снижение боли было отмечено ко 2-й неделе терапии и в дальнейшем сохранялось на протяжении всего курса лечения, с последующей положительной динамикой. Это очевидно также при оценке редукции показателей по ВАШ в процентах по отношению к интенсивности боли до лечения. Интенсивность боли до лечения составила 4,8±2,1 балла по ВАШ и достоверно снизилась после монотерапии габапентином до 2,5±2,0 (рПоказатели по опроснику DN4 до лечения были равны 4,23±1,8, что достоверно выше результатов после лечения, составивших 2,20±1,5 (р рис. 3.
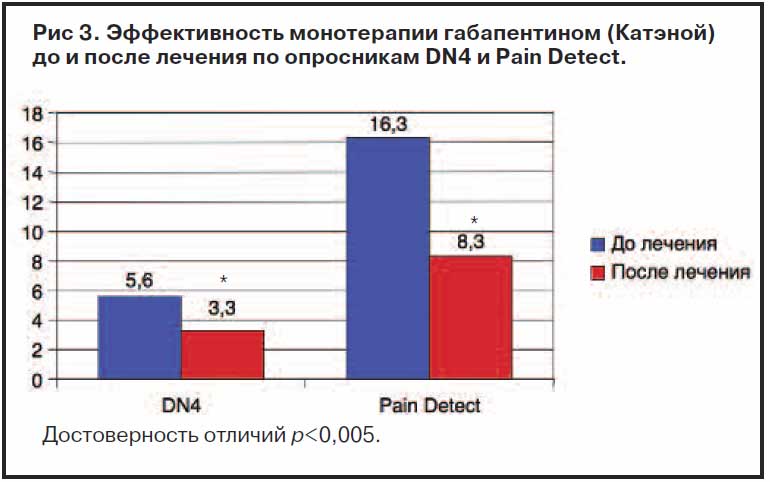
У пациентов, прошедших фармакотерапию габапентином, несколько уменьшалась частота возникновения парестезий до 8% (12% до начала лечения), признаки аллодинии встречались у 13%, тогда как до лечения этот симптом встречался у 25% пациентов. Кроме того, при опросе 78% пациентов отметили уменьшение зоны иррадиации боли после лечения, 22% не отмечали изменений в распространении болевого синдрома.
Улучшилось КЖ по опроснику Ролланда–Морриса: 6,9±2,0 до лечения, 4,3±3,2 после (р рис. 4.
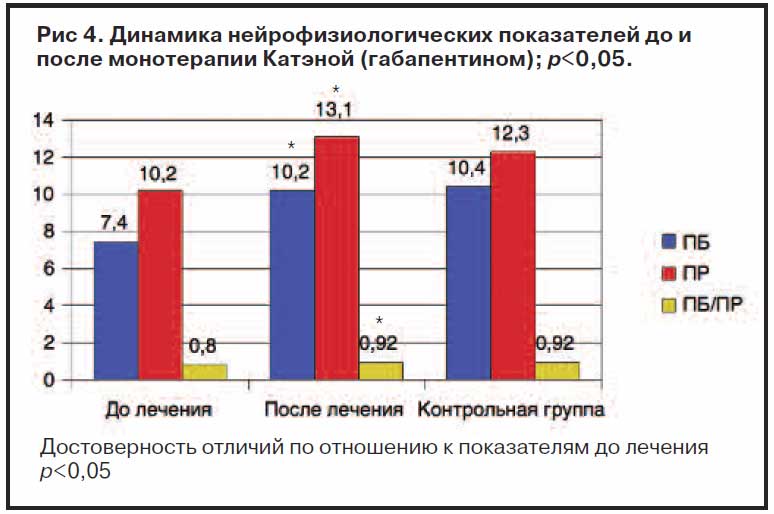
Как видно из рис. 4, пороговые величины ПБ и ПР, а также их соотношение после терапии приблизились к нормативным значениям.
Индекс wind up до лечения составил 31,2±13,4, тогда как после терапии достоверно снизился до 24,4±11,2 (рДля того чтобы определить, какие пациенты поддаются лечению Катэной (габапентином) в большей степени и выявить предикторы эффективности препарата, пациенты были разделены на группы с высокой эффективностью и меньшей эффективностью препарата. В группу с высокой эффективностью определялись пациенты, у которых произошло снижение интенсивности по ВАШ более чем на 40%, а также улучшение КЖ по опроснику Роланда–Морриса более чем на 30%.
Группа с высокой эффективностью лечения препаратом Катэна характеризовалась более длительным течением заболевания – 4,1±1,6 года (в группе сравнения 1,0±0,3; рВ группе с более выраженным нарушением жизнедеятельности по Роланду–Моррису (9,4±1,5) Катэна (габапентин) была более эффективна (5,1±2,3 балла в группе сравнения; р ОБСУЖДЕНИЕ
Для подбора конкретных препаратов для лечения боли важно знание патофизиологических механизмов, играющих ведущую роль в формировании боли в каждом конкретном случае. Диагностика только структурных изменений позвоночника является недостаточной для выбора терапии. Наряду с очень важной оценкой всех изменений, происходящих в позвоночнике, необходимо учитывать, что хроническая боль представляет собой самостоятельное заболевание со своими периферическими и центральными механизмами патогенеза. В основе дисфункционального типа боли лежат центральные механизмы формирования – центральная сенситизация и дезингибиция, что необходимо учитывать при подборе лечения.
В нашем исследовании показана эффективность препарата Катэна в отношении отраженной соматической боли в спине. На фоне терапии в суточной дозе 1800 мг/сут мы наблюдали как изменение клинических, так и нейрофизиологических показателей. Уменьшилась интенсивность боли, уменьшились показатели по нейропатическим опросникам, улучшилось КЖ. На фоне лечения уменьшилась иррадиация боли у большинства пациентов. Увеличились пороги появления боли и рефлекса, уменьшился индекс wind up, что подтверждает эффективность препарата в отношении центральных механизмов формирования боли.
Предикторами эффективности терапии препаратом Катэна (габапентин) у больных с соматической отраженной болью являются:
- показатели опросников нейропатической боли, не исключающие наличия этого компонента боли;
- наличие аллодинии;
- высокий уровень нарушения жизнедеятельности;
- низкий ПБ и порог НФР;
- высокий индекс wind up.
Таким образом, при наличии отраженной соматической боли предпочтение следует отдавать специальным препаратам, влияющим на центральные механизмы образования боли (габапентин, прегабалин, лидокаин, антидепрессанты).
Сведения об авторах
Николаева Наталия Сергеевна – аспирант каф. нервных болезней ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ.
Фролов Алексей Александрович – канд. мед. наук, врач-нейрофизиолог.
Данилов Андрей Борисович – д-р мед. наук, проф. каф. нервных болезней ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ.
Литература
1. Schmidt C, Raspe H, Pfingsten M et al. Back pain in the German adult population. Spine 2007; 37 (18): 2005–11.
2. Парфенов В.А., Батышева Т.Т. Боли в спине: особенности патогенеза, диагностики и лечения. health-ua.com
3. Попелянский Я.Ю. Ортопедическая неврология (вертеброневрология). М: Медпресс-информ, 2003.
4. Bogduk N. On the definitions and physiology of back pain, referred pain, and radicular pain. Pain 2009; 147.
5. Алексеев В.В., Яхно Н.Н. Боль. В кн.: Болезни нервной системы. Руководство для врачей. Под ред. Н.Н.Яхно. М.: Медицина, 2007; 1: 107–24.
6. Вознесенская Т.Г. Болевые синдромы в неврологической практике. Под ред. А.М.Вейна. М.: Медпресс, 1999; 6: 217–80.
7. Bogduk N, Schwarzer AC, Wang SC et al. Prevalence and clinical features of lumbar zygapophysial joint pain: a study in an Australian population with chronic low back pain. Ann Rheum Dis 1995; 54: 100–6.
8. Данилов А.Б., Давыдов О.С. Нейропатическая боль. М.: Боргес, 2007.
9. Мелкумова К.А., Подчуфарова Е.В., Яхно Н.Н. Особенности когнитивных функций у пациентов с хронической болью в спине. Журн. неврол. и психиатр. им. С.С.Корсакова. 2009; 11: 20–4.
10. Woolf CJ. Evidence for a central component of post-injury pain hypersensitivity. Nature 1983; 306: 686–8.
11. Woolf CJ. Pain: moving from symptom control toward mechanismspecific pharmacologic management. Ann Intern Med 2004; 140: 441–51.
12. Wiberg G. Back pain in relation to the nerve supply of the intervertebral disc. Acta Orthop Scand 1950; 19: 211–21.
13. Merskey H, Bogduk N. Classification of Chronic Pain. Seattle, WA. IASP Press 1994; 94–5.
14. Bogduk N. Lumbar dorsal ramus syndrome. Med J Aust 1980; 2: 537–41.
15. Kellgren JH. On the distribution of pain arising from deep somatic structures with charts of segmental pain areas. Clin Sci 1939; 4: 35–46.
16. Лиев А.А. Мануальная терапия миофасциальных болевых синдромов. Днепропетровск: Днепркнига, 1993; с. 28–31.
17. Чурюканов В.В., Кукушкин M.Л. О влиянии соматосенсорной коры на развитие деафферентационного болевого синдрома. Бюл. эксперим. биологии и медицины. 1993; 5: 473–5.
18. Dworkin RH. An over view of neuropathic pain: syndromes, symptoms, signs, and several mechanisms. Clin J Pain 2002; 18: 343–9.
19. Feinstein B, Langton JNK, Jameson RM, Schiller F. Experiments on pain reffered from deep somatic tissues. J Bone Joint Surg 1954; 35А: 981–7.
20. Jensen TS. Anticonvulsants in neuropathic pain: rationale and clinical evidence. Eur J Pain 2002; 6 (Suppl. A): 61–8.
21. Dworkin RH, Backonja M, Rowbotham MC et al. Advances in neuropathic pain: diagnosis, mechanisms, and treatment recommendations. Arch Neurol 2003; 60: 1524–34.
22. Anderson GB, Brown MD, Dvorak J et al. Weinstein JN: Consensus summary on the diagnosis and treatment of lumbar disc herniation. Spine 1996; 21: s75–8.
Комментарии
ПРАКТИКА ПЕДИАТРА
