Влияние ингибитора АПФ спираприла на структурно-функциональные свойства сосудистой стенки при метаболическом синдроме и эссенциальной гипертонии
Статьи Опубликовано в журнале:Российский кардиологический журнал № 2 (58) / 2006
Олейников В.Э., Матросова И.Б., Томашевская Ю.А., Герасимова А.С.
Пензенский медицинский институт при ПГУ, кафедра терапии, Пенза
Снижение податливости и увеличение жесткости артериальной системы - один из независимых факторов риска развития сердечно-сосудистых заболеваний и их осложнений. В связи с этим, изучение физических свойств сосудистой стенки при артериальной гипертонии (АГ) приобретает все большее клиническое значение [2]. В настоящей работе представлены результаты исследования влияния АГ и метаболического синдрома (МС) на состояние артериальной системы, а также рассмотрены возможности медикаментозной коррекции ремоделирования сосудов ингибитором АПФ спираприлом.
Действие некоторых ингибиторов АПФ на структурно-функциональное состояние сосудистой стенки оценивалось ранее [5, 11, 12], однако клиническая ценность спираприла в этом аспекте не рассматривалась.
Материал и методы
Обследовано 80 человек, включая 29 человек с МС, 27 больных с АГ 1 и 2 степени и 24 нормотензивных субъекта. МС диагностировали по критериям института национального здоровья США (Adult Treatment Panel III, 2001), согласно которым о наличии МС свидетельствуют 3 и более критерия из нижеперечисленных: окружность талии у мужчин > 102 см у женщин > 89 см; уровень триглицеридов плазмы крови > 1,69 ммоль/л, ХС ЛПВП у мужчин < 1,04 ммоль/л, у женщин < 1,29 ммоль/л; показатели глюкозы натощак > 6,1 ммоль/л и уровень САД > 130 мм рт.ст. и/или уровень ДАД > 85 мм рт.ст. [14].
В группе больных с МС в возрасте от 45 до 64 лет (средний возраст - 54,03 ± 0,9 года), ЧСС составила 70,7 ± 3,2 уд/мин., ИМТ - 30,8 ± 1,6 кг/м2; САД - 156,7 ± 2,6 мм рт.ст., ДАД -95,3 ± 1,5 мм рт.ст. У лиц с артериальной гипертензией 1-2 степени в возрасте от 21 до 66 лет (средний возраст - 47,6 ± 2,1 лет), ЧСС - 69 ± 2,2 уд/мин., ИМТ - 27,02 ± 0,7 кг/м2, САД - 147,9 ± 2,5мм рт.ст., ДАД - 94,19 ± 1,1 мм рт.ст. В контрольную группу вошли лица в возрасте от 43 до 58 лет (средний возраст - 49,4 ± 0,9); ЧСС составила 70,3 ± 1,7 уд/мин., ИМТ - 25,4 ± 0,7 кг/м2, САД- 121,7 ± 1,5 мм рт.ст., и ДАД - 80,5 ± 1,2 мм рт.ст.
Для оценки податливости артерий использовали прибор VaSera (VS-1000) (Fucuda Denshi, Япония), являющийся сфигмоманометром и сфигмографом. Аппарат измеряет и автоматически регистрирует АД осциллометрическим методом, плетизмограммы на 4-х конечностях (с помощью манжет), ЭКГ и ФКГ. Оценивали информативность и клиническое значение следующих показателей: скорости распространения пульсовой волны (СРПВ) справа и слева (R-PWV, L-PWV) и сердечно-лодыжечного сосудистого индекса (CAVI1 и L-CAVI1). У 15 больных с АГ 1 и 2 ст, не получавших регулярной антигипертензивной терапии, оценивали воспроизводимость этих показателей при двукратном определении одним и тем же исследователем с 3-х месячным интервалом в одинаковое время суток.
Прибор автоматически вычисляет СРПВ справа и слева (R-PWV, L-PWV) по формулам: 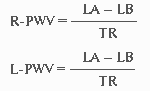
где LB - длина сосуда от начала аорты до места наложения манжеты на левую (или правую) голень, LА - длина сосуда от начала аорты до места наложения манжеты на правое плечо, TR, TL - время между началом пульсовой волны, регистрируемой на правом плече и началом пульсовой волны, регистрируемой на правой (левой) голени [18].
Сердечно-лодыжечный сосудистый индекс (CAVI1) - новый показатель для оценки истинной жесткости артерий, не зависящий от уровня АД и отраженной волны в сосуде между клапаном и голенью, вычисляется автоматически по формуле: 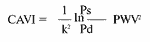
где k - константа, Ps и Pd - систолическое и диастолическое артериальное давление.
Кроме указанных показателей, автоматически определяется биологический возраст по нормограмме, учитывающей значения R/ L-PWV, фактический возраст и стандартное отклонение PWV [18].
В соответствии с дизайном исследования, 29 пациентов с МС (6 мужчин и 23 женщины) и 16 пациентов с АГ 1 и 2 ст. (8 женщин и 8 мужчин) получали препарат спираприл (Квадроприл®, Pliva) в дозе 6 мг/сут однократно. Если целевые значения АД не достигались (САД <140, ДАД < 90 мм рт.ст., а у больных СД 2 типа САД < 130 и ДАД < 85 мм рт.ст.), добавляли гипотиазид 12,5-25 мг/сут. Длительность лечения составила 16 недель.
Артериальное давление (АД офисное) измеряли по методу Короткова в положении сидя после 5 минут отдыха, трижды, через 1 минуту, с расчётом среднего значения. До лечения и через 16 недель проводили СМАД по стандартной методике. Всем пациентам, включённым в исследование, определяли биохимические показатели сыворотки крови: общий холестерин, триглицериды, ЛПВП и ЛПНП, глюкозу. СРПВ и CAVI оценивали до и через 4 месяца лечения.
Статистическую обработку данных осуществляли с помощью пакета программ Statistica 6. При статистической обработке использовали t-критерий, коэффициент корреляции по Пирсону; воспроизводимость оценивали с помощью дисперсионного анализа повторных измерений, парного t-критерия, коэффициента корреляции Пирсона, а также в соответствии с рекомендациями Bland и Altman. Результаты представлены в виде M±m, воспроизводимость - в виде M ± σ.
Результаты и обсуждение
Податливость артерий представляет собой результат сложных взаимодействий таких факторов, как жесткость, сопротивление и напряжение сосудистой стенки, отражение пульсовой волны, сосудистая растяжимость и эластичность. Эти понятия концептуально связаны между собой [4].
Под податливостью артерий (С) понимают изменение объема (ДV) в ответ на изменение давления (ДР): С= ДV/ДР. Податливость можно представить, как наклон нелинейной кривой "давление - объем" при данном значении давления [1, 2, 3].
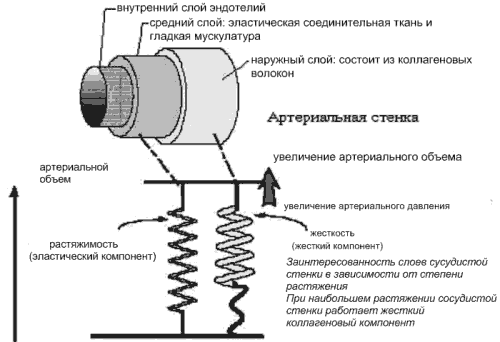
В растяжении сосудистой стенки при изменении давления задействованы как коллагеновые, так и эластические волокна. При низком уровне АД напряжение сосудистой стенки зависит, главным образом, от растяжения эластических волокон, при высоком АД - от более жёстких коллагеновых (рис.1) [2, 3, 8, 10].
Рис.1 Структурные и механические свойства артериального сегмента.
Растяжимость (Д1) определяется как отношение податливости к начальному объему и вычисляется по формуле:
Д1= ΔV/ΔР·V
где ΔV/ΔР - податливость, а V - начальный объем.
СРПВ (PWV) может определяться по уравнению Moens - Korteweg:
PWV=Eh/2rp
где PWV - скорость распространения пульсовой волны, E - модуль Юнга, h - толщина стенки, r - радиус, p - плотность жидкости.
СРПВ увеличивается с возрастанием жесткости артерий и увеличением толщины стенки сосуда. Модуль упругости - термин, описывающий жесткость сосудистой стенки. В отличие от податливости, он не зависит от размера и геометрии сосуда [1,2,3].
Одна из функций артериальной системы - преобразование пульсирующего неустойчивого артериального потока от сосудов в непрерывный и устойчивый - по капиллярам (эффект Windkessel). В норме во время систолы только часть потока крови (40-50%) продвигается вперёд, оставшаяся часть сохраняется в артериях (в основном, в крупных) и впоследствии поступает к периферическим органам и тканям в диастолу (рис.2) [8, 9].
Рис.2. Эффект Windkessel
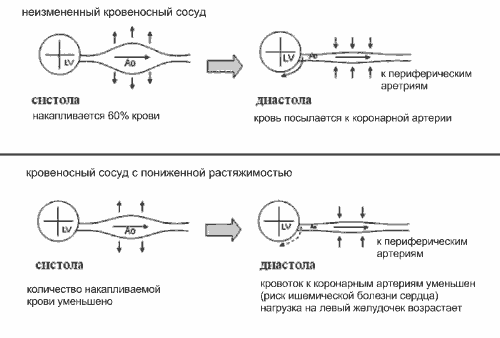
Важное последствие увеличения ригидности артерий - изменение постнагрузки левого желудочка (ЛЖ) и нарушение коронарной перфузии, что объясняется повышением САД и снижением ДАД, пульсовое давление при этом возрастает. Существуют 2 механизма влияния эластических свойств артериальной системы на АД. Первый механизм состоит в генерировании повышенного САД вследствие выброса крови из ЛЖ в ригидную артериальную систему и в уменьшении диастолической отдачи. Это ведёт к снижению ДАД. Второй механизм определяется влиянием ригидности артериальной стенки на СРПВ и продолжительность прямой и отражённой пульсовых волн [8, 9].
Податливость имеет структурные и функциональные компоненты. Непосредственное увеличение АД при эссенциальной артериальной гипертензии вызывает временное увеличение жесткости артерий чисто механически, поскольку существует прямая зависимость объем/давление. Это - функциональный эффект изменения давления. Однако, длительное увеличение АД может вызвать структурные изменения в стенке артерии. Артериальная гипертензия ускоряет развитие атеросклероза, гиперплазию и гипертрофию гладкомышечных волокон сосуда, синтез коллагена, делая сосуды более жесткими и менее податливыми [6].
В настоящем исследовании состояние сосудов оценивали по СРПВ и индексу CAVI, позволяющим косвенно оценить податливость артерий с помощью автоматического прибора, в котором АД измеряется осциллометрическим методом, имеющим высокую корреляцию с допплеровской методикой измерения. Сердечно-лодыжечный сосудистый индекс (CAVI), определяемый только с помощью автоматического прибора VaSera для оценки жесткости артерий, не зависит от уровня АД и отраженной волны в сосуде между клапаном сердца и голенью. Необходимо подчеркнуть, что величина CAVI прямо коррелирует с жесткостью сосудистой стенки [18].
На первом этапе для оценки адекватности используемой методики задачам исследования, была изучена воспроизводимость получаемых результатов у больных с АГ.
При оценке воспроизводимости значения R-PWV для первого и второго измерений составляли 13,53 ± 1,2 м/с и 13,5 ± 1,9 м/с; L-PWV - 13,27 ± 1,15 м/с и 13,25 ± 1,7 м/с соответственно. Показатели CAVI1 составляли 8,8 ± 1,7 и 8,42 ± 1,1 для первого и второго измерений и L-CAVI1 - 8,48 ± 1,4 и 8,3 ± 0,95 соответственно. Результаты, проанализированные в соответствии с рекомендациями Bland и Altman, показали среднюю разность абсолютных показателей для R-PWV - 0,03 ± 1,5м/с и для L-PWV - 0,013 ± 1,4м/с; для CAVI1 и L-CAVI1 0,38 ±0,09 и 0,23 ± 0,76 соответственно. Столь низкая разность показателей свидетельствует об отсутствии систематического расхождения между двумя измерениями. Хорошую согласованность результатов подтверждает дисперсионный анализ повторных измерений, парный t-критерий, а также достаточно высокий коэффициент корреляции Пирсона - для CAVI1 и L-CAVI1 - 0,85 (р < 0,001), для R-PWV и L-PWV - 0,65 (р < 0,05) и 0,58 (р < 0,05).
Таким образом, высокая воспроизводимость результатов, получаемая при использовании прибора VaSera (VS-1000), позволяет проводить динамическую оценку влияния медикаментозной терапии на СРПВ и индекс CAVI.
Результаты определения указанных показателей до лечения представлены на рис.3, 4. Как видно, в группе нормотензивных субъектов R-PWV составила 11,82 ± 0,2 м/с, L-PWV -11,81 ±0,2 м/с, CAVI1 и L-CAVI1 - 7,3 ± 0,07. У лиц с артериальной гипертензией 1-2 ст в сравнении с контрольной группой отмечались достоверно (р<0,05) более высокие показатели - R-PWV составила 13,1 ± 0,4 м/с и L-PWV -13,01 ± 0,8 м/с. Значения индекса CAVI1 и L-CAVI1 у пациентов этой группы были также выше, чем у нормотензивных лиц - 8,2 ± 0,2 (р<0,0001).
Рис.3 Сравнительная оценка исходных показателей R-PWV и L-PWV в группах нормотензивных лиц и больных с артериальной гипертензией и метаболическим синдромом.
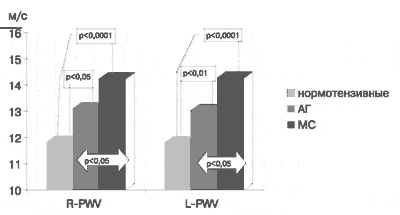
Рис.4. Сравнительная оценка исходных показателей CAVI1 и L-CAVI в группах нормотензивных лиц и больных с артериальной гипертензией и метаболическим синдромом.
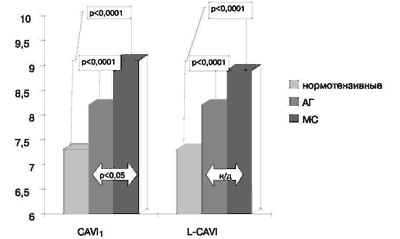
При обследовании больных с МС отмечено значительное увеличение всех исследуемых показателей по сравнению с контрольной группой (рис. 3, 4). Так, R-PWV составил 14,35 ± 0,47 м/с, L-PWV - 14,4 ± 0,5 м/с (р< 0,0001), CAVI1 - 9 ± 0,3 (р < 0,0001) и L-CAVI1- 8,57 ± 0,45 (р< 0,05). У лиц с МС значения показателей R-PWV, L-PWV и CAVI1 были так же достоверно выше, чем у пациентов с артериальной гипертензией 1-2 ст (р< 0,05).
Выявленное явное увеличение СРПВ и индекса CAVI1 при МС обусловлено, по-видимому, опосредованным влиянием МС на податливость артерий (за счет высокого АД), развивающимся в условиях инсулинорезистентности, которая вызывает извращение действия инсулина, и, как следствие, усиление выработки вазоконстрикторов. Кроме того, инсулинорезистентность способствует повышению стимуляции симпатической нервной системы, нарушает функцию эндотелия и внутриклеточный транспорт Na и Ca, повышает реабсорбцию Na. Инсулин опосредованно повышает активность ренин-ангиотензин-альдостероновой системы [13, 15].
Непосредственное влияние инсулинорезистентности на сосуды проявляется в усилении в них процессов пролиферации, гиперинсулинемия приводит к гиперплазии и гипертрофии гладкомышечных клеток артерий, а следствием усиления выработки инсулиноподобного фактора роста (ИФР-1) является гиперплазия мезанглия и гипертрофия левого желудочка [13, 14, 15].
Результаты настоящего исследования свидетельствуют, что как у пациентов с А Г, так и у больных с МС, показатели PWV и CAVI были существенно выше, чем у нормотензивных субъектов. Причем, при метаболическом синдроме эти показатели были значительно выше, чем при эссенциальной АГ.
Представленные данные дают основание заключить, что МС, вероятно, главным образом из-за инсулинорезистентности, вызывает более выраженные изменения в стенке артерии и, соответственно, большее снижение податливости, чем эссенциальная гипертензия. G. Reaven рассматривал МС как открытую систему, при которой к основным метаболическим изменениям (инсулинорезистентность, ожирение), выраженным у разных больных в разной степени, могут присоединяться другие нарушения и/или усугубляться выраженность уже имеющихся у больного изменений [19, 20]. Было установлено, что сочетание хотя бы трех симптомов МС с большой вероятностью ассоциируется с инсулинорезистентностью. Одним из вариантов МС является сочетание АГ с дислипидемией и абдоминальным ожирением при отсутствии манифестации нарушений углеводного обмена [15, 16, 20].
На начальных стадиях развития инсулинорезистентности происходит резкое повышение секреции инсулина клетками поджелудочной железы для поддержания гомеостаза глюкозы. Поэтому при проведении стандартного теста на толерантность к глюкозе на данном этапе у пациентов не выявляется нарушение углеводного обмена [17]. Таким образом, отсутствие у больного при обследовании нарушений углеводного обмена не исключает у него инсулинорезистентность при наличии других компонентов МС.
Необходимо подчеркнуть отсутствие различий изучаемых показателей в группах больных с полным и неполным МС. Это, во-первых, свидетельствует о выраженном в равной мере повреждении артерий у пациентов с повышенным и нормальным уровнем глюкозы в плазме крови; во-вторых, обуславливает немаловажное значение рассматриваемых показателей в определении прогноза и выборе медикаментозной терапии у больных с МС.
Для выявления возможных взаимосвязей во всех 3-х группах изучалась корреляция PWV и CAVI с возрастом, уровнем САД и ДАД, окружностью талии, индексом объем талии/объем бедер, биохимическими показателями (общий холестерин, ХС ЛПВП, ХС ЛПНП, триглицериды).
При анализе линейной регрессии и корреляции выявлено, что во всех 3-х группах отмечалась положительная корреляция R-PWV и L-PWV с возрастом, что согласуется с результатами других исследований [7]. В группе больных с МС для R-PWV коэффициент корреляции составил r=0,76 (p < 0,001), для L-PWV - r=0,73 (p< 0,001). У пациентов с АГ - r=0,6 (р< 0,05) для R-PWV и r=0,67 (р < 0,05) для L-PWV. В контрольной группе - r =0,68 (р < 0,05) для R-PWV и r=0,66 (р < 0,05) для L-PWV, соответственно. Необходимо отметить, что в группе больных с МС также была выявлена положительная корреляция возраста с CAVI1 (r=0,51; р< 0,05) и L-CAVI1 (r=0,58; р< 0,05).
В контрольной группе САД коррелировало с CAVI1 (r=0,62; р<0,05) и L-CAVI1 (r=0,65; р< 0,05), а ДАД - с R-PWV (r=0,71; p< 0,05) и L-PWV (r=0,69; p <0,05).
Корреляции PWV и CAVI с уровнем холестерина, триглицеридов, ЛПВП, ЛПНП, глюкозы, индексом М Т, индексом ОТ/ОБ, окружностью талии ни в одной из групп не установлено.
На фоне лечения Квадроприлом в виде монотерапии или в комбинации с диуретиком у больных АГ 1-2 ст отмечено достоверное снижение офисного САД со 149,8 ± 4,6мм рт.ст. до 123,9 ± 1,4 мм.рт.ст. ( на 17,3%; р = 0, 01) и ДАД - с 91,29± 2.2 мм рт.ст. до 80,86 ± 1,3мм рт.ст. ( на 11,4% ; р < 0,001 ). Достоверного изменения ЧСС, СРПВ и CAVI не выявлено.
В группе больных с МС после 16 недель лечения (рис. 5) произошло явное снижение (р < 0,001) как офисного САД - с 156,7±2,6 мм рт.ст до 130,1 ± 2,4 мм.рт.ст., так и ДАД - с 95,3±1,5 мм.рт.ст. до 82,58±1,4 мм рт.ст. Наряду со снижением АД, в этой группе пациентов наблюдалось уменьшение R-PWV с 14,5±0,4 м/с до 14,05±0,3 м/с (р = 0,001) и L-PWV с 14,91±0,5 м/с до 14,19±0,4 м/с (р = 0,0 05). Индексы CAVI1 и L-CAVI1 снизились на 7,6% и 5,7%, соответственно. Корреляции между снижением АД и изменением PWV и CAVI выявлено не было.
Рис.5 Динамика показателей R-PWV и L-PWV в группе больных с МС и АГ после 16 недель лечения Квадроприлом.
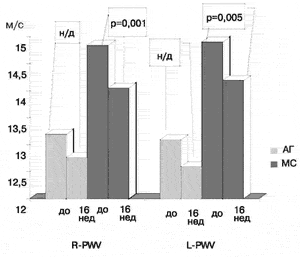
Как видно, из данных, представленных на рис.5, наряду с нормализацией офисного АД, достоверное снижение PWV и CAVI при применении Квадроприла наблюдается только в группе больных с МС. Следует, однако, отметить существенные различия в значениях исходных показателей PWV и CAVI у пациентов с МС и у больных с АГ. Это дает основания предполагать, что 16 недель лечения - недостаточный срок для появления структурных изменений сосудистой стенки у пациентов с А Г, которые могут быть выявлены использованной в настоящей работе методикой.
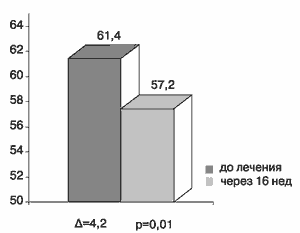
Интересно отметить, что у большинства больных с МС исходно определялся более высокий, чем паспортный, биологический возраст - в среднем 61,4 года. После лечения Квадроприлом произошло его достоверное снижение на 4 года (рис.6).
Рис.6 Биологический возраст больных в группе с метаболическим синдромом до и после 16 недель лечения Квадроприлом.
Возможны различные механизмы воздействия лекарственных средств на податливость сосудистой стенки при снижении АД; инициированной вазодилатации и, наконец, при прямом влиянии на структуру сосудистой стенки. Разумеется, более физиологична терапия, позитивно изменяющая структуру сосуда. По современным представлениям, ингибиторы АПФ являются группой препаратов, которые, кроме гемодинамических и вазодилатирующих эффектов, вызывают структурные изменения в стенке артерий [4, 11, 12]. Отмеченное в настоящем исследовании отсутствие корреляции между снижением АД и уменьшением PWV и CAVI демонстрирует не обусловленное гипотензивным эффектом прямое влияние ингибитора АПФ Квадроприла на структуру сосудистой стенки.
Выводы
- Артериальная гипертония 1-2 степени и метаболический синдром вызывают уменьшение податливости артерий. При метаболическом синдроме (полном и неполном) эти изменения более выражены.
- Оценка податливости артерий может быть проведена автоматически с помощью объёмной сфигмографии. Этот метод отличается высокой воспроизводимостью результатов и у больных с артериальной гипертонией и метаболическим синдромом может применяться для ранней диагностики сосудистых изменений.
- У больных с метаболическим синдромом ингибитор АПФ Квадроприл® эффективно нормализует АД и оказывает выраженное вазопротекторное действие в результате снижения жесткости и повышения упругости крупных артерий.
Квадроприл® - Досье препарата
Литература
1. Савицкий Н. Н. Биофизические основы кровообращения и клинические методы изучения гемодинамики// Л.1974.
2. Кочкина М.С., Затейщиков Д.А., Сидоренко Б.А. Измерение жёсткости артерий и её клиническое значение // Кардиология, 2005; 1: 63-71.
3. London G.M. Arterial remodeling and blood pressure in uremic patients. 2002.
4. Glasser S.P., Arnett D.K., PHD, Gary E., Mc Veigh, Finkelstein S.M., A.K. Bank et al. The importance of arterial compliance in cardiovascular drug therapy // J clin Pharmacol 1998; 38: 202-212.
5. Asmar R., Topouchian J., Pannier B.at al. Pulse wave velocity as endpoint in large-scale intervention trial. The Complior study // J. hypertens. 2001, Vo l 19 № 4, 813-818.
6. Safar M.E., Frohlich E.D. The arterial system in hypertension. A prospective view // Hypertension Vol 26, # 01 july 1995: 10-14.
7. Милягин В.А., Милягина И.В., Греков М.В. и др. Новый автоматизированный метод определения скорости распространения пульсовой волны // Функциональная диагностика 2004, 1: 33-39.
8. Nichols W.W., O'Rourlre M.E. Vascular impedance. In McDonald's Blood low in arteries: theoretical, experimental and clinical principles, 1998 (4edh), Edward Arnold, London.
9. O'Rourke M.E.. Arterial function in health and disease // Churchile Livingstone, 1982. - Edinburg.
10. Raine A.E.G., Margreiter R., Brunner P. P et al. Report on management of renal failure in Europe, XXII. 1991 // Nephrol Dial transplantation 1992; 7: 7-35.
11. De Cesavis R, Ranieri G et al. Forearm distensibility in patients with hypertension: comparatire effects of long-term ACE inhibition and betablocking // J. Clin Pharm ther. 1993; 53: 360-367.
12. De Luca N., Rosiello G. et al. Reversal of cardiac and large artery structural abnormalities indused by long-term antihypertensive treatment with trandolapril // Am.J.Cardiol. 1992; 6: 381-385.
13. Рязанов А.С., Аракелянц Т.Н., Юренев А.П. Патогенез артериальной гипертонии/ Терапевтический архив, 2003, № 3: 86-88.
14. Savers S.R. Insulin and insulin - like growth factor in normal and pathological cardiovascular physiology // Hypertension 1997; 29: 691-699.
15. Чазова И.Е., Мычка В.Б. Метаболический синдром. - М.: Медиа Медика, 2004. - 168с.
16. Мамедов М.Н. Метаболический синдром: практические аспекты диагностики и лечения в амбулаторных условиях // Москва, 2005.
17. Метаболический синдром. (Под редакцией Сокольского Е.И.). Пособие для терапевтов и кардиологов // М., 2005.
18. Руководство по эксплуатации к прибору VaSera VS - 1000 CAVI plus. Fukuda Denshi.
19. Reaven G.M. Insulin resistanse/compensatory hiperinsulinemia, essential hypertension, and cardiovascular disease // J. Clin.Endocrinol.Metab. 2003; 88: 2399-2403.
20. Мамедов М.Н., Оганов Р. Г. Необходимо ли определение инсулинорезистентности для диагностики метаболического синдрома в клинической практике? // Кардиология,2005, №4:92-97.
