Агомелатин в терапии большого депрессивного расстройства
Статьи Agomelatine in the Treatment of Major Depressive Disorder: An 8-Week, Multicenter, Randomized, Placebo-Controlled Trial
Stephen M. Stahl, MD, PhD; Maurizio Fava, MD; Madhukar H. Trivedi, MD; Angelika Caputo, PhD; Amy Shah, PharmD; и Anke Post, MD
J Clin Psychiatry. 2010
Цель: Оценить эффективность, безопасность и переносимость агомелатина в фиксированных дозах 25 и 50 мг/сут в терапии амбулаторных пациентов с умеренным-тяжелым большим депрессивным расстройством (БДР) в сравнении с плацебо.
Метод: В данном 8-недельном мультицентровом двойном-слепом с параллельными группами исследовании пациенты с БДР по критериям DSM-IV методом рандомизации распределялись (1:1:1) для однократного суточного приема агомелатина 25 мг, агомелатина 50 мг или плацебо. Главным показателем эффективности было изменение стартового балла 17-пунктовой Шкалы депрессии Гамильтона (HDRS17) по оценке клинициста на 8-й неделе терапии; другие показатели эффективности включали доли пациентов с клинической ремиссией и эффектом (в соответствии с показателями HDRS17), баллы Шкалы общего клинического впечатления, баллы Госпитальной шкалы тревоги и депрессии (HADS), субъективные показатели сна и общее качество жизни. Исследование проводилось с декабря 2006 г. по январь 2008 г.
Результаты: Агомелатин 25 мг/сут был эффективнее плацебо на протяжении всего периода терапии в соответствии с динамикой суммарного балла HDRS17 (P = 0.01) в сравнении с плацебо, тогда как при назначении агомелатина 50 мг/сут, статистически достоверная редукция суммарного балла HDRS17 отмечалась со 2-й до 6-й недели лечения, но не на 8-й неделе терапии (P = 0.144). В группе пациентов, получавших агомелатин 25 мг/сут, зафиксированы достоверно более высокие доли пациентов с клиническим эффектом (P = 0.013), клинической ремиссией (P = 0.07) и улучшением баллов Шкала общего клинического впечатления - Улучшение (P = 0.065) в сравнении с пациентами, получавшими плацебо. Не обнаружено статистически достоверных различий между пациентами, получавшими агомелатин 50 мг/сут, и пациентами из группы плацебо по показателям клинического эффекта (P = 0.116) или клинической ремиссии (P = 0.457). Терапия агомелатином 25 мг/сут обеспечивала достоверно более выраженное улучшение показателей HADS, качества сна и качества жизни в сравнении с плацебо. При использовании в обеих дозах агомелатин был безопасным и хорошо переносился пациентами, хотя в группе агомелатина 50 мг/сут отмечалось клинически значительное повышение аминотрансфераз.
Заключение: Агомелатин 25 мг/сут был эффективен в терапии пациентов с умеренным-тяжелым БДР и характеризовался безопасностью и хорошей переносимостью. Агомелатин 50 мг/сут обеспечивал антидепрессивный эффект до 6-й недели лечении и также был безопасным и хорошо переносился.
Большое депрессивное расстройство (БДР) является наиболее распространенным аффективным расстройством и сопряжено с тяжелым экономическим бременем и человеческими страданиями, включая снижение качества жизни (QoL), нарушения функционирования и повышенный уровень смертности. В соответствии с современными прогнозами к 2020 году депрессивное расстройство займет второе место среди лидирующих причин болезненности во всем мире.[1] Распространенность БДР на протяжении жизни в Соединенных Штатах составляет примерно 16.6%.[2] Менее четверти пациентов получают корректный диагноз и адекватную терапию.[3] Кроме того, многие из пациентов, которым назначается корректная фармакотерапия доступными препаратами, все же не получают адекватного лечения вследствие недостаточной комплаентности, плохой переносимости и низкой эффективности.
БДР часто обнаруживает хроническое и рекуррентное течение. У пациентов, перенесших 1 или 2 депрессивных эпизода, вероятность рецидивов варьирует от 55% до 90%. Более чем у 80% пациентов, перенесших второй эпизод и не получающих терапии, развивается третий эпизод в течение 3-х лет.[4] Основными средствами современной фармакологической терапии депрессии являются селективные ингибиторы обратного захвата серотонина [5,6] и ингибиторы обратного захвата серотонина и норадреналина,[7] обеспечивающие рациональный выбор метода лечения. Однако эти препараты эффективны не у всех пациентов и часто вызывают нежелательные побочные эффекты, такие как прибавка в весе и половые дисфункции. Недостаточная эффективность и нежелательные явления (НЯ) при использовании этих антидепрессантов часто становятся причиной преждевременной отмены терапии.[8] Даже при последовательной смене нескольких курсов терапии лишь небольшая часть пациентов остается без симптомов.[9] Соответственно сохраняется актуальность разработки новых антидепрессантов с более высокой эффективностью и улучшенной переносимостью.
При некотором упрощении нейробиологии БДР считается, что моноаминергические пути в центральной нервной системе, особенно с участием серотонина (5-HT) и норадреналина, связаны со многими симптомами БДР.[10] Более современные подходы к нейробиологии депрессии предусматривают оценку роли гормонов стресса, нарушений функции гипоталамо-гипофизарно-надпочечниковой системы, изменений в циркадианной системе (например, ритмы сон-бодрствование), изменений в нейропептидных механизмах и влияния на нейрогенез в определенных регионах центральной нервной системы.[10-14]
Перспективный подход к разработке инновационного антидепрессанта основан на данных о том, что дисрегуляция циркадианных ритмов является ключевым признаком аффективных расстройств.[15-17] Наиболее типичными проявлениями циркадианных нарушений являются расстройства сна, которые выявляются примерно у 80% пациентов с депрессией.[18,19]
Агомелатин является инновационным антидепрессантом с уникальным фармакологическим профилем – агонизм к MT1 и MT2 рецепторам и антагонизм к 5-HT2C рецепторам – который сочетает хронобиотическую активность со способностью усиливать функцию нейротрансмиттеров.[6] Агомелатин повышает моноаминергическую нейротрансмиссию (норадерналин и дофамин) в префронтальной коре, что, как было показано в экспериментальных исследованиях, связано с антидепрессивным эффектом у животных, предположительно вследствие антагонизма к 5-HT2C рецепторам.[20] Влияние агомелатина на медленноволновый сон,[21,22] которое может быть опосредовано 5-HT2C антагонизмом и агонизмом агомелатина к мелатонинергическим рецепторам, вносит вклад в такие эффекты агомелатина, как нормализация нарушенных циркадианных ритмов и коррекция нарушений сна.[23] Такой механизм действия рассматривается как инновационный подход к терапии БДР.[20,24,25] Антидепрессивные и анксиолитические свойства агомелатина установлены в клинических исследованиях26 и на преклинических моделях депрессии у животных.[27,28]
Агомелатин не вызывает прибавки в весе[29] и половых дисфункций, обнаруживая сходный с бупропионом профиль переносимости, что может быть обусловлено повышением выброса норадерналина и дофамина.[24,30] Агомелатин не вызывает симптомов отмены,[31] а также улучшает засыпание и качество сна у больных депрессией.[19] По уровню эффективности агомелатин как минимум сопоставим с современными антидепрессантами, но значительно превосходит их более благоприятным профилем НЯ.[32,33] Недавно агомелатин был зарегистрирован в Европейском Сообществе для терапии пациентов с БДР.
В данном исследовании оценивалась эффективность, безопасность и переносимость агомелатина в фиксированных дозах (25 мг и 50 мг однократно в сутки) в терапии амбулаторных пациентов с умеренным-тяжелым БДР в сравнении с плацебо.
МЕТОД
8-недельное, рандомизированное, двойное-слепое, с фиксированными дозами, плацебо-контролируемое, мультицентровое, с параллельными группами исследование проводилось в Соединенных Штатах с декабря 2006 г. до января 2008 г. в соответствии с принципами Качественной клинической практики и Хельсинской декларации 2002 года. Протокол исследования был одобрен этическими комитетами каждого центра. В настоящей статье представлены результаты двойного-слепого, плацебо-контролируемого исследования. Все участники дали письменное информированное согласие.
Таблица 1. Критерии включения и исключения
| Критерии включения
Подписание информированного согласия до выполнения любых оценок Пациенты мужского и женского пола в возрасте от 18 до 70 лет Диагноз БДР, единичный или рекуррентный эпизод по критериям DSM-IV Суммарный балл IVR HDRS17 > 20a Суммарный балл HDRS17 по оценке клинициста > 22a Балл CGI-S > 4a |
|
| Критерии исключения
Редукция скринингового суммарного балла HDRS17 более чем на 20% на момент стартовой оценки (IVR или по оценке клинициста) В анамнезе |
|
| Биполярное расстройство (I или II типа), шизофрения, шизоаффективное расстройство, расстройство пищевого поведения, обсессивно-компульсивное расстройство, любое другое текущее расстройство по Оси I по критериям DSM-IV Суицидальные попытки или суицидальные тенденции в течение последних 6 месяцев до скрининга Сердечная недостаточность с дисфункцией левого желудочка Позитивный серологический тест на вирусный гепатит и патология печени в анамнеза |
|
| На скрининге | |
| Злоупотребление психоактивными веществами или алкоголем, либо зависимость в последние 3 месяцаb Систолическое артериальное давление > 165 мм рт. ст. или диастолическое артериальное давление > 95 мм рт. ст.a Нестабильная стенокардияa Инфаркт миокарда и/или цереброваскулярное явление или инсультc Синдром удлиненного QT или QTc > 450 мсек (мужчины) или > 470 мсек (женщины)c Позитивные результаты лекарственного скрининга мочиc |
|
| Сопутствующая терапия | |
| Применение психоактивных препаратов после скринингового визита Применение препаратов с известными психотропными свойствами (включая, но не ограничиваясь, мелатонин, сусло Св. Джона, омега жирные кислоты) Терапия другими экспериментальными препаратами в течение 30 дней до скрининга Любая психотерапия в течение 30 дней до скрининга или в течение исследования Электросудорожная терапия, транскраниальная магнитная стимуляция, вагусная стимуляция в течение 3-х месяцев до скрининга |
|
| Разное | |
| Пациенты женского пола с сохранной детородной функцией, не использующие эффективных методов контрацепции, в периоде лактации или с позитивными результатами сывороточного теста на беременность, либо теста мочи на беременность по данным стартовых оценок Любое значимое заболевание, которое может препятствовать участию в исследовании и/или оценкам исследования Два и более документально зафиксированных неэффективных курса терапии текущего депрессивного эпизода зарегистрированными антидепрессантамиd Аномальные показатели лабораторных анализов на скрининге, оцениваемые исследователем как клинически значимые Пациенты, которые по оценке исследователя, будут не способны завершить исследование или не будут достаточно комплаентными к процедурам исследования, а также пациенты, занятые на сменной работе |
|
b В течение последних 6 месяцев.
c На скрининге.
d Период минимум 4 недели, в течение которых пациент получал адекватную дозу антидепрессанта.
Сокращения: CGI-S = Шкала общего клинического впечатления-Тяжесть заболевания, HDRS17 = 17-пунктовая Шкала депрессии Гамильтона, IVR=интерактивная голосовая система, БДР = большое депрессивное расстройство.
Выборка исследования
В исследование включались пациенты с диагнозом БДР по критериям DSM-IV [34]. Критерии включения и исключения представлены в Таблице 1. По завершении предрандомизационного периода длительностью до 14 дней 503 пациента из 49 центров методом рандомизации распределялись (1:1:1) для терапии агомелатином 25 мг/сут, агомелатином 50 мг/сут или плацебо в течение 8 недель. Препарат исследования назначался для перорального приема примерно за 1 час перед сном.
Показатели эффективности и безопасности
Плановые оценки эффективности и безопасности проводились на скрининговом визите (неделя от -2 до -1), на стартовом визите и визита, в фазе двойной-слепой терапии на неделях 1, 2, 3, 4, 6 и 8 (или преждевременное исключение) а также на неделе 9 (катамнез). Главным показателем эффективность было изменение стартового суммарного балла 17-пунктовой Шкалы депрессии Гамильтона (HDRS17) на неделе 8 по оценке клинициста.[35] В каждом центре шкала HDRS17 заполнялась сертифицированным оценщиком.
Дополнительные показатели эффективности и тяжести включали баллы 7-пунктовой Шкалы общего клинического впечатления-Улучшение (CGI-I),36 доли пациентов с клиническим улучшением, которое определялось по критерию 1 или 2 балла (1 = очень выраженное улучшение; 2 = выраженное улучшение) по шкале CGI-I. Клинический эффект квалифицировался у пациентов с редукцией стартового суммарного балла HDRS17 по оценке клинициста на минимум 50%, клиническая ремиссия определялась как суммарный балл HDRS17< 7 по оценке клинициста на неделе 8. Кроме того оценивалось изменение стартовых баллов подшкал HDRS17 (шкала Maier, тревога, заторможенность и сон) на 8-й неделе. Для оценки тяжести состояния использовалась 7-пунктовая Шкала общего клинического впечатления-Тяжесть заболевания (CGI-S). Дополнительные post hoc анализы для подтверждения результатов главного анализа включали анализ изменения суммарного балла HDRS17 за вычетом баллов по пунктам нарушений сна (ранняя инсомния, средняя инсомния и раннее утренние пробуждения) и анализ изменения балла по пункту 1 шкалы HDRS17 (депрессивное настроение) по визитам и на неделе 8.
Субъективные показатели сна (засыпание и качество сна) измерялись с помощью Вопросник для оценки сна Leeds (LSEQ; Leeds Сон Evaluation Questionnaire),[37] 10-пунктового инструмента для самооценки пациентами, состоящего из визуальных аналоговых шкал. Для анализа самооценки пациентами эффективности терапии использовалось изменение стартового суммарного балла, а также стартовых баллов депрессии и тревоги Госпитальной шкалы тревоги и депрессии (HADS)[38] на неделе 8. Оценка функционирования и QoL была основана на изменении стартовых суммарных баллов Шкала дезадаптации Шихана (SDS; Sheehan Disability Scale) на неделе 8,[39] которая предназначена для самооценки пациентом дезадаптации в трех областях жизни – профессиональной, социальной и семейной, а также Шкала оценки QoL при депрессии (QLDS; QoL in Depression Scale)[40] – вопросник для самооценки QoL, специфичный для депрессии.
Нежелательные явления, серьезные нежелательные явления (СНЯ) и случаи беременности отслеживались и регистрировались на протяжении всего периода исследования. Оценки безопасности также включали физикальное обследование (проводилось на скрининге и неделе 8/визите раннего исключения), витальные показатели, индекс массы тела, лабораторные анализы и параметры электрокардиограммы (регистрировались на скрининге, стартовом визите и на протяжении всего исследования). Данные по нежелательным явлениям были получены с помощью неструктурированного глобального метода, противоположного стандартизованному списку.
Клинические лабораторные образцы анализировались в центральной лаборатории, значимые отклонения сообщались исследователям. Наряду с рутинными образцами крови и мочи проводились дополнительные послестартовые тесты функции печени, включая концентрации аспартат аминотрансферазы (АСТ), аланин аминотрансферазы (АЛТ), γ-глутамил трансферазы (ГГТ), щелочной фосфатазы и билирубина, которые проводились на 2, 4, 6 и 8 неделе/визите раннего исключения.
Статистика
Расчеты объема выборки и мощности выполнялись в соответствии с главным показателем (изменение стартового суммарного балла HDRS17 на неделе 8) с помощью 2-сторонних t тестов. Допуская минимальный клинически значимый терапевтический эффект на уровне 3.0 и стандартное отклонение для главного показателя на уровне 8.0 в сумме потребуется 490 доступных для оценки пациентов (по 163 в каждой терапевтической группе), чтобы обеспечить минимум 90% мощности для опровержения минимум 1 нулевой гипотезы об отсутствии различий в эффективности между группами агомелатина и плацебо с помощью процедуры Hochberg [41] с общей α равной 5%. Мощность отдельных сравнения каждой дозы агомелатина с плацебо составит 87% на 2.5% уровне α.
Для коррекции множественности в главном анализе эффективности использовалась процедура Hochberg. Если набольшее значение P было < 0.05, обе нулевые гипотезы считались опровергнутыми. Если наибольшее значение P было > 0.05, соответствующая нулевая гипотеза не опровергалась и процедура продолжалась для меньших значений P. Что касается меньших значений P, соответствующая нулевая гипотеза опровергалась если P < 0.025 и ни одна из нулевых гипотез не опровергалась, если P > 0.025.
Анализы эффективности проводились на материале общей выборки терапии (intention-to-treat; ITT), в которую включались все рандомизированные пациенты, получившие минимум 1 дозу препарата исследования и прошедшие минимум 1 послестартовую оценку суммарного балла HDRS17. Однако 3 рандомизированных пациента были исключены из ITT и выборки безопасности данного исследования, поскольку они были последовательно рандомизированы во второе текущее исследование агомелатина.
Дескриптивная обобщающая статистика использовалась для количественных переменных, а частоты и доли рассчитывались для качественных переменных. Кроме того рассчитывались 2-сторонние 95% CI и значения P для различий между каждой дозой агомелатина и плацебо. Для каждой из двух доз агомелатина тестировались следующие нулевые гипотезы: отсутствие различий между агомелатином и плацебо в изменениях стартовых суммарных баллов HDRS17 на неделе 8 (метод замещения недостающего значения предыдущим [LOCF]). Тесты гипотез были 2-сторонними и основывались на различиях между каждой из двух доз агомелатина и плацебо в модели ковариационного анализа (ANCOVA), в которой терапия, объединенный центр и стартовый суммарный балл HDRS17 учитывались как поясняющая переменные (фиксированные эффекты).
Сходные анализы проводились для оценки влияния терапии на баллы подшкал HDRS17 (Maier, тревога, заторможенность и сон), балл пункта 1 шкалы HDRS17 (депрессивное настроение) и суммарный балл HDRS17 за вычетом 3 пунктов нарушений сна. Доли пациентов с клиническим улучшением, эффектом и ремиссией анализировались методом логистической регрессии с учетом терапии и стартового суммарного балла HDRS17 в качестве поясняющих переменных. Баллы шкалы CGI-S на неделе 8 (LOCF) анализировались с помощью теста Cochran-Mantel-Haenszel блоками из объединенных центров с учетом среднего статистического балла порядкового эффекта. Изменения суммарного стартового балла HADS и стартовых баллов подшкал HADS, суммарных баллов SDS и QLDS на неделе 8 (LOCF) анализировались в модели ANCOVA аналогично анализу главного показателя эффективности с учетом терапии и объединенного центра в качестве фиксированных эффектов. Кроме того, соответствующие стартовые баллы включались в модель в качестве поясняющих переменных. Баллы категорий LSEQ на неделе 8 (LOCF) анализировались в модели ANCOVA с учетом терапии, объединенного центра и стартового суммарного балла HDRS17 в качестве поясняющих переменных (фиксированные эффекты).
Для оценки различий между терапевтическими группами как функции времени в качестве дискретной переменной анализ чувствительности главного показателя эффективности с помощью модели смешанных эффектов для повторных измерений (MMRM), которая учитывала эффекты терапевтической группы, объединенного центра, стартового суммарного балла HDRS17, визита и взаимодействия между терапевтической группой и визитом. Дополнительные анализы чувствительности включали, в том числе, анализы «по визитам» и «по случаям» (данные не представлены).
Рисунок 1. Распределение пациентов и выборки для анализов
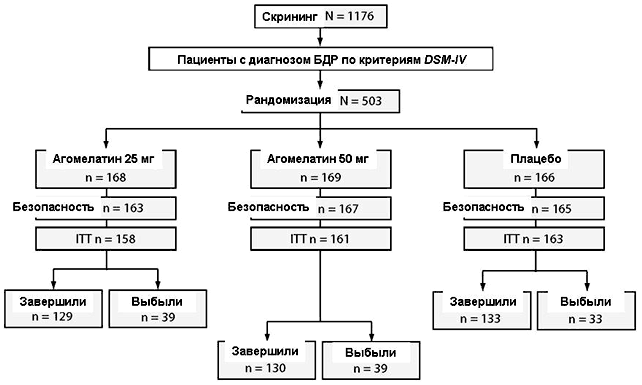
Сокращения: ITT = общая выборка терапии (intent-to-treat), БДР = большое депрессивное расстройство
Таблица 2. Стартовые демографические показатели по терапевтическим группам (N = 503)a
| Демографический показатель | Агомелатин 25 мг/сут (n=168) |
Агомелатин 50 мг/сут (n=169) |
Плацебо (n=166) |
| Возраст, n (%) | |||
| < 45 лет | 84 (50.0) | 83 (49.1) | 86 (51.8) |
| От 45 до < 65 лет | 80 (47.6) | 83 (49.1) | 72 (43.4) |
| > 65 лет | 4 (2.4) | 3 (1.8) | 8 (4.8) |
| Возраст, среднее (SD) | 43.2 (11.82) | 43.8 (11.96) | 43.0 (13.11) |
| Пол, n (%) | |||
| Женский | 114 (67.9) | 108 (63.9) | 107 (64.5) |
| Мужской | 54 (32.1) | 61 (36.1) | 59 (35.5) |
| Раса, n (%) | |||
| Кавказская | 124 (73.8) | 131 (77.5) | 123 (74.1) |
| Черная | 31 (18.5) | 25 (14.8) | 30 (18.1) |
| Азиатская | 5 (3.0) | 4 (2.4) | 3 (1.8) |
| Другая | 8 (4.8) | 9 (5.3) | 10 (6.0) |
| Число предыдущих эпизодов БДР, среднее (SD)b | 5.6 (8.45) | 5.7 (7.91) | 4.9 (6.14) |
| Суммарный балл HDRS17, среднее (SD)c | 26.8 (3.28) | 26.8 (3.35) | 26.4 (2.92) |
| a Всего было рандомизировано 503 пациента. b Выборка безопасности. Агомелатин 25 мг/сут, n = 163; агомелатин 50 мг/сут, n = 161; плацебо, n = 164. c Общая выборка терапии. Агомелатин 25 мг/сут, n = 158; агомелатин 50 мг/сут, n = 161; плацебо, n = 163. Сокращения: HDRS17 = 17-пунктовая Шкала депрессии Гамильтона, БДР = большое депрессивное расстройство. |
|||
РЕЗУЛЬТАТЫ
В данном исследовании скрининг прошли 1176 пациентов, из них было рандомизировано 503 пациента. Из 503 рандомизированных пациентов 76.9% среди распределенных в группы агомелатина и 80.1% среди распределенных в группу плацебо завершили исследование (Рисунок 1). Главными причинами исключения из исследования были обстоятельства из категории «другие» (преимущественно несоответствие критериям HDRS17 по оценкам интерактивной голосовой системы) и неприемлемые лабораторные показатели, которые препятствовали отбору 49.9% и 27.6% скринированных пациентов, соответственно.
Терапевтические группы были хорошо сбалансированными по стартовым демографическим характеристикам (Таблица 2). Средний возраст всех пациентов составил 43.3 года. Большинство пациентов были женского пола (65.1%) и кавказской расы (75.1%). Средний (± SD) стартовый суммарный балл HDRS17 был 26.6 (± 3.19) и соответствовал умеренному-тяжелому БДР. Среднее число предыдущих эпизодов БДР также было одинаковым в терапевтических группах (5.6 для агомелатина 25 мг, 5.7 для агомелатина 50 мг, 4.9 для плацебо) (Таблица 2).
Таблица 3. Изменения стартовых суммарных баллов HDRS17 на неделе 8 (LOCF) - выборка ITT (n = 482)
| Терапевтические группы в сравнении с плацебо | ||||||
| Стартовый средний балл (SE) |
Финальный средний балл (SE) |
LS среднее изменение (SE) |
Различия в LS средних изменениях | |||
| Терапия | Среднее (SE) | 95% CI | Значение P | |||
| Агомелатин 25 мг/сут (n = 158) | 26.8 (0.26) | 15.0 (0.64) | 11.8 (0.61) | 2.2 (0.85) | 0.5 to 3.9 | .010 |
| Агомелатин 50 мг/сут (n = 161) | 26.8 (0.26) | 15.9 (0.65) | 10.8 (0.61) | 1.2 (0.85) | -0.4 to 2.9 | .144 |
| Плацебо (n = 163) | 26.4 (0.23) | 17.1 (0.62) | 9.6 (0.60) | |||
| Сокращения: CI = доверительный интервал, HDRS17 = 17-пунктовая Шкала депрессии Гамильтона, ITT = общая выборка терапии (intent-to-treat), LOCF = замещение недостающего значения предыдущим, LS = минимальное квадратичное, SE = стандартная ошибка. | ||||||
Рисунок 2. Средние суммарные баллы 17-пунктовой Шкалы депрессии Гамильтона (HDRS17) по визитам исследования (MMRM) – выборка ITT, наблюдаемые случаиa
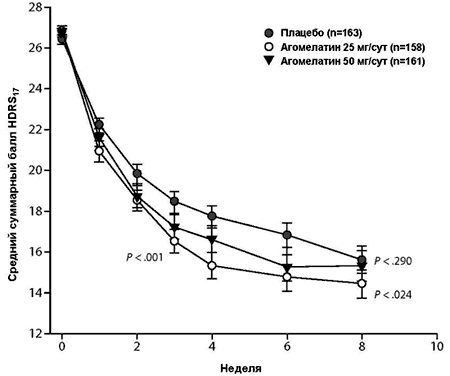
a Значения P (в сравнении с плацебо) для агомелатина 25 мг/сут составили 0.005 (неделя 1), 0.011 (неделя 2), < 0.001 (недели 3, 4), 0.001 (неделя 6) и 0.024 (неделя 8) и для агомелатина 50 мг/сут составили 0.109 (неделя 1), 0.041 (неделя 2), 0.029 (неделя 3), 0.053 (неделя 4), 0.014 (неделя 6) и 0.290 (неделя 8).
Сокращения: ITT = общая выборка терапии (intent-to-treat), MMRM = модель смешанных эффектов повторных измерений.
Результаты главного анализа эффективности
В выборке ITT (n = 482) средний стартовый суммарный балл HDRS17 снизился на момент финальной оценки (неделя 8, LOCF) во всех терапевтических группах. Расчетные различия между группой агомелатина 25 мг/сут и группой плацебо составили 2.2 балла с 95% CI (от 0.5 до 3.9) и значением P = 0.010, тогда как различие между группой агомелатина 50 мг/сут и группой плацебо составило 1.2 с 95% CI (от -0.4 до 2.9) и значением P = 0.144 (Таблица 3). Соответственно с использованием процедуры Hochberg различие между группой агомелатин 25 мг и группой плацебо было статистически достоверным (меньшее значение P в сравнении с α = 0.025), тогда как различие между группой агомелатина 50 мг и группой плацебо не было статистически достоверным (большее значение P в сравнении с α = 0.05).
В результате MMRM анализа баллов HDRS17 показано, что общие различия в минимальных квадратичных (LS) средних изменениях между агомелатином 25 мг/сут и плацебо составило 2.2 ± 0.61 (P < 0.001). Статистически достоверные различия отмечались уже на неделе 1 (P = 0.005) и далее на всех последующих этапах оценки (P = 0.024 на неделе 8). Общие различия между агомелатином 50 мг/сут и плацебо составили 1.4 ± 0.60 (P = 0.024) и были достоверными на неделях 2 (P = 0.041), 3 (P = 0.029) и 6 (P = 0.014), но не достигали статистической достоверности на неделях 1, 4 и 8 (P = 0.290 на неделе 8) (Рисунок 2).
Результаты дополнительных анализов эффективности
Баллы подшкал HDRS17 (Maier, тревога, заторможенность и сон).
Различие in LS среднее изменение from стартовое значение на неделе 8 (LOCF) achieved статистически достоверными между группа агомелатина 25 мг/сут и группа плацебо (P = 0.013) for the HDRS17 Maier subscale score (пункты 1, 2, 7, 8, 9 и 10). The respective LS среднее изменения were 5.5 ± 0.32 и 4.4 ± 0.32 in the агомелатин 25 мг/сут и группа плацебоs, соответственно. LS среднее изменение на неделе 8 для агомелатина 50 мг/сут was 5.0 ± 0.32 (P = 0.158). For the HDRS17 тревога subscale, the LS среднее изменения were 3.3 ± 0.21 для агомелатина 25 мг/сут (P = 0.277), 3.1 ± 0.21 для агомелатина 50 мг/сут (P = 0.751) и 3.0 ± 0.21 для плацебо.
При сравнении группы агомелатина 25 мг/сут и группы плацебо выявлены статистически достоверные различия в изменениях на неделе 8 стартовых суммарных баллов (LOCF) подшкалы HDRS17 заторможенность (пункты 1, 7, 8 и 14; LS среднее изменение = 0.7 ± 0.32, P = 0.022) и подшкалы HDRS17 сон (пункты 4, 5 и 6; P = 0.004). У пациентов в группах агомелатина 25 мг/сут и плацебо соответствующие LS среднее изменения баллов подшкалы сна составили 2.6 ± 0.16 и 1.9 ± 0.16, а среднее различие было 0.7 ± 0.22. При сравнении группы агомелатина 50 мг/сут и группы плацебо по изменениям баллов подшкалы заторможенность (LS среднее изменение = 0.5 ± 0.32) и подшкалы сна не обнаружено статистически достоверных различий.
Клинический эффект, ремиссия и улучшение по шкале CGI-I
Клинический эффект
В группах агомелатина 25 мг/сут и 50 мг/сут доли пациентов с клиническим эффектом (46.8% и 41.6%, соответственно) были выше в сравнении с группой плацебо (33.1%) на неделе 8 (LOCF) (Рисунок 3). Различия между группами агомелатина 25 мг/сут и плацебо были статистически достоверными (P = 0.013). Для группы агомелатина 50 мг/сут различия в сравнении с плацебо не были статистически достоверными (P = 0.116).
Рисунок 3. Доли пациентов с клиническим эффектом, клинической ремиссией и клиническим улучшением на 8-й неделе терапии
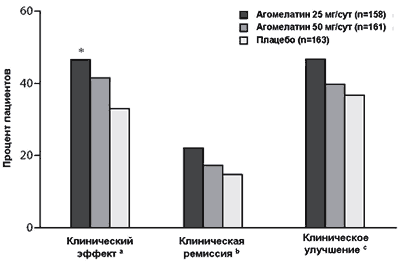
a Минимум 50% редукция стартового суммарного балла 17-пунктовой Шкалы депрессии Гамильтона.
b Суммарный балл 17-пунктовой Шкалы депрессии Гамильтона < 7.
c Шкала общего клинического впечатления-Улучшение (балл 1 или 2, соответствующий улучшению).
* P = 0.013 (в сравнении с плацебо).
Клиническая ремиссия. Доля пациентов, достигших клинической ремиссии на неделе 8 (LOCF), была выше в группе агомелатина 25 мг/сут в сравнении с группой плацебо (Рисунок 3), но различия не достигали статистической достоверности (22.2% и 14.7%, соответственно; P = 0.070). В группе агомелатина 50 мг/сут доля пациентов, достигших ремиссии, также была больше в сравнении с группой плацебо, однако различия не были статистически достоверными (17.4% и 14.7%, соответственно; P = 0.457).
Клиническое улучшение (CGI-I). Доля пациентов с клиническим улучшением в группах агомелатина была больше, чем в группе плацебо (Рисунок 3). Процент пациентов с улучшением по шкале CGI-I на неделе 8 (LOCF) в группе агомелатина 25 мг/сут, группе агомелатина 50 мг/сут и группе плацебо составил 46.8%, 39.8% и 36.8%, соответственно (P = 0.065 для агомелатина 25 мг/сут и P = 0.568 для агомелатина 50 мг/сут, в сравнении с плацебо).
Шкала общего клинического впечатления-Тяжесть заболевания. Доля пациентов с оценкой «норма, не болен» на неделе 8 (LOCF) была больше в обеих группах агомелатина (10.1% для группы агомелатина 25 мг/сут и 8.1% для группы агомелатина 50 мг/сут) в сравнении с группой плацебо (5.5%). Доля пациентов с оценкой «значительно болен» на неделе 8 была больше в группе плацебо (20.9%) в сравнении с группой агомелатина 25 мг/сут (11.4%) и группой агомелатина 50 мг/сут (16.8%). Различия в баллах CGI-S на неделе 8 между группой агомелатина 25 мг/сут и группой плацебо были статистически достоверными (P = 0.010), тогда как различия между группой агомелатина 50 мг/сут и группа плацебо не достигали уровня статистической достоверности (P = 0.115).
Госпитальная шкала тревоги и депрессии. Редукция среднего стартового суммарного балла HADS на неделе 8 (LOCF) отмечалась во всех терапевтических группах. Различия в LS средних изменениях составили 2.6 балла и были статистически достоверными только при сравнении группы агомелатина 25 мг/сут и группы плацебо (P = 0.004) (Таблица 4). Касательно баллов подшкал депрессии и тревоги HADS различия в LS средних изменениях между группами агомелатина 25 мг/сут и плацебо составили 1.3 балла для обеих подшкал и были статистически достоверными (P = 0.010 для подшкалы депрессии и P = 0.006 для подшкалы тревоги).
Вопросник для оценки сна Leeds. Позитивные различия, отражающие более выраженное улучшение в группах агомелатина 25 мг/сут и 50 мг/сут в сравнении с плацебо, установлены по категориям вопросника LSEQ «засыпание» и «качество сна» на неделе 8 (LOCF) (Рисунок 4A и B). По обеим категориям выявлены статистически достоверные различия в пользу агомелатина 25 мг/сут и 50 мг/сут в сравнении с плацебо.
Шкала дезадаптации Шихана. Средний стартовый суммарный балл SDS снизился во всех терапевтических группах. Уменьшение дезадаптации в соответствии с различиями в LS средних изменениях были статистически достоверно более выраженным в группе агомелатина 25 мг/сут (стартовый балл = 22.7, LS среднее изменение = 7.9) в сравнении с плацебо (стартовый балл = 22.3, LS среднее изменение = 6.2), среднее различие составило 1.7 балла ( P = 0.049). При этом не обнаружено различий в LS средних изменениях при сравнении группы агомелатина 50 мг/сут и группы плацебо (P = 0.970).
Шкала оценки QoL при депрессии. Среднее изменение стартовых суммарных баллов шкалы QLDS на неделе 8 (LOCF) составило 9.7 в группе агомелатина 25 мг/сут (среднее стартовое значение = 25.4), 8.4 в группе агомелатина 50 мг/сут (стартовое значение = 24.9) и 7.7 в группе плацебо (стартовое значение = 24.0). Отличия агомелатина 25 мг/сут и агомелатина 50 мг/сут от плацебо не были статистически достоверными (P = 0.082 и 0.508, соответственно).
HDRS17 пункт 1 (депрессивное настроение). В результате post hoc анализа установлено различие в LS средних изменениях стартовых баллов по пункту 1 шкалы HDRS17 (депрессивное настроение) на неделе 8 (LOCF) в выборке ITT, которое составило 0.2 (P = 0.044) при сравнении агомелатина 25 мг/сут с плацебо, тогда как отличие агомелатина 50 мг/сут от плацебо составило только 0.1 (P = 0.641). В анализе LS средних изменений стартовых баллов по пункту 1 шкалы HDRS17 по визитам выявлены статистически достоверные различия между агомелатином 25 мг/сут и плацебо, начиная с недели 1 и далее на протяжении всего периода терапии (данные не приводятся).
В post hoc анализе суммарных баллов HDRS17 за вычетом баллов по трем пунктам нарушений сна установлено более выраженное LS среднее изменение в группах агомелатина, которое составило 9.2 ± 0.52 для агомелатина 25 мг/сут (P = 0.035) и 8.5 ± 0.51 для агомелатина 50 мг/сут (P = 0.231), в сравнении с плацебо (7.7 ± 0.51).
Таблица 4. Изменение стартовых суммарных баллов Госпитальной шкалы тревоги и депрессии на неделе 8 (LOCF) - выборка ITT (n = 482)
| Терапевтические группы в сравнении с плацебо | ||||||
| Стартовый средний балл (SE) |
Финальный средний балл (SE) |
LS среднее изменение (SE) |
Различия в LS средних изменениях | |||
| Терапия | Среднее (SE) | 95% CI | Значение P | |||
| Агомелатин 25 мг/сут (n = 158) | 27.8 (0.49) | 18.4 (0.77) | 9.5 (0.65) | 2.6 (0.90) | 0.9 to 4.4 | .004 |
| Агомелатин 50 мг/сут (n = 161) | 27.9 (0.46) | 20.2 (0.74) | 7.7 (0.64) | 0.8 (0.90) | -0.9 to 2.6 | .345 |
| Плацебо (n = 163) | 26.4 (0.47) | 20.2 (0.66) | 6.9 (0.64) | |||
| Сокращения: ITT = общая выборка терапии (intent-to-treat), LOCF = замещение недостающего значения предыдущим, LS = минимальное квадратичное, SE = стандартная ошибка. | ||||||
Рисунок 4. Баллы вопросника для оценки сна Leeds (LSEQ) по визитам (LOCF): выборка ITT, post hoc анализ
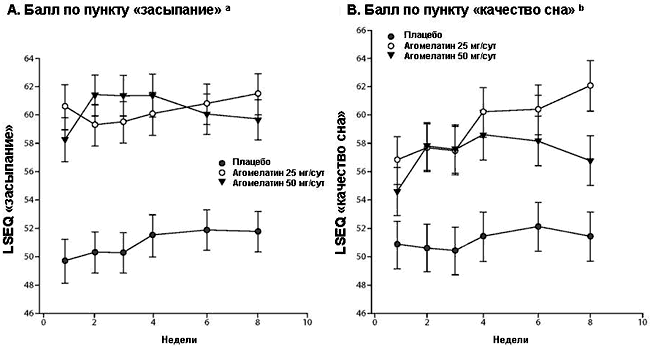
a По показателю «засыпание» установлены достоверно более выраженные различия в пользу обеих доз агомелатина на всех этапах оценки в сравнении с плацебо (P < 0.001).
b По показателю «качество сна» установлены достоверно более выраженные различия в сравнении с плацебо на всех этапах оценки в пользу агомелатина 25 мг/сут, а также со 2 до 8 недели в пользу агомелатина 50 мг/сут.
Сокращения: ITT = общая выборка терапии (intent-to-treat), LOCF = замещение недостающего значения предыдущим.
Безопасность
В выборке безопасности (n = 495) доля пациентов с НЯ были одинаковыми в обеих группах агомелатина и группе. Большинство НЯ были легкими или умеренными по выраженности. Наиболее частым органным классом были НЯ со стороны центральной нервной, затем следовали гастроинтестинальные расстройства.
Нежелательные явления зафиксированы у 69.9%, 70.7% и 65.5% пациентов, получавших агомелатин 25 мг/сут, агомелатин 50 мг/сут и плацебо, соответственно. В сравнении с плацебо более частыми НЯ при терапии агомелатином были расстройства центральной нервной системы: головная боль (13.3% против 17.0%), сонливость (9.1% против 4.2%), головокружение (7.3% против 3.0%) и седация (5.2% против 4.2%). Два пациента из группы агомелатина 25 мг/сут были исключены из исследования из-за головокружения, в группе плацебо случаев исключения пациентов по причине этого симптома не было. Связанными с расстройствами гастроинтестинальной системы НЯ, чаще наблюдавшимися при терапии агомелатином в сравнении с плацебо, были диарея (7.3% против 6.7%), тошнота (6.1% против 4.8%), сухость во рту (4.8% против 8.5%), диспепсия (2.7% против 2.4%) и запоры (2.7% против 1.8%). Другие НЯ включали боль в спине (3.3% против 1.2%), слабость (5.8% против 2.4%), назофарингит (5.2% против 4.2%), инфекцию верхних дыхательных путей (4.2% против 4.2%), грипп (2.4% против 1.2%) и гипертермию (2.4% против 0.6%).
НЯ, связанные с психическими расстройствами, включали инсомнию (3.3% против 6.1%), тревогу (2.4% против 3.0%) и аномальные сновидения (2.1% против 1.8%). За исключением случаев отмены терапии вследствие изменений показателей функции печени (2 пациента в группе агомелатина 50 мг/сут) отчетливых дозозависимых различий в профилях НЯ не установлено. По одному пациенту в каждой группе агомелатина и 2 пациента в группе плацебо обнаруживали СНЯ (Таблица 5). Случаев смерти во время исследования не зафиксировано.
Таблица 5. Смертельные исходы, другие серьезные или клинически значимые нежелательные явления и исключением из-за нежелательных явлений в терапевтических группах (выборка безопасности; n = 495)a
| Явление | Агомелатин 25 мг/сут (n = 163) |
Агомелатин 50 мг/сут (n = 167) |
Обе группы агомелатина (n = 330) |
Плацебо (n = 165) |
| Смерть | 0 | 0 | 0 | 0 |
| Серьезные нежелательные явления | 1 (0.6) | 1 (0.6) | 2 (0.6) | 2 (1.2) |
| Исключение из-за нежелательных явлений | 7 (4.3) | 10 (6.0) | 17 (5.2) | 8 (4.8) |
| Психические нежелательные явления | 32 (19.6) | 21 (12.6) | 53 (16.1) | 23 (13.9) |
Повышение аминотрансфераз (АЛТ/АСТ) чаще отмечалось в группе агомелатина 50 мг/сут. В сумме у 7 пациентов зафиксировано клинически существенное повышение АЛТ/АСТ: 1 пациент (0.6%) в группе агомелатина 25 мг/сут, 5 пациентов (3.0%) в группе агомелатина 50 мг/сут и 1 пациент (1.3%) в группе плацебо (критерий клинически существенного повышения АСТ, АЛТ, ГГТ и щелочной фосфатазы: превышение верхней границы нормы [ULN] в > 3 раза, для общего билирубина – превышение ULN в > 1.5 раз, т.е. > 26 раз (µмоль/л). Повышение АЛТ отмечалось только в 2 случаях в группе агомелатина 50 мг/сут (n = 2; 1.2%) в сравнении с группой агомелатина 25 мг/сут (n = 1; 0.6%) и группой плацебо (n = 1; 0.6%). Ни один из случаев клинически существенного повышения ферментов печени не был квалифицирован как СНЯ. В целом повышение аминотрансфераз отмечалось преимущественно в интервале между неделями 6 и 8 и было кратковременным. В 2 из 7 случаев повышения аминотрансфераз (оба в группе агомелатина 50 мг/сут) пациенты исключались из исследования, а уровни ферментов возвращались к норме после отмены терапии. У 4 из оставшихся 5 пациентов уровни аминотрансфераз возвращались к норме на фоне продолжения терапии агомелатином, у 1 пациента (агомелатин 25 мг/сут) не удалось получить катамнестических данных; 4 пациента (группа 50 мг/сут) были включены в 1-летнюю фазу открытой терапии этого исследования.
Агомелатина не оказывал значимого влияния на вес пациентов в течение всех 8 недель терапии. Клинически существенные изменения в массе тела (повышение/снижение в кг > 7%) отмечались у 1.9% и 1.3% пациентов в группах агомелатина и плацебо, соответственно, у которых наблюдалось увеличение веса, а также у 2.6%, 1.9% и 2.0% пациентов, получавших агомелатин 25 мг/сут, агомелатин 50 мг/сут и плацебо, соответственно, у которых зафиксировано снижение веса. Доли пациентов со связанными с терапией изменения параметров электрокардиограммы составили 6.1%, 7.3% и 9.3% в группах агомелатина 25 мг/сут, агомелатина 50 мг/сут и плацебо, соответственно. В большинстве случаев отмечались нарушения проводимости (преимущественно атриовентрикулярная блокада 1-й степени и левый передний полублок) и аномалии зубца T (преимущественно уплощение зубца T). Профили явлений были одинаковыми в обеих группах агомелатина и группе плацебо.
Исключение по причине НЯ потребовалось 4.3% пациентов в группе агомелатина 25 мг/сут, 6.0% в группе агомелатина 50 мг/сут и 4.8% в группе плацебо.
Главными причинами преждевременного исключения из-за НЯ были психические расстройства (по 1.8% в каждой группе агомелатина и 2.4% в группе плацебо) и расстройства нервной системы (1.8% в группе агомелатина 25 мг и по 1.2% в группах агомелатина 50 мг/сут и плацебо). Ни одно из НЯ, связанных с психическими расстройствами и расстройствами нервной системы, ставшее причиной преждевременного исключения из исследования, не было квалифицировано как СНЯ.
ОБСУЖДЕНИЕ
В проведенном исследовании в результате главного анализа эффективности показано, что агомелатин 25 мг/сут обеспечивает статистически достоверную редукцию симптомов БДР в соответствии с изменениями стартовых суммарных баллов оцениваемой клиницистами шкалы HDRS17 на неделе 8 (ITT-LOCF). Агомелатин 50 мг/сут не достигал статистически достоверного превосходства над плацебо по главному показателю эффективности на неделе 8, но обеспечивал статистически достоверную редукцию стартовых суммарных баллов HDRS на неделях 2, 3 и 6.
MMRM является надежным инструментом для компенсации недостающих данных в клинических исследованиях.[42] Эффективность агомелатина 25 мг/сут, установленная в соответствии с главным анализом эффективности, подтверждается результатами MMRM (ITT-наблюдаемые случаи) анализа на неделе 8, которые свидетельствуют о статистически достоверных различиях в изменениях стартовых суммарных баллов HDRS17 между агомелатином 25 мг/сут и плацебо. Кроме того, статистически достоверные различия в изменениях стартовых баллов HDRS17 (MMRM) между группами агомелатина 25 мг/сут и плацебо отмечались уже на 1 неделе и далее на каждом этапе оценки вплоть до недели 8. Различия между группами агомелатина 50 мг/сут и плацебо были статистически достоверными на неделях 2, 3 и 6. Эти данные подтверждают антидепрессивный эффект агомелатина в обеих дозах.[43,44]
Доли пациентов с клиническим эффектом, ремиссией или улучшением на неделе 8 были больше в группах агомелатина в сравнении с группой плацебо. Эти результаты согласуются с данными предыдущих исследований агомелатина.[30,45,46] Статистически достоверные различия в сравнении с плацебо установлены при оценке клинического эффекта в группе агомелатина 25 мг/сут, но не обнаружены в группе агомелатина 50 мг/сут. Хотя показатели ремиссии (по критерию шкалы HDRS17) и улучшения (по критерию шкалы CGI-I) были выше в группе агомелатина 25 мг/сут, они не достигали уровня статистически достоверных. Ранее Tedlow et al47 сообщали о том, что в кратковременных исследованиях очень трудно достичь ремиссии у пациентов с относительно высокими баллами HDRS. Соответственно многим пациентам может потребоваться более длительная терапия для достижения ремиссии в исследованиях антидепрессантов.
В соответствии с оценками по CGI-S пациенты, получавшие агомелатин в обеих дозах, обнаруживали менее тяжелую депрессию на неделе 8 в сравнении с пациентами, получавшими плацебо. Статистически достоверные различия были обнаружены при сравнении с плацебо группы агомелатина 25 мг/сут, но не были обнаружены для агомелатина 50 мг/сут. Баллы подшкал HDRS17 на неделе 8 отражают статистически достоверную редукцию ядерных аффективных симптомов депрессии (подшкала Maier), заторможенности и нарушений сна в группе агомелатина 25 мг/сут в сравнении с плацебо. Результаты анализа самооценок пациентов по шкале HADS свидетельствуют о статистически достоверном улучшении как суммарного балла шкалы, так и баллов подшкал депрессии и тревоги в группе агомелатина 25 мг/сут. При терапии агомелатином 50 мг/сут редукция баллов по подшкалам HDRS17 или HADS не была статистически достоверно более выраженной в сравнении с плацебо.
В предыдущих исследованиях показано улучшение сна у пациентов, получавших агомелатин.[22,23,48] В нашем исследовании агомелатин 25 мг/сут обеспечивал значительную редукцию симптомов нарушений сна в сравнении с плацебо. Такое заключение основано на редукции баллов подшкалы сна шкалы HDRS, снижении баллов всех категорий вопросника LSEQ и снижении частоты инсомнии как НЯ у пациентов, получавших агомелатин. Однако, статистически достоверные изменения баллов подшкал Maier и заторможенности шкалы HDRS, а также суммарного балла и баллов подшкал HADS свидетельствуют, что агомелатин также эффективно воздействует на другие ядерные симптомы депрессии, а не только на расстройства сна. Следовательно можно считать, что антидепрессивный эффект агомелатина 25 мг/сут при кратковременной терапии обусловлен другими компонентами клинического действия, не связанными с коррекцией нарушений сна. Такое заключение дополнительно подтверждается статистически достоверной редукцией баллов по пункту 1 шкалы HDRS (депрессивное настроение) в группе агомелатина 25 мг/сут, а также достоверным влиянием агомелатина 25 мг/сут на суммарный балл HDRS17 за вычетом пунктов нарушений сна.
Депрессия оказывает негативное влияние на QoL,49 часто со снижением социального функционирования.[50] Несмотря на кратковременный период терапии в данном исследовании агомелатин 25 мг/сут обеспечивал повышение баллов QoL (без статистически достоверных различий) и улучшение функционирования по SDS, а также статистически достоверное улучшение подшкалы «работа». Эти результаты, основанные на широком спектре оценок благополучия пациентов, свидетельствуют о клинической значимости антидепрессивного эффекта агомелатина при кратковременной терапии большой депрессии.
В исследовании установлен антидепрессивный эффект агомелатина 25 мг/сут при кратковременной терапии пациентов с БДР. Агомелатин 50 мг/сут обнаруживал абсолютное, но не достигающее статистической достоверности, превосходство над плацебо. Соответственно в проведенном исследовании не было получено подтверждения дозозависимости эффекта агомелатина. Однако редукция суммарных баллов HDRS17 при терапии агомелатином 50 мг была статистически достоверно более выраженной в сравнении с плацебо до недели 6, что согласуется с результатами оценки эффективности агомелатина 50 мг/сут в другом исследовании (неопубликованные данные авторов). На последнем визите (неделя 8) изменение суммарного балла HDRS17 в группе агомелатина 50 мг/сут утрачивало статистическую достоверность. Плацебо эффект, наблюдавшийся в нашем исследовании, был сопоставим с эффектом плацебо в других клинических исследованиях антидепрессантов и был обусловленным частыми визитами, позитивными ожиданиями пациентов относительно эффективности и переносимости препарата, а также поддержкой со стороны персонала в центрах исследования, что также могло влиять на результаты оценки антидепрессивного эффекта в группе агомелатина 50 мг/сут. В целом полученные результаты не позволяют полностью оценить антидепрессивный эффект агомелатина в дозе 50 мг/сут.
Антидепрессивный эффект агомелатина, установленный в данном исследовании, сопоставим с результатами предыдущих исследований агомелатина, в которых также установлена значительная редукция баллов HDRS17 при назначении агомелатина в дозах 25-50 мг.[51,52]
В целом показатели переносимости и частоты преждевременной отмены из-за НЯ были одинаковыми в группах агомелатина и плацебо. Дозозависимости побочных эффектов в группах агомелатина по показателям СНЯ, НЯ или преждевременного исключения из-за НЯ не обнаружено. Хотя наше исследование было слишком кратковременным для оценки влияния агомелатина на массу тела, в целом на протяжении 8 недель исследования агомелатин оставался нейтральным в отношении веса. Применение агомелатина сопровождалось транзиторным дозозависимым повышением печеночных аминотрансфераз. Клинически существенное повышение аминотрансфераз чаще наблюдалось в группе агомелатина 50 мг/сут (2.4%), но частота клинически существенного повышения аминотрансфераз в группе агомелатина 25 мг/сут (0.6%) и группе плацебо (0.6%) была одинаковой. Ни в одном из случаев повышения аминотрансфераз не наблюдалось никаких признаков токсичности (ни клинических симптомов, ни изменений в лабораторных показателях).
В целом доли пациентов, преждевременно исключенных из исследования из-за НЯ, были одинаковыми в группах агомелатина и плацебо.
В связи с кратковременностью терапии полученные в нашем исследовании данные нельзя экстраполировать на длительную терапию. Обобщение результатов также лимитируется относительно высокими стартовыми баллами HDRS17, которые требовались для включения пациентов в исследование, и исключением пациентов с любыми коморбидными психическими расстройствами по Оси I. В связи с этим необходимы дополнительные данные для подтверждения эффективности и безопасности агомелатина в терапии БДР, которые могут быть получены в текущих длительных исследованиях агомелатина.
ЗАКЛЮЧЕНИЕ
Результаты исследования подтверждают, что агомелатин эффективен при кратковременной терапии пациентов с умеренной и тяжелой депрессией. Агомелатин 25 мг/сут обеспечивал более выраженную и быструю редукцию всех ядерных симптомов депрессии в сравнении с плацебо на протяжении всего курса терапии исследования, тогда как агомелатин 50 мг/сут обнаруживал достоверный антидепрессивный эффект до 6 недели лечения, но не до конца исследования. Агомелатин оказывал значимое воздействие на субъективные симптомы сна, но общий терапевтический эффект препарата также был обусловлен воздействием на другие ядерные симптомы депрессии.
В целом агомелатин хорошо переносился пациентами, большинство НЯ были легкими или умеренными. Клинически существенное транзиторное повышение аминотрансфераз отмечалось у 2.4% пациентов в группе агомелатина 50 мг/сут. Частота преждевременной отмены терапии была одинаковой в группах агомелатина и плацебо.
Место работы авторов: Department of Psychiatry, University of California, San Diego (Доктор Stahl); Department of Psychiatry, Massachusetts General Hospital, Boston (Доктор Fava); University of Texas Southwestern Medical Center, Dallas (Доктор Trivedi); Novartis Pharma AG, Basel, Switzerland (Drs Caputo и Post); и Novartis Pharmaceutical Corporation, East Hanover, New Jersey (Доктор Shah).
Финансирование/поддержка: Исследование полностью спонсировалось компанией Novartis Pharma AG, Базель, Швейцария.
Потенциальный конфликт интересов: Доктор Stahl на протяжении последних 12 месяцев (апрель 2008 – май 2009) выполнял обязанности консультанта для компаний Arena, Azur, Bionevia, Boehringer Ingelheim, Bristol-Myers Squibb, CeNeRx, Dainippon Sumitomo, Eli Lilly, Endo, Forest, Janssen, Jazz, Johnson & Johnson, Labopharm, Lundbeck, Marinus, Neuronetics, Novartis, Noven, Pamlab, Pfizer, Pierre Fabre, Sanofi, Sepracor, Servier, Shire, SK Corporation, Solvay, Somaxon, Tetragenex и Vanda; has served on speakers bureaus for Wyeth, Pfizer и Eli Lilly; и has received grant support from Forest, Johnson & Johnson, Novartis, Organon, Pamlab, Pfizer, Sepracor, Shire, Takeda, Vanda и Wyeth. Доктор Fava получал исследовательские гранты от компаний Abbott, Alkermes, Aspect Medical Systems, AstraZeneca, Bio Research, BrainCells, Bristol-Myers Squibb, Cephalon, Клинический Исследование Solutions, Eli Lilly, Forest, Ganeden, GlaxoSmithKline, Johnson & Johnson, Lichtwer Pharma, Lorex, NARSAD, NCCAM, NIDA, NIMH, Novartis, Organon, Pamlab, Pfizer, Pharmavite, Roche, Sanofi-Aventis, Shire, Solvay, Synthelabo и Wyeth-Ayerst; выполнял обязанности консультанта или советника для компаний Abbott, Amarin, Aspect Medical Systems, AstraZeneca, Auspex, Bayer, Best Practice Project Management, Biovail, BrainCells, Bristol-Myers Squibb, Cephalon, Clinical Trials Solutions, CNS Response, Compellis, Cypress, Dov, Eli Lilly, EPIX, Fabre-Kramer, Forest, GlaxoSmithKline, Grunenthal GmBH, Janssen, Jazz, Johnson & Johnson, Knoll, Labopharm, Lorex, Lundbeck, MedAvante, Merck, Methylation Sciences, Neuronetics, Novartis, Nutrition 21, Organon, Pamlab, Pfizer, PharmaStar, Pharmavite, Precision Human Biolaboratory, Roche, Sanofi-Aventis, Sepracor, Schering-Plough, Solvay, Somaxon, Somerset, Synthelabo, Takeda, Tetragenex, Transcept, Vanda и Wyeth-Ayerst; выполнял деятельность, связанную с лекциями/публикациями для компаний Advanced Meeting Partners, American Psychiatric Association, AstraZeneca, Belvoir, Boehringer lngelheim, Bristol-Myers Squibb, Cephalon, Eli Lilly, Forest, GlaxoSmithKline, Imedex, Novartis, Organon, Pfizer, Pharmastar, MGH Psychiatry Academy/Primedia, MGH Psychiatry Academy/Reed-Elsevier и UBC и Wyeth-Ayerst; has equity holdings in Compellis; участвовал в заявке на патент для SPCD и комбинации азапиронов с бупропионом при БДР; получал гонорары за авторское право для MGH CPFQ, SFI, ATRQ, DESS и SAFER. В последние 12 месяцев Доктор Trivedi получал исследовательскую поддержку от Agency for Healthcare Research and Quality, National Institute of Mental Health, National Institute on Drug Abuse и Targacept; гонорары за консультации от компаний AstraZeneca, Cephalon, Fabre-Kramer, GlaxoSmithKline, Janssen, Johnson & Johnson, Eli Lilly, Neuronetics, Otsuka и Pfizer; и полату/гонорары за консультации от компаний Bristol-Myers Squibb, Forest и Wyeth-Ayerst. Доктора Shah, Caputo и Post являются постоянными сотрудниками компании Novartis.
Выражение благодарности: Авторы выражают благодарность исследователям и персоналу центров, участвовавшим в исследовании, за их сотрудничество, а также пациентам, участвовавшим в исследовании. Авторы также выражают благодарность Smitha Amarjeeth, MD (Novartis Healthcare Pvt. Ltd.) за помощь в подготовке рукописи и Trevor Fusaro, Novartis Pharmaceutical Corporation, East Hanover, New Jersey, за критическое рецензирование рукописи.
Список использованной литературы
