Липиды и липопротеиды плазмы крови
Статьи П.Х. Джанашия, В.А. Назаренко, С.А. Николенко Содержание »»Липиды и липопротеиды плазмы крови
Липиды плазмы крови представлены в основном холестерином (ХС) и триглицеридами (ТГ). ХС имеет сложное гетероциклическое стероидное ядро (рис. 1) и выполняет следующие физиологические функции. Во-первых, он является пластическим материалом, так как представляет собой обязательный структурный компонент любых клеточных мембран, обеспечивающий их стабильность. Во-вторых, из ХС в печени синтезируются желчные кислоты, которые необходимы для эмульгации и абсорбции жиров в тонком кишечнике. В-третьих, ХС является предшественником стероидных гормонов коры надпочечников (гидрокортизона и альдостерона), а также половых гормонов (эстрогенов и андрогенов). Источником экзогенного (поступающего в организм с пищей) ХС служат продукты животного происхождения. При обычной европейской диете потребляется от 300 до 500 мг ХС в день. Однако экзогенный ХС не имеет жизненно важного значения, поскольку даже при исключительно вегетарианской диете ХС синтезируется в количествах, вполне достаточных для обеспечения потребности в нем организма.
| Триглицериды - | 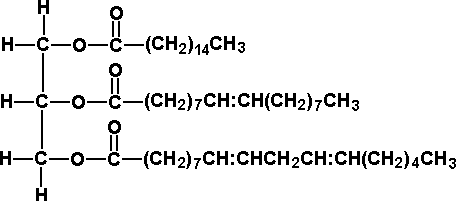 |
| Холестерин - | 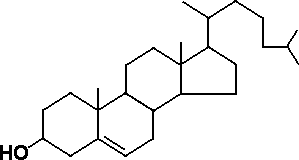 |
Рис. 1. Структура триглицеридов и холестерина
Главным источником эндогенного ХС является печень. Основные этапы синтеза ХС представлены на схеме 1. На первом этапе этого процесса из трех молекул ацетата и коэнзима А синтезируется 3-гидрокси-3-метилглютарил коэнзим А (ГМГ-КоА). Далее в результате воздействия фермента ГМГ-КоА-редуктазы образуется мевалоновая кислота, которая примерно через 20 последующих этапов превращается в ХС. Несмотря на всю сложность и многоэтапность этих процессов, ключевым ферментом, определяющим скорость синтеза ХС, является именно ГМГ-КоА-редуктаза. Выбор этого фермента в качестве мишени для воздействия статинов позволяет решающим образом вмешиваться в синтез ХС и контролировать тем самым его уровень в плазме крови.
Схема 1. Основные этапы синтеза холестерина
| Ацетат -> ГМГ-КоА + ГМГ-КоА-редуктаза -> Мевалоновая кислота -> -> ~ 20 этапов -> -> Холестерин |
Синтезируемый в печени ХС обеспечивает потребность в нем ряда органов и тканей и прежде всего - самой печени, которая является не только его основным "производителем", но и "потребителем". Известно, что средний период полужизни гепатоцита составляет не более 100 дней, в связи с чем печени требуется много ХС для построения собственных клеточных мембран. Относительно небольшое количество синтезируемого ХС поступает в кровь, а основная его часть трансформируется в желчные кислоты и попадает с желчью в просвет тонкого кишечника. Из нижних отделов кишечника около 97% желчных кислот абсорбируется и возвращается в печень. Этот процесс называется энтерогепатической циркуляцией. Абсорбция желчных кислот в просвете кишечника является основным механизмом действия секвестрантов желчных кислот (анионообменных смол) - холестирамина и колестипола. Небольшие количества ХС и желчных кислот могут также связываться богатыми растительной клетчаткой пищевыми продуктами.
Потребность печени в ХС удовлетворяется не только за счет его синтеза гепатоцитами, но и за счет поступления из крови. В условиях "холестеринового голода", в частности, вызванного приемом статинов, гепатоциты стимулируют специфические рецепторы, расположенные на их клеточной мембране, которые осуществляют распознавание и захват липопротеидов низкой плотности, являющихся основным холестеринсодержащим классом липопротеидов. Это рецепторы к апопротеидам В и Е (В/Е рецепторы). Активация этих рецепторов является основным условием понижения уровня ХС плазмы крови.
ТГ представляют собой эфиры трехатомного спирта глицерина и высших жирных кислот. В зависимости от количества двойных связей жирные кислоты могут быть насыщенными (нет двойных связей), мононенасыщенными (одна связь) и полиненасыщенными (две и более связи). ТГ являются важнейшим источником энергии как для скелетной муслулатуры, так и для миокарда. По своей энергетической ценности жирные кислоты вдвое превосходят глюкозу и другие моносахариды. Функция ТГ (и жирных кислот) как пластического материала заключается в их способности аккумулироваться в жировых депо. Насыщенные жирные кислоты являются атерогенными и содержатся в животных жирах, а также в кокосовом масле. Неатерогенные мононенасыщенные жирные кислоты содержатся в оливковом масле, а полиненасыщенные - в масле подсолнечника и некоторых других растительных маслах.
ХС и ТГ являются гидрофобными соединениями, нерастворимыми в воде и плазме крови. Они могут переноситься с током крови только в составе белково-липидных комплексов - липопротеидов (ЛП), которые представляют собой сферические частицы, имеющие электрический заряд. Наружный слой ЛП образуют белки - апопротеиды, или просто "апо", а ядро ЛП составляют липиды - ХС и ТГ. Выделяют четыре основных класса ЛП, отличающихся по размеру, удельному весу (плотности), подвижности при электрофорезе, содержанию ХС и ТГ и составу апопротеидов: хиломикроны (ХМ), ЛП очень низкой плотности (ЛПОНП), ЛП низкой плотности (ЛПНП) и ЛП высокой плотности (ЛПВП) (рис. 2).
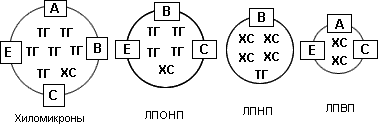
Рис. 2. Классы липопротеидов
Идентификация ЛП возможна с помощью двух основных методов - ультрацентрифугирования, при котором используются их различия по плотности, и электрофореза в агаровом геле, при котором разделение ЛП основывается на различии их подвижности в электрическом поле. Эти методы, являющиеся достаточно сложными и дорогостоящими, применяются преимущественно в научно-исследовательских целях, а также в сложных диагностических случаях. На практике типирование гиперлипопротеидемий (ГЛП) осуществляют с помощью более приблизительной оценки по уровню общего ХС, ТГ и ХС ЛПВП (см. ниже).
При расположении классов ЛП в той последовательности, в которой они представлены на рис. 2 (от ХМ до ЛПВП), легко прослеживаются следующие закономерности: постепенное увеличение их плотности (наиболее "легкими" являются частицы ХМ, а наиболее "тяжелыми" - ЛПВП), усиление подвижности при электрофорезе (ХМ остаются на старте, а ЛПВП составляют наиболее мобильный класс ЛП), уменьшение размера частиц (диаметр ХМ равен примерно 800-5000 А, а ЛПВП - всего лишь 50-80 А), а также увеличение содержания ХС и уменьшение содержания ТГ.
ХМ образуются в стенке тонкого кишечника из экзогенных (поступающих с пищей) жиров. Они представлены крупными частицами, богатыми ТГ и бедными ХС, и содержат 10 различных апопротеидов. Основное назначение ХМ состоит в обеспечении скелетных мышц и миокарда энергией, заключенной в ТГ (вернее, во входящих в их состав жирных кислотах). ХМ переносятся с током крови в мышцы, где фиксируются на соответствующих клеточных рецепторах и подвергаются воздействию фермента липопротеинлипазы, которая расщепляет ТГ, в результате чего жирные кислоты поступают в клетки. После этой операции из ХМ образуется так называемая ремнантная (остаточная) частица. Хиломикроновые ремнанты поступают в печень (принося с собой ХС, потребляемый с пищей), где происходит их полное разрушение. Атерогенность ХМ не доказана, однако хиломикроновые ремнанты являются атерогенными.
ЛПОНП, как и ХМ, представлены крупными частицами, богатыми ТГ и бедными ХС, и содержат 5 апопротеидов. Они выполняют ту же функцию обеспечения мышц энергией, что и ХМ, однако синтезируются в печени не из экзогенных, а из эндогенных источников. Далее они поступают в кровь и доставляются к мышцам. После извлечения миоцитами из ЛПОНП большей части ТГ они, как и ХМ, трансформируются в ремнантные частицы (их также называют липопротеидами промежуточной плотности - ЛППП), которые затем попадают в печень. Концентрация ЛППП в плазме крови примерно в 10 раз ниже, чем концентрация ЛПОНП. В отличие от хиломикроновых ремнантных частиц ЛППП не катаболизируются, а трансформируются в ЛПНП, являясь, таким образом, их предшественниками. Повышение уровня ЛПОНП связано с определенным риском развития атеросклероза. Ускорение катаболизма и/или уменьшение синтеза ЛПОНП лежит в основе холестеринпонижающего эффекта двух групп гиполипидемических препаратов - никотиновой кислоты и фибратов (табл. 1).
Таблица 1. Основные характеристики липопротеидов плазмы крови
| Класс ЛП | Липиды | Аполипопротеиды | Плотность, г/мл | Диаметр, А |
| ХМ | ТГ>>ХС | A-I, A-II, A-IV, B-48 С-I, С-II, С-III, Е | <0,95 | 800-5000 |
| ЛПОНП | ТГ>>ХС | В-100, С-I, С-II, С-III, E | <1,006 | 300-800 |
| ЛППП | ТГ=ХС | В-100, Е | 1,006-1,019 | 250-350 |
| ЛПНП | ХС>ТГ | В-100 | 1,019-1,063 | 180-280 |
| ЛПВП | ХС>>ТГ | А-I, А-II, С-I, С-II, С-III, e | 1,125-1,210 | 50-90 |
ЛПНП синтезируются в печени и являются основным холестеринсодержащим классом ЛП, на долю которого приходится около 70% общего ХС плазмы крови. Физиологическая роль ЛПНП заключается в транспорте ХС к его "потребителям", в основном к надпочечникам, другим эндокринным органам и к самой печени . Окисленные формы ЛПНП, образующиеся в процессе их так называемой модификации эндотелием, проникают в интиму артерий и инициируют формирование атеросклеротической бляшки. В состав ЛПНП входит единственный апопротеид - апо-В100. Распознавание ЛПНП и их фиксация на поверхности клеток осуществляются с помощью В/Е рецепторов, вступающих во взаимодействие с этим апопротеидом. В настоящее время ЛПНП рассматриваются в качестве основного атерогенного класса ЛП, на чем основывается вся стратегия гиполипидемической терапии. Выделяют несколько фракций ЛПНП, характеризующихся различной атерогенностью.
ЛПВП представлены самыми маленькими частицами, весьма богатыми фосфолипидами и белком. Они синтезируются преимущественно в печени. Основная роль ЛПВП заключается в эвакуации избытка ХС из сосудистой стенки и других тканей. При этом относительно бедная ХС фракция ЛПВП3 трансформируется в богатые ХС ЛПВП2, которые возвращаются в печень и затем выводятся с желчью. Предполагается, что ЛПВП обладают протекторным эффектом за счет благоприятного влияния на функции эндотелия и предупреждения образования окисленных форм ЛПНП. В настоящее время ЛПВП считаются единственным антиатерогенным классом ЛП. Снижение уровня ХС ЛПВП менее 35 мг/дл (0,9 ммоль/л) является самостоятельным фактором риска ИБС, а повышение более 80 мг/дл (2,1 ммоль/л) - так называемым отрицательным фактором риска (можно сказать, фактором антириска).
Помимо описанных 5 классов ЛП выделяют ЛП (а). В структурном отношении они идентичны ЛПНП, но содержат дополнительный апо-протеид - апо (а), связанный дисульфидным мостиком с апо В-100. Показано, что ЛП (а) является независимым фактором риска ИБС. Атерогенные окисленные формы ЛП (а) образуются значительно легче, чем окисленные формы ЛПНП. В связи со структурным сходством с плазминогеном ЛП (а) рассматриваются как конкурентные антагонисты плазминогена, ассоциирующиеся с повышенным риском возникновения тромбоза коронарных артерий.
Таким образом, атерогенность ЛП зависит не только от количества содержащегося в них ХС, но и от некоторых качественных параметров. Известно, что существует несколько фракций ЛПНП, обладающих различной атерогенностью. В частности, выделяют "мелкие плотные" ЛПНП, являющиеся весьма атерогенными, и "крупные флотирующие" ЛПНП, наличие которых ассоциируется со значительно меньшим риском возникновения ИБС. Примерно у 20% взрослого населения США и Европы имеет место атерогенный вариант дислипопротеидемии, характеризующийся наличием избыточного количества "мелких плотных" ЛПНП, повышенным уровнем ТГ и пониженным - ХС ЛПВП на фоне нормального содержания общего ХС.
В связи с тем, что определение уровня ЛП (а), а также "мелких плотных" ЛПНП далеко не относится к числу рутинных биохимических методов, оценка так называемого коронарного риска на практике неизбежно оказывается приблизительной. Принятая в настоящее время ориентация на уровень ХС ЛПНП является тем разумным компромиссом, который позволяет оценивать риск возникновения ИБС и ее осложнений с проведением доступных и относительно недорогих лабораторных тестов.
Комментарии
ПРАКТИКА ПЕДИАТРА
