Спрайсел (дазатиниб): новый препарат для пациентов с ХМЛ при резистентности или непереносимости предыдущей терапии, включая иматиниб.
Статьи- СПРАЙСЕЛ™ показан взрослым пациентам с хроническим миелолейкозом (ХМЛ) в хронической фазе или фазе акселерации, лимфоидном или миелоидном бластном кризе при резистентности или непереносимости предыдущей терапии, включая иматиниб.
- СПРАЙСЕЛ™ также показан взрослым пациентам с острым лимфобластным лейкозом (ОЛЛ) с положительной Филадельфийской хромосомой при резистентности или непереносимости предыдущей терапии.
- СПРАЙСЕЛ™: новый эффективный препарат для лечения пациентов с ХМЛ при резистентности или непереносимости предыдущей терапии, включая иматиниб (1)
- СПРАЙСЕЛ™ обеспечивает стойкий гематологический и цитогенетический ответ (1)*
- СПРАЙСЕЛ™: обладает новым многонаправленным механизмом действия, заключающимся в интбировании не только BCR-ABL-киназы, но и SRC--киназы (1)**
СПРАЙСЕЛ™ назначается:
|
1- СПРАЙСЕЛ™ Инструкция по медицинскому применению препарата,
2-Talpaz M, Shah NP, Kantaijian H, ef a/. N Engl J Med. 2006; 354:2531-2541.
* В первой Фазе клинических испытаний было пролечено 84 пациента с последующим наблюдением в течении 19 мес. Первичной задачей была оценка переносимости и безопасности дазатиниба. Во второй фазе было пролечено 646 больных с двухгодичным наблюдением.
** На основании данных in vitro.
ХМЛ - болезнь со сложной молекулярной основой (1)
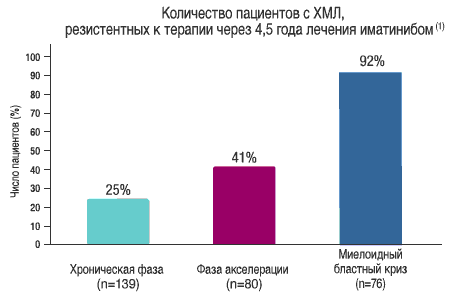
- Резистентность к терапии увеличивается с течением времени и зависит от фазы заболевания (2,3)
- У некоторых пациентов может отмечаться непереносимость проводимой терапии (4)
В хронической фазе ХМЛ: (5)- 31% пациентов прервали лечение иматинибом через 5 лет (исследование IRIS)
- 14% теряют установленный ответ или прогрессируют к пяти годам
- 15% не достигают Большого Цитогенетического Ответа к 1 году (БЦО)
1-VDeininger MWN, Goldman JM, Melo JV, Blood, 2000; 96:3343-3352,
2-LahayeT, Riehm B, Betger U, et ai Cancer. 2005; 103:1659-1669.
3-Burgess MR, Skaggs BJ, Shah NP, etal. PNAS, 2005; 102: 3395-3400.
4-Deininger MWN, O'Brien SG, Ford JM et a/. J Clin Oncol; 2003; 1637-1647
5-Druker et a/. New England Journal ol Medicine, 2006;355:24O8.
СПРАЙСЕЛ™: разработан для решения проблем, связанных с лечением ХМЛ
- СПРАЙСЕЛ™: новый эффективный препарат для лечения пациентов с ХМЛ при резистентности или непереносимости препарата иматиниб (1)
- СПРАЙСЕЛ™ обеспечивает стойкий гематологический и цитогенетическии ответ в течение 2 лет, по данным исследований Фазы I и Фазы 11 (1,2,3)*
- СПРАЙСЕЛ™: обладает новым многонаправленным механизмом действия, заключающемся в ингибировании не только BCR-ABL-киназы, но и SRC-KHHa3bi (1)*
1-СПРАЙСЕЛ™ Инструкция по медицинскому применению препарата (FDA - США).
2-Talpaz M, Shah NR Kantarjian H, eta/. N Engl J Med. 2006; 354:2531-2541.
3-Stone R., Kantarjian H., Baccarani M., ef a/., ASH 2007 Nov. 16, 2007 Volume 110, Issue 11, Abstract 734 - START-C - Efficacy of dasatinib in patients with chronic phase CML with resistance or intolerance to imatinib - 2 year update.
* В первой Фазе клинических испытаний было пролечено 84 пациента с последующим наблюдением в течении 19 мес. Это исследование не предусматривало оценку эффективности лечения. Первичной задачей была оценка переносимости и безопасности дазатиниба.
**Основано на данных, полученных in vitro.
Преодоление резистентности*
- Существует несколько механизмов резистентности (1)
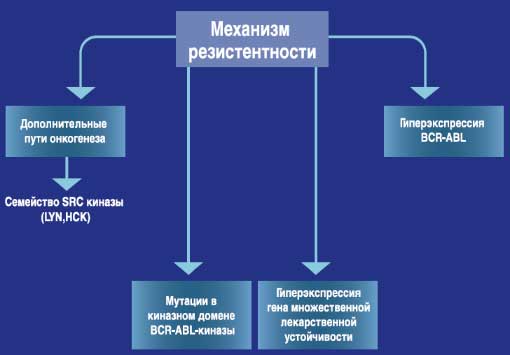
*основано на данных, полученных in vitro
1 - СПРАЙСЕЛ™ - инструкция по медицинскому применению препарата (FDA - США)
"Механизм действия, отличающийся от механизма действия других препаратов" *
- СПРАЙСЕЛ™: первый и единственный ингибитор BCR-ABL-киназы и SRC-киназы
СПРАЙСЕЛ™ также действует на другие пути онкогенеза, такие как: C-KIT, киназы зфринового рецептора, рецептор PDGFβ - СПРАЙСЕЛ™ - НОВЫЙ ИНГИБИТОР BCR-ABL-киназы, связывающийся как с активной, так и с неактивной конформацией BCR-ABL киназы
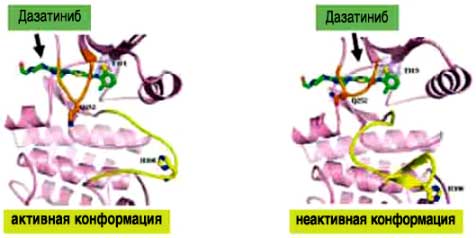
- СПРАЙСЕЛ™: в 325 активнее, чем иматиниб, в отношении Bcr-Abl in vitro (1)
- СПРАЙСЕЛ™: эффективен при всех известных мутациях в киназном домене BCR-ABL, кроме Т3151 (2).
1 - O'HareTWalters DK, Stoffregen ЕР, et a/. Cancer Res. 2005; 65:4500-4505.
2 - Talpaz M, Shah NP, Kantarjian H, eta/. N Engl J Med. 2006; 354:2531-2541.
* Основано на данных, полученных In vitro.
Программа клинических исследований II фазы: START "Исследования подавления активности SRC/ABL тирокиназы"
- Пациенты, включенные в исследования, ранее получали интенсивное лечение и имели мутации (1,2,3)
| Фаза (1) | Фаза II (2) |
|||||
| Все фазы (СА180002) |
Хроническая фаза START С (СА 180013) |
Фаза акселерации STARTA (СА 180005) |
Миелоидный бластный криз START В (СА 180006) |
Лимфоидный бластный криз START L (СА 180015) |
Ph+ ОЛЛ STARTL (СА 180015) |
|
| Число пациентов | n = 84 | n = 387 | n = 107 | n = 74 | n = 42 | n = 36 |
| Число пациентов, получавших иматиниб более 3 лет, % | нет данных | 53% | 68% | 47% | нет данных | нет данных |
| Число пациентов, получавших иматиниб в дозе свыше 600 мг в день, % | 63% | 55% | 59% | 49% | 52% | 47% |
| Число пациентов, имевших мутации, % | 71% | 40% | 52% | 36% | 48% | 47% |
| Число пациентов, ранее получавших лечение интерфероном, % | 71% | 70% | 75% | 55% | 48% | 8% |
1-Talpaz M, Shah NP, Kantarjian H, ef a/. N Engl J Med, 2006; 354:2531-2541,
2-Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) briefing document, имеется на стр, 24,30,35 и 39 Имеется на htty://www,fda,gw/ohrms/dockets^^ BristolMyersSquibb-Background.pdf.
3-Stone R., Kantarjian H., Baccarani M., ef a/., ASH 2007 Nov. 16, 2007, Volume 110, Issue 11, Abstract 734 - START С - Efficacy of dasatinib in patients with chronic phase CML with resistance or intolerance to imatinib - 2 year update.
СПРАЙСЕЛ™: показан для лечения пациентов с ХМЛ при резистентности или непереносимости предыдущей терапии, включая иматиниб, а также для пациентов с Ph-позитивным ОЛЛ при резистентности или непереносимости предыдущей терапии
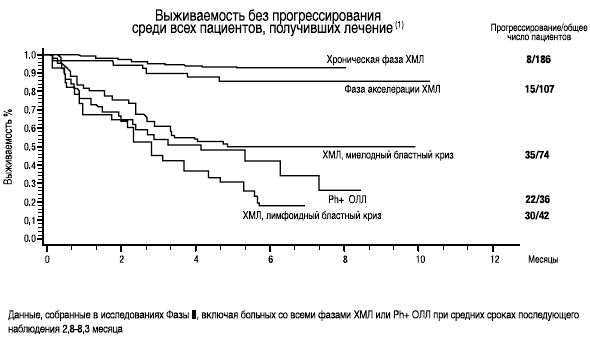
- На основании этих данных II фазы клинических исследований, FDA зарегистрировала СПРАЙСЕЛ™ в США 28 июня 2006 года в ускоренном режиме (6 месяцев)(1)
1-Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) документ для брифинга. Стр. 26, 33,37,41 и 43. Имеется на htrp://www.fda.gov/ohrms/dockets/AC/06/briefing/2006-4220-B1-01 BristolMyersSquibb-Background.pdf
2-СПРАЙСЕЛ™ Инструкция по медицинскому применению препарата.
Борис С.
|
- Ответы у 387 пациентов, принимавших дазатиниб в дозе 140 мг в сутки(1)
- Выживаемость без прогрессирования - 88%(2)
- Ответ был продолжительным, БЦО был утрачен только у 7 (3%) из 230 пациентов, достигших БЦО
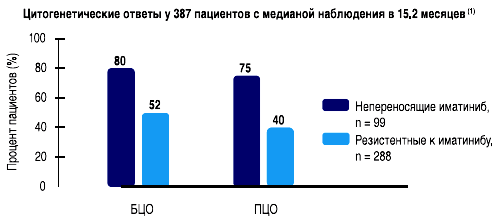
- Последние данные о результатах 2-летнего наблюдения были представлены на конференции ASH 2007 (1)
- Большой Молекулярный Ответ был получен у 25% пациентов к 12 месяцам наблюдения (1)
Рекомендуемая дозировка для пациентов в хронической фазе ХМЛ является 100 мг один раз в день, что дает наилучший профиль эффективности и безопасности - сопоставимая эффективность с дозой в 140 мг в сутки, с меньшим числом побочных эффектов, согласно данным исследования 034.(2)
(1) Stone R, Kantarjian H, Baccarani M, ef el. ASH 2007 Abstract "Efficacy of Dasatinib in Patients with Chronic-phase Chronic Myelogenous Leukemia with Resistance or Intolerance to Imatinib: 2-year Follow-up Data from START-C (CA180013)': November 16, 2007, Volume 110, issue 11: Abstract 734
(2) Guilhot F, Appertey J, Facon T, ef a/. Haematologica 2007; 92 (S1): abstract 358
СПРАЙСЕЛ™: показан для лечения пациентов с ХМЛ при резистентности или непереносимости препарата иматиниб
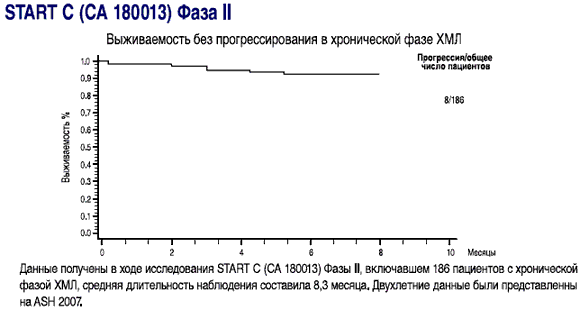
- Выживаемость без прогрессирования составила 92,4% пациентов при минимальной продолжительности лечения в 8 месяцев
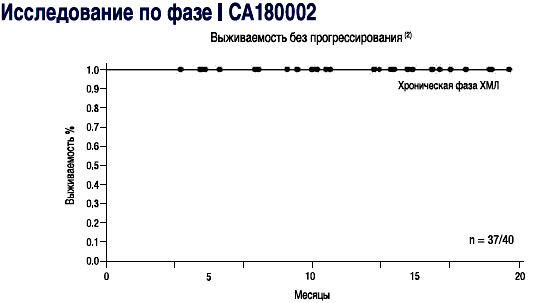
- СПРАЙСЕЛ™: у пациентов в хронической фазе, ответы на лечение сохранялись в течение последующего наблюдения (2-19 месяцев) в ходе исследования СА180002 Фазы l(2)
1-Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) документ для брифинга. Стр. 26. Имеется на http://www.fda.gov/ohrms/dockets/AC/06/briefing/2006-422C^B14)1BristolMyersSquibb-Background.pdf
2-Talpaz M, Shah NP, Kantarjian H, era/. N Engl J Med. 2006; 354:2531-2541.
Маргарита Л.
|
Основной критерий: общий и большой гематологический ответы (ОГО и БГО) Исследование START A (CA180005) Фаза II
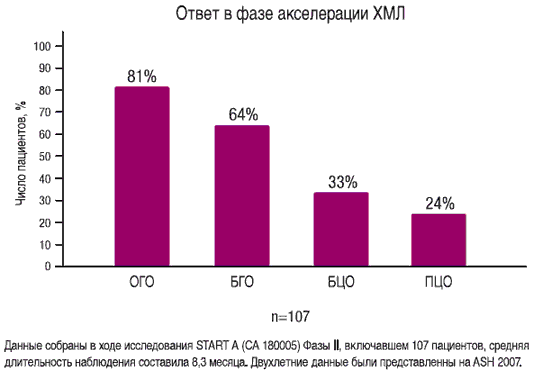
СПРАЙСЕЛ™ эффективен у пациентов с ХМЛ в фазе акселерации
- 81% ОГО (основной критерий)
- 64% БГО (основной критерий)
- 33% БЦО (дополнительный критерий)
- 24% ПЦО (дополнительный критерий)
Общий гематологический ответ (ОГО): ПГО + отсутствие признаков лейкоза (ОПЛ) + минимальный гематологический ответ (МГО. Большой гематологический ответ (БГО): ПГО + ОПЛ. ПГО (пациенты с продвинутыми стадиями ХМЛ/Рh+ОЛЛ): количество лейкоцитов не превышает 10,0х109/л, количество тромбоцитов ≥ 100,0x109/л, властные клетки или промиелоциты в периферической крови отсутствуют, количество властных клеток в костном мозге ≤ 5%, суммарное количество миелоцитов + метамиелоцитов в периферической крови составляет не более 5%, количество баэофилов в периферической крови нормальное, очаги экстрамедуллярного кроветворения в печени и селезенке отсутствуют. ОПЛ: те же критерии что и для ПГО, но количество нейтрофилов составляет 0,5-1,0x109/л и/или количество тромбоцитов составляет 20-100,0x109/л.
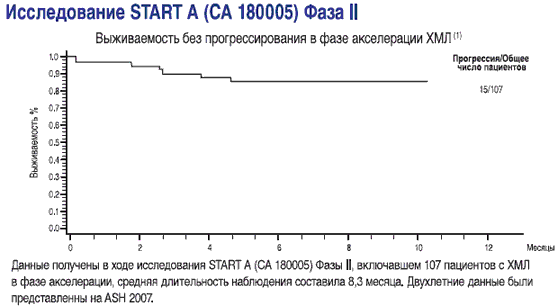
СПРАЙСЕЛ™ показан для лечения пациентов с ХМЛ в фазе акселерации при резистентности или непереносимости предыдущей терапии, включая иматиниб
- выживаемость без прогрессирования у пациентов в фазе акселерации(1)
- СПРАЙСЕЛ™: у пациентов в фазе акселерации, ответы на лечение сохранялись в течение последующего наблюдения (2-19 месяцев) в ходе исследования СА180002 Фазы l(2)
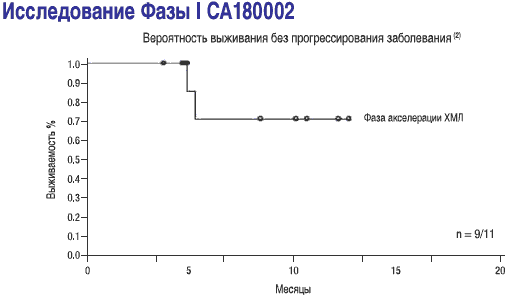
1-Данные получены в ходе исследования START A (CA180005) Фазы II, включавшем 107 пациентов с ХМЛ в фазе акселерации, средняя длительность наблюдения составила 8,3 месяца Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) документ для брифинга. Стр. 33. Имеется на http://www.fda.gov/ohrms/dockets/AC/06/brlefing/2006-4220-B1-01 BristolMyersSquibb-Background.pdf.
2-Talpaz M, Shah NP, Kantarjian H, eta/. N Engl J Med. 2006; 354:2531-2541.
Анатолий Т.
|
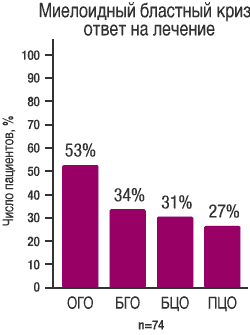
| Основной критерий: ОГО и БГО START В (СА180006) Фаза II |
Основной критерий: ОГО и БГО START L (СА 180015) Фаза II |
 |
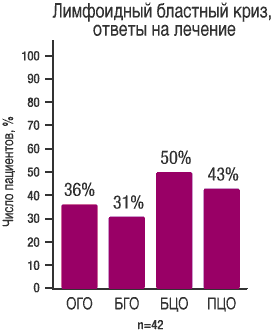 |
| Данные получены в ходе исследования START В (СА 180006) Фазы II, включавшем 74 пациента с миелобластным вариантом бластного криза ХМЛ, средняя длительность наблюдения составила 3,5 месяца | Данные, получены в ходе исследования START L (CA180015) Фазы II, включавшем 42 пациента с лимфобластным вариантом бластного криза, средняя длительность наблюдения составила 2,8 месяца |
при миелоидном бластном кризе ХМЛ (1) |
при лимфоидном бластном кризе ХМЛ (1) |
Двухлетние данные были представленны на ASH 2007
1-СПРАЙСЕЛ™ - инструкции по применению - Евросоюз
СПРАЙСЕЛ™: показан для лечения пациентов с лимфоидным или миелоидным бластным кризом ХМЛ при резистентности или непереносимости предыдущей терапии, включая иматиниб, а также для пациентов с Рh+ ОЛЛ при резистентности или непереносимости предыдущей терапии.
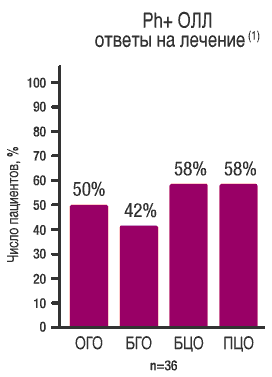
| Основной критерий: ОГО и БГО START L (СА180015) Фаза II
Данные получены в ходе исследования START L (СА 180015) Фазы II, вклочавиюм 36 пациентов Рh+ ОЛЛ, средняя длительность наблюдения составила 3,2 месяца |
Ответы на лечение препаратом СПРАЙСЕЛ™ достигались быстро: гематологический ответ в течение:
при Ph+ ОЛЛ |
1-СПРАЙСЕЛ™ - инструкции по применению - Евросоюз
Двухлетние данные были представленны на ASH 2007
СПРАЙСЕЛ™: показан для лечения пациентов с ХМЛ в хронической фазе при непереносимости предыдущей терапии, включая иматиниб
У 59 (32%) из 186 пациентов в хронической фазе ХМЛ отмечалась непереносимость препарата иматиниб, по данным исследования START С (СА180013) Фазы Н(1)
Непереносимость иматиниба заключалась в:(2)
- негематологической токсичности III степени и выше
- гематологической токсичности IV степени продолжительностью более 7 дней
Большинство больных в хронической фазе ХМЛ, непереносящих иматиниб, переносили лечение дазатинибом(1)*
* Примерно у 30% пациентов, получавших дазатиниб, отмечались такие же проявления токсичности, как и в случае приема иматиниба, однако, эти нежелательные явления обычно были менее выраженными и не требовали отмены препарата.
| Причины непереносимости иматиниба (негематологическая токсичность Степени 3-4)(2) | Число больных** | Осложнения 3-4 степени при применении СПРАЙСЕЛа™ |
| Кожная токсичность (сыпь) | 22 | 0 |
| Печеночная токсичность | 17 | 0 |
| Миалгия/артралгия | 13 | 0 |
| Непереносимость со стороны желудочно-кишечного тракта |
6 | 2 (тошнота, рвота) |
| Отеки | 5 | 0 |
| Легочная токсичность | 3 | 0 |
| Повышенная утомляемость | 2 | 1 |
| Увеличение массы тела | 2 | 0 |
| Почечная недостаточность | 1 | 0 |
| Анафилаксия | 1 | 0 |
**У некоторых пациентов на фоне приема иматиниба отмечались множественные проявления токсичности
Полный перечень побочных эффектов препарата СПРАЙСЕЛ™ описан в инструкции по медицинскому применению препарата
1-Hochhaus A, Kantaijian H, Baccarani M, et al. Blood, 2007, volume 109,
2-Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) документ для брифинга. Стр. 17. Имеется на http://www.fda.gov/ohrms/dockets/AC/06/briefing/2006-4220-B1-01BristolMyersSquibb-Background.pdf
3-Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) документ для брифинга. Стр. 54. Имеется на http://www.fda.gov/ohrms/dockets/AC/06/briefing/2006-4220-B1-01BristolMyersSquibb-Background.pdf
СПРАЙСЕЛ™: показан для лечения пациентов в хронической фазе ХМЛ при непереносимости иматиниба
Непереносимость иматиниба(1):
Пациентов считали непереносящими лечение, если у них в ходе лечения иматинибом отмечалась выраженная токсичность, препятствующая продолжению лечения.
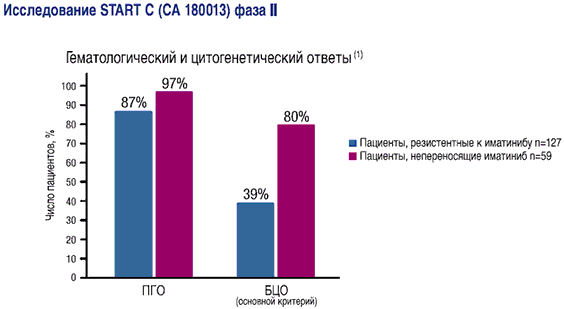
Данные получены в ходе исследования START С (СА 180013) Фазы II, включавшем 186 пациентов с хронической фазой ХМЛ, средний срок наблюдения составил 8,3 месяца
Пациенты с непереносимостью иматиниба дают ответ на лечение препаратом СПРАЙСЕЛ™
- 97% ПГО (дополнительный критерий)
- 80% БЦО (основной критерий)
1-СПРАЙСЕЛ™ - инструкция по применению - Евросоюз
Частота побочных эффектов
- Миелосупрессия обычно носила обратимый характер
Частота цитопений 3 и 4 степени (1) Процент % (n=2182) Нейтропения Тромбоцитопения Анемия ХМЛ Хроническая фаза 44 40 17 Фаза акселерации 66 71 53 Миелоидный бластный криз 79 81 73 Лимфобластный криз ХМЛ и Рh+ОЛЛ 78 77 45 - Негематологические побочные эффекты(2) Большинство реакций носили легкий или умеренный характер
Пациенты всех фаз заболевания (n=2182) Процент (%) пациентов (1) Все степени Степени 3-4 ЦНС Очень часто: Головная боль 23 1 Часто: Нейропатия (вкл. периферическую) 5 <1 Респираторные, торакальные, медиастинальные Очень часто: Плевральный выпот 17 4 Одышка 16 3 Часто: кашель 7 <1 ЖКТ Очень часто: диарея 29 3 Тошнота 20 1 Рвота 11 1 Часто: боль в животе 9 1 Кровотечения в ЖКТ 7 4 Воспаление слизистых (вкл. мукозит, стоматит) 6 <1 Кожные и подкожные Очень часто: сыпьa 20 1 Часто: зуд 6 <1 Костно-мышечные Очень часто: Боли в костях и мышцах 12 1 Часто: Артралгия 7 1 Миалгия 7 <1 Метаболические / питание Часто: Анорексия 8 <1 Инфекции Часто: Инфекции (вкл. бактериальные, вирусные, грибковые и неспецифические) 8 2 Сосудистые Очень часто: кровотечение 19 6 Общие Очень часто: Поверхностные отекиb 18 <1 Усталость 19 2 Пирексия 12 1 Часто: боль 6 <1 Астения 8 1
* Были проанализированы данные 2182 пациента со всеми фазами ХМЛ и Рп+ ОЛЛ, включенных в клинические исследования Фазы I, Фазы II и Фазы III. Анализ также включает 4 дозы: 100 мг/день, 140 мг/день, 50 мг два раза в день и 70 мг два раза в день.
aвключает эритему, генерализованную эритему, потницу, сыпь, эритематозную сыпь, фолликулярную сыпь, генерализованную сыпь, пятнистую сыпь, пятнисто-папулезную сыпь, папулезную сыпь, зудящую сыпь, пустулезную сыпь, шелушение, эритематозную сыпь при системной красной волчанке, крапивницу, лекарственную сыпь и везикулярную сыпь
bвключает отеки глаз, век, периорбитальный отек, отек лица, отеки нижних конечностей, периферические отеки, вдавления при отеках, отеки гениталий, отек мошонки
1-СПРАЙСЕЛ™ Инструкция по медицинскому применению препарата, США, Евросоюз
В хронической фазе частота побочных эффектов была ниже на дозе в 100 мг в день(1)
- Негематологические побочные эффекты %(1)
100 мг один раз в день (n=166) 70 мг два раза в день (n=167) Все степени Степени 3/4 Все степени Степени 3/4 Диарея 24 1 22 4 Задержка жидкости 21 1 28 4 Поверхностные отеки 14 0 14 0 Плевральный выпот 7 1 16 1 Генерализированные отеки 2 0 1 0 Застойная сердечная недостаточность/ дисфункция миокарда 0 0 3 2 Перикардиальный выпот 1 0 1 1 Отек легких 0 0 1 1 Легочная гипертензия 0 0 1 1 Кровотечение
ЖКТ кровотечение1 1 4 2 - Гематологические побочные эффекты %(1)
100 мг один раз в день (n=166) Степени 3/4 70 мг два раза в день (n=167) Степени 3/4 Нейтропения 33 42 Тромбоцитопения 22 37 Анемия 10 16
1-СПРАЙСЕЛ™ Инструкция по медицинскому применению препарата, США, Евросоюз
В связи с побочными эффектами у пациентов, получавших препарат СПРАЙСЕЛ™в дозе 140 мг в сутки, предпринимали следующие меры:
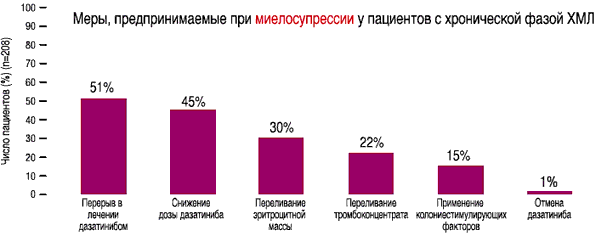
- Меры, предпринимаемые при миелосупрессии у пациентов с хронической фазой ХМЛ на дозе 140 мг/день(1)
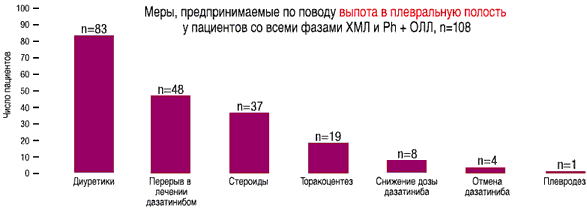
- У 108 из 511 пациентов со всеми фазами ХМЛ и Рh+ ОЛЛ на дозе 140 мг/день отмечался выпот в плевральную полость любой степени, по поводу которого проводилось соответствующее лечение(1)
- Лечение дазатинибом было прекращено в связи с побочными эффектами у 5-11% пациентов(2)
1-Dasannib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) Sponsor presentation. 2 июня, 2006. Слайды 46 и 50. Имеется на http://www.fda.gov/ohrms/dockets/ac/06/slides/2O06-422O-S1-01 BristolMyersSquibb_files/frame.htm
2-СПРАЙСЕЛ™ Инструкция по медицинскому применению препарата - Евросоюз
Критерии гематологического ответа(1)
| Полный Гематологический Ответ (ПГО) пациенты с продвинутыми стадиями ХМЛ/Рh+ОЛЛ |
|
| Общий гематологический ответ (ОГО) | Это более широкое понятие ответа, поскольку оно включает полный и минимальный гематологический ответ, а также отсутствие признаков лейкоза (ОПЛ). |
| Большой гематологический ответ (БГО) | Включает Полный Гематологический Ответ (ПГО) и отсутствие признаков лейкемии (ОПЛ) - но НЕ ВКЛЮЧАЕТ минимальный гематологический ответ |
| Отсутствие Признаков Лейкемии (ОПЛ) | Те же критерии что и для ПГО, но количество нейтрофилов составляет 0,5-1,0x109 /л и/или количество тромбоцитов составляет 20-100,0x109/л. |
| Минимальный Гематологический Ответ (МГО) |
|
1-Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) Sponsor presentation. 2 июня, 2006. Слайды 46 и 50. Имеется на http://wmv.fda.gov/ohrms/dockets/ac/06/slides/2006-4220-S1-01BristolMyersSquibb_files/frame.htm
Применение препарата СПРАЙСЕЛ™ в клинической практике
- Назначается перорально (1)
- Рекомендуемая доза составляет: 100 мг 1 раз в день в хронической фазе, в остальных случаях - 70 мг два раза в день (140 мг в сутки)
В ходе клинических исследований лечение продолжали до прогрессии заболевания или до появления признаков непереносимости препарата
- Выпускается в форме таблеток, покрытых оболочкой, содержащих 20, 50 и 70 мг дазатиниба
- СПРАЙСЕЛ™ подбор дозы
Пациенты в хронической фазе ХМЛ, при резистентности или непереносимости препарата иматиниб Пациенты в продвинутых стадиях ХМЛ или Рh+ОЛЛ, при резистентности или непереносимости препарата иматиниб Рекомендуемая начальная доза 100 мг 1 раз в день
2 таблетки по 50 мгПо 70 мг 2 раза в день
(140 мг в сутки)70 мг + 70 мг Сниженная доза 80 мг 1 раз в день
4 таблетки по 20 мгПо 50 мг 2 раза в день
(100 мг в сутки)50 мг + 50 мг или по 40 мг 2 раза в день (80 мг в сутки) 2 х 20 мг + 2 х 20 мг Повышенная доза 140 мг 1 раз в день
2 таблетки по 70 мгПо 100 мг 2 раза в день
(200 мг в сутки)2 x 50мг + 2 x 50мг Принимать в одно и то же время утром или вечером утро вечер СПРАЙСЕЛ™ можно принимать независимо от приема пищи
По вопросам подбора дозы препарата следует обращаться к Инструкции по медицинскому применению препарата
1-СПРАЙСЕЛ™ Инструкция по медицинскому применению препарата - Росздравнадзор
Методы определения резистентности и непереносимости в исследованиях.
| Исследование | Дизайн исследования (Фаза II) | Основной критерий оценки эффективности терапии |
Определение резистентности | Определение непереносимости |
| Хроническая фаза ХМЛ (n =186) START С (СА180013) |
Многоцентровое нерандомизированное исследование Фазы II, включавшее пациентов с хронической фазой ХМЛ, которые получали СПРАЙСЕЛ ™ (по 70 мг два раза в день) в связи с резистентностью или непереносимостью иматиниба | БЦО | Прогрессия заболевания на фоне приема максимально переносимой дозы иматиниба, в связи с приобретенной (потеря предшествующих БЦО или ПГО или нарастание лейкоцитоза) или первичной резистентностью (отсутствие ПГО через 3 месяца, или отсутствие цитогенетическою ответа через 6 месяцев, или отсутствие БЦО через 12 месяцев лечения иматинибом, или отсутствие БЦО или ПГО на фоне лечения иматинибом и нарастание лейкоцитоза по результатам >2 последовательных анализов). Резистентность к иматинибу < 600 мг/сутки также может быть обусловлена наличием мутаций в гене BCR-ABL | Непереносимость к иматинибу определяется как негематологическая токсичность Степени III или выше, связанная с приемом иматиниба, или как гематологическая токсичность Степени IV, связанная с иматинибом и продолжающаяся более 7 дней |
| ХМЛ в фазе акселерации (n=107) START A (CA180005) |
Открытое нерандомизированное исследование фазы II, включавшее пациентов с ХМЛ в фазе акселерации, которые получали СПРАЙСЕЛ™ (по 70 мг два раза в день) в связи с резистентностью или непереносимостью иматиниба | Общий гематологический ответ (ОГО) Большой гематологический ответ (БГО) |
Переход хронической фазы ХМЛ в фазу акселерации на фоне лечения иматинибом в дозе >400 мг/сутки (первичная или приобретенная резистентность). Отсутствие гематологического ответа у пациентов с ХМЛ в фазе акселерации через >4 недели (или через >2 недели у пациентов с быстрым прогрессированием заболевания) на фоне лечения иматинибом в дозе >600 мг/сутки (первичная резистентность). Переход в бластную фазу у пациентов с первично диагностированной фазой акселерации и бластной фазой ХМЛ с достигнутым гематологическим ответом на лечение иматинибом в дозе >600 мг/сутки и потерей гематологического ответа (приобретенная резистентность). | Определяется или как токсичность, которая, по крайней мере, возможно связана с приемом иматиниба в дозе <400 мг/день,что привело к прекращению лечения иматинибом, или как способность переносить иматиниб только в дозах < 400 мг/день |
| Миелоидный бластный криз ХМЛ (n=74) START В (СА 180006) |
Открытое нерандомизированное исследование фазы II, включавшее пациентов с миелобластным вариантом бластного криза ХМЛ, которые получали СПРАЙСЕЛ™ (по 70 мг два раза в день) в связи с резистентностью или непереносимостью иматиниба | ОГО БГО |
Определение резистентности или непереносимости иматиниба у пациентов с бластным кризом ХМЛ аналогичны тем, которые используются у пациентов в фазе акселерации, за исключением того, что должна была произойти прогрессия в фазу бластного криза | Определяется или как токсичность, которая является вероятно связанной с приемом иматиниба < 400 мг/день, что привело к прекращению лечения иматинибом, или как способность переносить иматиниб в дозах только < 400 мг/день |
| Лимфоидный бластный криз ХМЛ и Рh+ (n=78) START L (CA 180015) |
Открытое нерандомизированное исследование фазы II, включавшее пациентов с лимфобластным вариантом бластного криза ХМЛ или пациентов с Ph+ ОЛЛ, которые получали СПРАЙСЕЛ™ (по 70 мг два раза в день) в связи с резистентностью или непереносимостью иматиниба | ОГО БГО |
Определение резистентности или непереносимости иматиниба у пациентов с бластным кризом ХМЛ аналогичны тем, которые используются у пациентов в фазе акселерации, за исключением того, что должна была произойти прогрессия в фазу бластного криза | Определяется или как токсичность, которая является вероятно связанной с иматинибом < 400 мг/день, что привело к прекращению лечения иматинибом или как способность переносить иматиниб только в дозах < 400 мг/день. Для больных Ph+ ОЛЛ ранее получавших лечение индукционной или консолидирующей химиотерапией при наличии прогрессии или отсутствии эффективности иматиниба в дозе > 600 мг/день через 4 недели |
| Исследование фазы I | Основные критерии: эффективность и безопасность препарата СПРАЙСЕЛ™ у пациентов с хронической фазой ХМЛ (n=40), пациентов с ХМЛ в фазе акселерации (n=11), пациентов с бластным кризом ХМЛ или Ph+ ОЛЛ: ПГР была получена у 92% с хронической фазой ХМЛ и сохранялась у 95% пациентов при средней длительности наблюдения более 12 месяцев. БГО был получен у 70% пациентов с ХМЛ в фазе акселерации и сохранялся у 82% пациентов при средней длительности наблюдения более 5 месяцев. Миелосупрессия отмечалась часто, но не являлась дозолимитирующей. | |||