Актуальные аспекты применения лекарственных препаратов на основе интерферонов в практике педиатра
СтатьиИ.М. Османов1, д-р мед. наук, профессор, Л.Н. Мазанкова1,2, д-р мед. наук, профессор, С.Н. Борзакова1-3, к.м.н., А.В. Винокуров3, канд. мед. наук
1 ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
2 ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования Минздрава России», г. Москва
3 ГБУ «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента Департамента здравоохранения г. Москвы»
Резюме. Статья посвящена основным направлениям использования интерферонов для лечения различной патологии у детей. Приводятся важные, с точки зрения практического применения, сведения о классификации, методах получения, механизмах действия интерферонов. Рассмотрены основные группы применяемых у детей лекарственных препаратов, разработанных на основе различных типов интерферонов и зарегистрированных в Российской Федерации. Представлены данные о фармакодинамике и способах их введения. Описано применение препаратов при острых инфекционных заболеваниях, включая интерферонотерапию COVID-19 у детей. Обсуждаются особенности одного из наиболее широко применяемых у детей препаратов интерферона α-2b - «Виферон®». Обобщен собственный опыт его применения для лечения новой коронавирусной инфекции у детей в условиях стационара. Рассмотрены ближайшие задачи по совершенствованию терапии препаратами интерферонов у детей, а также основные направления модификации и разработки новых лекарственных средств с применением методов молекулярной биологии и биотехнологии.
Ключевые слова: интерфероны, цитокины, классификация, механизм действия, фармакокинетика, IFNα, IFNβ, IFNλ, зарегистрированные лекарственные препараты, пэгилированные интерфероны, интерферон α-2b «ВИФЕРОН®», лечение COVID-19 у детей
Summary. The article is devoted to the main directions of the use of interferons for the treatment of various pathologies in children. Important, from the point of view of practical application, information about the classification, methods of obtaining, mechanisms of action of interferons is given. The main groups of drugs used in children, developed on the basis of various types of interferons and registered in the Russian Federation, are considered. Data on pharmacodynamics and methods of their administration are indicated. A review of the use of drugs in acute infectious diseases, including interferon therapy for COVID-19 in children, is presented. The features of one of the most widely used in children drug interferon α-2b - VIFERON® are discussed. The author's own experience of its use for the treatment of a new coronavirus infection in children in a hospital setting is presented. The immediate tasks for improving the therapy with interferon preparations in children, as well as the main directions for the modification and development of new drugs using the methods of molecular biology and biotechnology, are considered.
Keywords: interferons, cytokines, classification, mechanism of action, pharmacokinetics, IFNα, IFNβ, IFNλ, registered drugs, pegylated interferons, interferon α-2b VIFERON®, treatment of COVID-19 in children
Введение
Препараты на основе интерферонов получили широкое распространение в отечественной педиатрической практике, прежде всего для лечения инфекционных заболеваний. Последние годы они неизменно побеждают в одной или нескольких номинациях ежегодной российской премии в области фармации и медицины Russian Pharma Awards, а в 2019 г. заняли все три призовых места в номинации «самый назначаемый противовирусный препарат для лечения ОРВИ у детей с первых дней жизни» [1].
Данные лекарственные препараты широко применяются при вирусных заболеваниях, когда идентификация возбудителя не проводится или не представляется возможной, а также когда не разработаны специфические лекарственные препараты или их применение связано с риском причинения существенного вреда здоровью.
Пандемия новой коронавирусной инфекции значительно увеличила популярность препаратов на основе рекомбинантного интерферона в педиатрической практике. Эти лекарственные средства были включены в последние рекомендации по терапии новой коронавирусной инфекции у детей [2, 3].
Другая область применения интерферонов - терапия вялотекущих, рецидивирующих и персистирующих инфекционных заболеваний. Показаниями к назначению препаратов на основе интерферонов являются также некоторые онкологические заболевания, иммунодефицитные состояния, прогрессирующие заболевания нервной системы.
Спектр заболеваний и клинических состояний, при которых возможно использование данной группы препаратов, стремительно расширяется. Однако эффективное и безопасное проведение интерферонотерапии связано с соблюдением ряда правил, которые позволяют выбрать необходимые лекарственные формы, оптимальные сроки и пути введения, а также избежать возможных осложнений. Обзор актуальных источников информации об этом, по мнению авторов, будет полезен для практических врачей.
Открытие и получение интерферонов
Интерфероны - общее название группы белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса, на некоторые бактериальные вещества и на низкомолекулярные химические соединения. Этот класс белков случайно открыли в 1957 г. вирусологи Алик Айзекс (A. Isaacs) и Жан Линдеман (J. Lindemann) [4]. У них возникла проблема при проведении научного эксперимента на мышах, которые не заболевали при заражении вирусом. Поиск причин позволил выявить белковую субстанцию, которая синтезировалась в организме мышей в результате предшествующего заражения другим вирусом.
На протяжении многих лет основным поставщиком человеческого интерферона по всему миру являлась исследовательская лаборатория в Финляндии, производившая лейкоцитарный интерферон, преимущественно интерферон а, путем стимуляции лейкоцитов крови вирусом Сендай. Затем компания Wellcome Research Laboratories научилась получать большое количество этого интерферона из лимфобластов, которые выращивались в суспензии уже в промышленных масштабах [5].
В 1980-х гг. был совершен прорыв в производстве интерферона. Компании Biogen в Швейцарии и Genentech в США создали технологию синтеза рекомбинантного интерферона с помощью кишечной палочки, внедрив в нее ген интерферона, что позволило увеличить объем выработки и производить интерфероны любого типа, а себестоимость производства сократилась примерно в 100 раз [5].
Таким образом, в зависимости от способа получения интерфероны разделяются на:
При первых двух способах производства получается смесь нескольких белковых молекул. Метод генетической рекомбинации позволяет синтезировать однотипные по составу и структуре молекулы, которые могли быть детально изучены. Среди рекомбинантных человеческих интерферонов в настоящее время выделяют 3 типа, которые классифицируют на основе взаимодействия со специфическими рецепторами, последовательности нуклеотидов, строения и физико-химических свойств [6, 7].
Некоторые характеристики основных групп интерферонов представлены в табл. 1.
Таблица 1.
Характеристика интерферонов (по А.А. Ярилину [10] с изменениями [11])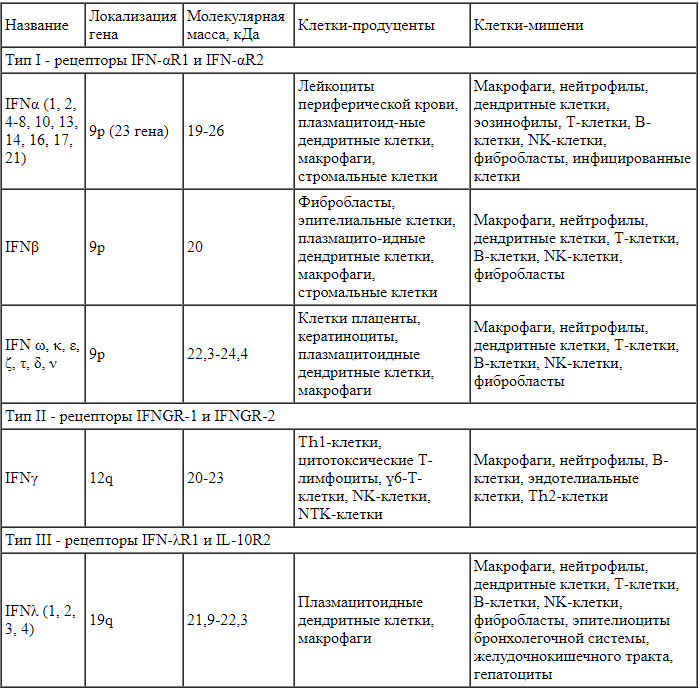
К I типу относят следующие интерфероны: α, β, ω, κ, ε, ζ, τ, δ, ν. Они распознаются и связываются рецептором, образованным двумя пептидами, IFN-aR1 и IFN-aR2. К представителям интерферонов II типа относится интерферон γ. Он связывается с рецептором, состоящим из цепей IFNGR-1 и IFNGR-2. В 2003 г. выделены интерфероны III типа (IFN-λ), которые включают 4 семейства молекул. Они действуют на рецепторы, образованные субъединицами IFN-λR1 и IL-10R2 [8-11]. Каждый вид и разновидность интерферонов кодируется отдельным геном. Некоторые гены существуют в нескольких аллелях, которым соответствуют изоформы интерферонов (например, IFNα2a, IFNα2b, IFNα2c) [12-14].
Для изменения фармакокинетических свойств лекарственного препарата полученные белковые молекулы химически модифицируют. Так, пэгилированные интерфероны представляют собой белки, химически связанные с полиэтиленгликолем. Активно проводятся клинические испытания химически модифицированных молекул интерферонов для повышения их эффективности при лечении отдельных заболеваний (NCT04638439, NCT04380545).
Разработаны и широко применяются комбинированные препараты на основе интерферонов и вспомогательных лекарственных средств, усиливающих основные лечебные эффекты интерферонов, улучшающих их биодоступность и снижающих риск побочных эффектов. Ярким примером такого препарата служит «Виферон»®.
Механизм действия
Механизмы действия интерферонов в организме сложны, многообразны, включают в себя множество биологических эффектов, которые специфичны для каждого типа молекул. Наиболее изученным свойством интерферонов является их способность препятствовать размножению вирусов. Основными противовирусными протективными внутриклеточными факторами являются белки-интерфероны I типа (а, β) и III типа (λ), которые продуцируются ядерными клетками человеческого организма в ответ на внедрение чужеродной генетической вирусной информации. Их активность основана на индукции и регуляции механизмов врожденного и приобретенного иммунитета. Связываясь с трансмембранными рецепторами, интерфероны активируют сигнальные пути JAK-STAT (янус-киназа-сигнальный преобразователь и активатор транскрипционного белка) в сочетании с другими клеточными элементами (факторами регуляции интерферона), что приводит к индукции сотен интерферон-стимулированных генов для достижения клеткой состояния устойчивости к вирусам. В результате защитного действия интерферонов прекращается связывание вируса с клетками и проникновение вирусных частиц в клетки, подавляется выход из клетки нуклеокапсида оболочки вируса. Нарушение процессов транскрипции и трансляции структурных белков препятствует образованию вирионов или выделению вирусов и, как следствие, приводит к деградации вирусной мРНК. Кроме того, интерферон лимитирует распространение вирусных частиц путем активации белка p53, что ведет к апоптозу инфицированной клетки.
Интерфероны способны подавлять размножение клеток, оказывать регулирующее воздействие на иммунные процессы. Интерфероны активируют антигенпрезентирующие функции макрофагов, усиливают экспрессию антигенов гистосовместимости I класса на поверхности клеток [15], усиливают синтез цитокинов и активность натуральных киллеров (NK-клеток) и дендритных клеток [16].
Интерфероны II типа (ү) стимулируют активность и выживаемость фагоцитов, управляют развитием клеток приобретенного (адаптивного) иммунитета; усиливают экспрессию антигенов гистосовместимости II класса, инициируют и регулируют противовирусные процессы иммунной памяти при повторной встрече с инфекцией [17-19].
Образование интерферонов в организме могут стимулировать не только интактные вирусы, но и другие агенты, например некоторые инактивированные вирусы, их частицы, двухцепочечные РНК, синтетические двухцепочечные олигонуклеотиды и бактериальные эндотоксины. Это позволяет рассматривать их как иммуномодулирующие препараты широкого спектра действия, применение которых может быть эффективно при ряде онкологических, аутоиммунных и аллергических заболеваний, состояний, обусловленных хроническими инфекционными процессами, системным воспалением.
Интерферон-содержащие препараты
Использование интерферонов в качестве лекарственных препаратов было затруднено практически до 1970-х годов, когда были разработаны методики их промышленного получения и высококачественной очистки [20]. Изобретение технологии получения рекомбинантного интерферона дало возможность производить интерфероны любого типа в необходимом количестве, что создало предпосылки для их широкого применения.
Специфическая фармакологическая активность является основным показателем клинических свойств препаратов интерферона и выражается в международных единицах (ME). Метод ее определения основан на способности интерферона защищать культуру клеток от цитопатического действия вируса-индикатора [21]. Биологическая активность интерферонов, продемонстрированная в экспериментальных исследованиях на культурах клеток, достаточно высока. Однако белковая природа молекул затрудняет доставку препарата к клеткам-мишеням при системном применении.
Исходя из методов введения, препараты на основе интерферонов можно разделить на 2 большие группы:
При этом способы введения препаратов оказывают большое влияние на фармакологические эффекты, вероятность развития побочных эффектов и осложнений, а также выбор условий (стационарно, амбулаторно), необходимых для проведения лечения. Выбор метода введения зависит от действующего вещества. Интерферон а может вводиться внутримышечно, что позволяет достичь приемлемых терапевтических концентраций в крови. Интерферон β вводится внутривенно, поскольку после внутримышечного введения он почти не обнаруживается в крови. При необходимости создания высоких локальных концентраций (например, при терапии солидных опухолей) препараты могут вводиться непосредственно в опухоль, внутрибрюшинно или внутриплеврально. Использование других методов введения интерферонов (энтерального введения липосомальных форм, ректального, ингаляционного методов) для системного применения активно обсуждается и является предметом научных исследований.
Все серии препаратов интерферона, поступающие в обращение на территории Российской Федерации, подлежат обязательной сертификации и проходят лабораторные испытания в аккредитованных лабораториях с целью подтверждения их соответствия требованиям нормативной документации. Показатели качества, содержащиеся в нормативной документации на препарат, обеспечивают его безопасность и клиническую эффективность [22].
Зарегистрированные в Российской Федерации препараты для подкожного, внутримышечного и внутривенного введения представлены в табл. 2.
Таблица 2.
Препараты на основе интерферонов для подкожного, внутримышечного и внутривенного введения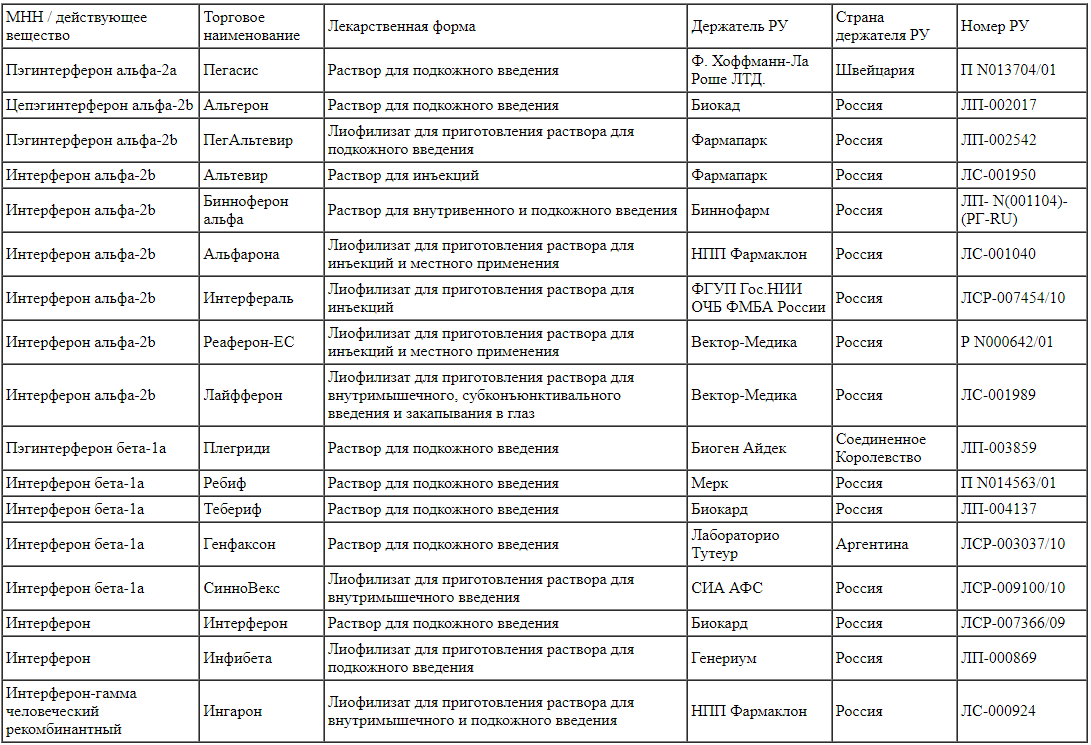 Примечание. РУ - регистрационное удостоверение.
Примечание. РУ - регистрационное удостоверение.
Широкое распространение получило локальное наружное применение интерферонов путем их местного нанесения на эпителий слизистых оболочек, тропный к возбудителю заболевания или находящийся в зоне поражения. Доступно большое количество различных лекарственных форм (ректальные и вагинальные свечи, капли для слизистой оболочки носоглотки и конъюнктивы, гель, мазь) от отечественных и зарубежных производителей для безрецептурного отпуска. Список зарегистрированных в Российской Федерации препаратов представлен в табл. 3-5.
Таблица 3.
Препараты на основе интерферонов для ректального и вагинального введения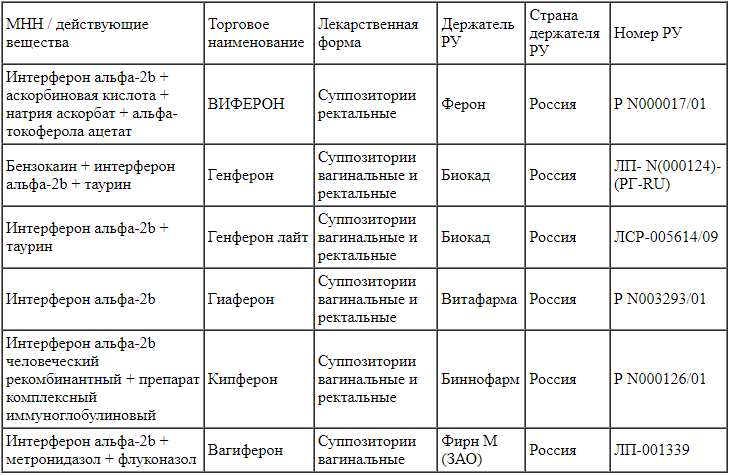 Примечание. РУ - регистрационное удостоверение.
Примечание. РУ - регистрационное удостоверение.
Таблица 4.
Препараты на основе интерферонов для наружного применения (гели и мази) Примечание. РУ - регистрационное удостоверение.
Примечание. РУ - регистрационное удостоверение.
Таблица 5.
Препараты на основе интерферонов для наружного и энтерального применения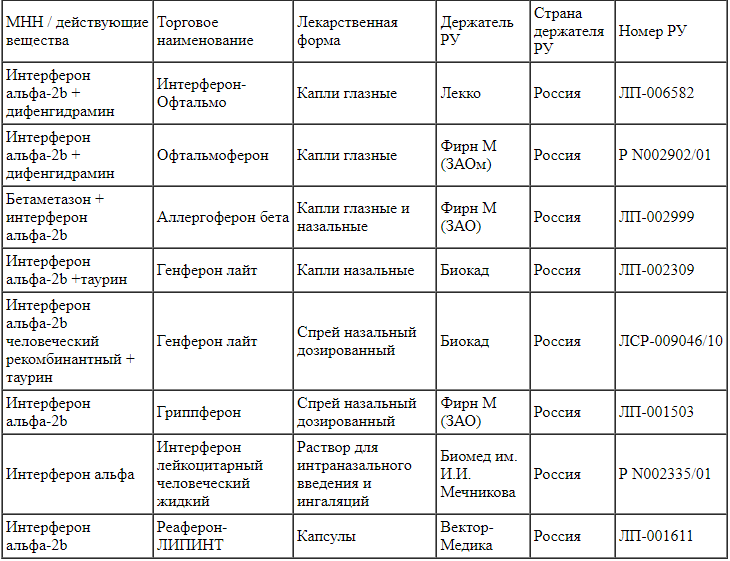 Примечание. РУ - регистрационное удостоверение.
Примечание. РУ - регистрационное удостоверение.
Фармакокинетика
Прямое определение концентрации интерферонов при парентеральном введении препарата опирается на количественные методы иммуноферментного анализа; оно технически сложно, затратно и, как правило, проводится только в рамках научных исследований. Кроме того, необходимо учитывать, что на показатели может влиять уровень собственного интерферона пациента, количество и распределение которого зависит от возраста, веса, наличия заболевания и ряда других факторов. Ввиду этого часто используется непрямая оценка присутствия и концентрации интерферонов на основании вторичных биологических эффектов (например, оценка уровня 2,5-олигоаденилатсинтетаз в лимфоцитах крови, способности клеток периферической крови к продукции интерферона а в ответ на индукцию стандартным антигеном и др.). Действие интерферонов развивается по каскадному механизму, длится достаточно долго, что затрудняет оценку изменений его концентрации на основании обычных фармакокинетических показателей.
При пероральном приеме обычных интерферонов обнаружить их в плазме не удается, а уровень 2,5-олиго-аденилатсинтетаз в лимфоцитах почти не повышается, так как препараты разрушаются в желудочно-кишечном тракте. При внутривенном введении в кровь попадает весь препарат, а пик концентрации достигается в конце инфузии. При внутримышечном или подкожном введении интерферонов а и ү биологическая доступность составляет 80-100%. У интерферона β она значительно ниже. Сывороточная концентрация интерферона а зависит от дозы; через 4-8 ч после введения она достигает максимума, а через 18-36 ч возвращается к исходному уровню. Динамика элиминации интерферона а сложна и зависит от распределения в организме, захвата клетками и распада, который происходит главным образом в печени и почках. Период полувыведения интерферона а составляет около 40 мин, а рекомбинантных интерферонов β и γ - около 4 ч и 30 мин соответственно [14 ].
Присоединение к интерферону а-2b молекулы линейного или разветвленного полиэтиленгликоля значительно замедляет элиминацию комплекса из плазмы, увеличивает период полувыведения такого препарата с 2-3 до 54 и 77 ч соответственно, а также снижает иммуногенность белковых препаратов [23].
До конца не изученным остается вопрос о фармакокинетике и механизмах развития системных фармакологических эффектов локальных лекарственных форм интерферонов, таких как суппозитории, мази и гели. В экспериментах [24] и в клинических исследованиях [25-29] при применении ректальных суппозиториев не было зарегистрировано достоверного повышения концентрации интерферонов в сыворотке крови из воротной и полой вен, смывов со слизистых оболочек носоглотки. При этом наблюдались биологические эффекты, аналогичные таковым при системном применении интерферонов (возрастание активности в крови 2,5-олигоаденилатсин-тетазы, количества CD3+, CD4+, CD+, CD25+, NK-клеток и HLA-DR+ лимфоцитов и др.). В то же время парентеральное введение больших доз (107 МЕ) интерферонов приводило к иммуносупрессии. Похожие эффекты были получены от локального нанесения мази или геля с интерферонами на слизистую оболочку носоглотки. В качестве возможного объяснения результатов была предложена гипотеза о том, что системный эффект возникает после взаимодействия интерферона с определенной популяцией регуляторных клеток, находящихся на слизистых оболочках [14]. Существование такого механизма обосновывало бы положительный эффект локального применения интерферонов не только при острых респираторных вирусных инфекциях (ОРВИ), но и при воспалительных процессах других локализаций (папилломавирусных и герпесвирусных инфекциях, вирусном гепатите В), а также ряде аутоиммунных заболеваний (болезни Шегрена, рассеянном склерозе, сахарном диабете I типа). В любом случае необходимы детальные исследования для определения механизма действия интерферона при ректальном, орально-слизистом, интраназальном, сублингвальном применении, а также для разработки и обоснования режима дозирования и схем приема данных лекарственных форм [30].
Важность этого направления научного поиска связана с простотой, безопасностью и удобством использования данных способов введения лекарственных средств, что особенно актуально для педиатрии, в том числе для амбулаторного лечения. Кроме того, при практическом использовании данных форм интерферона наблюдалось почти полное отсутствие каких-либо побочных эффектов, характерных для парентерального применения, что позволило разрешить использование локальных форм интерферона даже у беременных женщин и недоношенных новорожденных [31, 32].
Применение
Наибольшее распространение в клинической практике получили препараты на основе интерферона а [33]. Они применяются для лечения хронических вирусных инфекций и их последствий (гепатитов В и С, рецидивирующей герпесвирусной инфекции, саркомы Капоши у ВИЧ-инфицированных пациентов, остроконечных кондилом и папилломатоза), профилактики и лечения гриппа и ОРВИ, терапии ряда гематологических и онкологических заболеваний (таких как множественная миелома, волосатоклеточный лейкоз, грибовидный микоз, злокачественная меланома, почечная карцинома, хронический миелолейкоз, первичный (эссенциальный) и вторичный тромбоцитоз, переходная форма хронического гранулоцитарного лейкоза и миелофиброза, рак почки, ретикулосаркома) [34-37].
Препараты интерферона β с успехом применяются для лечения рассеянного склероза [38].
Лекарственные средства на основе интерферона ү используются в терапии хронических заболеваний различной этиологии, в патогенезе которых значительную роль играет выраженная дисфункция иммунной системы (хронический гранулематоз [39], тяжелый злокачественный остеопороз [40], атопический дерматит [41], ревматоидный артрит, системная красная волчанка [42]). Продемонстрирована также эффективность лекарственных средств данной группы в лечении туберкулеза [43].
Лекарственные препараты на основе интерферонов λ проявляют активность, близкую к таковой у препаратов на основе интерферона а, однако обладают большей избирательностью и меньшим числом побочных эффектов. В настоящее время они проходят клинические испытания как средства терапии вирусного гепатита С и ряда онкологических заболеваний [44].
В детской клинической практике преимущественное распространение получили лекарственные формы интерферона α-2b для местного, наружного и ректального использования (см. табл. 2-4). Одним из наиболее широко применяемых препаратов является «Виферон»®, который прошел полный цикл доклинических и клинических исследований в соответствии с требованиями законодательства РФ, включая многоцентровые двойные слепые плацебоконтролируемые исследования. Разработчик сообщает об успешно завершенных исследованиях применения препарата у новорожденных и детей с тяжелыми формами инфекционно-воспалительных заболеваний (в том числе внутриутробными инфекциями); с хроническими вирусными гепатитами (В, С, дельта) (в 1996 и 1999 гг.); острыми респираторными заболеваниями (в 2007-2008 гг.), у взрослых с герпетической инфекцией, а также о продолжающихся исследованиях по применению препарата «Виферон»® в лечении гриппа и других ОРВИ у детей и в комплексной терапии вирусных менингитов [45].
Сочетание в препарате «Виферон»® интерферона α-2b и высокоактивных антиоксидантов (α-токоферола ацетата и аскорбиновой кислоты) позволили снизить терапевтически эффективную концентрацию интерферона a-2b и избежать проявления побочных эффектов.
При лечении ОРВИ патогенетически обосновано применение препаратов интерферона у детей II-IV групп здоровья, которые имеют стойкие нарушения в функционировании иммунной, в том числе интерфероновой системы (длительно и часто болеющие дети) [46, 47]. Иммунологическое обследование детей с хроническими и рецидивирующими аденоидами, трахеобронхитами, риносинуситами, фаринготонзиллитами, отитами, туботитами выявило выраженные нарушения иммунного статуса, прежде всего снижение уровня интерферона, в 80% случаев [48]. Возрастные особенности интерферонового статуса свидетельствуют о том, что у детей в возрасте от 1 мес до 3 лет способность к продукции интерферона существенно снижена по сравнению с взрослыми [49-52].
В условиях пандемии COVID-19 терапия интерферонами у детей становится одним из основных направлений применения этих препаратов. В исследованиях in vitro была подтверждена высокая чувствительность SARS-CoV-2 к интерферонам. При обработке культуры pHAE интерферонами I или III типа за 24 ч до заражения количество вирусной РНК снижалось в 3 раза по сравнению с необработанными зараженными культурами, а репликация вируса уменьшалась на 90% [53]. Аналогичные данные о снижении репликации вируса в культуре клеток в 1-10 тысяч раз под воздействием интерферонов приводят другие авторы [54, 55]. Данные об эффективности клинического применения интерферонов при COVID-19 находятся в стадии накопления и анализа. Проведенный зарубежными исследователями ретроспективный многоцентровой анализ результатов лечения COVID-19 интерфероном α-2b показал, что раннее применение препарата было связано с благоприятными клиническими исходами и снижением летальности [56, 57].
В обзоре, посвященном роли интерферонов в иммунопатогенезе COVID-19 и клинической эффективности лекарственных препаратов на основе человеческого рекомбинантного интерферона α-2b в лечении детей (даты публикаций - до начала 2021 г.) отечественные авторы [58] приводят аргументы о целесообразности включения препаратов интерферона в схемы терапии COVID-19 у детей как в виде монотерапии, так и в комбинациях с другими противовирусными средствами.
Сведения об успешном применении и схемы назначения интерферонов у детей в условиях стационара при инфекции COVID-19 приводятся в ряде отечественных публикаций [59-61]. Применение интраназального рекомбинантного интерферона α-2b у детей, в том числе грудного возраста, в ранние сроки заболевания способствовало сокращению продолжительности периода интоксикации и катаральных симптомов за счет снижения вирусной нагрузки на организм. Статистически значимо уменьшались и сроки элиминации вируса [62, 63]. Продемонстрирована возможность применения интерферона в составе сочетанной терапии с антиоксидантами [64], противовирусными препаратами и их комбинациями [65, 66].
Авторы настоящей публикации сообщали о собственном опыте применения препаратов интерферона α-2b («Виферон»®) для лечения новой коронавирусной инфекции у детей в условиях стационара [67]. Так, в 2020-2021 гг. на базе Детской городской клинической больницы им. З.А. Башляевой (г. Москва) было проведено рандомизированное открытое научное исследование эффективности препаратов интерферона α-2b («Виферон»®, суппозитории ректальные) в терапии COVID-19 у детей. В исследование было включено 140 детей в возрасте от 1 года до 17 лет.
Результаты исследования показали, что комбинированная терапия COVID-19 у детей препаратами человеческого рекомбинантного интерферона α-2b с антиоксидантами на 4 дня сокращает суммарную продолжительность всех клинических симптомов COVID-19 по сравнению со стандартной терапией умифеновиром, в 2,2 раза быстрее элиминирует вирус из носоглотки, в 2,5 раза ускоряет прекращение вирусовыделения из кишечника. С учетом накопленного положительного опыта рекомбинантный интерферон α-2b включен в последние отечественные рекомендации в перечень обязательных назначений при легкой и среднетяжелой форме COVID-19 у детей [2, 3].
Перспективы разработки и применения лекарственных препаратов на основе интерферонов
Ближайшие актуальные задачи по совершенствованию интерферонотерапии у детей - это обобщение результатов последних клинических исследований по их применению и разработка рекомендаций по уточнению показаний и режимов дозирования. Дальнейшее повышение эффективности данной группы препаратов может быть направлено на снижение системных токсических эффектов и увеличение избирательности воздействия на клетки, пораженные патологическим процессом. Для достижения этих задач перспективными направлениями представляются модификация и разработка новых препаратов с применением методов молекулярной биологии и биотехнологии.
Примером может служить созданный методами генной инженерии вектор на базе аденоассоциированного вируса, кодирующий интерферон a и сцепленный с аполипопротеином А1, который продемонстрировал хороший терапевтический потенциал на моделях хронического вирусного гепатита в эксперименте [68].
Перспективным направлением является создание генетически измененных рекомбинантных молекул интерферона I типа, связанных со специфическими антителами. Такие соединения позволяют снижать системные токсические эффекты интерферонов, сохраняя при этом специфическое фармакологическое действие в отношении клеток-мишеней [69].
В экспериментах in vivo и in vitro было продемонстрировано, что такой молекулярный комплекс, содержащий измененный интерферон-α2 и специфическое антитело как способ доставки к клеткам-мишеням, на несколько порядков усиливал специфическую активность интерферонов, на 90% концентрируя ее на клетках-мишенях [70]. Интенсивно развивается применение интерферонов-α, связанных с антителами к различным маркерам опухолевых или иммунокомпетентных клеток-мишеней [69], что является основой для разработки новых лекарственных препаратов для иммунотерапии опухолей различного генеза.
Универсальность противовирусного, иммуномодулирующего и антипролиферативного действия интерферонов позволяет рассматривать созданные и разрабатываемые на их основе препараты как перспективные средства для лечения широкого спектра заболеваний у пациентов, включая детей различного возраста.
Литература
1. Лауреаты Российской премии в области фармации и медицины Russian Pharma Awards.
2. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19).
3. Клинический протокол лечения детей с новой коронавирусной инфекцией (COVID-19), находящихся на стационарном лечении в медицинских организациях государственной системы здравоохранения г. Москвы / И.М. Османов [и др.] ; под ред. А.И. Хрипуна. М. : НИИ-ОЗММ ДЗМ, 2021. 92 с.
4. Аллергология и иммунология. Национальное руководство, краткое издание / под ред. акад. Р.М. Хаитова, проф. Н.И. Ильиной. М. : ГЭОТАР-Медиа, 2012. С. 134-137.
5. White D.O., Fenner FJ. Medical virology. Elsevier, 2016. 664 p.
6. Вавиленкова Ю.А. Современные представления о системе интерферона // Вестник Смоленской государственной медицинской академии. 2012. Т. 11, № 2. С.74-82
7. Interferons: between structure and function / K. Bandurska [et al.] // Post^py Higieny i Medycyny Doswiadczalnej. 2014. Vol. 68. P 428-440.
8. Stanifer M.l., Pervolaraki K., Boulant S. Differential regulation of type I and type III interferon signaling // International Journal of Molecular Sciences. 2019. Vol. 20, No. 6. P. 1445.
9. Domeier P.P, Rahman Z.S. Regulation of B cell responses in SLE by three classes of interferons // International Journal of Molecular Sciences. 2021. Vol. 22, No. 19. P 10464.
10. Ярилин А.А. Иммунология : учебник. М. : ГЭОТАР-Медиа, 2010. С. 218-230.
11. Bandurska K., Krol I, Magdalena Myga-Nowak M. Interferons: between structure and function // Postepy Higieny i Medycyny Doswiadczalnej. 2014. Vol. 68. P. 428-444.
12. NK cells andinterferons / R. Paolini, G. Bernardini, R. Molfetta, A. Santoni// Cytokine and Growth Factor. 2015. Vol. 26, No. 2. Р 113-120.
13. Comparative functional analysis of 12 mammalian INF-14 orthologs / A. Paguin, O.O. Onabajo, W Tang, L. Prokunina-Olsson // Journal of Interferon and Cytokine Research. 2016. Vol. 36, No. 1. Р 30-36.
14. Василевский И.В., Лавриненко А.В. Клинико-фармакологическое обоснование применения интерферонов в клинической практике // Здравоохранение. 2016. № 7. С. 51-63.
15. Doherty P.C., Zinkernagel R.M. T-cell-mediated immunopathology in viral infections // Transplantation Reviews. 1974. Vol. 19. P. 89-120.
16. Herberman R.B. Immunoregulation and natural killer cells // Molecular Immunology. 1982. Vol. 19, No. 10. P. 1313-1321.
17. Basham T.Y., Merigan T.C. Recombinant interferon-gamma increases HLA-DR synthesis and expression // Journal of Immunology. 1983. Vol. 130, No. 4. P. 1492-1494.
18. Noma T., Dorf M.E. Modulation of suppressor T cell induction with gamma-interferon // Journal of Immunology. 1985. Vol. 135, No. 6. P. 3655-3660.
19. Blackman M.J., Morris A.G. The effect of interferon treatment of targets on susceptibility to cytotoxic T-lymphocyte killing: augmentation of allogeneic killing and virus-specific killing relative to viral antigen expression // Immunology 1985. Vol. 56, No. 3. P 451-457.
20. White D.O., Fenner FJ. Medical Virology 3rd edn. Elsevier, 2016.
21. Оценка состояния проблемы аттестации и применения отраслевых стандартных образцов медицинских иммунобиологических препаратов / Р.А. Волкова [и др.] // Стандартные образцы. 2013. № 3. С. 58-61.
22. Приказ Минпромторга России от 04.09.2020 № 2945 «Об утверждении Административного регламента Министерства промышленности и торговли Российской Федерации по предоставлению государственной услуги по выдаче сертификатов соответствия производителей лекарственных средств для медицинского применения требованиям правил надлежащей производственной практики Евразийского экономического союза» (Зарегистрировано в Минюсте России 15.09.2020 № 59855).
23. Клиническая фармакология по Гудману и Гилману / под ред. А.Г. Гилмана. М. : Практика, 2006. С. 1028-1031
24. Colorectal administration of human interferon-α / V. Bocci, A. Naldini, F. Corradeschi, E. Lencioni // International Journal of Pharmaceutics. 1985. Vol. 24, Iss. 1. P. 109-114.
25. Сравнительное изучение фармакокинетики различных лекарственных форм интерферона-альфа-2b / В.Н. Корсунский, А.Б. Брускин, Л.А. Денисов, Р.А. Иванов // Эффективная фармакотерапия. Акушерство и гинекология. 2007. № 1. C. 24-29
26. Костинов М.П., Лукачев И.В., Мещерякова А.К. Профилактика осложнений у беременных с легкой и средней тяжестью течения ОРИ с использованием интерферона α-2β.
27. Эпидемиологическая и иммунологическая эффективность использования препарата виферон, гель для профилактики гриппа и других острых респираторных инфекций в организованных воинских коллективах / В.Г. Акимкин [и др.] // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2011. № 1.
28. Курбанова Х.И. Клинико-иммунологическое обоснование местной интерферонотерапии при респираторных вирусных инфекциях у детей : автореф. дис. ... канд. мед. наук. М., 2012. 36 с.
29. Показатели местного иммунитета у беременных с острой респираторной инфекцией на фоне интерферонотерапии / А.К. Мещерякова [и др.] // Вопросы гинекологии, акушерства и перинатологии. 2014. Т. 13, № 2. С. 44-46.
30. Борзанова М.В., Алпенидзе Д.Н., Горелышева Н.Е. Обзор эффективности препаратов интерферона α-2β при интраназальном применении // Русский медицинский журнал. 2012. № 24. С. 1208-1214.
31. Модифицированная интерферонотерапия острых респираторных инфекций у детей раннего возраста: патогенетическое обоснование и эффективность / И.Н. Захарова [и др.] // Российский вестник перинатологии и педиатрии. 2011. № 3. С. 49-54.
32. Рекомбинантные интерфероны в лечении вирусных и вирусно-бактериальных инфекций у детей: методические рекомендации / Л.В. Феклисова [и др.]. М. : МОНИКИ, 2006. 32 с.
33. Терапевтический потенциал препаратов альфа интерферонов при социально-значимых заболеваниях человека вирусной этиологии / Т.П. Оспельникова, Е.М. Носейкина, Л.А. Гайдерова, Ф.И. Ершов // Журнал микробиологии. 2016. № 5. С. 109-121.
34. Козлов С.Н., Страчунский Л.С. Современная антимикробная терапия : руководство для врачей. М. : Медицинское информационное агентство, 2009. 448 с.
34. Осипова Л.С. Особенности клинического применения препаратов интерферона // Мистецтво лiкування. 2011. № 2. С. 70-73.
35. Friedman R.M. Clinical uses of interferons // British Journal of Clinical Pharmacology. 2008. Vol. 65, No. 2. Р. 158-162.
36. Оспельникова Т.П., Носейкина Е.М. Применение препаратов интерферона в клинической практике // Лечебное дело. 2005. № 1. С. 25-29.
37. Интерфероновый статус, препараты интерферона в лечении и профилактике инфекционных заболеваний и реабилитации больных / под ред. С.С. Афанасьева [и др.]. М., 2005. 767 с.
38. Долгосрочная эффективность и переносимость отечественного биоаналога интерферона бета-lb для лечения рассеянного склероза / Ф.А. Хабиров [и др.] // Практическая медицина. 2013. № 1-1 (68). С. 202-204.
39. Errante P.R., Frazro J.B., Condino-Neto A. The use of interferon-gamma therapy in chronic granulomatous disease // Recent Patents on Anti-Infective Drug Discovery 2008. Vol. 3, No. 3. P 225-230.
40. Recombinant human interferon gamma therapy for osteopetrosis / L.L. Key, W.L. Ries, R.M. Rodriguiz, H.C. Hatcher // Journal of Pediatrics. 1992. Vol. 121, No. 1. P. 119-124.
41. Akhavan А., Rudikoff D. Atopic dermatitis: systemic immunosuppressive therapy // Seminars in Cutaneous Medicine and Surgery. 2008. Vol. 27, No. 2. P. 151-155.
42. Интерферон и другие цитокины при ревматических заболеваниях / Т.П. Оспельникова [и др.] // Вестник РАМН. 2010. № 7. С. 3-7.
43. Reljic R. IFN-gamma therapy of tuberculosis and related infections / Journal of Interferon & Cytokine Research. 2007. Vol. 27, No. 5. P 353-364.
44. Lasfar A., Zloza A., Cohen-Solal K.A. IFN-lambda therapy: current status and future perspectives // Drug Discovery Today. 2015. Nov. 10. pii: S1359-6446(15)00419-5.
45. Клинические исследования по препарату Виферон.
46. Роль препаратов интерферона в терапии ОРВИ у детей грудного и раннего детского возраста - результаты многоцентрового сравнительного рандомизированного клинического исследования / Л.В. Феклисова [и др.] // Педиатрическая фармакология. 2011. Т. 8, № 4. С. 33-37.
47. Михайлова Е.В. Особенности клинического течения и иммунокорригирующая терапия острых респираторных вирусных инфекций у часто болеющих детей // Эффективная фармакотерапия. Педиатрия. 2015. № 3. С. 34-36.
48. Маркова Т.П.,Чувиров Д.Г.Длительно и часто болеющие дети// Русский медицинский журнал. 2002. Т. 10, № 3. С. 125-137.
49. Современная интерферонотерапия гриппа и острых респираторных инфекций у детей / Т. А. Чеботарева, Е.Н. Выжлова, И.Н. Захарова, А.Л. Заплатников // Лечащий врач. 2013. № 4. С. 92-97.
50. Обоснование, опыт лечения и профилактики острых респираторных вирусных инфекций препаратами рекомбинантного интерферона : методические рекомендации / В.Ф. Учайкин [и др.]. М. : Спецкнига, 2012. 48 с.
51. Оптимизация интерфероно- и иммунотерапии у иммуно-компрометированных детей с ассоциированными вирусно-вирусными инфекциями: повторные острые респираторные вирусные и различные герпесвирусные инфекции / И.В. Нестерова [и др.] // Аллергология и иммунология. 2013. № 2. С. 87-88.
52. Щеплягина Л.А., Круглова И.В. Возрастные особенности иммунитета у детей // Русский медицинский журнал. 2009. № 23. С. 39-43.
53. Type I and type III IFN restrict SARS-CoV-2 infection of human airway epithelial cultures / А. Vanderheiden [et al.] // BioRxiv. 2020.
54. Type I Interferon Susceptibility Distinguishes SARS-CoV-2 from SARS-CoV / K.G. Lokugamage [et al.] // Journal of Virology. 2020. Vol. 94, No. 23. P e01410-20.
55. Type I Interferon as a potential treatment against COVID-19 / E. Sallard [et al.] // Antiviral Research. 2020. Vol. 178. P 104791
56. Lokugamage K.G., Schindewolf C., Menachery V.D. SARS-CoV-2 sensitive to type I interferon pretreatment // BioRxiv. 2020.
57. Оспельникова Т.П.,Левицкая Д.С.,Колодяжная Л.В.,и др.Биологическая активность интерферонов при новой коронавирусной инфекции COVID-19 // Вопросы вирусологии. - 2022. -Т. 67. - №2. - C. 142-152.
58. Мазанкова Л.Н., Горбунов С.Г., Самитова Э.Р. Значение интерферонотерапии при COVID-19 у детей // Детские инфекции. 2021. Т. 20, № 1. С. 34-38.
59. Ведение детей с заболеванием, вызванным новой корона-вирусной инфекцией (SARSCoV-2) / Ю.С. Александрович [и др.] // Педиатрическая фармакология. 2020. Т. 17, № 2. С. 103-118.
60. Лечение детей, инфицированных COVID-19, в непрофильном стационаре / Д.О. Иванов [и др.] // Педиатр. 2020. Т. 11, № 2. С. 5-14.
61. Гасилина Е.С. Рациональная этиопатогенетическая интерферонотерапия у детей с инфекцией COVID-19 // Эффективная фармакотерапия. 2021. Т. 17. С. 14-22.
62. Современные возможности интерферонов в лечении детей с COVID-19 / А.И. Сафина [и др.] // Медицинский совет. 2021. № 1. С. 59-65.
63. Оптимизация противовирусной терапии новой коронавирусной инфекции COVID-19 у детей / Г.П. Мартынова [и др.] // Педиатрия. Журнал им. Г.Н. Сперанского. 2021. Т. 100, № 3. С. 208-218.
64. Хлынина Ю.О., Арова А.А., Невинский А.Б. Оценка эффективности рекомбинантного интерферона альфа-2Ь для лечения и профилактики новой коронавирусной инфекции у детей // Сборник трудов Конгресса по инфекционным болезням им. акад. В.И. Покровского. М., 2021. С. 161.
65. Показатели цитокинового статуса у детей с ОРВИ на фоне терапии интраназальными препаратами интерферона / О.И. Афанасьева [и др.] // Детские инфекции. 2021. Т. 20, № 4. С. 6-12.
66. COVID-19 у детей в мегаполисе: клинико-эпидемиологические и терапевтические аспекты / Р.А. Иванова [и др.] // Практическая медицина. 2020. Т. 18. С. 119-127.
67. Zachariah P COVID-19 in children // Infectious Disease Clinics of North America. 2022. Vol. 36, No. 1. P 1-14.
68. Coronavirus disease 2019 in children / M. Borrelli [et al.] // Frontiers in Pediatrics. 2021. Vol. 9. P. 668484.
69. Новая коронавирусная инфекция у детей / под ред. И.М. Османова, Л.Н. Мазанковой, И.Н. Захаровой. М. : ГЭОТАР-Медиа, 2023. 384 с.
70. Liver-directed gene therapy of chronic hepadnavirus infection using interferon alpha tethered to apolipoprotein A-I / P. Berraondo [et al.] // Journal of Hepatology 2015. Vol. 63, No. 2. P 329-336.
71. Uze G., Tavernier J. High efficiency targeting of IFN-α activity: Possible applications in fighting tumours and infections // Cytokine & Growth Factor Reviews. 2015. Vol. 26, No. 2. P. 179-182.
72. Highefficiencycell-specifictargetingofcytokineactivity/G.Garcin [et al.] // Nature Communications. 2014. Vol. 5. P. 3016


