Клинико-вирусологическая оценка эффективности индуктора интерферона, содержащего антитела к гамма-интерферону в релиз-активной форме, в терапии острых вирусных кишечных инфекций
СтатьиОпубликовано в журнале:
«Инфекционные болезни » № 3, т. 10, 2010
А.В.Горелов1, А.А.Плоскирева1, Н.Х.Тхакушинова1,2
1 Центральный НИИ эпидемиологии Роспотребнадзора, Москва;
2 Специализированная клиническая детская инфекционная больница, Краснодар
В статье приведены результаты двухцентрового рандомизированного двойного слепого плацебо-контролируемого исследования по оценке эффективности индуктора интерферона, содержащего антитела к гамма-интерферону в релиз-активной форме (Анаферон детский), в терапии острых кишечных инфекций вирусной этиологии у детей. Показана клиническая и санирующая эффективность Анаферона детского, проявляющаяся в сокращении выраженности и продолжительности основных симптомов заболевания, в более быстрой элиминации вируса, а также в снижении риска внутрибольничного инфицирования.
Ключевые слова: Анаферон детский, антитела к гамма-интерферону, индуктор интерферонов, острая кишечная инфекция, дети, релиз-активная форма, элиминация вирусов, этиотропная терапия
A.V.Gorelov1, A.A.Ploskireva1, N.Kh.Tkhakushinova 1,2
1 Central Research Institute of Epidemiology, Federal Supervision Service for Consumer Rights Protection and People's Welfare, Moscow;
2 Specialized Clinical Pediatric Infectious Hospital, Krasnodar
The article presents the results of a two-center randomized double blind placebo-controlled study to evaluate the effectiveness of an interferon inductor containing antibodies to gamma-interferon in a release-active form (Anaferon for children) in therapy of acute enteric infections of viral etiology in children. The clinical and sanitizing effectiveness of Anaferon for children is shown, which is manifested in a less severe and shorter period of the major symptoms of disease, in a faster elimination of virus, and also in a decreased risk for hospital-acquired infection.
Key words: Anaferon for children, antibodies to gamma-interferon, interferon inductor, acute enteric infection, children, release-active form, virus elimination, etiotropic therapy
Эпидемиологическая ситуация в мире и в нашей стране по ряду инфекционных болезней продолжает оставаться неустойчивой, в том числе по заболеваемости острыми кишечными инфекциями. Так, за период с января по декабрь 2011 г. по сравнению с аналогичным периодом 2010 г. в Российской Федерации зафиксировано снижение общей заболеваемости брюшным тифом на 21,7%, бактериальной дизентерией - на 21,9%, острыми кишечными инфекциями установленной этиологии - на 4,4%, острыми кишечными инфекциями неустановленной этиологии - на 12,9%. Вместе с тем, заболеваемость другими сальмонеллезными инфекциями в январе 2012 г. возросла и составила 2,3 случая на 100 тыс. населения против 1,91 за 2011 г., при этом 46% случаев сальмонеллеза было диагностировано у детей [1].
Детское население, в целом, является наиболее поражаемым контингентом в отношении заболеваемости острыми кишечными инфекциями (ОКИ). Так, среди ОКИ с установленной этиологией 80% случаев приходится на пациентов младше 14 лет, а среди ОКИ неустановленной этиологии на долю детей приходится 59% [1].
В этиологической структуре ОКИ у детей в настоящее время произошли существенные изменения, так, повсеместно в мире преобладают вирусные диареи, лидирующим патогенным агентом являются ротавирусы. По данным ВОЗ, большая часть детей в течение первых 5 лет жизни вне зависимости от места жительства и социальных факторов переносит ротавирусный гастроэнтерит, при этом на долю пациентов в возрасте младше 2 лет приходится значительная доля. Ротавирусная инфекция служит причиной госпитализации 30-54% детей по поводу острой диареи. Ротавирусы являются также одной из ведущих причин внутрибольничного инфицирования и вызывают заболевание в среднем в 27% случаев госпитализации в развитых и 32% - в развивающихся странах [2]. Данное обстоятельство определяется, прежде всего, доказанной высокой контагиозностью возбудителя и особенностями путей его передачи. Основной путь передачи ротавируса - фекально-оральный, хотя истинная доля респираторного (воздушно-капельного) пути передачи до настоящего момента не уточнена. Пациенты, больные ротавирусной инфекцией, выделяют в окружающую среду более 10 млрд вирусных частиц на 1 г (мл) фекалий, а привести к заражению другого человека может незначительное количество вируса (10 бляшкообразующих единиц на мл) [3-7]. Не менее значимым является и то, что ротавирусы могут длительное время сохранять жизнеспособность в условиях пониженной влажности и довольно устойчивы к мылу и дезинфектантам [5, 7]. После перенесенной инфекции и купирования клинической симптоматики выделение вируса сохраняется в течение периода от 4-7 до 30-70 сут [3]. Элиминация возбудителей наиболее распространенных ОКИ вирусной природы (Rotavirus, Norovirus) за среднее время госпитализации незначительна и составляет порядка 10%, в отличие от бактериальных патогенов (Shigella spp., Salmonella spp., Campylobacter spp.), у которых этот показатель колеблется от 37 до 100% [8].
Особую актуальность приобретает в настоящее время вспышечная заболеваемость ОКИ. Так, по данным Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, в 2011 г. продолжилась тенденция к увеличению числа вспышек инфекционных и паразитарных болезней в Российской Федерации, сложившаяся в последние 3 года [9]. При этом наибольшая часть выявленных очагов инфекционных заболеваний приходилась на детские учреждения: детские сады, школы, интернаты, летние лагеря (89,2% случаев или 2382 очага), а число пострадавших детей составило 38 460 человек (90,5% от всех заболевших). В прошедшем году на долю ОКИ вирусной этиологии пришлось около 30% от числа всех эпидемических очагов.
Не менее значимую проблему современного здравоохранения страны представляют собой внутрибольничные инфекции.
Наиболее часто возбудителями внутрибольничных ОКИ также являются ротавирусы и норовирусы. В последние годы наметилась также негативная тенденция - более чем в два раза выросло число случаев внутрибольничных инфекций сочетанной этиологии за среднее время госпитализации [8].
При обсуждении формы, течения и исходов ОКИ следует признать, что неблагоприятные исходы при острых кишечных вирусных инфекциях связаны с развитием тяжелых форм, которые особенно часто наблюдаются у детей раннего возраста и обусловлены быстрым нарастанием эксикоза, развитием метаболического ацидоза, незрелостью иммунной системы организма. Проведенные ранее исследования показали, что в остром периоде ОКИ у детей отмечается изменение широкого спектра иммунологических реакций. Так, характерной особенностью иммунопатогенеза ОКИ различной этиологии у детей является снижение местного иммунитета, проявляющееся уменьшением секреторного иммуноглобулина А (sIgA). Помимо этого, отмечается активное повышение продукции провоспалительных цитокинов, изменение интерферонового статуса за счет снижения уровня интерферонов, уменьшения показателей спонтанной и индуцированной продукции интерферонов вне зависимости от возраста, типа диареи и тяжести заболевания [10, 11].
При ОКИ вирусной этиологии, в частности при ротавирусной инфекции, основными механизмами иммунопатогенеза являются снижение фагоцитарной активности лейкоцитов, дисбаланс в продукции иммуноглобулинов (Ig) (дефицит IgA и IgG, повышение IgM в сыворотке крови), уменьшение числа Т-лимфоцитов (CD3+, CD4+) и В-лимфоцитов, снижение активности комплемента [10, 12-14].
Таким образом, развитие транзиторного дисбаланса иммунного гомеостаза у детей в остром периоде ОКИ вирусной этиологии и высокий риск внутрибольничного инфицирования обуславливают включение в комплексную терапию данных заболеваний препаратов, обладающих комбинированной противовирусной и иммуномодулирующей активностью.
Препаратами выбора в терапии ОКИ вирусной этиологии у детей могут быть иммуномодуляторы, в частности, индукторы интерферонов. По мнению Р.М.Хаитова с соавт.: «Для того чтобы тот или иной лекарственный препарат мог быть отнесен к группе иммуномодуляторов, должна быть доказана его способность изменять иммунологическую реактивность в зависимости от ее исходного состояния, т.е. препарат должен повышать пониженные и(или) понижать повышенные, т.е. регулировать и приводить к норме патологически измененные показатели иммунитета» [15].
В настоящее время одним из перспективных отечественных иммунотропных препаратов является индуктор эндогенных интерферонов - Анаферон детский (ООО «НПФ «Материа Медика Холдинг», Россия). Данный препарат в качестве действующего вещества содержит антитела к гамма-интерферону человека (ИФН-γ) в релиз-активной форме1. Будучи индуктором ИФН (α и γ), Анаферон оказывает комбинированное действие - этиотропное (непрямое противовирусное) и иммуномодулирующее. Влияние препарата на систему ИФН и иммунную систему проявляется в зависимости от исходного состояния организма и, как правило, реализуется в повышении активности макрофагов и NK-клеток, активации функций и увеличении функциональных резервов Т-эффекторов, Т-хелперов, B-лимфоцитов, а также других клеток, участвующих в иммунном ответе, и в повышении продукции иммуноглобулинов (включая sIgA).
В отличие от классических индукторов ИФН, Анаферон избирательно влияет на продукцию обоих видов ИФН (α и γ ): в остром периоде повышаются все виды продукции, а к периоду реконвалесценции содержание ИФН-α и ИФН-γ в сыворотке и их спонтанная продукция клетками снижаются до нормальных уровней, в то время как способность к индуцированной продукции ИФН (эквивалент синтеза ИФН при контакте с вирусом) повышается, обеспечивая тем самым высокий профилактический потенциал в отношении повторных инфекций [16-20].
Цель исследования - оценка эффективности индуктора ИФН (Анаферона детского) в терапии ОКИ вирусной этиологии у детей.
Пациенты и методы
Проведено рандомизированное двойное слепое плацебо-контролируемое исследование на базе ДИКБ №5 города Москвы (главный врач Власов Е.В.) и СКДИБ г. Краснодара (главный врач Тхакушинова Н.Х.) в период сезонного подъема заболеваемости (с ноября 2010 г. по апрель 2011 г.). В исследование включались больные ОКИ дети в возрасте от 1 мес до 3 лет, поступившие в профильные стационары в первые двое суток от начала заболевания и имевшие характерные проявления вирусных ОКИ (лихорадка >37,5°С, частый, жидкий стул, рвота, боли в животе, урчание по ходу кишечника, катаральные симптомы), родители которых выразили информированное согласие на участие в исследовании. Критериями исключения являлись: наличие симптомов, характерных для бактериальной ОКИ, и показаний к антибактериальной терапии, отягощенный преморбидный фон, тяжелая форма заболевания. Пациенты, включенные в исследование, были рандомизированы в две группы (по 2 группы в каждом центре). Основную группу составили 46 пациентов (всего в обоих центрах), в составе комплексной терапии которых использовался исследуемый препарат (Анаферон детский), группу сравнения - 42 ребенка (всего в обоих центрах), получавших в составе комплексной терапии препарат плацебо (не отличавшийся по внешним и органолептическим свойствам от активного препарата, но не содержащий активного компонента).
Группы были сопоставимы между собой за исключением применения исследуемого препарата: по полу (процентное соотношение мальчики/девочки в основной группе - 63/37, в группе сравнения - 48/52 соответственно), возрасту пациентов (средний возраст 2,0 ± 0,14 и 1,95 ± 0,17 года соответственно), срокам начала терапии (1,85 ± 0,07 и 1,83 ± 0,06 дней соответственно), а также проводимой комплексной терапии (энтеросорбенты, растворы для пероральной регидратации, пробиотики). Назначение исследуемого препарата/плацебо (в основной и группе сравнения соответственно) осуществлялось в первые сутки начала терапии по схеме: 1-й день - 8 приемов (в течение 2 ч по 1 таблетке каждые 30 мин - 5 приемов, затем по 1 таблетке каждые 3 ч), во 2-5-е сутки - по 1 таблетке 3 раза в день. С учетом того, что возраст участников был меньше 3 лет, непосредственно перед приемом таблетку растворяли в 15 мл питьевой воды, полученный раствор давали выпить ребенку.
Клиническое наблюдение за пациентами сравниваемых групп осуществляли ежедневно. Оценивали следующие показатели: температура тела (2 раза в сутки), масса тела ребенка (1 раз в сутки), кратность и характеристика стула в течение суток, наличие симптомов интоксикации, рвоты, катаральных явлений со стороны верхних и нижних дыхательных путей (ВДП и НДП), показатели работы сердечнососудистой и дыхательных систем и другие клинические данные. Клинико-лабораторное обследование включало в себя рутинные методы диагностики (клинический анализ крови, общий анализ мочи, биохимический анализ крови и другие) и установление этиологии заболевания методом полимеразной цепной реакции (ПЦР), проводимой на 1-е и 5-е сутки наблюдения за пациентом.
Для оценки эффективности терапии использовались первичные и вторичные критерии. К первичным относились:
- доля пациентов с нормализацией температуры тела (<37,0°С) к исходу 1-5-х суток лечения в группах;
- доля пациентов с прекращением рвоты к исходу 1-5-х суток лечения в группах;
- доля пациентов с нормализацией кратности стула к исходу 1-5-х суток лечения в группах;
- доля пациентов с отрицательным результатом ПЦР кала на возбудители ОКИ на 5-е сутки лечения (при условии положительного результата в 1-е сутки лечения) в группах.
Статистическая обработка данных проводилась с использованием статистического пакета Statistica 6.1 (StatSoft, Inc, USA). Использовались методы параметрической (для непрерывных и интервальных переменных) и непараметрической (частотный анализ по категориальным переменным) статистики.
Сравнение групп по качественным признакам (удельный вес пациентов с нормальными показателями) проводилось по критерию χ2, а также двустороннему точному тесту Фишера в случае, если значение хотя бы в одной ячейке таблицы сопряженности было меньше 5.
Сравнение двух независимых групп выполнялось с использованием параметрического метода проверки статистических гипотез - t-критерия Стьюдента для независимых выборок и непараметрического метода - критерия Манна-Уитни. Различия показателей считали статистически значимыми при р<0,05.
Таблица. Клиническая характеристика ОКИ в группах на момент включения в исследование
| Критерии | Основная группа | Группа сравнения | |
| Удельный вес пациентов, имеющих данные симптомы, % (абс.) |
Температура тела >37,0°С | 96 (44) | 88 (37) |
| Рвота | 65 (30) | 64 (27) | |
| Частый стул | 80 (37) | 81 (34) | |
| Снижен аппетит | 100 (46) | 100 (42) | |
| Ринит | 39 (18) | 48 (20) | |
| Кашель | 46 (21) | 45 (19) | |
| Среднее значение (M±m) |
Температура тела,°С | 38,10 ± 0,09 | 38,00 ± 0,11 |
| Частота рвоты, раз/сутки | 1,80 ± 0,26 | 1,20 ± 0,17 | |
| Частота стула, раз/сутки | 4,10 ± 0,48 | 4,00 ± 0,32 | |
Результаты исследования и их обсуждение
При поступлении основные клинические проявления заболевания в сравниваемых группах были сопоставимы между собой. Так, наличие лихорадки >37,5°С в группе активного препарата наблюдалось у 44 (96%) детей, а в группе сравнения - у 37 (88%) пациентов, при этом высота лихорадки составила 38,1 ± 0,09 и 38,0 ± 0,11°С соответственно. Рвота наблюдалась у 30 (65%) и 27 (64%) пациентов в группах детей, получавших Анаферон детский или плацебо, а средняя частота рвоты составила 1,8 ± 0,26 и 1,2 ± 0,17 раз/сутки соответственно. Удельный вес пациентов, у которых отмечалось учащение и разжижение стула, в обеих группах был примерно одинаков (37 (80%) пациентов в группе активного препарата против 34 (81%) - в группе плацебо). При этом в основной группе средняя частота жидкого стула составила 4,1 ± 0,48 раз/сутки, а в группе сравнения -4,0 ± 0,32 раз/сутки. По другим клиническим проявлениям заболевания в сравниваемых группах достоверных различий в первые сутки наблюдения также не было зарегистрировано (таблица).
Динамика лихорадочной реакции у пациентов в группах представлена на рис. 1. Как видно из рисунка, наиболее значимые различия в долях пациентов с нормализацией температуры тела наблюдались на 2-3-и сутки терапии: в основной группе у 48% пациентов на 2-е сутки от начала терапии в утренние часы температура тела была в пределах физиологической нормы, в то время как в группе сравнения только у 14% детей было отмечено снижение температуры тела до нормальных значений (р<0,001). Аналогичные данные были получены при анализе динамики вечерней температуры тела. Таким образом, в группе активного препарата значимо большая доля детей имела нормальную температуру тела на 2-е и 3-и сутки лечения, к 5-м суткам лечения различия нивелировались, но сохранялась тенденция к преобладанию лучших результатов в основной группе.
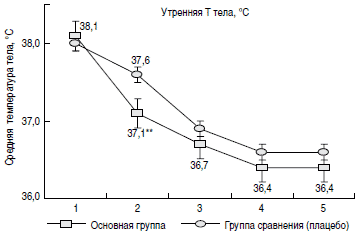
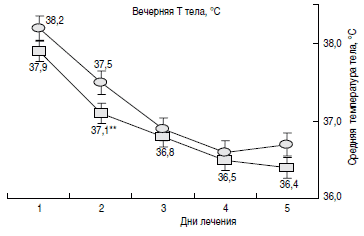
Динамика температурной кривой в сравниваемых группах представлена на рис. 2. Как видно из рисунка, характер утренней и вечерней кривой в обеих группах носил экспоненциальный характер. При этом в основной группе на 2-е сутки от начала терапии динамика уменьшения лихорадочного синдрома была более выраженной (р<0,001).
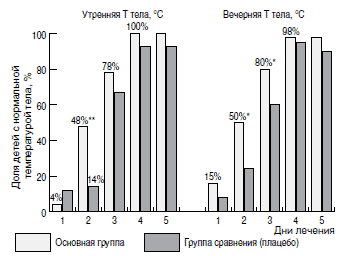
Здесь и на рис. 2-5 - достоверные различия между группами при *р<0,05, **р<0,001.
 |
 |
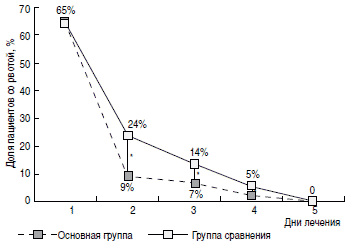
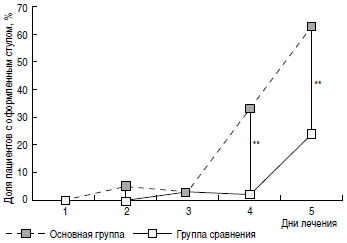
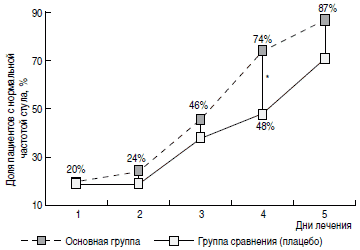
Регресс основных клинических симптомов ОКИ также был более быстрым у пациентов основной группы. Так, доля пациентов с наличием рвоты (рис. 3) уже на 2-е сутки терапии была значимо меньшей в основной группе (9%), чем в группе сравнения (24%). На 4-е и 5-е сутки от начала терапии в основной группе пациентов достоверно чаще отмечалась нормализация характера и частоты стула (рис. 4, 5). Динамика исчезновения катаральных симптомов также была более быстрой у пациентов основной группы. Так, на 3-и сутки от начала лечения ринит сохранялся у 24% пациентов основной группы и 37% группы сравнения (р<0,05), сухой кашель -у 25% основной группы и 45% группы сравнения (р<0,05).
У всех пациентов было проведено исследование кала методом ПЦР с целью установления этиологии заболевания и оценки продолжительности выделения возбудителя в окружающую среду. У большей части пациентов в 1-е сутки наблюдения был обнаружен ротавирус (у 85% детей в основной группе и у 83% - в группе сравнения). Кроме ротавируса методом ПЦР определялись норовирус, аденовирус, сальмонеллы и сочетание - ротавирус + норовирус. На 5-е сутки наблюдения выделение возбудителя сохранялось у 39% пациентов основной группы и 74% - группы сравнения. Таким образом, удельный вес детей, у которых после окончания курса терапии, по данным ПЦР, не происходило выделения возбудителя в окружающую среду (то есть, произошла элиминации возбудителей), в основной группе был значимо большим и составил 61%, в группе сравнения - 26% (р<0,001).
В ряде случаев методом ПЦР в фекалиях ребенка обнаруживалось наличие двух и более возбудителей. При этом в основной группе таких случаев выявлено не было ни при поступлении, ни при проверке во 2-й точке (после лечения) В то же время среди детей, получавших плацебо в составе комплексной терапии, уже 1-й точке в 7% случаев определялось микстовое сочетание. На 5-е сутки наблюдения в группе плацебо доля детей, у которых в фекалиях определялся более чем один возбудитель, выросла до 17%.
Мониторинг лабораторных показателей в группах сравнения не выявил каких-либо значимых отклонений от нормальных показателей.
В процессе проведения исследования в обеих группах не было зарегистрировано каких-либо нежелательных явлений (НЯ), имеющих достоверную связь с приемом препаратов.
Таким образом, результаты проведенного исследования продемонстрировали эффективность препарата Анаферон детский, содержащего антитела к ИФН-γ человека в релиз-активной форме, в терапии вирусных ОКИ. Назначение Анаферона детского в ранние сроки от начала заболевания существенно сокращает выраженность и продолжительность синдрома интоксикации и лихорадки, диспептических проявлений инфекции, а также катаральных симптомов верхних дыхательных путей.
Прием препарата Анаферон детский статистически значимо (в 2,3 раза) сокращает долю детей, выделяющих возбудителей вирусных ОКИ, и риск внутрибольничного инфицирования. Отдельно следует подчеркнуть хорошую переносимость данного лекарственного средства детьми в возрасте от 1 мес до 3 лет.
1В процессе производства данного лекарственного препарата осуществляется многократное уменьшение концентрации действующего компонента, что приводит к высвобождению особой физико-химической, биологической и фармакологической активности, названной релиз-активностью; форму, содержащую приготовленный таким образом действующий компонент, называют релиз-активной формой [16].
Литература
- Сведения об инфекционных и паразитарных заболеваниях (Форма 1) за январь-ноябрь 2011. www.rospotrebnadzor.ru.
- Горелов АВ, Усенко ДВ. Ротавирусная инфекция у детей. Вопросы современной педиатрии. 2008;6:78-84.
- Fischer TK, Bresee JS, Glass RI. Rotavirus vaccines and the prevention of hospital-acquired diarrhea in children. Vaccine. 2004;22S:S49-S54.
- Offit PA, Clark HF. Rotavirus. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 5th ed. New York, NY: Churchill Livingstone; 2000:1696-703.
- Dormitzer PR. Rotaviruses. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 6th ed. New York, NY: Churchill Livingstone; 2004:1902-13.
- Bishop RF. Natural history of human rotavirus infection. Arch Virol. 1996;12(Suppl):119-28.
- Paul MO, Erinle EA. Influence of humidity on rotavirus prevalence among Nigerian infants and young children with gastroenteritis. J Clin Microbiol. 1982;15:212-5.
- Литвинчук ОА, Плоскирева АА, Усенко ДВ, Горелов АВ. Клинико-лабораторная эффективность кисломолочной смеси в лечении острых кишечных инфекций у детей и профилактике внутрибольничного инфицирования. Инфекционные болезни. 2010;1:112-6.
- Письмо Роспотребнадзора от 28.03.2012г. №01/3130-12-32 «О противоэпидемической работе в Российской Федерации в 2011 году».
- Майкова ИД. Особенности иммунного статуса и иммунокорригирующая терапия при острых кишечных инфекциях у детей. Автореф. дисс. ... канд. мед. наук. М., 2008;22.
- Дубовцев АИ. Местные и системные нарушения иммунитета при острых кишечных инфекциях у детей 1-го года жизни. Автореф. дисс. ... канд. мед. наук. Челябинск, 1990;22.
- Тихомирова ОВ, Сергеева НВ, Сироткин АК, Аксенов ОА, Кветная АС. Вирусные диареи у детей: особенности клинического течения и тактика терапии. Детские инфекции. 2003;3:7-10.
- Сагалова ОИ. Клинико-иммуннологические особенности ротавирусной инфекции у взрослых. Автореф. дисс. ... канд. мед. наук. Челябинск, 2002;20.
- Azim T, Zaki MH, Podder G, Sultana N, Salam MA, Rahman SM, et al. Rotavirus-specific subclass antibody and cytokine responses in Bangladeshi children with rotavirus diarrhea. J Med Virol. 2003 Feb;69(2):286-95.
- Хаитов РМ, Пинегин БВ. Основные принципы иммуномодулирующей терапии. Аллергия, астма и клиническая иммунология. 2000;1:9-16.
- Эпштейн ОИ. Релиз-активность - от феномена до создания новых лекарственных средств. Бюллетень экспериментальной биологии и медицины. 2012;7:62-7.
- Эпштейн ОИ, Штарк МБ. и др. Фармакология сверхмалых доз антител к эндогенным регуляторам функций. М.: Изд. РАМН;2005;225.
- Сизякина ЛП, Мельникова МО. Иммуномодулирующие эффекты анаферона детского, проявляющиеся при лечении детей с рецидивирующими респираторными инфекциями. Фармакотерапевтический альманах. 2009;3:52-62.
- Кондюрина ЕГ, Малахов АБ, Ревякина ВА. Анаферон детский. Клинические и иммунотропные эффекты в педиатрии. Фармакотерапевтический альманах. СПб., 2009;40-5.
- Филиппова ГМ, Иванов ИВ, Ефименко ОЕ, Манченко СМ, Сидорова ОС. Применение Анаферона детского в комплексной терапии острых вирусно-бактериальных кишечных инфекций у детей. Инфекционные болезни. 2008;1:20-2
References
- Svedeniya ob infektsionnykh i parazitarnykh zabolevaniyakh (Forma 1) za yanvar-noyabr 2011. www.rospotrebnadzor.ru. Russian.
- Gorelov AV, Usenko DV. Voprosy sovremennoy pediatrii. 2008;6:78-84. Russian.
- Fischer TK, Bresee JS, Glass RI. Rotavirus vaccines and the prevention of hospital-acquired diarrhea in children. Vaccine. 2004;22S:S49-S54.
- Offit PA, Clark HF. Rotavirus. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 5th ed. New York, NY: Churchill Livingstone; 2000:1696-703.
- Dormitzer PR. Rotaviruses. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 6th ed. New York, NY: Churchill Livingstone; 2004:1902-13.
- Bishop RF. Natural history of human rotavirus infection. Arch Virol. 1996;12(Suppl):119-28.
- Paul MO, Erinle EA. Influence of humidity on rotavirus prevalence among Nigerian infants and young children with gastroenteritis. J Clin Microbiol. 1982;15:212-5.
- Litvinchuk OA, Ploskireva AA, Usenko DV, Gorelov AV. Infektsionnyye bolezni. 2010;1:112-6. Russian.
- Pismo Rospotrebnadzora ot 28.03.2012g. №01/3130-12-32 «O protivoepide-micheskoy rabote v Rossiyskoy Federatsii v 2011 godu». Russian.
- Maykova ID. Osobennosti immunnogo statusa i immunokorrigiruyushchaya terapiya pri ostrykh kishechnykh infektsiyakh u detey. Avtoref. diss. ... kand. med. nauk. M., 2008;22. Russian.
- Dubovtsev AI. Mestnyye i sistemnyye narusheniya immuniteta pri ostrykh kishechnykh infektsiyakh u detey 1-go goda zhizni. Avtoref. diss. ... kand. med. nauk. Chelyabinsk, 1990;22. Russian.
- Tikhomirova OV, Sergeyeva NV, Sirotkin AK, Aksenov OA, Kvetnaya AS. Detskiye infektsii. 2003;3:7-10. Russian.
- Sagalova OI. Kliniko-immunnologicheskiye osobennosti rotavirusnoy infektsii u vzroslykh. Avtoref. diss. . kand. med. nauk. Chelyabinsk, 2002;20. Russian.
- Azim T, Zaki MH, Podder G, Sultana N, Salam MA, Rahman SM, et al. Rotavirus-specific subclass antibody and cytokine responses in Bangladeshi children with rotavirus diarrhea. J Med Virol. 2003 Feb;69(2):286-95.
- Khaitov RM, Pinegin BV. Allergiya, astma i klinicheskaya immunologiya. 2000;1:9-16. Russian.
- Epshteyn OI. Byulleten eksperimentalnoy biologii i meditsiny. 2012;7:62-7. Russian.
- Epshteyn OI, Shtark MB. et al. Farmakologiya sverkhmalykh doz antitel k endogennym regulyatoram funktsiy. M.: Izd. RAMN;2005;225. Russian.
- Sizyakina LP, Melnikova MO. Farmakoterapevticheskiy almanakh. 2009;3:52-62. Russian.
- Kondyurina YeG, Malakhov AB, Revyakina VA. Anaferon detskiy. Klinicheskiye i immunotropnyye effekty v pediatrii. Farmakoterapevticheskiy almanakh. SPb., 2009;40-5. Russian.
- Filippova GM, Ivanov IV, Yefimenko OYe, Manchenko SM, Sidorova OS. Infektsionnyye bolezni. 2008;1:20-2. Russian.
